文章信息
- 章淑玲, 廖琳琳, 肖顺
- ZHANG Shuling, LIAO Linlin, XIAO Shun
- 花生根际斯克里布纳短体线虫(Pratylenchus scribneri Steiners)的记述
- A description of nematode Pratylenchus scribneri Steiners in rhizospheres of peanut plants
- 亚热带农业研究, 2016, 12(4): 271-274
- Subtropical Agriculture Research, 2016, 12(4): 271-274.
- DOI: 10.13321/j.cnki.subtrop.agric.res.2016.04.011
-
文章历史
- 收稿日期: 2016-07-22
2. 福建农林大学植物保护学院, 福建 福州 350001
2. College of Plant Protection, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002
短体线虫(Pratylenchus spp.)是花生(Arachis hypogaea L.)上的重要病原物,可对其产量和质量造成严重影响。目前已记述寄生花生的短体线虫有短尾短体线虫(P.brachyurus Filipjev & Schuurmans Stekhoven)、咖啡短体线虫(P.coffeae Filipjev & Schuurmans Stekhoven)、沼泽短体线虫(P.helophilus Seinhorst)、弗莱克短体线虫(P.flakkensis Seinhorst)和落选短体线虫(P.neglectus Filipjev & Schuurmans)等十几个种[1-7],其中短尾短体线虫和咖啡短体线虫可对花生造成危害[1-2, 8-9]。近年来课题组在河北省邢台市巨鹿县巨鹿镇西闫庄村多块花生地根系及根际土壤中分离出大量形态特征一致的短体线虫,该线虫经显微形态和分子鉴定,确定为斯克里布纳短体线虫(P.scribneri Steiners)。
1 材料与方法 1.1 线虫样本的采集与分离从河北省邢台市巨鹿县巨鹿镇西闫庄村多块花生地采集生长不良的花生地下部植株及根际200 g土壤样本,每地块至少采集20份。采用贝尔曼漏斗法分离样本中的病原线虫[3]。
1.2 线虫的形态学观测线虫样本经60~65 ℃温热杀死后,以三乙醇胺福尔马林固定液(triethanolamine-formalin, TAF)进行固定和作为浮载剂,用Leica DM6000显微镜对线虫形态特征进行观察和度量,形态计量采用De Man公式[3]。
1.3 线虫的分子鉴定线虫DNA的提取参照文献[10]。ITS区与28S rDNA-D2D3区扩增采用50 μL反应体系,即25 μL PCR Master Mixture、5 μL DNA模板、2.0 μL上游引物(10 mM)、1.0 μL下游引物(10 mM)、21 μL ddH2O。其中ITS区引物为通用引物TW81(5′-GTTTCCGTAGGTGAACCTGC-3′)和AB28(5′-ATATGCTTAAGTTCAGCGGGT-3′)[11],D2D3区引物为通用引物D2A (5′-ACAAGTACCGTGAGGGAAAGTTG-3′)和D3B (5′-TCGGAAGGAACCAGCTACTA-3′)[12]。PCR扩增程序为:94 ℃预变性4 min;35个循环,每循环94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸80 s;72 ℃延伸10 min,于4 ℃保存。
反应结束后,取5 μL扩增产物加1 μL加样缓冲液在1%琼脂糖凝胶上电泳,用0.5×TBE作为电泳缓冲液,100 V下电泳30 min,用EB染色,电泳结果用全自动凝胶成像仪观察、拍照。将获得的PCR产物送交上海生工生物技术有限公司进行回收、克隆、测序。测序结果在NCBI上对进行BLAST比对后在GenBank (http://www.ncbi.nlm.nih.gov/genbank/)上登录以获得相应的序列登录号。从GenBank中下载短体线虫的ITS和D2D3区序列,使用MEGA 5.0的Muscle算法进行多重序列比对后,应用Mrbayes 3.2.6软件基于贝叶斯法构建系统发育树,最佳核苷酸替换模型采用GTR+I+G,运行200万代,相关参数的收敛性通过tracer 1.6进行判断(有效样本大小ESS>200);舍弃25%老化样本后,根据剩余样本构建一致树,并计算后验概率[13]。
2 结果与分析 2.1 形态测量值邢台种群♀♀(n=30):L(体长)=490.5±56.6(417.2~567.3) μm, a(体长/最大体宽)=21.4±2.0(18.5~25.6), b(体长/头端至食道与肠连接处的距离)=5.1±0.6(3.8~5.8), b′(体长/头端至食道与肠接合处末端距离)=4.0±0.4(3.4~4.8), c(体长/尾长)=19.1±2.5(13.9~22.0), c′(尾长/肛门处体宽)=2.2±0.2(1.8~2.6), V(阴门至头顶距离×100/体长)=78.4±1.9(74.4~80.6), SP (口针长)=13.6±0.9 (12.2~15.2) μm, 排泄孔至头端距离=83.4±5.9(72.7~92.2) μm。后阴子宫囊长=20.5±2.3(16.4~23.8), 尾腹环数=18.3±1.5(17.0~20.0)。
2.2 形态描述雌虫虫体经温热杀死后直伸或稍向腹面弯曲(图 1A)。唇区低平,2条唇环。口针粗壮,基部球发达、圆球形,针锥的长度略长于针杆。背食道腺开口位于口针基部球下方2~4 μm处(图 1C)。中食道球发达,近圆形,瓣膜明显,食道腺覆盖肠的侧腹面。排泄孔位于中食道球与食道腺末端距离的中部,半月体位于排泄孔前2个体环处(图 1B)。侧区宽约占虫体宽的1/4,有明显的3脊4线结构(图 1D)。单卵巢前生,后阴子宫囊长度约为阴门至肛门处距离的1/4。阴门横裂,阴唇不隆起,阴门至肛门的距离约为尾长的3倍(图 1E)。尾圆锥形,末端宽圆(图 1F)或钝锥状(图 1G),体环包至近尾端,尾腹面有体环17~20个。
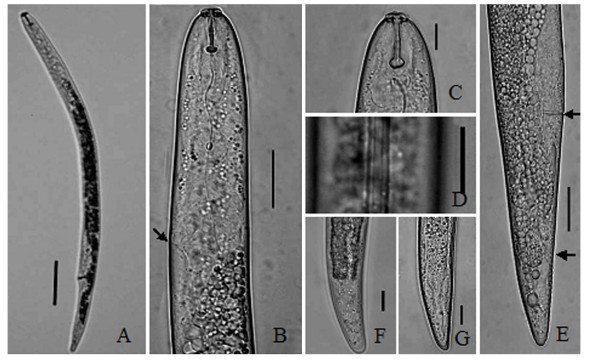
|
图 1 寄生于花生的斯克里布纳短体线虫形态特征 Figure 1 Morphological characteristics of P.scribneri parasites from peanut |
雄虫未发现。
通过测量值与形态特征比较,河北邢台短体线虫与斯克里布纳短体线虫的原始描述[14]相符。该种的鉴别特征为:唇区2条唇环,口针基部球圆形,侧区4条侧线,阴门位于虫体中后74%~80.6%处,尾末端宽圆或钝锥状。
2.3 分子生物学鉴定河北邢台花生短体线虫ITS区和28S rDNA-D2D3区的序列片段长度分别为883 bp和785 bp,GenBank登录号为KM094195和KM094196。NCBI中BLAST比对分析结果,该短体线虫的rDNA-ITS序列和D2D3序列均与斯克里布纳短体线虫序列的同源性最高。其中,ITS区序列的同源性为93%~95%,D2D3区序列的同源性为98%~99%。
运用贝叶斯法分别构建的ITS系统发育树(图 2)和28S rDNA-D2D3系统发育树(图 3)显示,河北邢台花生短体线虫均以100%的高置信度与斯克里布纳短体线虫种群聚为一大支。rDNA-ITS区和rDNA-D2D3区测序及系统发育树比对结果,同样证实了河北邢台花生短体线虫为斯克里布纳短体线虫。
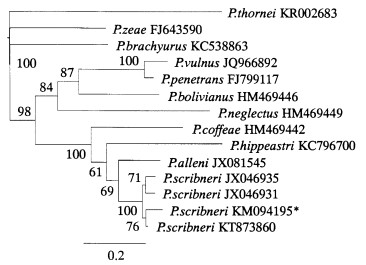
|
图 2 基于ITS序列的系统发育树 Figure 2 A phylogenetic tree based on ITS DNA nucleotide sequences |
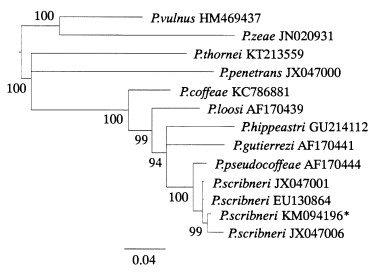
|
图 3 基于28S rDNA-D2D3序列的系统发育树 Figure 3 A phylogenetic tree based on 28S rDNA-D2D3 nucleotide sequences |
短体线虫是植物上一种十分重要的迁移型内寄生线虫,该属线虫主要取食受害寄主的根部,引起根区生长点坏死或根系腐烂,从而使植株生长受阻[15]。此外,该线虫还能与其他病原物对植物造成复合侵染[3]。斯克里布纳短体线虫由于其寄主广、世代短、繁殖快,在我国多种植物上,如玉米、高羊茅草、樱桃、甘蔗及多种蔬菜等发生记录[4-5, 16-20]。本研究中该线虫以较大虫量(即每200 g根系及土壤混合样本中最高可分离出56条斯克里布纳短体线虫)寄生于长势衰弱的花生植株根际,故其对花生的危害性值得进一步研究。
| [1] | DICKSON D W, DEWAELE D. Nematode parasites of peanut. In Luc M, Sikora R A, Bridge J. eds. Plant Parasitic Nematodes in Subtropical and Tropical Agriculture (2nd edition)[M]. UK, Wallingford: CABI publishing, 2005 : 393 -436. |
| [2] | SHARMA S B, MCDONALD D. A world list of plant parasitic nematodes associated with groundnut[M]. 1990 : 13 -18. |
| [3] | 张绍升. 植物线虫病害诊断与治理[M]. 福州: 福建科学技术出版社, 1999 . |
| [4] | 刘修勇.山东省短体科线虫主要属种的分类研究[D].山东:莱阳农学院, 2006. |
| [5] | 刘维志. 植物线虫志[M]. 北京: 中国农业出版社, 2004 . |
| [6] | 王明祖. 湖北省植物栽培线虫种类的鉴定(续)[J]. 华中农业大学学报, 1988, 7(4): 337–348. |
| [7] | 李笃肇. 四川省植物寄生短体线虫种的记述[J]. 西南农学院学报, 1985, 2(2): 49–51. |
| [8] | 章淑玲, 廖琳琳, 刘国坤, 等. 花生短体线虫病的病原鉴定与诊断[J]. 热带作物学报, 2015, 36(2): 365–370. |
| [9] | 廖琳琳, 章淑玲, 肖顺, 等. 寄生于花生的根腐线虫种类鉴定及致病性测定[J]. 福建农林大学学报(自然科学版), 2015, 44(3): 240–244. |
| [10] | LIU G K, CHEN J A, XIAO S, et al. Development of species-specific PCR primers and sensitive detection of the Tylenchulus semipenetrans in China[J]. Agricultural Sciences in China, 2011, 10: 252–258. 10.1016/S1671-2927(11)60002-3 |
| [11] | SCHMITZ B, BURGERMEISTER W, BRAASCH H. Molecular genetic classification of Central European Meloidogyne chitwoodi and M.fallax populations[J]. Nachrichtenbl Deutschen Pflanzenschutzd, 1998, 50: 310–317. |
| [12] | SUBBOTIN S A, STURHAN D, CHIZHOV V N, et al. Phylogenetic analysis of Tylenchida Thorne, 1949 as inferred from D2 and D3 expansion fragments of the 28S rRNA gene sequences[J]. Nematology, 2006, 8: 455–474. 10.1163/156854106778493420 |
| [13] | 吴祖建, 高芳銮, 沈建国. 生物信息学分析实践[M]. 北京: 科学出版社, 2010 : 177 -180. |
| [14] | ROMAN J, HIRSCHMANN H. Morphology and morphometrics of six species of Pratylenchus[J]. Journal of Nematology, 1969, 1(4): 363–386. |
| [15] | CASTILLO P, VOVLAS N. Pratylenchus (Nematoda:Pratylenchidae):diagnosis, biology, pathogenicity and management[M]. Leiden: The Netherlands:Brill Academic Publisers, 2007 : 529 . |
| [16] | 高学彪, 程瑚瑞. 玉米短体线虫病的病原鉴定和致病性研究[J]. 南京农业大学学报, 1992, 15(4): 50–55. |
| [17] | 陈艳, 高利媛, 马腾, 等. 高羊茅根际一种短体线虫的分离与鉴定[J]. 草业科学, 2015, 32(6): 988–993. |
| [18] | 江晓帆, 董春华, 马骏, 等. 大边樱桃根际寄生线虫种类的调查与鉴定[J]. 安徽农业科学, 2014, 42(9): 2600–2601. |
| [19] | 江晓帆, 王雪, 李想, 等. 海南省甘蔗根际寄生线虫调查与鉴定[J]. 甘蔗糖业, 2015, 5: 17–22. |
| [20] | 赵鸿, 朱建兰, 彭德良. 甘肃省蔬菜根际寄生线虫的研究[J]. 干旱地区农业研究, 2004, 22(3): 197–201. |
 2016,Vol. 12
2016,Vol. 12

