文章信息
- 李冬萍, 廖楠, 汪茜, 龙艳艳, 宋娟, 张金莲, 陈廷速
- LI Dongping, LIAO Nan, WANG Qian, LONG Yanyan, SONG Juan, ZHANG Jinlian, CHEN Tingsu
- 木薯根系丛枝菌根真菌染色方法
- A method to stain arbuscular mycorrhizal fungi in cassava roots
- 亚热带农业研究, 2016, 12(01): 50-55
- JOURNAL OF AERONAUTICAL MATERIALS, 2016, 12(01): 50-55.
- DOI: 10.13321/j.cnki.subtrop.agric.res.2016.01.008
-
文章历史
- 收稿日期:2015-10-08
木薯(Manihot esculanta Crantz)别名树薯,为1年生或多年生大戟科木薯属植物,其茎干高大如灌木,块根似薯,是世界三大薯类作物之一[1]。木薯素有“淀粉之王”、“地下粮仓”和“特用作物”的美称[2],其块根不仅是工业淀粉的主要原料之一,也是燃料乙醇的主要原料。木薯产业的发展对保护生态环境及缓解能源危机具有重要的意义[3, 4]。木薯植株高大,种植时间长,耐贫瘠、干旱,吸肥力强,尤其对磷、钾肥需求量较大,多年单一连作地力消耗较大,土壤肥力有下降的趋势[5]。
丛枝菌根(arbuscular mycorrhiza,AM)是由球囊菌门真菌与植物根系形成的互惠共生体,约80%以上的陆地植物都能与AM真菌共生[6]。AM真菌不仅能够促进宿主植物对水分和土壤矿质元素(尤其是磷、锌、铜等矿质元素)的吸收和利用,还能增强宿主植物对干旱、贫瘠、病虫害等不良环境的抵抗能力,改善土壤的理化性状,促进植物生长,提高作物产量和品质[7, 8]。木薯为菌根依赖型植物,其根际土壤中富含AM真菌资源[9, 10]。Phillips et al[11]和Kormanik et al[12]认为台酚蓝和酸性品红染色法染色效果可靠而稳定,但除了AM真菌被染色外,其根皮层组织也会被染上相同而略浅的颜色,使得AM真菌的结构与皮层组织颜色反差不大,不利于观察拍照。Vierheilig et al[13]指出台酚蓝、酸性品红都是致癌疑似物,长期使用可能对操作者的健康有害。本课题组采用台酚蓝对大田木薯根系进行染色,除AM真菌被染色外,其根皮层组织也被染上相同而略浅的颜色,两者之间的颜色反差不明显,不利于AM真菌菌丝等结构的观察。因此,建立一种安全可靠的木薯根系丛枝菌根真菌染色方法很有必要。本研究以大田木薯根系为样品,比较酸性品红、台酚蓝、苏丹红、苯胺蓝、Quink牌纯黑墨水、北京牌蓝黑墨水等6种染色剂对其AM真菌的染色效果,建立安全可靠理想的染色方法,以期为木薯根系的AM真菌研究提供支持。
1 材料与方法 1.1 材料与试剂 1.1.1 材料大田木薯根系取自广西南宁市武鸣县罗波镇岽周村木薯试验基地,冲洗后置于体积分数为50%酒精中室温保存。
1.1.2 染色剂配制①酸性品红:0.15 g酸性品红+100 mL乳酸+100 mL甘油+100 mL蒸馏水;②苏丹红Ⅳ:0.1 g苏丹Ⅳ+10 mL 95%酒精+10 mL甘油;③台酚蓝:0.15 g台酚蓝+100 mL乳酸+100 mL甘油+100 mL蒸馏水;④苯胺蓝:0.1 g苯胺蓝+100 mL 95%酒精;⑤2种墨水:95 mL 5%冰乙酸(体积分数)+5 mL墨水,配制成5%的墨水醋染液(体积分数)。
1.2 试验方法 1.2.1 菌根染色采用酸性品红、苏丹红Ⅳ、台酚蓝、苯胺蓝、Quink牌纯黑墨水、北京牌蓝黑墨水等6种染色剂进行根系菌根染色试验,浸染方法参考文献[14]并略作改进。取保存于50%酒精中的木薯根系,用清水冲洗干净,并将水分控干。将根系剪成约1 cm长,分装于不同的离心管中,加入 20% KOH 溶液完全浸泡,90 ℃水浴30 min,除去根部皮层细胞的细胞质,利于染料的浸透,清水冲洗3~5 次并将水分控干。加入碱性 H2O2(10 mL 10% H2O2+1 mL氨水+189 mL蒸馏水)室温脱色2 h,除去深色根系表层的颜色,同时软化根系,脱色结束后用清水冲洗3~5次并将水分控干。加5%冰乙酸,室温酸化5 min。用上述配制好的6种染色剂进行染色处理:66 ℃水浴染色30 min,用清水漂洗数次后,用清水浸泡12 h以上脱色。Quink牌纯黑墨水染色留两份材料,一份不加碱性 H2O2作为对照处理;另一份常温染色过夜,其余处理一致。
1.2.2 制片与显微镜观察将脱色处理后的根段平展于载玻片上,挑出根中的坚硬组织,用尖嘴镊子将木薯根外皮与内皮轻轻分开。每片平行摆放3~4个根段,盖上盖玻片,用镊子轻轻敲压使其平展均匀。每个处理制片3张,3次重复。使用尼康Ci-L显微镜观察、拍照。
2 结果与分析 2.1 酸性品红染色由图 1可知,用酸性品红染料进行染色后,木薯根内的菌丝染上极浅的颜色,背景也染上相近的颜色,对比非常不明显,菌丝很难观察。不同种类的泡囊染色效果不尽相同,有些染上很浅的颜色,有些则能观察到泡囊的内含物。
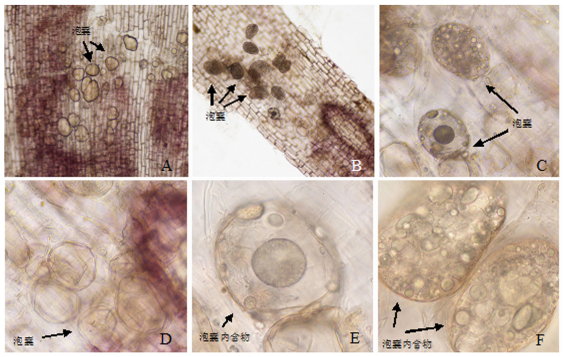 |
A-D.泡囊;E-F.泡囊内含物。 图 1 酸性品红染色木薯丛枝菌根 Figure 1 The arbuscular mycorrhiza, dyed with acid fuchsin, in cassava |
苏丹红Ⅳ染色操作简便,效果可靠稳定不褪色,与背景对比差异大。不同种类的泡囊染色效果各异,有大红色、浅黄色、黑色等,还有些泡囊壁染不上色,而内含物却染成大红色或橙色,菌丝染成红色但数量极少(图 2)。
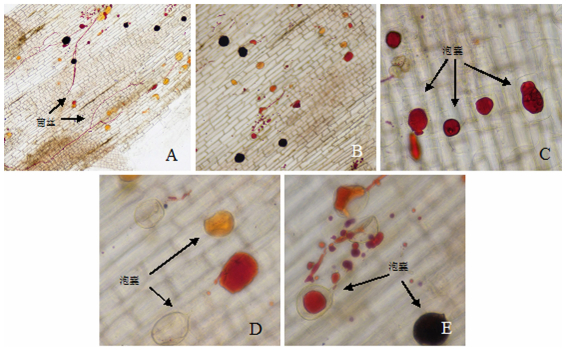 |
A-B.菌丝及泡囊;C-E.泡囊。 图 2 苏丹红Ⅳ染色木薯丛枝菌根 Figure 2 The arbuscular mycorrhiza, dyed with Sudan red Ⅳ, in cassava |
用台酚蓝进行染色后,虽然可观察到菌丝和泡囊,但是由于根皮层组织也染上了相同或者相近的颜色,使得菌丝、泡囊颜色与背景颜色反差小(图 3)。
 |
A-B.菌丝及泡囊;C.泡囊。 图 3 台酚蓝染色木薯丛枝菌根 Figure 3 The arbuscular mycorrhiza, dyed with trypan blue, in cassava |
苯胺蓝染色后背景颜色很深,根内的杂质多被染色,菌丝染色效果不佳,且与背景色接近或是染色不连续,泡囊染色效果一般(图 4),不利于泡囊与菌丝等结构的观察。
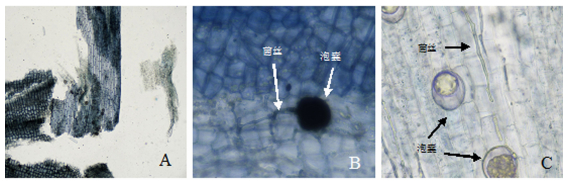 |
A.整体染色效果;B-C.菌丝及泡囊。 图 4 苯胺蓝染色木薯丛枝菌根 Figure 4 The arbuscular mycorrhiza, dyed with aniline blue, in cassava |
墨水对木薯根系AM真菌的菌丝、泡囊和孢子等结构着色好,在低倍镜下就能观察清楚(图 5)。
 |
Quink牌纯黑墨水染色:A.整体染色效果;B-C.孢子及菌丝;D-E.泡囊及菌丝;F.菌丝。北京牌蓝黑墨水染色:G-H.泡囊;I.泡囊与菌丝。 图 5 墨水染色木薯丛枝菌根 Figure 5 The arbuscular mycorrhiza, dyed with ink, in cassava |
北京牌蓝黑墨水染色后,观察到的菌丝、泡囊等结构虽然染色效果较好,但背景也染上了相近而略浅的颜色,染上色的菌丝、泡囊等结构放置几日后逐渐褪色,染色效果不稳固(图 5G-5I)。
2.5.2 Quink牌纯黑墨水Quink牌纯黑墨水染色后,能清晰地观察到孢子、泡囊和菌丝等结构,这些结构均染成深紫色且边缘清晰,经清水浸泡后背景褪色效果好,反差大、清晰度高、染色效果极佳,适用于木薯AM真菌的染色和制片观察(图 5A-5F)。
为探讨Quink牌纯黑墨水对木薯根系的最佳染色方法,本研究设置以下处理:(1)正常处理,即20%的KOH溶液90 ℃水浴30 min,碱性H2O2室温脱色2 h,5%冰乙酸酸化5 min,5%墨水醋(Quink牌纯黑墨水)66 ℃水浴染色30 min,清水浸泡脱色12 h;(2)常温染色过夜,其余处理一致;⑶不加碱性H2O2脱色,其余处理一致。试验表明:碱性H2O2脱色2 h能将其背景的棕黄色很好地褪色,背景颜色浅,利于观察(图 6A-6C);而不加碱性H2O2脱色,其背景呈现棕黄色,颜色深,不利于观察(图 6G、6H)。常温染色过夜处理,菌丝、泡囊染色过深,边缘模糊不清晰(图 6D-6F);而66 ℃水浴染色30 min,菌丝、泡囊等结构的染色效果良好,边缘清晰(图 6A-6C)。
 |
A-C.正常处理;D-F.常温染色过夜;G、H.不加碱性H2O2脱色。 图 6 Quink牌纯黑墨水染色木薯丛枝菌根 Figure 6 The arbuscular mycorrhiza, dyed with Quink pure black ink, in cassava |
本研究比较了6种染色剂对木薯菌根的染色效果,结果显示它们之间存在较大差异。酸性品红染色后,菌丝很难着色,几乎看不到,泡囊染上较浅的颜色,其中有些透明不易观察,有些则非常清晰地看到泡囊里的内含物。苏丹红Ⅳ染色效果稳定不褪色,与背景对比差异大,只有极少量菌丝能染成红色,大部分菌丝染得很浅或染不上颜色,不同种类的泡囊染色效果形态各异。台酚蓝染色后,菌丝和泡囊染色效果较好,但背景也染上相同或相近的颜色,不利于观察。苯胺蓝染色后背景颜色过深,且皮层杂质也染上较深颜色,菌丝和泡囊染色效果一般。北京牌蓝黑墨水染色后,泡囊与菌丝染上较浅的颜色,背景也染上同样而略浅的颜色,不便于观察,而且染色效果不稳固,持续褪色。Quink牌纯黑墨水染色后,AM真菌的孢子、泡囊和菌丝等结构均染成深紫色且边缘十分清晰,经清水浸泡过夜后背景褪色比较干净,各个结构与背景颜色反差大,染色效果极佳。齐宗韶[15]研究表明,标准派克纯黑墨水由亮黑和坚牢黄2种染料组成,且均为食用色素,安全无毒。因此,采用Quink牌纯黑墨水染色可以兼顾好的染色效果和低毒安全。蓝黑墨水染色后持续褪色,Quink牌纯黑墨水却较稳固,这可能与墨水中的染料不同有关,有待进一步研究。
供试木薯根系多为老根,种植时间长,呈深棕色。要观察其内生真菌,不仅要使根系的菌丝和泡囊结构(AM真菌)染好颜色,还要将较深的背景颜色褪去,使两者产生较大的反差,便于观察,因此根系的脱色是试验中至关重要的环节。有些植物根系呈乳黄色至乳白色,仅使用KOH溶液透明处理即可[16],对于根系颜色较深的,应加以漂白处理[17]。本试验采用碱性H2O2脱色漂白2 h,与不加碱性H2O2脱色(CK)相比,对木薯根皮层组织的棕黄色褪色效果显著,使其背景颜色变浅,便于观察。因此木薯根系5%墨水醋染色,添加碱性H2O2脱色十分必要。 除墨水外其余4种染料均有毒性,部分是致癌疑似物,价格也比较高,不适合长期使用,且操作时要谨慎小心。因此,采用Quink牌纯黑墨水对木薯根系进行染色,染色效果稳定可靠且反差大,适合木薯根系AM真菌的侵染检测、制片和观察,而且成本低廉、安全无毒,对环境污染小。
| [1] | 周凤珏, 许鸿源, 白坤栋, 等.PP333对木薯生长、光合和蒸腾的影响[J].中国农学通报, 2004, 20(1):17-20. |
| [2] | 李开绵, 林雄, 黄洁.国内外木薯科研发展概况[J].热带农业科学, 2001(1):56-60. |
| [3] | 方佳, 濮文辉, 张慧坚.国内外木薯产业发展近况[J].中国农学通报, 2010, 26(16):353-361. |
| [4] | 苏凤秀.不同AM真菌对木薯的生长效应研究[D].长沙:中南林业科技大学, 2012. |
| [5] | 罗兴录.广西木薯产业化发展战略思考[J].耕作与栽培, 2001(4):59-61. |
| [6] | 刘润进, 李晓林.丛枝菌根及其应用[M].北京:科学出版社, 2000. |
| [7] | BOROWICZ V A. Do arbuscular mycorrhizal fungi alter plant-pathogen relations?[J]. Ecology, 2001, 82(11):3057-3068. |
| [8] | FITTER A H. Darkness visible: reflections on underground ecology[J]. Journal of Ecology, 2005, 93(2):231-243. |
| [9] | 罗晓莹, 黄华成, 庄雪影.广东省三种植物群落土壤AMF孢子比较[J].生态科学, 2003, 22(1):21-26. |
| [10] | 苏凤秀, 罗晓莹, 庄雪影.广西木薯主产区丛枝菌根真菌孢子多样性调查研究[J].安徽农业科学, 2008, 36(34):15083-15086. |
| [11] | PHILLIPS J M, HAYMAN D S. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J]. Transactions of the British Mycological Society, 1970, 55(1):158-161. |
| [12] | KORMANIK P P, CRAIG BRYON W, SCHULTZ R C. Procedures and equipment for staining large numbers of plant root samples for endomycorrhizal assay[J]. Canadian Journal of Microbiology, 1980, 26(4):536-538. |
| [13] | VIERHEILIG H, COUGHLAN A P, WYSS U, et al. Ink and vinegar, a simple staining technique for arbuscular-mycorrhizal fungi[J]. Applied and Environmental Microbiology, 1998, 64(12):5004-5007. |
| [14] | 王幼珊, 张淑彬, 张美庆.中国丛枝菌根真菌资源与种质资源[M].北京:中国农业出版社, 2012. |
| [15] | 齐宗韶.犀飞利黑墨水和标准派克纯黑墨水染料分析[J].中国制笔, 2008(2):9-11. |
| [16] | 杨亚宁, 巴雷, 白晓楠, 等.一种改进的丛枝菌根染色方法[J].生态学报, 2010, 30(3):774-779. |
| [17] | KOSKE R E, GEMMA J N. A modified procedure for staining roots to detect VA mycorrhizas[J]. Mycological Research, 1989, 92(4):486-488. |
 2016, Vol. 12
2016, Vol. 12


