| 水面菲涅尔反射对~761 nm叶绿素荧光估算的影响 |
收稿日期: 2017-06-26
2. State Key Laboratory of Satellite Ocean Environment Dynamics, SOA, Hangzhou 310012, China
3. Nanjing Institute of Geography and Limnology, Chinese Academy of Science, Nanjing 210008, China
太阳诱导叶绿素荧光(本文简称叶绿素荧光)是光合作用的有效探针(Meroni 等,2009),被广泛应用于陆地植被状态监测(Meroni 等,2009;Zarco-Tejada 等,2009;Alonso 等,2008)与水体叶绿素浓度估算(Gower和Borstad,1990;Letelier和Abbott,1996;Al Shehhi 等,2013;Hu 等,2005),能进一步实现对生态系统初级生产力的监测(Abbott 等,1995;Chamberlin 等,1990;Kiefer和Reynolds,1992;Stegmann 等,1992)。水体浮游植物或陆地植被叶绿素荧光的光谱范围大致覆盖650—800 nm(Meroni 等,2009);其光谱在~685 nm附近会形成一个狭窄且显著的荧光峰,在~740 nm附近会形成一个相对较宽,但能量明显比~685 nm峰值低的次级荧光峰(Krause和Weis,1991)。目前,海洋叶绿素荧光遥感主要利用~685 nm波段范围的荧光信号进行叶绿素浓度估算(Fischer和Kronfeld,1990;Wolanin 等,2014;Maxwell和Johnson,2000),并基于MODIS(Abbott和Letelier,1999;Al Shehhi 等,2013;Hu 等,2005)、MERIS(Gower和King,2007)、GOCI(O’Malley 等,2014)等的荧光探测波段,可实现对海水叶绿素浓度的卫星遥感估算。较高浓度的悬浮泥沙,显著增强了红光和近红外光谱范围内的后向散射信号,致使该光谱范围内的水体遥感反射率明显抬升,覆盖荧光信号,给叶绿素浓度估算带来诸多不确定性影响(Abbot和Letelier,1999;Fischer和Kronfeld,1990)。
基于水面实测的遥感反射率光谱曲线,在~761 nm会有一个狭窄的光谱反射峰,常被认为是水面菲涅尔反射信号中氧气吸收造成的测量误差。Lu等人(2016)通过系统的分析,首次阐明了水体遥感反射率(~761 nm)光谱曲线上,叶绿素荧光信号在大气中氧气吸收谱线(O2-A吸收波段)的填充效应。利用归一化荧光基线高度法,基于反射率数据计算的~761 nm荧光基线高度与叶绿素浓度具有良好的线性统计关系。研究同时表明,该荧光信号能克服水体高浓度悬浮物的影响,并对高浓度叶绿素估算具有较好的抗饱和性(Lu 等,2016)。
水面菲涅尔反射光是水色遥感中不能忽视的信号之一,会给叶绿素荧光计算带来干扰,对利用该波段估算叶绿素浓度产生不确定性影响(Abbott和Letelier,1999)。本研究基于水面实测光谱数据和叶绿素浓度数据,分析~761 nm波段叶绿素荧光信号与其浓度的数值统计关系,开展水面菲涅尔反射系数的敏感性评估。研究表明,水面菲涅尔反射会对水体叶绿素荧光信号估算带来较大的不确定性,准确估算菲涅尔系数,有助于提高计算的精度。菲涅尔反射差异所带来的不确定性影响,在低浓度叶绿素水体中表现明显,在高浓度叶绿素水体中影响较小。随着对~761 nm水体叶绿素荧光估算的深入分析,能为海洋叶绿素荧光遥感应用研究提供参考。
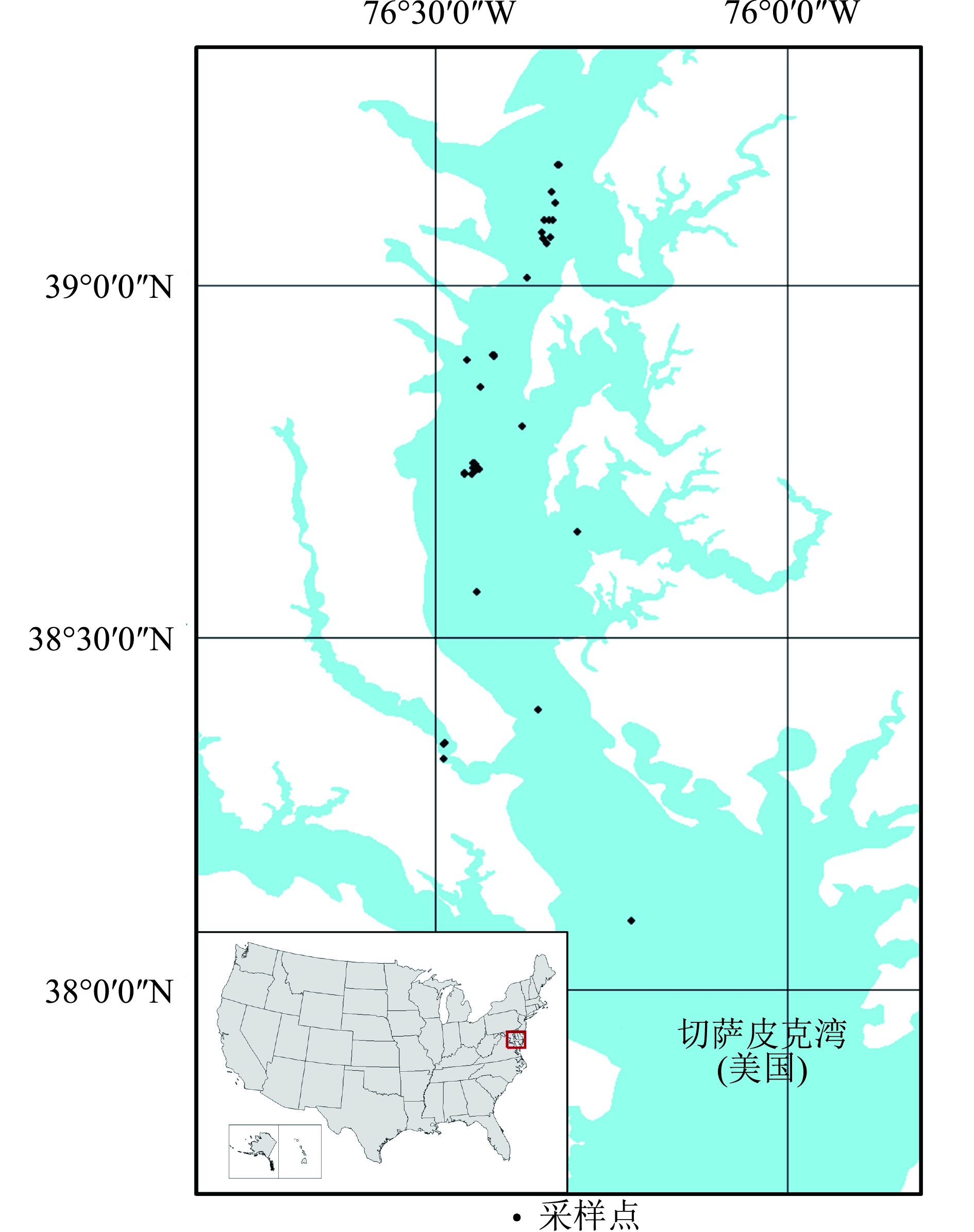
2、研究区与数据获取 (2.1) 研究区研究区位于美国东海岸中部的切萨皮克湾(Chesapeake Bay),是美国东海岸北大西洋的入海口之一(图1)。该湾区北部位于马里兰州,南半部在维吉尼亚州境内,西部被陆地环绕,东部是美国的德尔马瓦半岛。切萨皮克湾周围整个流域的住宅、农场和工业污染,带来大量氮、磷,造成湾内水体富营养化,有害藻类爆发,严重破坏了切萨皮克湾的海洋生态环境。
|
| 图 1 研究区及采样点示意图 Figure 1 Study area and sampling position |
美国南佛罗里达大学海洋学院对切萨皮克湾海水开展了现场观测与采样分析,使用的观测设备为ASD地物光谱仪(光谱覆盖范围400—1000 nm,光谱分辨率3.5 nm,光谱采样间隔为1 nm)和标准灰板。现场观测光谱数据采集于2011年11月7日—20日,利用水面以上测量方法,测量了水面上行光谱辐亮度(Lu,单位:W·m–2·nm–1·Sr–1)、天空散射光光谱辐亮度(Lsky,单位:W·m–2·nm–1·Sr–1),标准灰板的光谱辐亮度(Lgray,单位:W·m–2·nm–1·Sr–1);于此同时,采集表层海水样品进行实验室分析,获取表层海水的叶绿素浓度(叶绿素浓度变化范围为9.24— 67.52 mg·m–3),一共获得有效数据42组,具体采样点见图1。
3、基于水体遥感反射率(~761 nm)的叶绿素荧光探测机理 (3.1) 氧气吸收波段的填充效应水体遥感反射率光谱曲线在~761 nm处存在的反射峰,已经被证明是水体中太阳诱导叶绿素荧光在氧气吸收波段内的填充效应所产生(Lu 等,2016)。近红外光谱700—800 nm范围内,存在氧气(O2-A)的特征吸收,因此在下行的辐照度光谱中,~761 nm波段附近会存在诸多显著的吸收峰特征;由于探测器光谱分辨率的不同,这些氧气(O2-A)吸收特征的表现也具有较大差异(Meroni 等,2009)。太阳诱导叶绿素荧光在750—775 nm的光谱范围内具有荧光信号,且该范围同时覆盖了O2-A吸收波段。当用水面遥感反射率光谱曲线来展现这一荧光信号时,因荧光能量在该氧气吸收峰的填充作用,遥感反射率曲线上会有一异常反射峰(Lu 等,2016)。如该氧气吸收峰的主要波段为λ2,其左右两侧无氧气吸收的邻近波段分别为λ1和λ3,上述3个波段的遥感反射率(Rrs)为
| ${R_{\rm{rs}}}\left( {{{\textit{λ}} _i}} \right) = \frac{{{L_{\rm{w}}}\left( {{{\textit{λ}} _i}} \right)}}{{{{\small{E}}_{\rm{d}}}\left( {{{\textit{λ}} _i}} \right)}} = \frac{{L_{\rm{w}}^{\scriptstyle{\rm E}}\left( {{{\textit{λ}} _i}} \right) + {L_{\rm{f}}}\left( {{{\textit{λ}} _i}} \right)}}{{{E_{\rm{d}}}\left( {{{\textit{λ}} _i}} \right)}} = {R_{\rm{rso}}}\left( {{{\textit{λ}} _i}} \right) + \frac{{{L_{\rm{f}}}\left( {{{\textit{λ}} _i}} \right)}}{{{E_{\rm{d}}}\left( {{{\textit{λ}} _i}} \right)}}$ | (1) |
式中,Ed为水面上的下行光谱辐照度,Lw为离水光谱辐亮度,
| ${\rm{FLH}} = {R_{\rm{rs}}}({{\textit{λ}}_2}) - \left[ {\frac{{{{\textit{λ}} _3} - {{\textit{λ}}_2}}}{{{{\textit{λ}} _3} - {{\textit{λ}}_1}}}\left( {{R_{\rm{rs}}}({{\textit{λ}}_1}) - {R_{\rm{rs}}}({{\textit{λ}} _3})} \right) + {R_{\rm{rs}}}({{\textit{λ}}_3})} \right]$ | (2) |
FLH与该波段叶绿素荧光信号线性相关,从而可以与叶绿素浓度表现出较好的线性统计关系(Lu 等,2016)。
(3.2) 光谱分辨率的影响太阳诱导叶绿素荧光对氧气吸收波段(O2-A)的填充效应,使水体遥感反射率在761 nm附近形成了一个反射峰(是荧光信号的体现,但并非是叶绿素荧光峰),该峰值的形态特征还取决于光学传感器的光谱分辨率(半波高宽FWHM(Full Width at half maximum))。要利用该峰值进行叶绿素浓度估算,传感器的光谱分辨率需优于5 nm(Lu 等,2016)。本研究基于MODTRAN 4.0软件,模拟了美国标准大气条件下,750—775 nm光谱范围内,5种不同光谱分辨率(0.1 nm、0.5 nm、1 nm、3 nm、5 nm)的下行光谱辐照度。设定该光谱范围内,弹性散射条件下的水体遥感反射率不变(Rrso=0.02 Sr–1);基于Alonso等人(2008)关于叶绿素荧光估算的研究,设定~761 nm处叶绿素荧光能量Lf=0.7081 (W·m–2·μm–1·Sr–1),且750—775 nm内的荧光为线性变化(Lf (λ1)=Lf

|
| 图 2 遥感反射率光谱上叶绿素荧光形态特征模拟 Figure 2 Modeled chlorophyll fluorescence in the remote sensing reflectance around 761 nm |
模拟的水体遥感反射率曲线,在不同光谱分辨率条件下,叶绿素荧光信号具有不同的形态特征。当光谱分辨率为0.1 nm时,叶绿素荧光信号形态表现为明显的多峰值特征,主要峰值位于760.60 nm,其遥感反射率为0.027 Sr–1;当光谱分辨率为0.5 nm时,表现为双峰值特征,主要峰值位于760.66 nm,遥感反射率为0.024 Sr–1;当光谱分辨率为1.0 nm时,表现为不明显的双峰值特征,主要峰值位于760.69 nm,遥感反射率为0.023 Sr–1;当光谱分辨率为3.0 nm时,表现为单峰值特征,主要峰值位于761.16 nm,遥感反射率为0.0217 Sr–1;当光谱分辨率为5.0 nm时,表现为明显的单峰值特征,位于762.66 nm,遥感反射率为0.0213 Sr–1。随着光谱分辨率的降低,叶绿素荧光填充作用形成的反射峰会发生较大的形态特征变化,峰值所在波段向长波方向移动,其遥感反射率也会随之降低,这对探测设备的光谱分辨率、信噪比与辐射量化比率提出了一定的要求。当光谱分辨率为3 nm时,模拟光谱只表现出一个峰值形态,此时遥感反射率中叶绿素荧光信号的填充峰位于~761 nm。
4、菲涅尔反射系数的敏感性分析 (4.1) ~761 nm叶绿素荧光信号采用水面以下测量法获取的数据,可忽略菲涅尔反射的影响(唐军武 等,2004)。而采用水面以上测量法获取的水面上行光谱辐亮度(Lu)中,除了弹性散射贡献的离水辐亮度(
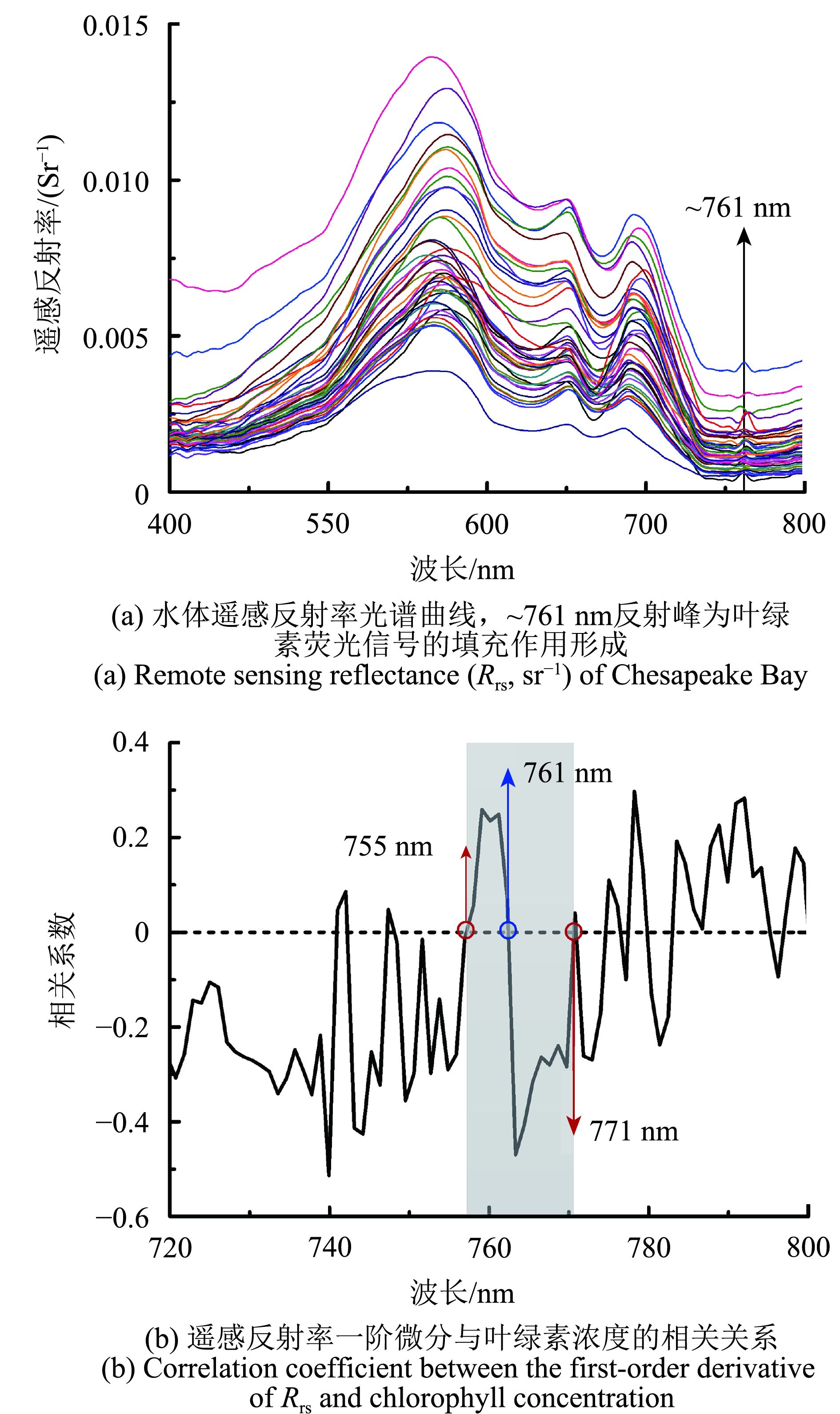
本研究中获取的切萨皮克湾海水遥感反射率数据(如图3(a)所示,菲涅尔系数ρ设定为0.022),可观察到明显的叶绿素荧光填充特征,即~761 nm的反射峰。遥感反射率一阶微分与叶绿素浓度的相关关系如图3(b)所示,可以进一步确定叶绿素荧光填充峰位于~761 nm,左右基线波段(λ1和λ3)分别位于755 nm和771 nm。
(4.2) 基于不同菲涅尔系数的统计分析水面菲涅尔系数(ρ)与水面粗糙度、观测角度等有着密切关系,当太阳天顶角为0°—40°时,基于Cox-Munk模型模拟的ρ值范围介于0.021—0.043(Haltrin 等,2000)。在采用水面以上测量法获取的数据计算遥感反射率时,一般取一个经验值带入计算。对于不同的采样点,它们的水面粗糙度和观测角度很难保持一致,这必然会对应着不同的菲涅尔反射系数。因此,在利用水面以上测量法获取数据进行~761 nm叶绿素荧光分析的过程中,这种菲涅尔反射差异带来的不确定性问题难以回避。
|
| 图 3 遥感反射率及其一阶微分与叶绿素浓度相关关系 Figure 3 Remote sensing reflectance and its correlation coefficient with chlorophyll concentration |
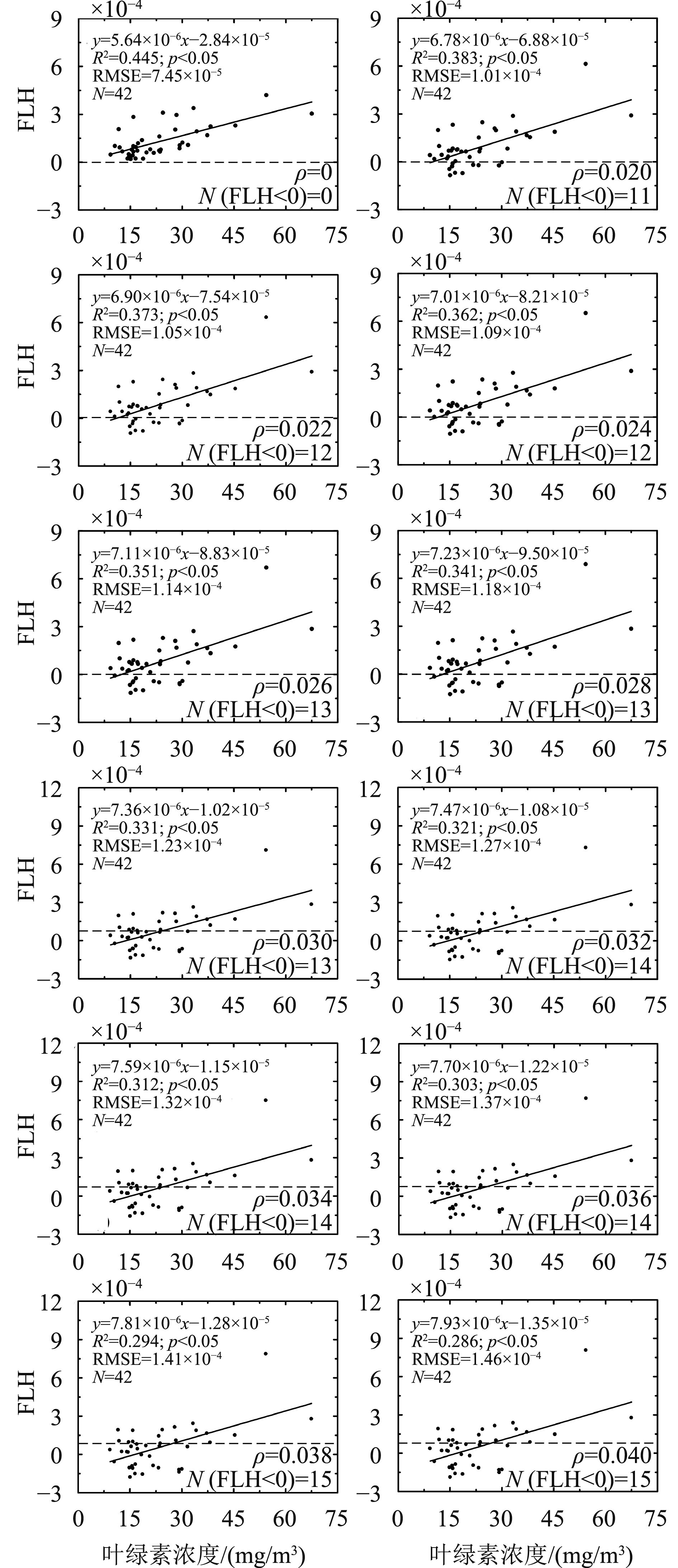
针对水面菲涅尔反射差异带来的不确定性,虽然不能完全剔除,但可以通过确定最优的菲涅尔系数,来最大程度的降低水面菲涅尔反射的不确定性影响。本研究中水面菲涅尔系数(ρ)的范围分别设定为0和0.020—0.040,后者ρ值的变化步长设定为0.002,分别带入计算,一共得到12组遥感反射率。利用FLH方法计算~761 nm的叶绿素荧光信号值,其左右基线波段分别设置为755 nm和771 nm。对12组采用不同菲涅尔系数计算得到的FLH(~761 nm),分别与叶绿素浓度进行线性统计分析,其结果如图4所示。
|
| 图 4 叶绿素荧光FLH(~761 nm)及其浓度的统计分析 Figure 4 Statistical relationship between FLH (~761 nm) and chlorophyll concentration |
FLH(~761 nm)与叶绿素浓度具有较好的线性关系,但随着水面菲涅尔系数从0变化到0.040,其R2从0.445降低到0.286,RMSE从7.45×10–5增加到1.46×10–4,相对的FLH(~761 nm)值也逐渐变小,同时表现出N(FLH<0)(FLH<0的样点数)的增加。虽然菲涅尔系数为0时,线性统计关系具有最高的R2和最小的RMSE,但这并不意味着菲涅尔反射的影响可以忽略。水面以上测量法获得的遥感反射率,因为天空散射光和水面菲涅尔反射系数的差异,会对~761 nm荧光信号的估算带来诸多不确定性影响,虽然上述统计分析结果具有一定的变化规律,但还难以厘清菲涅尔反射系数变化带来的不确定性影响,需要进一步开展荧光信号对菲涅尔系数的敏感性分析。
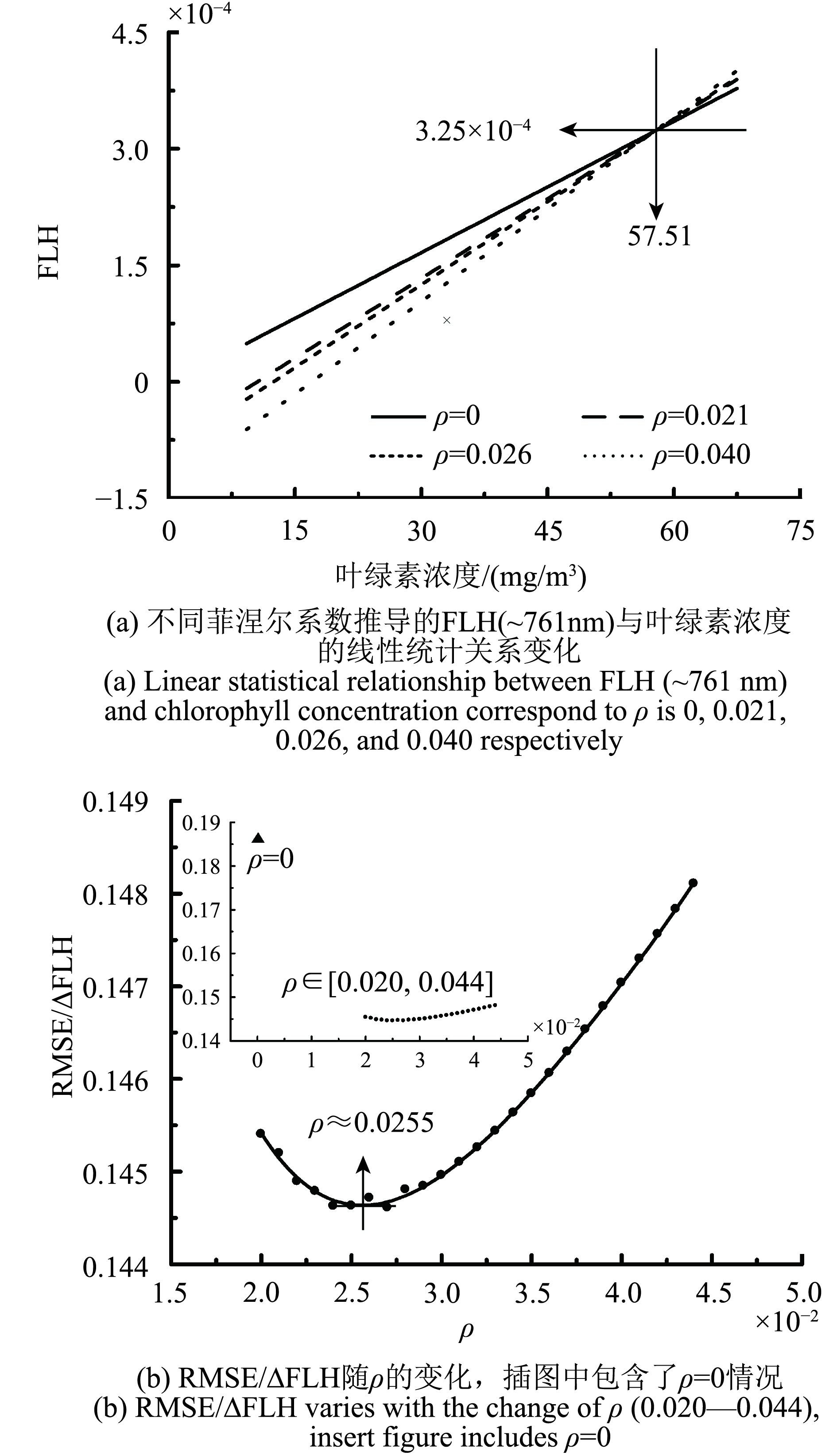
(4.3) FLH(~761 nm)对菲涅尔系数的敏感性分析FLH(~761 nm)与叶绿素浓度具有良好的线性统计关系,但随着水面菲涅尔系数的增大,该线性统计关系的R2逐渐降低,RMSE相对增大,FLH(~761 nm)的绝对值也发生变化。针对这种情况,还需要分析统计误差(RMSE)对FLH(~761 nm)变化的敏感性;可计算每组数据中最大与最小的叶绿素荧光信号的差值(ΔFLH=FLH(~761 nm)max–FLH(~761 nm)min),进一步利用统计误差与叶绿素荧光信号差值的比值(RMSE/ΔFLH)来进行敏感性分析(如图5),其表达的是每个观测值同线性模拟值之间的偏差在FLH范围中所占的比例。
结果表明:(1)菲涅尔反射系数的变化,对高浓度叶绿素的估算影响较小,对低浓度叶绿素荧光估算产生的不确定性影响较大(如图5(a))。(2)RMSE与ΔFLH的比值,并不与水面菲涅尔反射系数呈线性变化关系。不考虑菲涅尔反射影响时(ρ=0),RMSE/ΔFLH不小于0.18(如图5(b)中插图所示),虽然具有最好的统计关系(图4(a),最大的R2与最小的RMSE),但高估了低浓度叶绿素荧光信号,从而产生了较大的误差;考虑菲涅尔反射的影响时(ρ在0.020—0.044变化),RMSE/ΔFLH相对变化较小,在ρ=0.0255时,RMSE/ΔFLH最小(如图5(b)),估算的叶绿素荧光信号相对稳定。此外,当菲涅尔系数较大时,又会低估低浓度叶绿素荧光,并扩大水面菲涅尔反射的不确定性影响。对于水面以上测量法,虽然难以获得真实的菲涅尔反射系数,但合理的菲涅尔系数设定,还是有助于利用该波段进行叶绿素荧光的准确估算。
|
| 图 5 FLH(~761 nm)对菲涅尔系数的敏感性分析 Figure 5 Sensitivity of FLH (~761 nm) to Fresnel reflection coefficient |
太阳诱导叶绿素荧光普遍存在于650—800 nm光谱范围内,在~685 nm和~740 nm附近有两个不同的荧光峰特征;大气中氧气(O2-A)在~761 nm具有吸收作用,水体遥感反射率因叶绿素荧光信号在该吸收波段的填充,所以表现出反射峰的特征,且该形态特征又随着观测设备光谱分辨率的差异而不同。
利用水体遥感反射率~761 nm峰值提取的荧光信号,能用于水体叶绿素浓度估算并具备特定的优势。水面以上测量法获取的离水辐亮度,会受到水面菲涅尔反射的天空光的影响,其计算依赖于天空光辐亮度和水面菲涅尔系数。因观测时间、角度、水面风速等不同,会导致菲涅尔系数具有较大差异,给~761 nm叶绿素荧光信号的识别与估算带来了诸多不确定性影响。模拟不同菲涅尔系数对应的遥感反射率,基于遥感反射率FLH(~761 nm)与叶绿素浓度的线性统计关系,采用RMSE与ΔFLH的比值,结合统计参数,定量评估了FLH(~761 nm)对水面菲涅尔系数变化的敏感性。菲涅尔系数为0时,虽然具有较好的统计关系,但会导致对叶绿素荧光信号的高估,从而产生较大误差;正常范围内的菲涅尔系数,产生的误差相对较小,但是较大的菲涅尔系数又会导致对~761 nm叶绿素荧光信号的低估。在低浓度叶绿素水体荧光估算中,上述差异比较显著;在高浓度叶绿素水体中,这些差异会缩小并可忽略。
太阳诱导水体藻类叶绿素荧光光谱,能反映不同藻类光合系统(光系统Ⅰ和光系统Ⅱ)的特征。在今后的研究中,是否有可能结合~685 nm和~761 nm二处的荧光信号,实现对自然水体中不同藻类光合作用的深入分析,是未来值得关注的研究点。
志 谢 感谢美国南佛罗里达大学海洋学院胡传民教授提供的美国切萨皮克湾实测数据。
| [1] | Abbott M R, Brink K H, Booth C R, Blasco D, Swenson M S, Davis C O and Codispoti L A. Scales of variability of bio-optical properties as observed from near-surface drifters[J]. Journal of Geophysical Research: Oceans, 1995, 100 (C7) : 13345 –13367. DOI: 10.1029/94JC02457 |
| [2] | Abbott M R and Letelier R M. 1999. Algorithm Theoretical Basis Document Chlorophyll Fluorescence (MODIS Product Number 20). Greenbelt, Md: NASA: 5–38 |
| [3] | Al Shehhi M R, Gherboudj I, Zhao J, Mezhoud N and Ghedira H. 2013. Evaluating the performance of MODIS FLH ocean color algorithm in detecting the harmful algae blooms in the Arabian gulf and the gulf of Oman//Proceedings of 2013 Oceans-San Diego. San Diego, CA: IEEE: 1–7 [DOI: 10.23919/OCEANS.2013.6741163] |
| [4] | Alonso L, Gomez-Chova L, Vila-Frances J, Amoros-Lopez J, Guanter L, Calpe J and Moreno J. Improved fraunhofer line discrimination method for vegetation fluorescence quantification[J]. IEEE Geoscience and Remote Sensing Letters, 2008, 5 (4) : 620 –624. DOI: 10.1109/LGRS.2008.2001180 |
| [5] | Chamberlin W S, Booth C R, Kieffer D A, Morrow J H and Murphy R C. Evidence for a simple relationship between natural fluorescence, photosynthesis and chlorophyll in the sea[J]. Deep Sea Research Part A. Oceanographic Research Papers, 1990, 37 (6) : 951 –973. DOI: 10.1016/0198-0149(90)90105-5 |
| [6] | Department of Commerce, NOAA, NOS and SP. 1998. Estuarine Bathymetric Digital Elevation Models (30 Meter and 3 Arc Second Resolution) Derived from Source Hydrographic Survey Soundings Collected by NOAA[EB/OL]. Silver Spring, MD: NOAA’s Ocean Service, Special Projects (SP). [2015-01-22]. http://estuarinebathymetry.noaa.gov/ |
| [7] | Fischer J and Kronfeld U. Sun-stimulated chlorophyll fluorescence 1: influence of oceanic properties[J]. International Journal of Remote Sensing, 1990, 11 (12) : 2125 –2147. DOI: 10.1080/01431169008955166 |
| [8] | Fisher T R, Peele E R, Ammerman J W and Harding L W Jr. Nutrient limitation of phytoplankton in Chesapeake Bay[J]. Marine Ecology Progress Series, 1992, 82 : 51 –63. DOI: 10.3354/meps082051 |
| [9] | Gower J and King S. Validation of chlorophyll fluorescence derived from MERIS on the west coast of Canada[J]. International Journal of Remote Sensing, 2007, 28 (3/4) : 625 –635. DOI: 10.1080/01431160600821010 |
| [10] | Gower J F R and Borstad G A. Mapping of phytoplankton by solar-stimulated fluorescence using an imaging spectrometer[J]. International Journal of Remote Sensing, 1990, 11 (2) : 313 –320. DOI: 10.1080/01431169008955022 |
| [11] | Haltrin V I, McBride W E and Weidemann A D. Fresnel reflection by wavy sea surface//Proceedings of IEEE 2000 International Geoscience and Remote Sensing Symposium[J]. Honolulu, HI: IEEE, 2000, 5 : 1863 –1865. DOI: 10.1109/IGARSS.2000.858148 |
| [12] | Hu C M, Muller-Karger F E, Taylor C, Carder K L, Kelble C, Johns E and Heil C A. Red tide detection and tracing using MODIS fluorescence data: a regional example in SW Florida coastal waters[J]. Remote Sensing of Environment, 2005, 97 (3) : 311 –321. DOI: 10.1016/j.rse.2005.05.013 |
| [13] | Kiefer D A and Reynolds R A. 1992. Advances in understanding phytoplankton fluorescence and photosynthesis//Falkowski P G, Woodhead A D and Vivirito K, eds. Primary Productivity and Biogeochemical Cycles in the Sea. New York: Springer: 155–174 |
| [14] | Krause G H and Weis E. Chlorophyll fluorescence and photosynthesis: the basics[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1991, 42 : 313 –349. DOI: 10.1146/annurev.pp.42.060191.001525 |
| [15] | Letelier R M and Abbott M R. An analysis of chlorophyll fluorescence algorithms for the moderate resolution imaging spectrometer (MODIS)[J]. Remote Sensing of Environment, 1996, 58 (2) : 215 –223. DOI: 10.1016/S0034-4257(96)00073-9 |
| [16] | Lu Y C, Li L H, Hu C M, Li L, Zhang M W, Sun S J and Lv C G. Sunlight induced chlorophyll fluorescence in the near-infrared spectral region in natural waters: interpretation of the narrow reflectance peak around 761 nm[J]. Journal of Geophysical Research: Oceans, 2016, 121 (7) : 5017 –5029. DOI: 10.1002/2016JC011797 |
| [17] | Maxwell K and Johnson G N. Chlorophyll fluorescence-a practical guide[J]. Journal of Experimental Botany, 2000, 51 (345) : 659 –668. DOI: 10.1093/jexbot/51.345.659 |
| [18] | Meroni M, Rossini M, Guanter L, Alonso L, Rascher U, Colombo R and Moreno J. Remote sensing of solar-induced chlorophyll fluorescence: review of methods and applications[J]. Remote Sensing of Environment, 2009, 113 (10) : 2037 –2051. DOI: 10.1016/j.rse.2009.05.003 |
| [19] | O’Malley R T, Behrenfeld M J, Westberry T K, Milligan A J, Shang S L and Yan J. Geostationary satellite observations of dynamic phytoplankton photophysiology[J]. Geophysical Research Letters, 2014, 41 (14) : 5052 –5059. DOI: 10.1002/2014GL060246 |
| [20] | Stegmann P M, Lewis M R, Davis C O and Cullen J J. Primary production estimates from recordings of solar-stimulated fluorescence in the Equatorial Pacific at 150°W[J]. Journal of Geophysical Research: Oceans, 1992, 97 (C1) : 627 –638. DOI: 10.1029/91JC02014 |
| [21] | 唐军武, 田国良, 汪小勇, 王晓梅, 宋庆君. 水体光谱测量与分析Ⅰ: 水面以上测量法[J]. 遥感学报, 2004, 8 (1) : 37 –44. Tang J W, Tian G L, Wang X Y, Wang X M and Song Q J. The methods of water spectra measurement and analysis I: above-water method[J]. Journal of Remote Sensing, 2004, 8 (1) : 37 –44. DOI: 10.11834/jrs.20040106 |
| [22] | Wolanin A, Dinter T, Rozanov V, Noël S, Vountas M, Burrows J P and Bracher A. 2014. Marine fluorescence from high spectrally resolved satellite measurements//Proceedings of EGU General Assembly. Vienna: EGU: 16 |
| [23] | Zarco-Tejada P J, Berni J A J, Suárez L, Sepulcre-Cantó G, Morales F and Miller J R. Imaging chlorophyll fluorescence with an airborne narrow-band multispectral camera for vegetation stress detection[J]. Remote Sensing of Environment, 2009, 113 (6) : 1262 –1275. DOI: 10.1016/j.rse.2009.02.016 |

