|
|
|
收稿日期: 2014-12-11; 修订日期: 2015-07-31; 优先数字出版日期: 2015-08-07
基金项目: 国家科技支撑计划(编号:2012BAH32B03); 国家自然科学基金(编号:41301452, 41204332); 广东省水资源节约和保护资金项目(编号:FLXGL2014D41); 海洋公益性行业科研专项(编号:201205040); 广州市珠江科技新星项目(编号:2013J2200073)
第一作者简介: 梁业恒(1987-),男,博士研究生,现从事水体重金属含量遥感反演模型研究。E-mail:liangyeheng@163.com
中图分类号: TP701
文献标识码: A
文章编号: 1007-4619(2016)01-0027-08
|
摘要
金属溶解物的吸收光谱测量是水体重金属遥感反演的关键。本文使用水体透射光测量装置,利用ASD光谱仪测量相同厚度不同浓度铜离子溶液的透射光辐亮度,运用比值法计算水体铜离子消光系数和吸收系数,最终得到400-900 nm波长范围内的水体铜离子单位浓度吸收系数光谱。该方法可以较好地消除实验装置和水中悬浮物的影响。结果表明,水体铜离子在蓝、绿光波段吸收作用极小,红光至红外波段的吸收系数快速增大,与铜离子溶液颜色相吻合;吸收峰位于810 nm。多次独立实验测量所得结果的标准差很小,说明测量结果稳定。与Jancsò测量结果的对比分析表明,本文结果与国际上著名测量结果接近,且部分波段的测量值更为合理。
关键词
水体重金属污染; 铜离子; 吸收光谱; 测量装置; 水质遥感
1 引 言
水体重金属污染是严重威胁人类健康乃至生命安全的污染类型之一。随着中国对矿产资源的开发力度加大及电镀、印染等污染型企业数量的增多,水体重金属污染事件越发频繁且污染水域面积不断扩大。利用遥感技术进行水体重金属污染监测具有巨大的潜力。但目前尚未实现水体重金属的有效遥感提取。重金属遥感的技术关键是水体重金属吸收系数光谱的精确测量。水体中的铜离子是重金属污染的常见成分之一,而且铜离子吸收光谱特征明显,利用遥感方法进行水中铜离子含量提取具有可行性。所以,本文以铜离子为突破口进行重金属吸收光谱测量研究。使用水体透射光测量装置,对铜离子的吸收系数进行测量,为该金属离子的遥感反演打下基础。
很多学者(Holmes和McClure,1957;Smith和Loewenstein,1976;Freeman等,1985;Ordal等,1983,1985,1987,1988;Tilaki等,2007;Kaminskien等,2013;Dolenko等,2014)对铜元素或其化合物的不同波长范围的光学性质进行了研究。然而,这些学者主要的测量波长范围集中在远红外、亚毫米、厘米波长范围内,均不在光学遥感的探测波段范围内;并且研究对象以单质铜为主,与本文研究的水体铜离子存在形式不同。Vosburgh和Cooper(1941),Bjerrum等(1954),Bjerrum和Agarwala(1980)利用分光光度计分别测量了500—680 nm和600—1200 nm五水硫酸铜的吸光度(透过率倒数的常用对数)。Jancsò(2005)利用分光光度计测量了0.1 cm厚度的3种同位素水分子下的400—1100 nm 硫酸铜溶液的摩尔吸收系数(其数值是单位浓度消光系数的1/ln10)。
总体上,前人测量水体铜离子吸收系数的过程存在以下问题:(1)实验过程使用小玻璃容器(厚度约为0.1 cm),光穿过的路径过短,可见光范围结果出现明显不稳定现象;(2)测量的过程中,待测溶液和纯水分别用两个小容器装起来,忽略两个小容器的透过率差异,运用比值法得到的计算结果存在一定的误差;(3)未有效分离水和悬浮物的影响,得到的是五水硫酸铜溶液总的消光系数,并不是水体铜离子的吸收系数。
鉴于上述存在问题,本文采用的实验装置可以方便地改变测量水体厚度,调整透射光穿过水体的路径长度,使各波长测得的辐亮度均在ASD最佳探测范围内,获得最好的信噪比结果。然后通过比值法可以很好消除实验装置以及水和水中悬浮物的影响,获得精度和稳定程度较高的测量结果。本装置已成功测量出350—920 nm悬浮泥沙消光系数(何颖清等,2011)和400—2500 nm纯水吸收系数(邓孺孺等,2012a,2012b)。故本文将这套测量装置用于可见光波段和近红外波段(400—900 nm)铜离子的吸收系数光谱的测量。
2 实验原理
2.1 测量装置
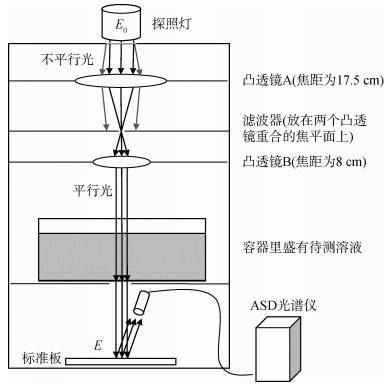
使用邓孺孺等人(2012a,2012b)测量纯水吸收系数的装置进行。如图 1所示,该装置通过探照灯强光源和加了滤波器的透镜组获得平行光束。该光束从上至下穿过盛有待测溶液的玻璃缸,照射到底部的标准板上形成光斑,溶液的散射绝大部分被缸底的黑板所挡住。用ASD连续光谱仪测量标准板上该光斑的反射辐亮度。然后根据不同浓度溶液光斑的反射辐亮度计算出溶液的光学厚度。
本文所用光谱仪为ASD FieldSpec3,探测波长范围为350—2500 nm,其光谱采样间隔最高可达2 nm,数据间隔为1 nm,测量结果稳定,被广泛用于辐亮度、反射率等参数的测量。
2.2 测量方法
使用纯度为99.99%的五水硫酸铜粉末试剂配制铜离子溶液然后进行测量实验。在固定厚度的纯水中逐次加入定量的五水硫酸铜粉末,并得到溶液的光学厚度,然后计算出铜离子的单位浓度吸收系数光谱曲线。由于硫酸根在光学波段的吸收作用极微可以忽略,所以五水硫酸铜溶液的吸收作用可认为是铜离子的吸收作用。实验用的纯水采用蒸馏水,由Research超纯水机制备。具体操作方法如下:
将ASD光谱仪先预热1 h,安装好透镜组和滤波器,然后放上玻璃缸和标准板,往玻璃缸加入厚度0.15 m的纯水,水面静止后测量直射光穿透纯水后经过标准板反射的辐亮度;再往纯水中逐次加入质量为0.5 g的五水硫酸铜粉末并充分搅拌,测量每次加入硫酸铜粉末后直射光穿透溶液后投射到标准板上的反射辐亮度。直至溶液中的五水硫酸铜含量增至150 g。
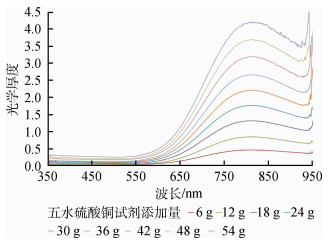
将五水硫酸铜粉末的添加量从0.5 g递增到150 g,通过多次独立实验,寻找ASD光谱仪探测的最佳浓度,发现当添加量小于6 g或大于60 g时,得到的辐亮度曲线在400 nm以前和650 nm以后出现明显波动,噪声较大,这是由于当添加量太小的时候,水中其他杂质对光的衰减影响远远超过了水体铜离子,对短波范围造成明显影响;而当添加量太大的时候,溶液的透光性已经很弱,超过了ASD光谱仪探测的下限值,测量数据出现异常。所以,经过剔除异常数据,把添加量6—54 g计算得到的吸收系数作为测量的最终结果。
3 数据处理
根据邓孺孺等人(2012a,2012b)结论,光谱仪接收到的辐亮度可表示为:
$L = \frac{1}{\pi }{c_d}{E_0}{T_{ws}}{e^{ - \tau }}{T_g}{R_b}$ (1)
可见,测量得到的辐亮度L与距离衰减因子cd、光源直射光辐照度E0、水表面透过率Tws、玻璃容器底部的透过率Tg、标准板的反射率Rb、待测溶液的透过率e-τ有关。除了待测溶液的透过率e-τ,其余变量均为取决于实验环境和装置本身的物理量,在实验中保持不变,但是直接对其测量极其困难,本文通过测量光束经纯水和铜离子溶液透射后在标准板上的反射辐亮度,然后对其进行比值运算,将公式中相同的物理量约去。
3.1 光学厚度的计算
对于均质溶液,其光学厚度τ与消光系数k的关系可表示为:
$\tau = hk$ (2)
式中,h为待测溶液的厚度,取值为0.15 m;k为待测溶液的消光系数,单位为m-1。
对于待测溶液的光学厚度τ,认为由水分子光学厚度τw、可能存在的悬浮物等其他杂质光学厚度τs和第n次添加试剂后的铜离子光学厚度τCun 3部分组成。
对于第1次的纯水测量,即τCu1=0,标准板反射的辐亮度可表示为:
${L_1} = \frac{1}{\pi }{c_d}{E_0}{T_{ws}}{e^{ - {\tau _1}}}{T_g}{R_b}$ (3)
对于第n次测量,标准板反射的辐亮度可表示为:
${L_n} = \frac{1}{\pi }{c_d}{E_0}{T_{ws}}{e^{ - {\tau _n}}}{T_g}{R_b}$ (4)
式(3)与式(4)作比值运算,然后取自然对数,可以得到(τn-τ1)的值,其中变化的只有铜离子光学厚度τCun,故该值即为第n次测量的铜离子光学厚度:
${\tau _{Cun}} = {\tau _n} - {\tau _1} = \ln \frac{{{L_1}}}{{{L_n}}}$ (5)
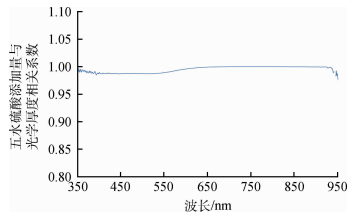
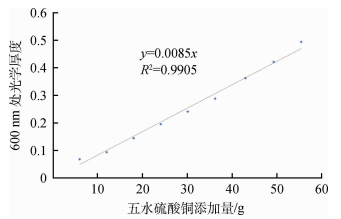
图 2为实验计算得到的五水硫酸铜粉末添加量从6—54 g的水中铜离子的光学厚度,显示不同浓度的铜离子溶液的光学厚度曲线相互平行,而且从图 3中各波长算出的光学厚度与浓度的相关系数可知,在400—900 nm波长范围内的五水硫酸铜粉末添加量与光学厚度的相关系数接近于1。图 4为600 nm处水体铜离子光学厚度与其浓度的散点图,显示二者成完好的线性相关。说明水体铜离子光学厚度τCun与浓度D成正比,与Beer(1852)提出的光吸收定律吻合。
3.2 消光系数和吸收系数的计算
根据比尔定律(Beer,1852),铜离子的光学厚度可以表示为:
${\tau _{Cun}} = h{D_n}{k_{Cu}}$ (6)
式中,Dn为第n次测量铜离子浓度,单位为g/L,kCu为铜离子单位浓度消光系数,单位为(m·g/L)-1。故:
${k_{Cu}} = \frac{{{\tau _{Cun}}}}{{h \cdot {D_n}}}$ (7)
由于水中铜离子的直径非常小,故散射类型可看作瑞利散射,与等体积的水分子散射程度相近,其作用已在式(5)中被消除。所以,最终得到水中铜离子的单位浓度吸收系数为:
${\alpha _{Cu}} \approx {k_{Cu}}$ (8)
3.3 实验结果
经过剔除异常曲线,最终把添加量6—54 g计算出来的10组吸收系数光谱取其算术平均值作为测量最终结果,其结果的标准差σ用式(9)计算:
$\sigma = \sqrt {\frac{1}{N}\sum\limits_{i = 1}^N {{{\left({{x_i} - \bar x} \right)}^2}} } $ (9)
式中,N为测量次数,xi为第i次测量值,$\bar x$为N次测量值的算术平均值。
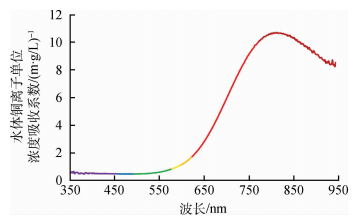
表 1为水体铜离子单位浓度吸收系数αu和标准差σ随波长λ变化函数表,图 5为水体铜离子单位浓度吸收系数光谱曲线,可以看出水体铜离子在蓝、绿光波段吸收作用极小,波长增至550 nm后吸收系数逐渐增强,650 nm至770 nm增速达到最大,吸收峰位于810 nm,其后随波长增加,铜离子吸收作用又逐渐变小。
Table 1 Absorption coefficient αu and standard deviation σ of copper ion as a function of wavelength λ 下载CSV
| λ/nm | αu/(m·g/L)-1 | σ | λ/nm | αu/(m·g/L)-1 | σ | λ/nm | αu/(m·g/L)-1 | σ |
| 400 | 0.5371 | 0.0034 | 570 | 0.7869 | 0.0034 | 740 | 8.6143 | 0.0040 |
| 405 | 0.5503 | 0.0033 | 575 | 0.8370 | 0.0034 | 745 | 8.9019 | 0.0040 |
| 410 | 0.5341 | 0.0037 | 580 | 0.8945 | 0.0034 | 750 | 9.1748 | 0.0039 |
| 415 | 0.5273 | 0.0037 | 585 | 0.9544 | 0.0034 | 755 | 9.4042 | 0.0040 |
| 420 | 0.5254 | 0.0038 | 590 | 1.0273 | 0.0034 | 760 | 9.6185 | 0.0041 |
| 425 | 0.5315 | 0.0037 | 595 | 1.1059 | 0.0035 | 765 | 9.8148 | 0.0043 |
| 430 | 0.5304 | 0.0037 | 600 | 1.1863 | 0.0035 | 770 | 10.0166 | 0.0042 |
| 435 | 0.5239 | 0.0035 | 605 | 1.2862 | 0.0035 | 775 | 10.1589 | 0.0042 |
| 440 | 0.5215 | 0.0036 | 610 | 1.4007 | 0.0035 | 780 | 10.2980 | 0.0043 |
| 445 | 0.5214 | 0.0036 | 615 | 1.5260 | 0.0035 | 785 | 10.4150 | 0.0042 |
| 450 | 0.5146 | 0.0036 | 620 | 1.6686 | 0.0035 | 790 | 10.5223 | 0.0041 |
| 455 | 0.5071 | 0.0035 | 625 | 1.8238 | 0.0035 | 795 | 10.5962 | 0.0041 |
| 460 | 0.5027 | 0.0036 | 630 | 1.9975 | 0.0035 | 800 | 10.6120 | 0.0044 |
| 465 | 0.5024 | 0.0035 | 635 | 2.1851 | 0.0035 | 805 | 10.6858 | 0.0041 |
| 470 | 0.5023 | 0.0035 | 640 | 2.3942 | 0.0035 | 810 | 10.6948 | 0.0041 |
| 475 | 0.5042 | 0.0035 | 645 | 2.6140 | 0.0036 | 815 | 10.6481 | 0.0047 |
| 480 | 0.4962 | 0.0035 | 650 | 2.8548 | 0.0035 | 820 | 10.6456 | 0.0044 |
| 485 | 0.5002 | 0.0034 | 655 | 3.1072 | 0.0036 | 825 | 10.6272 | 0.0043 |
| 490 | 0.5007 | 0.0034 | 660 | 3.3814 | 0.0036 | 830 | 10.5698 | 0.0047 |
| 495 | 0.5018 | 0.0034 | 665 | 3.6673 | 0.0036 | 835 | 10.4975 | 0.0047 |
| 500 | 0.5049 | 0.0034 | 670 | 3.9691 | 0.0037 | 840 | 10.4620 | 0.0044 |
| 505 | 0.5087 | 0.0033 | 675 | 4.2845 | 0.0037 | 845 | 10.3768 | 0.0047 |
| 510 | 0.5115 | 0.0033 | 680 | 4.6058 | 0.0037 | 850 | 10.3329 | 0.0040 |
| 515 | 0.5202 | 0.0034 | 685 | 4.9440 | 0.0037 | 855 | 10.1888 | 0.0044 |
| 520 | 0.5249 | 0.0034 | 690 | 5.2861 | 0.0037 | 860 | 10.0721 | 0.0045 |
| 525 | 0.5396 | 0.0034 | 695 | 5.6343 | 0.0037 | 865 | 9.8866 | 0.0052 |
| 530 | 0.5500 | 0.0033 | 700 | 5.9795 | 0.0038 | 870 | 9.8898 | 0.0041 |
| 535 | 0.5701 | 0.0033 | 705 | 6.3349 | 0.0038 | 875 | 9.7528 | 0.0044 |
| 540 | 0.5844 | 0.0034 | 710 | 6.6868 | 0.0038 | 880 | 9.6095 | 0.0045 |
| 545 | 0.6074 | 0.0034 | 715 | 7.0318 | 0.0037 | 885 | 9.4949 | 0.0042 |
| 550 | 0.6317 | 0.0034 | 720 | 7.3662 | 0.0038 | 890 | 9.2784 | 0.0060 |
| 555 | 0.6630 | 0.0034 | 725 | 7.6930 | 0.0039 | 895 | 9.2962 | 0.0044 |
| 560 | 0.6980 | 0.0034 | 730 | 8.0265 | 0.0038 | 900 | 9.1165 | 0.0050 |
| 565 | 0.7393 | 0.0034 | 735 | 8.3213 | 0.0039 |
4 消光系数误差讨论
4.1 数据稳定性
由于本文采用比值法,控制了影响测量装置的环境因素,只改变测量溶液的浓度,所以,很好地消除了系统误差带来的影响,结果比较稳定,因而标准差很小。标准差随着波长的增大稍有增加,是因为长波波段水的吸收作用非常大,投射到标准板上的光在该波段范围内能量较弱,测量装置带来的误差和人为误差影响作用比例增大,影响测量结果稳定性。光源的衰减也会造成一定的误差,但测量过程尽可能在探照灯衰减到99%前完成。而且将溶液均匀搅拌使得实际浓度与理论值一致。所以,总体上测量结果标准差仍然较小,均在误差允许范围内。
4.2 与其他算法结果对比
国际上Vosburgh和Cooper(1941)、Bjerrum等(1954),Bjerrum和Agarwala(1980)以及Jancsò(2005)等人对硫酸铜溶液的吸收系数进行了测量,但Vosburgh和Bjerrum是早期20世纪四五十年代测量结果,受到当时的实验条件限制,仅对其部分波长范围进行了测量,且测量精度有限。而Jancsò(2005)则在前人的研究基础上对其400—1100 nm连续波长范围的吸收系数进行了测量,是目前国际上普遍认可和较新的成果。所以,将Jancsò的测量结果与本文的测量结果进行比较。
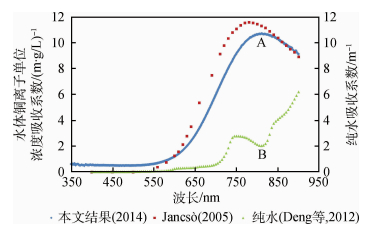
由图 6可见,Jancsò在350—600 nm测量值略小,而在600—850 nm测量值大于本文结果,850—900 nm测量值一致。本文认为二者差异的原因是:(1)在350—600 nm,由于水中气泡对短波影响较大,造成本文测量值在此波段比Jancsò稍大。另外,由于Jancsò使用的容器厚度太小(h=0.1 cm),造成直射光穿透路程小,根据我们的测量结果铜离子在蓝绿光波长的吸收很弱,故短光程使得吸收作用变化太小,以致超过了仪器在该波长探测的下限,造成该波长的吸收作用未被测量出来,所以Jancsò测量值几乎为零。(2)在600—850 nm,由于水的吸收作用急剧增大,而Jancsò并没有消除水的影响,所以得到的结果比我们结果偏大。因此,认为本文结果比Jancsò更合理。
图 6中绿色曲线是邓孺孺等人(2012a,2012b)测量的纯水吸收系数光谱。本文把铜离子单位浓度吸收系数光谱(等效于铜离子浓度为1 g/L时的吸收系数)与纯水吸收系数光谱作对比分析,是因为纯水的吸收系数光谱与本文的铜离子吸收系数光谱有大部分相同的分布趋势,即在可见光波段吸收作用小,近红外波段吸收作用增大。在可见光波长范围,铜离子吸收红光波长能力比纯水强;在近红外波段,铜离子吸收峰在810 nm(A处),刚好是纯水吸收系数吸收区域750—900 nm的最小值(B处)。未来可根据二者吸收光谱的特点,进而利用遥感手段分离纯水中的铜离子。
4.3 验证
(1)标准板上光斑颜色
由图 7可见,直射光穿过纯水后光斑颜色为白色,而穿过较高浓度的铜离子溶液后光斑颜色变为青色。说明铜离子溶液在可见光波段确实吸收了光源中红光波段的能量,也说明了测量得到的铜离子单位浓度吸收系数曲线从蓝光向红光波段逐渐增大的趋势是合理的。
(2)浓度验证
为了检验本文测量的结果精度,独立测量了6条已知浓度的光学厚度曲线,利用式(6)算出溶液的浓度,与实际浓度进行比较。由于722 nm波长处的相关系数接近于1(R=0.9990),所以选取波长722 nm处的单位浓度吸收系数计算溶液浓度大小,计算结果如表 2所示。由表 2可知,如果浓度较大,相对误差将在3%以内。浓度较小相对误差稍大,是因为浓度小,容易受到水中杂质的影响。但总体相对误差仍在5%以内,精度较高。
| 计算值/(g/L) | 实际值/(g/L) | 绝对误差/(g/L) | 相对误差/% |
| 3.2030 | 3.3430 | 0.1400 | 4.37 |
| 3.8260 | 4.0156 | 0.1896 | 4.95 |
| 4.5644 | 4.6849 | 0.1205 | 2.64 |
| 5.2102 | 5.3523 | 0.1421 | 2.73 |
| 6.1227 | 6.0188 | 0.1039 | 1.70 |
| 6.8027 | 6.6936 | 0.1091 | 1.60 |
5 机理分析与结论
5.1 机理分析
由实验测量得到的水体铜离子单位浓度吸收系数光谱可知:(1)在可见光波段(400—750 nm),其值总体较小,蓝绿光波段要比红光波段小,说明水体铜离子对红光的吸收作用比蓝绿光强,故铜离子溶液呈现青色(吸收颜色的补色)。这是因为当五水硫酸铜晶体溶解于水后,二价铜离子与6个水分子结合,由原子轨道理论和晶体场理论可知,二价铜离子的最外层电子结构为3 d9,是属于过渡金属离子d9价电子结构,与水分子结合过程中二价铜离子最外层d轨道会发生分裂,而分裂后两个d轨道形成能级差,且正好等于红光波长的能量,所以当复合光(白光)穿过溶液时,二价铜离子最外层电子会吸收其中红光波长的能量,使其从低能量的d轨道(含6个电子)跃迁到高能量的d轨道(含3个电子),即发生“d-d跃迁”,从而使得铜离子溶液最终呈现青色。(2)在近红外波段(750—900 nm),测量得到吸收系数光谱在近红外波段810 nm处达到最大值,这与Halpern和Harkness(1959)以及Freeman等人(1985)结果相吻合。说明了水体铜离子对该波长的吸收作用最大,也反映了该波长对水体中铜离子浓度的变化最为敏感。
5.2 结论
本文改进了邓孺孺等人(2012a,2012b)测量纯水吸收系数的实验装置,使得每次独立实验环境客观上得到更好的一致性,避免了一些实验装置带来的系统误差,使得比值法精度更高。并计算出水体铜离子单位浓度吸收系数光谱。与Jancsò测量结果进行了对比分析,认为本文测量结果更加合理。
实验证明,水体铜离子的光学厚度在400—900 nm 的波段范围内与其浓度成正比。实验得到的吸收光谱结果,其特征与二价铜离子轨道理论和晶体场理论相吻合,浓度验证的结果也说明本次测量的单位浓度吸收系数在波长722 nm处精度较高,相对误差不超过5%。
同时,铜离子的吸收系数光谱在810 nm出现波峰,由此推断该波长对水体铜离子浓度变化的敏感性最高,同时也是纯水吸收区域的波谷,所以该波长可考虑将来用遥感手段从水体中分离铜离子的重要参考波长。
参考文献
-
Beer A. 1852. Bestimmung der Absorption des rothen Lichts in farbigen Flüssigkeiten. Annalen der Physik, 162(5):78-88[DOI:10.1002/andp.18521620505]
-
Bjerrum J, Ballhausen C J and Jørgensen C K. 1954. Studies on absorption spectra. I. Results of calculations on the spectra and configuration of copper (Ⅱ) ions. Acta Chemica Scandinavica, 8(7):1275-1289[DOI:10.3891/acta.chem.scand.08-1275]
-
Bjerrum J and Agarwala B V. 1980. Metal ammine formation in solution. XIX. On the formation of tetraamminedi-μ-hydroxodicopper (Ⅱ) and hydroxotetra-ammine complexes in ammoniacal copper (Ⅱ) solutions. Acta Chemica Scandinavica, A, 34:475-481[DOI:10.3891/acta.chem.scand.34a-0475]
-
Deng R R, He Y Q, Qin Y, Chen Q D and Chen L. 2012a. Pure water absorption coefficient measurement after eliminating the impact of suspended substance in spectrum from 400 nm to 900 nm. Journal of Remote Sensing, 16(1):174-191 (邓孺孺, 何颖清, 秦雁, 陈启东, 陈蕾. 2012a. 分离悬浮质影响的光学波段(400-900 nm)水吸收系数测量. 遥感学报, 16(1):174-191)[DOI:10.11834/jrs.2012183]
-
Deng RR, He Y Q, Qin Y, Chen Q D and Chen L. 2012b. Measuring pure water absorption coefficient in the near-infrared spectrum(900-2500 nm). Journal of Remote Sensing, 16(1):192-206 (邓孺孺, 何颖清, 秦雁, 陈启东, 陈蕾. 2012b. 近红外波段(900-2500 nm)水吸收系数测量. 遥感学报, 16(1):192-206)[DOI:10.11834/jrs.20121188]
-
Dolenko T A, Burikov S A, Laptinskiy K A, Laptinskaya T V, Rosenholm J M, Shiryaev A A, Sabirov A R and Vlasov I I. 2014. Study of adsorption properties of functionalized nanodiamonds in aqueous solutions of metal salts using optical spectroscopy. Journal of Alloys and Compounds, 586(S1):S436-S439[DOI:10.1016/j.jallcom.2013.01.055]
-
Freeman J E, Childers A G, Steele A W and Hieftje G M. 1985. A fiber-optic absorption cell for remote determination of copper in industrial electroplating baths. Analytica Chimica Acta, 177:121-128[DOI:10.1016/S0003-2670(00)82944-X]
-
Halpern J and Harkness A C. 1959. Spectra of some transition metal ions and complexes in D2O. The Journal of Chemical Physics, 31(4):1147-1149[DOI:10.1063/1.1730538]
-
He Y Q, Deng RR, Chen Q D, Chen L and Qin Y. 2011. Diffuse attenuation coefficient of suspended sediment based on ASD spectrometer. Acta Scientiarum Naturalium Universitatis Sunyatseni, 50(3):134-140 (何颖清, 邓孺孺, 陈启东, 陈蕾, 秦雁. 2011. 基于ASD光谱仪的悬浮泥沙光学衰减系数研究. 中山大学学报(自然科学版), 50(3):134-140)
-
Holmes O G and McClure D S. 1957. Optical spectra of hydrated ions of the transition metals. The Journal of Chemical Physics, 26(6):1686-1694[DOI:10.1063/1.1743606]
-
Jancsò G. 2005. Effect of D and 18O isotope substitution on the absorption spectra of aqueous copper sulfate solutions. Radiation Physics and Chemistry, 74(3/4):168-171[DOI:10.1016/j.radphyschem.2005.04.011]
-
Kaminskien Ž, Prosyevas I, Stonkut J and Guobien A. 2013. Evaluation of optical properties of Ag, Cu, and Co nanoparticles synthesized in organic medium. Acta Physica Polonica A, 123(1):111-114[DOI:10.12693/APhysPolA.123.111]
-
Ordal M A, Long L L, Bell R J, Bell S E, Bell R R, Alexander R WJr and Ward C A. 1983. Optical properties of the metals Al, Co, Cu, Au, Fe, Pb, Ni, Pd, Pt, Ag, Ti, and W in the infrared and far infrared. Applied Optics, 22(7):1099-1119[DOI:10.1364/AO.22.001099]
-
Ordal M A, Bell R J, Alexander R W Jr, Long L L and Querry M R. 1985. Optical properties of fourteen metals in the infrared and far infrared:Al, Co, Cu, Au, Fe, Pb, Mo, Ni, Pd, Pt, Ag, Ti, V, and W. Applied Optics, 24(24):4493-4499[DOI:10.1364/AO.24.004493]
-
Ordal M A, Bell R J, Alexander R W Jr, Long L L and Querry M R. 1987. Optical properties of Au, Ni, and Pb at submillimeter wavelengths. Applied Optics, 26(4):744-752[DOI:10.1364/AO.26.000744]
-
Ordal M A, Bell R J, Alexander R W Jr, Newquist L A and Querry M R. 1988. Optical properties of Al, Fe, Ti, Ta, W, and Mo at submillimeter wavelengths. Applied Optics, 27(6):1203-1209[DOI:10.1364/AO.27.001203]
-
Smith D R and Loewenstein E V. 1976. Optical constants of metal oxides in the far infrared region. Applied Optics, 15(4):859-861[DOI:10.1364/AO.15.000859]
-
Tilaki R M, Iraji Z A and Mahdavi S. 2007. Size, composition and optical properties of copper nanoparticles prepared by laser ablation in liquids. Applied Physics A, 88(2):415-419[DOI:10.1007/s00339-007-4000-2]
-
Vosburgh W C and Cooper G R. 1941. Complex ions. I. The identification of complex ions in solution by spectrophotometric measurements. Journal of the American Chemical Society, 63(2):437-442[DOI:10.1021/ja01847a025]
Abstract
The key to extracting heavy metal from water through remote sensing is to accurately obtain the absorption coefficient spectrum of the dissolved heavy metal. The first step is to calculate the absorption coefficient per unit concentration of each dissolved heavy metal. The absorption coefficient is an important parameter in our remote sensing inversion model of heavy metals in water. We measure copper ions, which are common heavy metals in water that display evident characteristics in the absorption spectrum. Therefore, extracting copper ions by using remote sensing is a breakthrough. We designed equipment, which can adjust the path length of passing light and provide accurate results at the visible and near-infrared wavelength range. Then, we use an Analytical Spectral Devices (ASD) spectrometer to measure the radiance of direct light passing through copper ion solutions with different concentrations on the standard board. Using the ratio method to eliminate environmental errors and the effect of suspended solids in water, we calculate the extinction coefficient and the absorption coefficient per g/L of copper ion solutions. Finally, we obtain the absorption spectrum per g/L of copper ions from 400 nm to 900 nm. The absorption coefficient in the blue and green solutions is very low but rapidly increases from the red to near-infrared region, which coincides with the color of copper ions. Maximum absorption is observed at 810 nm, and the absorption coefficient is larger in red than in blue and green. This observation is caused by the d-d transition in the outermost electrons of copper ions, which mostly absorb the energy of red color. We perform numerous independent experiments and find that the standard deviations of the results are minimal, indicating the stability of our measurement results. Our results are consistent and more reasonable and accurate than those of Jancsò's in some wavelength ranges. This conclusion is based on observations of the different light colors on the standard board between pure water and high concentration copper ion solutions. We use the absorption coefficient at 722 nm to calculate the concentration of some copper ion solutions and compare them with the real concentrations. The relative errors are less than 5%, which verifies the accuracy of our results at 722 nm. We conclude that the obtained absorption spectrum is reasonable and accurate. The results can be used as the base parameter in the remote sensing inversion model of copper ions in water. Our results suggest that the maximum absorption is at 810 nm, indicating that this wavelength is the most sensitive to copper ion concentration changes in water.
Key words
heavy metal pollution in water; copper ion; absorption spectrum; measuring equipment; water quality remote sensing