2. 西南石油大学材料科学与工程学院, 四川 成都 610500
2. School of Material Science and Engineering, Southwest Petroleum University, Chengdu, Sichuan 610500, China
目前,有机醇胺溶剂吸收酸性气体是工业上净化天然气的主要方法,其对H2S具有较好的吸收性,但在CO2含量较高的情况下对H2S选择吸收性较差,使应用受到一定的局限[1-3]。空间位阻胺与醇胺相比具有更高的脱硫选择性和更小的溶剂循环量,并能较大幅度降低能耗,达到节能的目的。因此,空间位阻胺迅速成为了研究的热点,在工业上被广泛应用[4-6]。空间位阻胺是指有机胺化合物分子中氨基的N原子上连接一个或多个体积较大的碳链(尤其是非线性碳链)基团的化合物。该碳链基团会对氨基产生空间位阻效应,抑制位阻胺与CO2的反应,进一步加强对H2S的选择吸收。有关空间位阻胺选择脱除H2S的研究工作已经被大量报道[7-11],但位阻胺溶液对H2S的吸收率与脱硫选择性随时间变化规律的研究却少有报道。这些研究对于位阻胺的工业应用具有非常重要的意义。
针对这一问题,本文自行设计并搭建了一套可用于进行位阻胺吸收H2S和CO2混合气体实验的装置,并利用此装置采用气体静态吸收法研究了几种常见的位阻胺TBE(叔丁氨基乙醇),TBDEE(叔丁氨基二乙氧基乙醇)和AMP(2-氨基-2-甲基-1-丙醇)溶液对H2S的脱除率和脱硫选择性随时间的变化规律,并对位阻胺溶液的再生性能进行了研究。
1 实验部分 1.1 原料H2S和CO2混合气(摩尔分数:H2S,15%;CO2,85%),成都中国测试技术研究院;叔丁氨基乙醇(TBE)和2-氨基-2-甲基-1-丙醇(AMP),南京森贝伽生物科技有限公司,分析纯AR;叔丁氨基二乙氧基乙醇(TBDEE),实验室自制;氢氧化钠(NaOH),成都科龙化工试剂厂,分析纯AR;去离子水。图 1为本文所用3种位阻胺的结构示意图。
 |
| 图1 空间位阻胺的结构示意图 Fig. 1 Structure of sterically hindered amines |
天然气采样钢瓶(500 mL),西安伽赛德实验仪器有限公司;高温高压反应釜(300 mL),山东威海环宇化工机械有限公司;KP810型号便携式H2S气体检测仪,济南如特科贸有限公司;GC-7860型气相色谱仪,上海辉世仪器设备有限公司。
本文实验装置如图 2所示,采用材质为哈氏合金C-276的金属管线连接设备各部件,反应釜材质与金属管线相同,混合气瓶与天然气采样瓶内衬涂有聚四氟乙烯涂层,以防止酸性气体腐蚀设备。反应釜排气口处架设尾气处理装置以吸收多余的H2S。实验采用气体静态吸收法在反应釜内恒温进行。
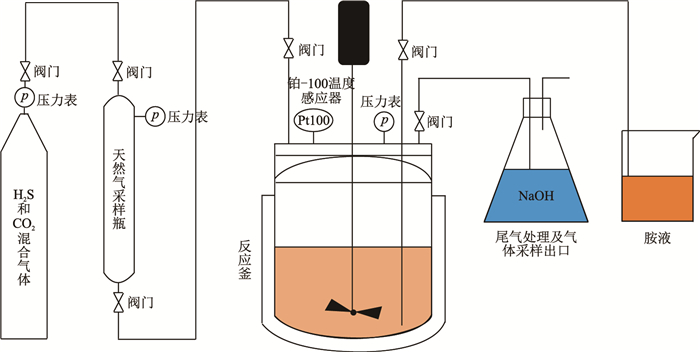 |
| 图2 气体吸收装置 Fig. 2 Apparatus of measuring the acid gas solubility in amines |
先将H2S和CO2混合气体通入采样瓶,记录采样瓶压力
在100 ℃条件下加热回流对吸收完酸性气体的位阻胺水溶液进行解吸再生,解吸时间分别选择1,2和3 h。最后将位阻胺再生溶液和新鲜位阻胺水溶液(未吸收过酸气的胺液)的性能进行比较,研究了位阻胺的再生性能。在之后的分析中将新鲜TBE溶液简称为0 h-TBE,解吸1 h、2 h和3 h的再生溶液分别简称为1 h-TBE、2 h-TBE和3 h-TBE。其他位阻胺的命名与TBE相似。
1.3 胺液脱硫选择性评价本文主要根据位阻胺对H2S的吸收率和选择因子两个方面来评价脱硫选择性。位阻胺对酸气的吸收率以及选择因子的具体计算如下。
1.3.1 气体实际物质的量利用Peng-Robinson气体状态方程计算出当前温度与压力下,气体的摩尔体积V
| $ p = \dfrac{{{\rm{R}}T}}{{V - b}} - \dfrac{a}{{V(V + b) + b(V - b)}} $ | (1) |
式中:
p─气体压强,Pa;
T─体系温度,K;
V─气体摩尔体积,mol/m3;
R─理想气体常数,R=8.314 J/(mol·K)。
参数a和参数b计算公式如下
| $ a = 0.45724\dfrac{{{\rm{R}}^2 T_{\rm{c}} ^2 }}{{p_{\rm{c}} }}\left[{1 + (0.37464 + 1.54226{\rm{\omega-0}}{\rm{.26992\omega }}^{\rm{2}} )\left( {1-\sqrt {\dfrac{T}{{T_{\rm{c}} }}} } \right)} \right]^2 $ | (2) |
| $ b = 0.0778\dfrac{{{\rm{R}}T{}_{\rm{c}}}}{{p_{\rm{c}} }} $ | (3) |
式中:
对于混合气体,Peng-Robison气体状态方程中的参数a和b需要采用以下的混合规则
| $ b = \sum {y_i b_i } $ | (4) |
| $ a = \sum\nolimits_i {\sum\nolimits_j {y_i y_j a_{ij} } } $ | (5) |
| $ a_{ij} = (a_i a_j )^{0.5} (1 - k_{ij} ) $ | (6) |
式中:
先利用Peng-Robison气体状态方程计算出H2S和CO2混合气体的摩尔体积V,再利用混合气体的实际体积
| $ n = \dfrac{{V'}}{V} $ | (7) |
利用采样瓶压力示数的变化
| $ n_{{\rm{H}}_2{\rm{S}}} = n_{\text{采样瓶}}\times0.15 $ | (8) |
| $ n_{{\rm{CO}}_2} = n_{\text{采样瓶}}\times0.85 $ | (9) |
利用取出气样时所对应读出的反应釜压力值
| $ n_{i, {\rm{H}}_2{\rm{S}}} = n_i\times y_{i, {\rm{H}}_2{\rm{S}}} $ | (10) |
| $ n_{i, {\rm{CO}}_2} = n_i\times y_{i, {\rm{CO}}_2} $ | (11) |
根据每次取样时反应釜内剩余气体中所含的H2S和CO2的物质的量来计算每个时间点胺液对酸气的吸收率
| $ \eta _{{\rm{H}}_2 {\rm{S}}} = \dfrac{{n_{{\rm{H}}_2 {\rm{S}}} {\rm{ - }}n_{i, {\rm{H}}_2 {\rm{S}}} }}{{n_{{\rm{H}}_2 {\rm{S}}} }} $ | (12) |
| $ \eta _{{\rm{CO}}_2 } = \dfrac{{n_{{\rm{CO}}_2 } {\rm{ - }}n_{i, {\rm{CO}}_2 } }}{{n_{{\rm{CO}}_2 } }} $ | (13) |
胺液对H2S的选择吸收因子S,为吸入液相中的H2S相对于CO2的浓度同吸收后气相中的H2S相对于CO2浓度的比较程度,选择因子S的值越大,代表胺液对H2S的选择吸收性越好。
通过下式计算
| $ S = \dfrac{{[{\rm{H}}_2 {\rm{S}}]_{\rm{l}} [{\rm{CO}}_2]_{\rm{g}} }}{{[{\rm{H}}_2 {\rm{S}}]_{\rm{g}} [{\rm{CO}}_2]_{\rm{l}} }} $ | (14) |
式中:
图 3为质量分数为30%的TBE,TBDEE和AMP 3种位阻胺水溶液对H2S和CO2吸收率随时间的变化曲线。根据曲线的上升趋势可看出,这几种位阻胺吸收H2S的速度远远大于吸收CO2的速度。这是因为空间位阻胺与H2S的反应属于传质反应,会在瞬时完成。其过程如式(15),该反应在常温下反应速率常数k>109 m3·kmol-1·s-1[12-13]。
 |
| 图3 空间位阻胺TBE,TBDEE,AMP分别对CO2和H2S的吸收率 Fig. 3 CO2 and H2S absorptivity of sterically hindered amine: TBE, TBDEE, AMP |
| $ {\rm{H}}_{\rm{2}} {\rm{S + R}}_{\rm{1}} {\rm{R}}_{\rm{2}} {\rm{NH\rightleftharpoons R}}_{\rm{1}} {\rm{R}}_{\rm{2}} {\rm{NH}}^{\rm{ + }} {\rm{ + SH}}^{\rm{ - }} $ | (15) |
而位阻胺和CO2的反应如式(16) 所示,该反应在30 ℃的反应速率常数k=7.72×103 m3·kmol-1·s-1,比式(15) 慢的多,这是由于位阻基团的影响,使生成的氨基甲酸盐中═NCOO─基团的稳定性变差,因此氨基甲酸盐易水解,减缓了位阻胺与CO2的反应速度。
| $ {\rm{CO}}_{\rm{2}} {\rm{ + 2R}}_{\rm{1}} {\rm{R}}_{\rm{2}} {\rm{NH}} \rightleftharpoons {\rm{R}}_{\rm{1}} {\rm{R}}_{\rm{2}} {\rm{NH}}_{\rm{2}} ^{\rm{ + }} {\rm{ + R}}_{\rm{1}} {\rm{R}}_{\rm{2}} {\rm{NCOO}}^{ - } $ | (16) |
另外,从图 3可知,几种位阻胺吸收酸性气体的速度关系为:TBE>AMP>TBDEE,这也和几种位阻胺的位阻效应相符。单独观察TBE的吸收率曲线,发现TBE吸收CO2的速度较慢,且对CO2的吸收率随着时间的增加而增大。而TBE吸收H2S的速率较快,4 min时吸收率已经达到82%,25 min时达到最大值94%,但25 min之后TBE对H2S的吸收率开始降低,到实验结束时降低到88%。这是因为在25 min时,TBE对H2S的吸收较快,达到了吸收平衡;而TBE对CO2的吸收较慢,在该时间点没有达到平衡。由于TBE吸收H2S和CO2是一个竞争反应,25 min以后,由于对CO2的吸收量增加,会使部分H2S从胺液中重新解吸出来,所以H2S的吸收率开始下降。AMP对H2S和CO2的吸收率随时间的变化曲线与TBE的变化规律类似。不同的是,AMP在35 min时才对H2S达到吸收平衡。这是因为AMP吸收H2S的速度比TBE慢,达到平衡所用的时间会延长。而TBDEE吸收酸性气体的速度为三者最慢,在实验结束时没有达到平衡,所以TBDEE对H2S和CO2的吸收率随反应时间的进行而增加。
图 4为TBE、AMP和TBDEE对H2S的选择吸收因子随时间变化的曲线。由图 4可看出,TBE和AMP的选择因子随反应时间的进行呈现先增大后减小的趋势。这是因为在位阻胺刚开始吸收酸性气体时,位阻胺吸收H2S的速度要大于吸收CO2的速度,所以选择因子随着时间的推移而增大。而随着反应的进行,气相中H2S的浓度降低,位阻胺吸收H2S的速度与吸收CO2的速度相等,这时胺液的脱硫选择性达到最大值。反应进行到最后,体系吸收CO2的速度大于吸收H2S的速度,选择因子开始下降。由图 4可得,TBE的选择因子在22 min时有最大值34,AMP在26 min时有最大值27。对于TBDEE,因为其吸收H2S和CO2的速度均较慢,而且相差不大,所以选择性并不理想。
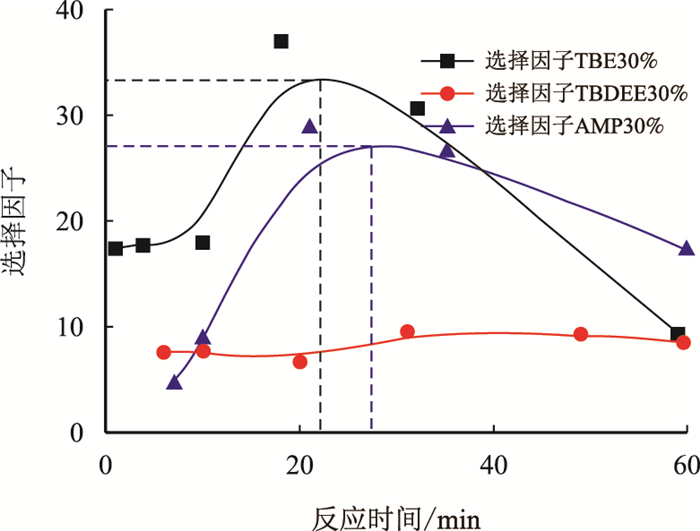 |
| 图4 空间位阻胺TBE,TBDEE,AMP分别对H2S的选择吸收因子 Fig. 4 The H2S selective factor of sterically hindered amine: TBE, TBDEE, AMP |
图 5为不同解吸时间的TBE再生溶剂与新鲜TBE溶液对H2S和CO2的吸收率的对比图。
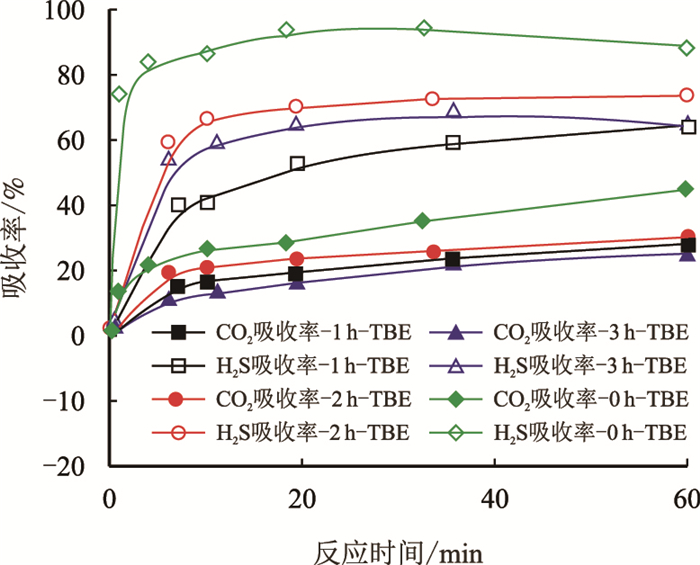 |
| 图5 不同解吸时间TBE再生溶剂与新鲜TBE溶液对H2S和CO2的吸收率(1 h,2 h,3 h) Fig. 5 CO2 and H2S absorptivity of different regenerative time for TBE regenerated solution and fresh TBE aqueous solution(1 h, 2 h, 3 h) |
由图 5可见,反应结束时1 h-TBE、2 h-TBE和3 h-TBE对H2S的吸收率分别为64%、74%和65%,明显小于0 h-TBE的吸收率88%,说明再生后的TBE对酸性气体的吸收能力明显下降。与1 h-TBE和3 h-TBE相比,2 h-TBE对酸性气体具有更高的吸收能力。1 h-TBE吸收的酸性气体未能完全解吸,所以再吸收性能较差。3 h-TBE在100 ℃下解吸时间太长,而且TBE的沸点为90 ℃,可能会发生分解或者在解吸过程中因为挥发而造成损失,导致其吸收性能也较差。
从图 6可以看出,TBE再生溶液的脱硫选择性明显降低。这是因为TBE吸收的CO2更容易通过加热解吸出来,而吸收的H2S由于跟TBE分子结合更紧密,较难从溶液中解吸出来,所以再生后的TBE吸收的CO2相较于H2S来说更多,因此其选择因子明显降低。从数值上看2 h-TBE和3 h-TBE的选择因子差别不大,而1 h-TBE最小。
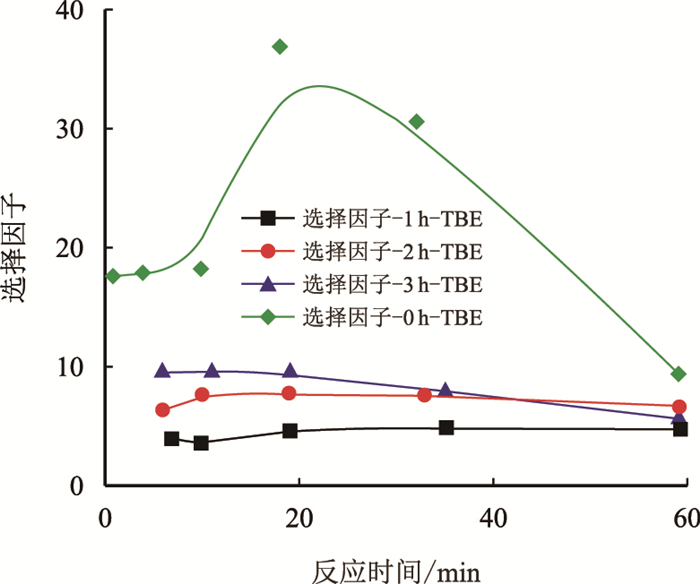 |
| 图6 同解吸时间TBE再生溶剂与新鲜TBE溶液对H2S的选择吸收因子(1 h,2 h,3 h) Fig. 6 The H2S selectivity factors of the different regenerative time for TBE regenerated solution and fresh TBE aqueous solution(1 h, 2 h, 3 h) |
图 7为不同解吸时间的AMP再生溶剂与新鲜AMP溶液对H2S和CO2吸收率的对比图。
 |
| 图7 不同解吸时间AMP再生溶剂与新鲜AMP溶液对H2S和CO2的吸收率(1 h,2 h,3 h) Fig. 7 CO2 and H2S absorptivity of different regenerative time for AMP regenerated solution and fresh AMP aqueous solution(1 h, 2 h, 3 h) |
由图 7可知,1 h-AMP、2 h-AMP和3 h-AMP在实验结束时,对H2S的吸收率分别为85%、76%和81%。相较于0 h-AMP的94%来说,再生后的AMP对H2S的吸收性能只是略微降低。而且,相比于2 h-AMP和3 h-AMP,1 h-AMP对H2S具有更高的吸收率。这是因为AMP与TBE相比,其吸收的酸性气体更容易通过加热解吸出来。1 h-AMP已经基本解吸完全,随着解吸时间的延长,可能会发生位阻胺的分解,导致AMP的再生溶液对酸气的吸收率降低。
从图 8中可以看出,AMP再生溶液的脱硫选择性出现了明显降低,如1 h-AMP的选择因子相较AMP的最高值27降低到了16。这也是由于位阻胺吸收的CO2相较于H2S更容易通过加热的办法解吸出来造成的现象。其中,1 h-AMP的脱硫选择性是再生溶液中最强的。
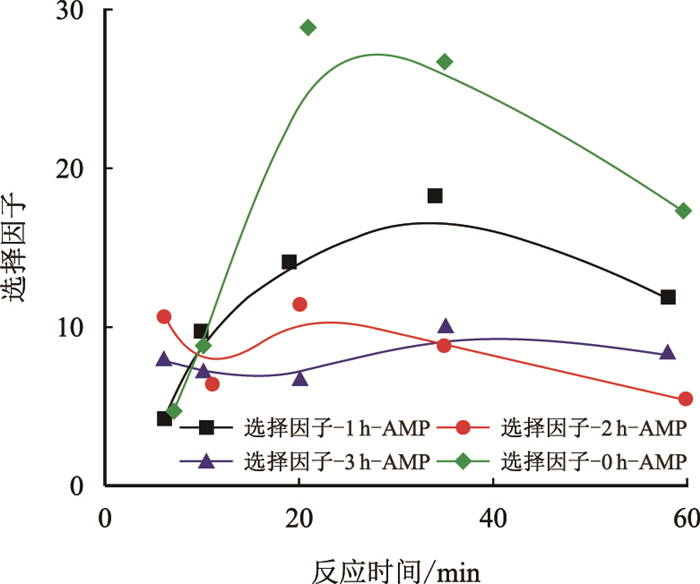 |
| 图8 同解吸时间AMP再生溶剂与新鲜AMP溶液对H2S的选择吸收因子(1 h,2 h,3 h) Fig. 8 The H2S selectivity factors of the different regenerative time for AMP regenerated solution and fresh AMP aqueous solution(1 h, 2 h, 3 h) |
综上所述,再生后的TBE和AMP对酸性气体的吸收性能均有不同程度的降低。其中TBE降低的较为显著。0 h-TBE对H2S吸收率为88%,与其相比,1 h-TBE降低到64%,2 h-AMP降低到74%,3 h-AMP降低到65%,其中2 h-TBE对H2S仍具有较好的吸收能力。而1 h-AMP对H2S的吸收率相较0 h-AMP的94%降低到85%,再相比2 h-AMP降低到76%和3 h-AMP降低到81%,1 h-AMP保持了对H2S较好的吸收能力。再生后,TBE和AMP的脱硫选择性均有较大程度的降低。不同解吸时间下TBE再生溶液的选择因子相较0 h-TBE的34均降低到10以下。相比之下,再生后1 h-AMP的选择因子相较0 h-AMP的27降低到16,仍具有一定的选择性。所以从经济性上考虑,AMP具有更高的工业应用价值。
3 结论(1)位阻胺TBE和AMP对H2S的吸收率分别在25 min和35 min时达到最大值且最大吸收率均为94%。继续延长吸收时间,会由于和吸收CO2存在竞争反应,使部分H2S从体系中解吸出来,造成对H2S的吸收率下降。
(2)位阻胺TBE和AMP的选择脱硫性随反应时间的进行呈现先增大后减小的趋势。TBE对H2S的选择因子在22 min达到最大值34,AMP在26 min达到最大值27,说明质量分数为30%的TBE的脱硫选择性比AMP好。
(3)通过对位阻胺再生性能的研究,发现TBE和AMP再生溶液的脱硫选择性有不同程度的降低,两者的选择因子都有明显降低。说明吸收进胺液的H2S相较于CO2更难通过解吸释放出来。
(4)与TBE相比,AMP具有更好的再生性能。从经济性考虑,AMP具有更好的工业应用价值。
| [1] |
陈赓良, 李劲. 天然气脱硫脱碳工业的选择[J].
油气加工, 2014, 32(6): 29–34.
CHEN Gengliang, LI Jin. Selection of gas desulfurization and decarburization process[J]. Natural Gas and Oil, 2014, 32(6): 29–34. doi: 10.3969/j.issn.1006-5539.2014.06.007 |
| [2] | QIAN Zhi, XU Lianbin, LI Zhenhu, et al. Selective absorption of H2S from a gas mixture with CO2 by aqueous N-Methyldiethanolamine in a rotating packed bed[J]. Industrial & Engineering Chemistry Research, 2010, 49(13): 6196–6203. doi: 10.1021/ie100678c |
| [3] | DUBOIS L, THOMAS D. Comparison of various alkaline solutions for H2S/CO2-selective absorption applied to biogas purification[J]. Chemical Engineering & Technology, 2010, 33(10): 1601–1609. doi: 10.1002/ceat.201000171 |
| [4] |
陈昌介, 何金龙, 温崇荣. 高含硫天然气净化技术现状及研究方向[J].
天然气工业, 2013, 33(1): 112–115.
CHEN Changjie, HE Jinlong, WEN Chongrong. A state of the art of high-sulfur natural gas sweetening technology and its research direction[J]. Natural Gas Industry, 2013, 33(1): 112–115. doi: 10.3787/j.issn.1000-0976.2013.01.-019 |
| [5] |
胡波. 高含硫天然气脱硫技术及应用[J].
能源化工, 2015, 36(4): 20–23.
HU Bo. Advances and application of the technology for removing sulfides from high sulfur-containing natural gas[J]. Energy Chemical Industry, 2015, 36(4): 20–23. doi: 10.3969/j.issn.1006-7906.2015.04.005 |
| [6] |
迟明浩, 李春虎, 张祥坤, 等. 空间位阻胺TBEE对天然气中酸气吸收的研究[J].
石油与天然气化工, 2015, 44(3): 14–18.
CHI Minghao, LI Chunhu, ZHANG Xiangkun, et al. Absorption study of acid gas in nature gas by sterically hindered amine TBEE[J]. Chemical Engineering of Oil & Gas, 2015, 44(3): 14–18. doi: 10.3969/j.issn.1007-3426.-2015.03.003 |
| [7] | 余勇. 新型位阻胺溶剂对H2S的选择性脱除[J]. 气体净化, 2013, 13(3): 17–19. |
| [8] |
胡天友, 何金龙, 彭修军. 高效有机硫脱除溶剂CT824的研究[J].
石油与天然气化工, 2013, 42(3): 205–210.
HU Tianyou, HE Jinlong, PENG Xiujun. Study on high effective organic sulfur removal solvent CT8-24[J]. Chemical Engineering of Oil & Gas, 2013, 42(3): 205–210. doi: 10.3969/j.issn.1007-3426.2013.03.001 |
| [9] | VENKAT A, KUMAR G, KUNDU M. Density and surface tension of aqueous solutions of (2-(Methylamino)-ethanol+2-Amino-2-methyl-1-propanol) and (2-(Methylamino)-ethanol+N-Methyl-diethanolamine) from(298.15 to 323.15) K[J]. Journal of Chemical & Engineering Data, 2009, 55(11): 4580–4585. doi: 10.1021/je1002626 |
| [10] | HAGHTALAB A, IZADI A. Simultaneous measurement solubility of carbon dioxide + hydrogensulfide into aqueous blends of alkanolamines at high pressure[J]. Fluid Phase Equilibria, 2014, 375(15): 181–190. doi: 10.1016/-j.fluid.2014.05.017 |
| [11] |
何金龙, 杨春生, 常宏岗, 等. 位阻胺选择性脱硫配方溶剂(CT816) 脱除天然气中H2S, CO2现场应用试验[J].
石油与天然气化工, 2010, 39(6): 487–490, 501.
HE Jinlong, YANG Chunsheng, CHANG Honggang, et al. Field application of sterical hindrance amine formula sweetening solvent (CT8-16) on selective removal of H2S and CO2 from natural gas[J]. Chemical Engineering of Oil and Gas, 2010, 39(6): 487–490, 501. doi: 10.3969/j.issn.-1007-3426.2010.06.007 |
| [12] | IDRIS Z, EIMER D A. Representation of CO2 absorption in sterically hindered amines[J]. Energy Procedia, 2014, 51: 247–252. doi: 10.1016/j.egypro.2014.07.028 |
| [13] |
杨绪甲. 高酸性天然气中有机硫脱除技术的研究[D]. 上海: 华东理工大学, 2014.
YANG Xujia. Research on removal of organic sulfur and acid gas in the high sour natural gas[D]. Shanghai: East China University of Science and Technology, 2014. |
 2017, Vol. 39
2017, Vol. 39


