文章信息
- 刘东东, 王海涛, 沈剑, 付绍梓, 孙高忠, 黄思远, 徐鹤云
- Liu Dongdong, Wang Haitao, Shen Jian, Fu Shaozi, Sun Gaozhong, Huang Siyuan, Xu Heyun
- 胸外科术后并发急性肺损伤/急性呼吸窘迫综合征及影响其死亡的危险因素分析
- Analysis of risk factors for death of patients with acute lung injury/acute respiratory distress syndrome after thoracic surgery
- 实用肿瘤杂志, 2020, 35(5): 440-445
- Journal of Practical Oncology, 2020, 35(5): 440-445
基金项目
- 浙江省中医药管理局项目(2019ZA002);浙江省医药卫生平台研究计划面上项目(2020KY009);浙江省自然科学基金项目(LY20H010005)
-
作者简介
- 刘东东(1995-), 男, 安徽阜阳人, 硕士生, 从事肺癌诊治相关研究.
-
通信作者
- 王海涛. E-mail:443292584@qq.com
-
文章历史
- 收稿日期:2020-07-04
2. 浙江省人民医院/杭州医学院附属人民医院心胸外科, 浙江 杭州 310014
2. Department of Cardiothoracic Surgery, Zhejiang Provincial People's Hospital/People's Hospital of Hangzhou Medical College, Hangzhou 310014, China
急性肺损伤(acute lung injury, ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是指机体遭受严重感染、放射和创伤等打击后发生的急性低氧血症并伴有放射性肺浸润,且不能被其他已知原因解释的一种病理状态[1-3]。ALI进展至ARDS后的病死率 > 40%[4-5],是影响胸外科手术预后的严重并发症之一。然而,胸部手术后发生ALI/ARDS的危险因素尤其是影响其死亡的危险因素尚未得到很好的研究。本研究对浙江省人民医院2015年12月至2019年4月胸外科术后发生ALI/ARDS的患者的临床资料进行回顾性分析,通过与随机抽取的等量的胸外科术后未发生ALI/ARDS的病例进行比较,以及胸外科术后发生ALI/ARDS的病例中死亡病例与术后恢复良好患者的资料的比较,探讨影响胸外科术后并发ALI/ARDS及其死亡的危险因素,为普胸手术后ALI/ARDS的预防及诊治提供思路。
1 资料与方法 1.1 一般资料收集2015年12月1日至2019年4月30日收治于浙江省人民医院的接受普胸手术(肺癌与食管癌根治术)的患者。临床资料收集经浙江省人民医院伦理审核委员会批准且符合知情豁免条件(编号:2019KY087)。
观察组纳入2015年12月1日至2019年4月30日浙江省人民医院心胸外科收治的接受普胸手术(肺癌与食管癌根治术)且发生ALI/ARDS的病例。排除标准:(1)术前即存在呼吸功能不全[术前未吸氧条件下动脉血氧分压(PaO2) < 60 mmHg(1 mmHg=0.133 kPa)];(2)合并慢性阻塞性呼吸系统疾病[第1秒用力呼气量(forced expiratory volume in first second,FEV1)/总肺活量(forced vital capacity,FVC) < 70%];(3)临床资料不全或临床判断不完全明确的病例。最终纳入该项研究的共20例,其中男性17例,女性3例;年龄55~84岁,中位年龄67岁,平均年龄68.4岁;平均体质量指数(body mass index, BMI)21.2 kg/m2;食管癌12例,肺癌8例;合并糖尿病3例,合并高血压5例;有吸烟史11例。
对照组病例采用简单随机抽取方法,连续抽取同一时间区间内浙江省人民医院接受普胸手术后痊愈出院的病例,直至与观察组病例等额为止。对照组20例患者中,男性12例,女性8例;年龄45~73岁,中位年龄60.5岁,平均年龄59.6岁;平均BMI为23.2 kg/m2;食管癌2例,肺癌18例;合并糖尿病0例,合并高血压7例;有吸烟史6例。
并发ALI/ARDS的入选标准采用2012年欧洲危重病医学会与美国胸科学会组成的联合委员会发表的《急性呼吸窘迫综合征柏林定义》的标准[6]:(1)患者在受已知危险因素影响后1周内发病,或在新发或原有呼吸系统症状加重后的1周内发病;(2)胸片或胸部CT检查显示双肺透光度减低的肺水肿征象;(3)如果具备ARDS的危险因素,则ARDS与心源性肺水肿可以并存,否则应通过超声心动图排除心源性肺水肿;(4)根据氧合指数(Oxygenation Index,PaO2 /FiO2),ARDS分为轻度(PaO2/FiO2:200~300 mmHg)、中度(PaO2/FiO2:100~200 mmHg)和重度(PaO2/FiO2≤100 mmHg)。
1.2 资料收集收集所有患者术前、术中及术后的临床资料。术前收集患者性别、年龄、吸烟史、手术原因、BMI、入院时白蛋白(albumin, ALB)、糖尿病史、原发性高血压史和术前肺功能指标(FEV1和FEV1/FVC)。术中收集美国麻醉医师协会(American Society of Anesthesiologists, ASA)评分、单肺通气时间、失血量、补液量、是否输血、呼吸机模式和单肺通气时间;术后收集第1天ALB水平、动脉血氧分压以及白细胞(white blood cell, WBC)、降钙素原(procalcitonin, PCT)和C反应蛋白(C-reactive protein, CRP)水平。
1.3 统计学分析采用SPSS 20.0统计学软件对计量资料作正态性检验,正态分布数据以均数±标准差(
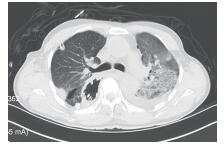
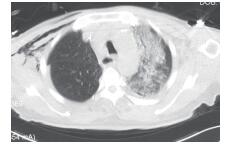
将观察组20例胸外科手术后并发ALI/ARDS的患者与对照组的随机抽取的普胸手术(食管癌及肺癌手术)后痊愈出院的20例患者作单因素分析显示,两组在手术原因、年龄、入院时ALB水平、单肺通气时间、ASA评分、失血量、补液量、术后CRP和术后ALB水平方面比较,差异均具有统计学意义(均P < 0.05),在性别、BMI、吸烟史、糖尿病史和高血压史方面比较,差异均无统计学意义(均P > 0.05,表 1)。术后因补液量影响,胸部CT检查可见特征性表现(图 1~2)。
| 临床特征 | 观察组 (n=20) |
对照组 (n=20) |
P值 |
| 性别(例,男/女) | 17/3 | 12/8 | 0.168 |
| 手术原因(例,食管癌/肺癌) | 12/8 | 2/18 | 0.001 |
| 年龄(岁, |
68.5±1.7 | 59.6±1.5 | < 0.01 |
| 入院时白蛋白(g/L, |
37.8±0.9 | 41.0±0.6 | 0.006 |
| 体质量指数(kg/m2, |
21.2±0.7 | 23.5±0.8 | 0.086 |
| 吸烟史(例,有/无) | 9/11 | 6/14 | 0.327 |
| 糖尿病史(例,有/无) | 3/17 | 0/20 | 0.072 |
| 高血压(例,有/无) | 5/15 | 7/13 | 0.490 |
| ASA评分(例,2分/3分) | 13/7 | 19/1 | 0.030 |
| FEV1(L) | 2.51 | 1.96 | 0.096 |
| FEV1/FVC(%) | 73.0 | 72.4 | 0.369 |
| 单肺通气时间(min, |
310.5±29.2 | 202.5±14.5 | 0.020 |
| 失血量(mL, |
444.0±42.9 | 144.5±23.4 | 0.045 |
| 补液量(mL, |
2 385.0±205.4 | 1 525.9±99.2 | 0.001 |
| 术后白蛋白(g/L, |
28.1±1.0 | 34.4±0.6 | < 0.01 |
| 术后CRP(mg/L) | 62.2 | 30.6 | < 0.01 |
| 注 术后白蛋白及术后CRP:术后第1天抽血检查结果;ASA:美国麻醉医师协会(American Society of Anesthesiologists);FEV1:第1秒用力呼气量(forced expiratory volume in first second);FVC:总肺活量(forced vital capacity);CRP:C反应蛋白(C-reactive protein) | |||
|
| 图 1 食管癌术后左肺下叶背段水肿明显 Fig.1 The edema of the dorsal part of the lower lobe of the left lung was obvious after esophagectomy |
|
| 图 2 右上肺癌根治术后左肺病变明显 Fig.2 The left lung lesion became obvious after radical resection of the upper right lung cancer |
术后发生ALI /ARDS并死亡的患者(死亡病例定义为:在院期间因术后并发ALI /ARDS死亡或因术后并发ALI /ARDS基础情况差家属拒绝进一步治疗自动出院,1个月后随访死亡的病例)8例,其中男性6例,女性2例;年龄(68.1±1.1)岁;食管癌7例,肺癌1例。死亡患者和生存患者在手术原因和术后ALB水平方面比较,差异均具有统计学意义(均P < 0.05),在性别、年龄、ALB水平、BMI、吸烟史、糖尿病史、高血压史、ASA评分、单肺通气时间、FEV1、FEV1/FVC、失血量、补液量和术后CRP方面比较,差异均无统计学意义(均P > 0.05,表 2)。
| 临床特征 | 死亡(n=8) | 生存(n=12) | P值 |
| 性别(例,男/女) | 6/2 | 11/1 | 0.306 |
| 手术原因(例,食管癌/肺癌) | 7/1 | 5/7 | 0.040 |
| 年龄(岁, |
68.1±1.1 | 68.8±2.7 | 0.859 |
| 入院时白蛋白(g/L, |
38.1±1.5 | 37.7±1.0 | 0.820 |
| 体质量指数(kg/m2, |
20.9±3.8 | 21.4±1.9 | 0.743 |
| 吸烟史(例,有/无) | 4/4 | 5/7 | 0.714 |
| 糖尿病史(例,有/无) | 1/7 | 2/10 | 0.798 |
| 高血压(例,有/无) | 3/5 | 2/10 | 0.292 |
| ASA评分(例,2分/3分) | 5/3 | 8/4 | 0.848 |
| FEV1(L, |
2.2±0.2 | 2.0±0.2 | 0.415 |
| FEV1/FVC(%, |
73.2±2.6 | 70.9±2.2 | 0.532 |
| 单肺通气时间(min) | 307.5 | 240.0 | 0.064 |
| 失血量(mL) | 250.0 | 200.0 | 0.427 |
| 补液量(mL, |
2 462.5±1 181.9 | 2 333.3±748.7 | 0.767 |
| 术后白蛋白(g/L) | 25.9 | 30.0 | 0.037 |
| 术后CRP(mg/L) | 82.2 | 58.1 | 0.238 |
| 注 术后白蛋白及术后CRP:术后第1天抽血检查结果;ASA:美国麻醉医师协会(American Society of Anesthesiologists);FEV1:第1秒用力呼气量(forced expiratory volume in first second);FVC:总肺活量(forced vital capacity);CRP:C反应蛋白(C-reactive protein) | |||
肺癌是我国发病率和死亡率最高的恶性肿瘤。食管癌是消化系统常见的恶性肿瘤。手术仍是早期肺癌和食管癌的主要治疗手段[6-9]。而术后ALI/ARDS作为胸外科术后严重的并发症,更是胸外科术后应重点关注的问题,但关于普胸外科术后继发ALI/ARDS的病死率尚无较统一意见,有报道指出食管癌术后病死率可达30%~40%[6-7]。研究显示, 全肺切除术患者的ARDS病死率最高(达50 %)[10]。本研究结果也显示,术后患ALI/ARDS的病死率为40%。
ALI/ARDS的病理改变为弥漫性肺泡损伤(diffuse alveolar damage), 主要表现为肺部大范围的充血水肿及肺泡内透明膜的形成,从而引起肺间质及肺泡的水肿。CT检查上其常表现为:肺水肿与肺不张呈“不均一”分布,即在重力依赖区,肺水肿严重,肺功能极差;相反,非重力依赖区,肺功能基本正常。本研究病例也多满足此表现(图 1),这一现象可能与术中补液量有关,所以有中心提出对于ALI/ARDS的患者应适当维持出入量的负平衡[11-12]。此外,本研究发现,病变的CT表现多出现在健侧(图 2), 关于这种现象的原因,尚未见报道,本中心结合自身手术过程认为,可能多与术中机械性鼓肺和潮气量较高导致健侧肺损伤有关。
在普胸手术后并发ALI/ARDS的病例与随机抽取的等量的术后痊愈出院的病例的比较显示,在手术原因、年龄、入院时ALB水平、ASA评分、单肺通气时间、失血量、补液量、术后CRP和术后ALB水平方面差异均具有统计学意义(均P < 0.05),这一结果与之前的报道结果符合[2, 13-17]。需要指出的是,既往研究指出,肥胖(BMI≥25 kg/m2)使ALI/ARDS病发率增加,但对病死率没有影响[18],原因可能是肥胖者有更高的气道压力及潮气量,而潮气量增加及呼气末正压(positive end-expiratory pressure, PEEP)升高均可使ALI/ARDS发生率增加[19-20]。但也有研究指出,对于并发急性肾损伤的ARDS患者,肥胖能降低其病死率[21]。而本研究中,患者肥胖(术前BMI≥25 kg/m2)对胸外科术后并发ALI/ARDS的病死率没有影响,可能与术中潮气量的设定并未严格按体质量计算,及肥胖患者有更好的能量储备有关。
但是既往关于术后发生ALI/ARDS后死亡的相关因素及预防尚未见统一报道。本研究进一步比较发现,生存和死亡患者在手术原因和术后ALB水平方面比较,差异均具有统计学意义(均P < 0.05)。但笔者认为,手术原因这一数据(P=0.040)更主要是因为两类手术时间的差异(本研究中食管癌平均手术时间328.8 min,肺癌平均手术时间283.1 min),所以更应该归于单肺通气时间的影响,这也与本研究术中数据的比较相符。其原因可能与以下几点有关。(1)炎性反应机制的触发:单肺通气时,术侧肺萎陷使通气血流比改变,肺泡上皮细胞低氧,大量炎性反应介质释放,尤其是促炎因子[如白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、IL-6及IL-8]和抗感染因子(如IL-10和IL-13)的水平改变[12, 22-23],引发炎性反应级联反应而导致肺泡毛细血管受损,肺水肿加重。(2)机械张力的损伤:单侧通气的肺因血流量的增加[17]、手术过程中机械性的鼓肺及为增加血氧含量而增加的单肺潮气量都会导致血管内皮细胞受损,引起肺微血管通透性增高,从而使ALI/ARDS患病率及病死率增加,其同时也是术后常出现健侧肺损伤的可能原因(图 2)。但死亡患者和生存患者在单肺通气时间方面比较,差异无统计学意义(P=0.064),这可能与以下几点原因有关:(1)单肺通气时间与术后发生ALI /ARDS的死亡相关,但相关性较低;(2)两者手术原因不同,导致手术方式的差异对术后ALI /ARDS存在影响,但原因尚未可知。生存和死亡患者术后第1天患者ALB水平比较差异具有统计学意义(P=0.037),这与之前的报道相符[24-26]。原因可能为低蛋白血症使机体胶体渗透压降低,增加肺水肿,进而影响患者氧合能力[27];同时低蛋白血症患者机体储备较差,创伤打击耐受力稍低,也可能使术后并发ALI/ARDS死亡率增加。
在其他报道中指出与术后并发ALI/ARDS相关的危险因素,如吸烟史、糖尿病史、FEV1、FEV1/FVC和输血量等[13-17, 28],本研究也进行了统计学分析。可能因为回顾性研究的缺陷以及本单中心研究的病例数较少,本研究显示患者生存情况在这些方面比较差异均无统计学意义(均P > 0.05)。但并不表明其与胸外科术后ALI/ARDS的发生及死亡没有关系,而更提示应该进行多中心大样本的深入研究。之前研究报道显示患者生存情况与FEV1和FEV1/FVC有关[29],本研究结果与此不一致。笔者认为,FEV1和FEV1/FVC主要反映肺的通气功能以及鉴别阻塞性肺疾病与限制性肺疾病,而本研究中的数据多来自择期手术的早期具备手术指征的患者,所以相关性减少。随着疾病谱的改变,相应的术前检查方式也应该同时更新与扩展。
综上所述,年龄、ALB水平、单肺通气时间、ASA评分、失血量、补液量、术后CRP和术后ALB水平是普胸手术后是否并发ALI /ARDS的影响因素。手术单肺通气时间和术后ALB水平影响普胸外科术后并发ALI/ARDS患者生存情况。当前普胸外科术后并发ALLI/ARDS的死亡率较高,应当引起充分重视。术中仔细熟练操作减少单肺通气时间和术后密切关注患者一般情况是降低术后ALLI/ARDS的发病率和病死率的有效措施。
| [1] |
Park SY, Lee HS, Jang HJ, et al. Efficacy of intraoperative, single-bolus corticosteroid administration to prevent postoperative acute respiratory failure after oesophageal cancer surgery[J]. Interact Cardiovasc Thorac Surg, 2012, 15(4): 639-643. DOI:10.1093/icvts/ivs167 |
| [2] |
Tandon S, Batchelor A, Bullock R, et al. Peri-operative risk factors for acute lung injury after elective oesophagectomy[J]. Br J Anaesth, 2001, 86(5): 633-8. DOI:10.1093/bja/86.5.633 |
| [3] |
Song C, Li H, Li Y, et al. NETs promote ALI/ARDS inflammation by regulating alveolar macrophage polarization[J]. Exp Cell Res, 2019, 382(2): 111486. DOI:10.1016/j.yexcr.2019.06.031 |
| [4] |
Maca J, Jor O, Holub M, et al. Past and present ARDS mortality rates:a systematic review[J]. Respir Care, 2017, 62(1): 113-122. DOI:10.4187/respcare.04716 |
| [5] |
黄立学, 朱光发. 急性呼吸窘迫综合征机械通气的研究进展[J]. 心肺血管病杂志, 2017, 36(7): 599-601. |
| [6] |
Force ADT, Ranieri VM, Rubenfeld GD, et al. Acute respiratory distress syndrome:the Berlin Definition[J]. JAMA, 2012, 307(23): 2526-2533. |
| [7] |
Jeong H, Choi J W, Ahn H J, et al. The effect of preventive use of corticosteroids on postoperative complications after esophagectomy:A retrospective cohort study[J]. Sci Rep-UK, 2019, 9(1): 11984. DOI:10.1038/s41598-019-48349-0 |
| [8] |
张海华, 张涛. 早期非小细胞肺癌亚肺叶切除临床研究进展[J]. 实用肿瘤杂志, 2019, 34(3): 198-201. |
| [9] |
李宾, 王忠民, 曹克鑫, 等. 微创食管癌术后淋巴结转移情况对预后的影响研究[J]. 实用肿瘤杂志, 2020, 35(2): 154-158. |
| [10] |
Dulu A, Pastores SM, Park B, et al. Prevalence and mortality of acute lung injury and ARDS after lung resection[J]. Chest, 2006, 130(1): 73-78. DOI:10.1016/S0012-3692(15)50955-0 |
| [11] |
Puybasset L, Cluzel P, Chao N, et al. A computed tomography scan assessment of regional lung volume in acute lung injury[J]. Am J Respir Crit Care Med, 1998, 158(5): 1644-1655. DOI:10.1164/ajrccm.158.5.9802003 |
| [12] |
Della RG, Coccia C. Acute lung injury in thoracic surgery[J]. Curr Opin Anaesthesiol, 2013, 26(1): 40-46. DOI:10.1097/ACO.0b013e32835c4ea2 |
| [13] |
Kim HJ, Cha SI, Kim CH, et al. Risk factors of postoperative acute lung injury following lobectomy for nonsmall cell lung cancer[J]. Medicine, 2019, 98: 13. |
| [14] |
Tugrul M, Camci E, Karadeniz H, et al. Comparison of volume controlled with pressure controlled ventilation during one-lung anaesthesia[J]. Br J Anaesth, 1997, 79(3): 306-310. DOI:10.1093/bja/79.3.306 |
| [15] |
Eichenbaum KD, Neustein SM. Acute lung injury after thoracic surgery[J]. J Cardiothorac Vasc Anesth, 2010, 24(4): 681-690. DOI:10.1053/j.jvca.2009.10.032 |
| [16] |
Misthos P, Katsaragakis S, Milingos N, et al. Postresectional pulmonary oxidative stress in lung cancer patients.The role of onelung ventilation[J]. Eur J Cardiothorac Surg, 2005, 27(3): 379-382. DOI:10.1016/j.ejcts.2004.12.023 |
| [17] |
徐稼轩, 王宏志, 董军, 等. 食管癌术后急性肺损伤/急性呼吸窘迫综合征的危险因素分析[J]. 北京大学学报:医学版, 2018, 50(6): 1057-1062. |
| [18] |
Gong MN, Bajwa EK, Thompson BT, et al. Body mass index is associated with the development of acute respiratory distress syndrome[J]. Thorax, 2010, 65(1): 44-50. DOI:10.1136/thx.2009.117572 |
| [19] |
Jia X, Malhotra A, Saeed M, et al. Risk factors for ARDS in patients receiving mechanical ventilation for>48h[J]. Chest, 2008, 133(4): 853-861. DOI:10.1378/chest.07-1121 |
| [20] |
Gajic O, FrutosVivar F, Esteban A, et al. Ventilator settings as a risk factor for acute respiratory distress syndrome in mechanically ventilated patients[J]. Intensive Care Med, 2005, 31(7): 922-926. DOI:10.1007/s00134-005-2625-1 |
| [21] |
Soto GJ, Frank AJ, Christiani DC, et al. Body mass index and acute kidney injury in the acute respiratory distress syndrome[J]. Crit Care Med, 2012, 40(9): 2601-2608. DOI:10.1097/CCM.0b013e3182591ed9 |
| [22] |
Tao H, Li N, Zhang Z, et al. Erlotinib protects LPS-induced acute lung injury in mice by inhibiting EGFR/TLR4 signaling pathway[J]. Shock, 2019, 51(1): 131-138. DOI:10.1097/SHK.0000000000001124 |
| [23] |
Wang BQ, Shi M, Zhang JP, et al. Knockdown of Tfpi-anchored endothelial cells exacerbates lipopolysaccharide-induced acute lung injury via NF-kappaB signaling pathway[J]. Shock, 2019, 51(2): 235-246. DOI:10.1097/SHK.0000000000001120 |
| [24] |
Xu B, Ge Y, Lu Y, et al. Risk factors and prognosis of acute respiratory distress syndrome following abdominal surgery[J]. Exp Ther Med, 2018, 17(1): 159-164. |
| [25] |
Caironi P, Tognoni G, Masson S, et al. ALBIOS Study investigators:Albumin replacement in patients with severe sepsis or septic shock[J]. N Engl J Med, 2014, 370(15): 1412-1421. DOI:10.1056/NEJMoa1305727 |
| [26] |
Masson S, Caironi P, Fanizza C, et al. Sequential N-terminal pro-B-type natriuretic peptide and high-sensitivity cardiac troponin measurements during albumin replacement in patients with severe sepsis or septic shock[J]. Crit Care Med, 2016, 44(4): 707-716. DOI:10.1097/CCM.0000000000001473 |
| [27] |
Tokgöz Y, Erdur B, Öztürk Y. HLA subtypes and Helicobacter pylori infection in an infant withceliac crisis[J]. Turk J Gastroenterol, 2013, 24(1): 74-76. |
| [28] |
Choi H, Cho JH, Kim HK, et al. Prevalence and clinical course of postoperative acute lung injury after esophagectomy for esophageal cancer[J]. J Thorac Dis, 2019, 11(1): 200-205. DOI:10.21037/jtd.2018.12.102 |
| [29] |
戴亮, 康晓征, 闫万璞, 等. 胸腔镜肺癌肺切除术后患者住院时间延长(>7天)的病因分析——附115例报道[J]. 中国肺癌杂志, 2018, 21(3): 223-229. |
 2020, Vol. 35
2020, Vol. 35


