文章信息
- 宋昕, 韩文莉, 王盼盼, 胡景峰, 吉佳佳, 杨媛啧, 孙琳, 葛维挺, 郑树, 王立东
- Song Xin, Han Wenli, Wang Panpan, Hu Jingfeng, Ji Jiajia, Yang Yuanze, Sun Lin, Ge Weiting, Zheng Shu, Wang Lidong
- 食管鳞癌、贲门腺癌和结肠腺癌高频突变基因谱比较
- Comparison of high-frequency mutation gene profiles in esophageal squamous cell carcinoma, gastric cardia adenocarcinoma and colon adenocarcinoma
- 实用肿瘤杂志, 2020, 35(5): 401-407
- Journal of Practical Oncology, 2020, 35(5): 401-407
基金项目
- 国家重点研发计划项目(2016YFC0901403);国家自然科学基金项目(81872032,U1804262);中央引导地方科技发展专项(20200715)
-
作者简介
- 宋昕(1981-), 女, 湖北荆州人, 博士生, 从事食管/贲门癌变机制和防治研究.
-
通信作者
-
郑树, E-mail:zhengshu@zju.edu.cn
王立东, E-mail:ldwang2007@126.com
-
文章历史
- 收稿日期:2020-09-03
2. 浙江大学第二附属医院恶性肿瘤预警与干预教育部重点实验室, 浙江 杭州 310009
2. Cancer Institute(Key Laboratory of Cancer Prevention and Intervention, China National Ministry of Education), The Second Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310009, China
本团队师徒三代在过去60年的食管癌研究过程中已建立50万例跨度47年(1973年至2019年)食管癌和贲门癌患者随访的临床诊疗、病理信息大数据库和大样本库,发现73例患者在确诊为食管癌的同时或继发结直肠肿瘤[1]。近年,越来越多的研究报道食管癌和结直肠癌存在共同的高危因素。过度饮酒、蔬菜和水果摄入不足以及人类乳头瘤病毒16(human papilloma virus 16,HPV16)感染等既是食管癌的高风险因素,也与结直肠癌的发生密切相关[2-5]。食管癌高危因素吸烟也可通过引起肠黏膜中异常启动子甲基化,进而导致结直肠癌的发生[6]。对60例食管鳞癌患者的研究发现,食管鳞癌可能会增加这些患者继发结直肠癌的风险[7]。一项meta分析结果发现,Barrett’s食管可使结直肠息肉和结直肠癌的风险提高1倍[8]。本研究旨在采用全基因组外显子测序和靶向测序的方法对结直肠癌、食管鳞癌和贲门腺癌的高频基因进行对比分析,揭示这3种不同组织来源肿瘤的分子分型,进一步阐明其发生的分子机制。
1 资料与方法 1.1 一般资料98例结肠腺癌患者来自浙江大学第二附属医院恶性肿瘤预警与干预教育部重点实验室。109例食管鳞癌和112例贲门腺癌患者来自郑州大学第一附属医院省部共建食管癌防治国家重点实验室已建立的50万例跨度47年(1973年至2019年)食管癌和贲门癌临床诊疗、病理和随访大资料库。98例结肠腺癌中男性59例,年龄32~89岁,中位年龄62岁;女性39例,年龄33~85岁,中位年龄66岁。109例食管鳞癌患者中男性85例,年龄36~77岁,中位年龄58岁;女性24例,年龄41~75岁,中位年龄60岁。112例贲门腺癌患者中男性90例,年龄37~84岁,中位年龄62岁;女性22例,年龄53~75岁,中位年龄64岁。
纳入标准:(1)患者均行根治性手术治疗;(2)术后病理确诊为食管鳞癌、贲门腺癌或结肠腺癌;(3)未接受任何术前放、化疗或其他治疗;(4)所有样品均为手术切除标本。
1.2 诊断标准食管鳞癌和贲门腺癌诊断标准符合第6版美国癌症联合委员会(American Joint Committee on Cancer,AJCC)指南[9]。结肠腺癌诊断标准符合第7版AJCC指南[10]。
1.3 方法 1.3.1 DNA提取及质控采用QIAGEN试剂盒(QIAGEN,德国)进行石蜡包埋组织基因组DNA提取,通过琼脂糖凝胶电泳分析DNA降解程度以及RNA污染情况,用Nanodrop2000(Thermo,美国)检测DNA的纯度,用Qubit(Qubit 2.0 Flurometer,Invitrogen,美国)对DNA浓度进行精确定量,其中吸光度(absorbance,A)值在1.8~2.0之间和含量 > 1.5 μg的DNA样品被用来建库。
1.3.2 全基因组外显子测序采用Agilent的液相芯片捕获系统(Agilent Technologies,美国),对人的全外显子区域DNA进行富集,将基因组DNA经Covaris破碎仪(Massachusetts,美国)随机打断成长度为180~280 bp的片段,经末端修复和加A尾后在片段两端分别连接上接头制备DNA文库。带有特异index的文库与多达543 872个生物素标记的探针进行液相杂交,再使用带链霉素的磁珠将20 965个基因的334 378个外显子捕获下来,经PCR线性扩增后进行文库质检,合格后在Illumina Hiseq平台(Illumina,美国)上进行高通量和高深度测序。建库和捕获实验采用Agilent SureSelect Human All ExonV5试剂盒(Agilent Technologies,美国)。
1.3.3 靶向测序采用Agilent的液相芯片捕获系统,对患者的特定目标区域DNA进行高效富集,将基因组DNA经Covaris破碎仪随机打断成长度为180~280 bp的片段,末端修复和加A尾后在片段两端分别连接上接头制备DNA文库。带有特异index的文库与多达500 000个生物素标记的探针进行液相杂交,再使用带链霉素的磁珠将目标基因的目的片段捕获下来,经PCR线性扩增后进行文库质检,合格后在Illumina Hiseq平台上进行高通量和高深度测序。建库和捕获实验采用Agilent Sure Select XT Custom试剂盒(Agilent Technologies,美国)。
1.3.4 数据处理和生物信息学分析对测序获得的原始序列进行质量评估和过滤,将有效测序数据通过BWA和Samblaster与参考基因组(B37)进行比对,并用Samblaster进行标记重复等处理,从而得到BAM格式的最终比对结果。用MuSiC软件进行高频突变基因分析。
1.4 统计学分析采用SPSS 21.0统计学软件进行数据分析。计数资料采用频数(百分比)表示,组间比较采用χ2检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 全基因组外显子测序结果98例结肠腺癌中黏蛋白16(mucin16,MUC16)、丝聚蛋白(filaggrin,FLG)、SMAD家族4(SMAD family member 4,Smad4)和Ⅵ型胶原蛋白α3(collagen type Ⅵ alpha 3 chain,COL6A3)的基因突变频率分别为18.4%(18/98)、6.1%(6/98)、14.3%(14/98)和10.2%(10/98),均以错义突变为主,错义突变在这4个基因突变中占比分别为83.3%、66.7%、50.0%和90.0%(图 1)。

|
| 图 1 98例结肠腺癌中MUC16、FLG、SMAD4和COL6A3基因突变图谱 Fig.1 The landscape of MUC16, FLG, SMAD4, and COL6A3 gene mutations in 98 cases of colon adenocarcinoma |
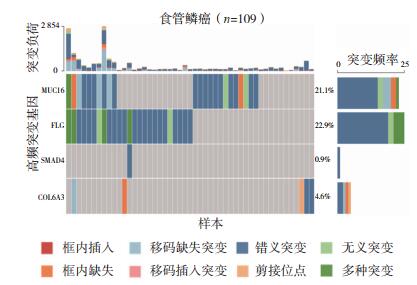
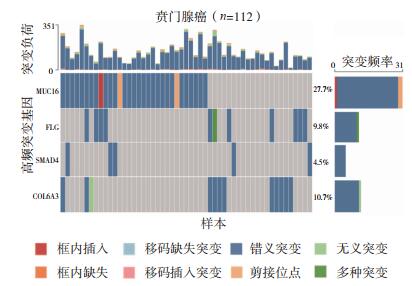
MUC16、FLG、SMAD4和COL6A3基因在109例食管鳞癌和112例贲门腺癌中均发生突变。在食管鳞癌中这4个基因的突变频率分别为21.1%(23/109)、22.9%(25/109)、0.9%(1/109)和4.6%(5/109),突变类型以错义突变为主(图 2)。在贲门腺癌中这4个基因的突变频率分别为27.7%(31/112)、9.8%(11/112)、4.5%(5/112)和10.7%(12/112),错义突变为主要突变类型(图 3)。
|
| 图 2 109例食管鳞癌中MUC16、FLG、SMAD4和COL6A3基因突变图谱 Fig.2 The landscape of MUC16, FLG, SMAD4, and COL6A3 gene mutations in 109 cases of esophageal squamous cell carcinoma |
|
| 图 3 112例贲门腺癌中MUC16、FLG、SMAD4和COL6A3基因突变图谱 Fig.3 The landscape of MUC16, FLG, SMAD4, and COL6A3 gene mutations in 112 cases of gastric cardia adenocarcinoma |
MUC16基因在食管鳞癌和贲门腺癌中的突变频率均有高于结肠腺癌的趋势,分别为21.1%、27.7%和18.4%,但差异无统计学意义(P > 0.05)。COL6A3基因在结肠腺癌中的突变频率有低于贲门腺癌和高于食管鳞癌的趋势,分别为10.2%、10.7%和4.6%,但差异无统计学意义(P > 0.05)。
SMAD4基因在结肠腺癌中的突变频率高于食管鳞癌和贲门腺癌,分别为14.3%、0.9%和4.5%,差异具有统计学意义(P < 0.05)。FLG基因在食管鳞癌中的突变频率高于贲门腺癌和结肠腺癌,分别为22.9%、9.8%和6.1%,差异具有统计学意义(P < 0.05)。
2.4 食管鳞癌和贲门腺癌患者MUC16、FLG、SMAD4和COL6A3基因突变与不同临床表型对比分析MUC16、FLG和COL6A3基因突变频率在食管鳞癌患者性别、年龄、高低发区、吸烟、饮酒、浸润程度和淋巴结转移等各临床表型方面比较,差异均无统计学意义(均P > 0.05,表 1)。SMAD4基因突变在T1期食管鳞癌患者中频率高于其他期别,差异具有统计学意义(P < 0.05)。而贲门腺癌患者中,这4个基因突变频率在各临床表型方面比较,差异均无统计学意义(均P > 0.05,表 2)。
| 临床特征 | 例数 | MUC16基因 | FLG基因 | SMAD4基因 | COL6A3基因 | |||||||
| 突变例数(%) | P值 | 突变例数(%) | P值 | 突变例数(%) | P值 | 突变例数(%) | P值 | |||||
| 性别 | 0.785 | 0.271 | 1.000 | 0.202 | ||||||||
| 男性 | 85 | 19(22.4) | 19(22.4) | 1(1.2) | 5(5.9) | |||||||
| 女性 | 24 | 6(25.0) | 8(33.3) | 0(0.0) | 4(16.7) | |||||||
| 年龄 | 0.475 | 0.051 | 1.000 | 0.683 | ||||||||
| < 55岁 | 37 | 7(18.9) | 5(13.5) | 0(0.0) | 2(5.4) | |||||||
| ≥55岁 | 72 | 18(25.0) | 22(30.6) | 1(1.4) | 7(9.7) | |||||||
| 高低发区 | 0.258 | 0.859 | 1.000 | 1.000 | ||||||||
| 低发区 | 46 | 13(28.3) | 11(23.9) | 0(0.0) | 4(8.7) | |||||||
| 高发区 | 63 | 12(19.0) | 16(25.4) | 1(1.6) | 5(7.9) | |||||||
| 吸烟史 | 0.643 | 0.066 | 1.000 | 0.075 | ||||||||
| 有 | 61 | 15(24.6) | 11(18.0) | 1(1.6) | 2(3.3) | |||||||
| 无 | 48 | 10(20.8) | 16(33.3) | 0(0.0) | 7(14.6) | |||||||
| 饮酒史 | 0.182 | 0.085 | 0.477 | 0.580 | ||||||||
| 有 | 52 | 9(17.3) | 9(17.3) | 1(1.9) | 3(5.8) | |||||||
| 无 | 57 | 16(28.1) | 18(31.6) | 0(0.0) | 6(10.5) | |||||||
| T分期 | 0.913 | 0.323 | 0.043 | 0.667 | ||||||||
| T1 | 12 | 2(16.7) | 5(41.7) | 1(8.3) | 0(0.0) | |||||||
| T2 | 32 | 7(21.9) | 6(18.8) | 0(0.0) | 3(9.4) | |||||||
| T3 | 62 | 15(24.2) | 16(25.8) | 0(0.0) | 6(9.7) | |||||||
| T4 | 3 | 1(33.3) | 0(0.0) | 0(0.0) | 0(0.0) | |||||||
| 淋巴结转移 | 0.528 | 0.292 | 1.000 | 0.173 | ||||||||
| N0 | 54 | 11(20.4) | 11(20.4) | 0(0.0) | 2(3.7) | |||||||
| N1 | 55 | 14(25.5) | 16(29.1) | 1(1.8) | 7(12.7) | |||||||
| 注 MUC16:黏蛋白16基因(mucin16);FLG:丝聚蛋白(filaggrin);SMAD4:SMAD家庭成员4(SMAD family member 4);COL6A3:Ⅵ型胶原蛋白α3(collagen type Ⅵ alpha 3 chain) | ||||||||||||
| 临床特征 | 例数 | MUC16基因 | FLG基因 | SMAD4基因 | COL6A3基因 | |||||||
| 突变例数(%) | P值 | 突变例数(%) | P值 | 突变例数(%) | P值 | 突变例数(%) | P值 | |||||
| 性别 | 0.754 | 1.000 | 0.581 | 0.662 | ||||||||
| 男性 | 90 | 36(40.0) | 11(12.2) | 5(5.6) | 14(15.6) | |||||||
| 女性 | 22 | 8(36.4) | 3(13.6) | 0(0.0) | 2(9.1) | |||||||
| 年龄 | 1.000 | 1.000 | 0.439 | 0.852 | ||||||||
| < 55岁 | 12 | 5(41.7) | 2(16.7) | 1(8.3) | 1(8.3) | |||||||
| ≥55岁 | 100 | 39(39.0) | 12(12.0) | 4(4.0) | 15(15.0) | |||||||
| 高低发区 | 0.859 | 0.559 | 1.000 | 0.685 | ||||||||
| 低发区 | 27 | 11(40.7) | 2(7.4) | 1(3.7) | 5(18.5) | |||||||
| 高发区 | 85 | 33(38.8) | 12(14.1) | 4(4.7) | 11(12.9) | |||||||
| 吸烟史 | 0.445 | 0.830 | 1.000 | 0.877 | ||||||||
| 有 | 61 | 22(36.1) | 8(13.1) | 3(4.9) | 9(14.8) | |||||||
| 无 | 51 | 22(43.1) | 6(11.8) | 2(3.9) | 7(13.7) | |||||||
| 饮酒史 | 0.205 | 0.614 | 0.773 | 1.000 | ||||||||
| 有 | 49 | 16(32.7) | 7(14.3) | 3(6.1) | 7(14.3) | |||||||
| 无 | 63 | 28(44.4) | 7(11.1) | 2(3.2) | 9(14.3) | |||||||
| T分期 | 0.594 | 0.781 | 0.836 | 0.297 | ||||||||
| T1 | 3 | 1(33.3) | 0(0.0) | 0(0.0) | 0(0.0) | |||||||
| T2 | 4 | 2(50.0) | 0(0.0) | 0(0.0) | 1(25.0) | |||||||
| T3 | 36 | 11(30.6) | 5(13.9) | 1(2.8) | 8(22.2) | |||||||
| T4 | 69 | 30(43.5) | 9(13.0) | 4(5.8) | 7(10.1) | |||||||
| 淋巴结转移 | 0.435 | 1.000 | 1.000 | 0.177 | ||||||||
| N0 | 30 | 10(33.3) | 4(13.3) | 1(3.3) | 7(23.3) | |||||||
| N1 | 82 | 34(41.5) | 10(12.2) | 4(4.9) | 9(11.0) | |||||||
| 注 MUC16:黏蛋白16基因(mucin16);FLG:丝聚蛋白(filaggrin);SMAD4:SMAD家庭成员4(SMAD family member 4);COL6A3:Ⅵ型胶原蛋白α3(collagen type Ⅵ alpha 3 chain) | ||||||||||||
本研究发现,MUC16基因在食管鳞癌、贲门腺癌和结肠腺癌中均存在高频突变。该基因又称糖类抗原125(carbohydrate antigen 125,CA125)。其编码的黏蛋白16属于黏蛋白家族成员。黏蛋白是上皮的重要保护因子。CA125目前已被公认为卵巢癌的标志物[11]。MUC16基因突变已被广泛报道与胃癌、胰腺癌和子宫颈癌等密切相关[12-14]。
本研究中COL6A3基因在结肠腺癌和贲门腺癌中的突变频率稍高于食管鳞癌,该基因编码的α-3链是多数结缔组织中发现的珠状细丝胶原蛋白Ⅵ型胶原蛋白的3个α链之一。COL6A3基因3号外显子与结肠腺癌发生有关[15]。其编码的COL6A3蛋白在结肠癌患者血清中表达升高,表达量与结肠癌的分化程度密切相关[16]。研究发现,COL6A3基因通过参与PI3K-Akt信号通路而影响胃腺癌细胞增殖、迁移、侵袭和凋亡[17]。对该基因进行的目标区域测序结果提示,COL6A3基因上的rs6720283可能是食管癌的易感位点[18]。
SMAD4基因,又被称为JNK相互作用蛋白(JNK interacting protein,JIP)或胰腺癌抑癌基因(deleted in pancreatic cancer locus 4,DPC4),是一种抑癌基因。该基因存在于转化生长因子(transforming growth factor-β,TGF-β)信号传导通路。当SMAD4基因发生突变时,TGF-β信号通路受到抑制,并促使血管生成,从而促进肿瘤生长和转移[19]。不仅结肠癌和胰腺癌中会出现SMAD4的缺失,在食管腺癌、胃腺癌、甲状腺癌和乳腺癌中也发现存在这一现象[20-25]。本研究发现,SMAD4基因突变对结肠腺癌的影响远高于食管鳞癌和贲门腺癌。并且,本研究小组前期与郑树教授课题组合作研究发现,SMAD4基因与Ⅲ期结肠腺癌的复发及结肠癌肝转移密切相关[26]。本研究结果中,SMAD4基因在T1期的食管鳞癌患者中突变频率较高,提示该基因突变可能出现在早期食管鳞癌中,但由于样本较少,尚需进一步扩大样品量以明确SMAD4基因突变对食管鳞癌的影响。
FLG基因能够编码一种聚集在哺乳动物表皮角蛋白中间丝的相关蛋白。该基因的突变与寻常性鱼鳞病和特异性皮炎相关[27-28]。研究表明,FLG基因可以通过不依赖血管生成的途径参与黑色素瘤细胞增殖[29]。本研究发现,食管鳞癌、贲门腺癌和结肠腺癌中都有FLG基因突变,提示FLG基因突变与消化道肿瘤的发生可能有一定关系,并且对鳞癌的影响更大。有研究发现,FLG基因是参与细胞外基质受体相互作用和细胞色素P450代谢途径的重要基因[30]。
本研究小组与郑树教授团队前期合作研究结果提示,MUC16、FLG、SMAD4和COL6A3基因与Ⅲ期结肠癌的复发和转移有关。然而,在本研究中并未发现这4个基因与食管鳞癌和贲门腺癌的不同临床表型间的关系。这一结果提示,这3种肿瘤患者预后影响因素不尽相同,食管鳞癌和贲门腺癌可能具有特异的分子机制,尚需深入研究,进一步确定食管鳞癌和贲门腺癌复发和转移相关的候选分子,为临床个体化治疗提供理论基础。
综上所述,本研究通过全基因组外显子测序和靶向测序发现MUC16和COL6A3基因错义突变与食管鳞癌、贲门腺癌和结肠腺癌均有关,SMAD4基因突变与消化道腺癌的发生密切相关,FLG基因突变对食管鳞癌的影响更大。
| [1] |
王立东, 宋昕, 赵学科, 等. 河南省食管癌高发现场防治和实验室研究60年回顾与展望[J]. 郑州大学学报:医学版, 2019, 54(2): 149-160. |
| [2] |
Steevens J, Schouten LJ, Goldbohm RA, et al. Alcohol consumption, cigarette smoking and risk of subtypes of oesophageal and gastric cancer:a prospective cohort study[J]. Gut, 2010, 59(1): 39-48. DOI:10.1136/gut.2009.191080 |
| [3] |
Ishiguro S, Sasazuki S, Inoue M, et al. Effect of alcohol consumption, cigarette smoking and flushing response on esophageal cancer risk:a population-based cohort study (JPHC study)[J]. Cancer Lett, 2009, 275(2): 240-246. DOI:10.1016/j.canlet.2008.10.020 |
| [4] |
Cho E, Smith-Warner SA, Ritz J, et al. Alcohol intake and colorectal cancer:a pooled analysis of 8 cohort studies[J]. Ann Intern Med, 2004, 140(8): 603-613. DOI:10.7326/0003-4819-140-8-200404200-00007 |
| [5] |
Ding GC, Ren JL, Chang FB, et al. Human papillomavirus DNA and P16INK4A expression in concurrent esophageal and gastric cardiacancers[J]. World J Gastroenterol, 2010, 16(47): 5901-5906. |
| [6] |
Noreen F, Röösli M, Gaj P, et al. Modulation of age- and cancer-associated DNA methylation change in the healthy colon by aspirin and lifestyle[J]. J Natl Cancer Inst, 2014, 106(7). |
| [7] |
Baeg MK, Choi MG, Jung YD, et al. Esophageal squamous cell carcinoma patients have an increased risk of coexisting colorectal neoplasms[J]. Gut Liver, 2016, 10(1): 76-82. DOI:10.5009/gnl14381 |
| [8] |
Yoshida N, Tamaoki Y, Baba Y, et al. Incidence and risk factors of synchronous colorectal cancer in patients with esophageal cancer:an analysis of 480 consecutive colonoscopies before surgery[J]. Int J Clin Oncol, 2016, 21(6): 1079-1084. DOI:10.1007/s10147-016-1015-8 |
| [9] |
Houette A, Gilain L, Mulliez A, et al. Prognostic value of two tumour staging classifications in patients with sinonasal mucosal melanoma[J]. Eur ann otorhinolaryngol head neck dis, 2016, 133(5): 313-317. DOI:10.1016/j.anorl.2016.05.008 |
| [10] |
Mayo E, Llanos AA, Yi X, et al. Prognostic value of tumour deposit and perineural invasion status in colorectal cancer patients:a SEER-based population study[J]. Histopathology, 2016, 69(2): 230-238. DOI:10.1111/his.12936 |
| [11] |
李娟, 顾笑梅. 血清HE-4和CA125检测在卵巢癌术后转归中的特点[J]. 实用肿瘤杂志, 2017, 32(4): 356-358. |
| [12] |
Zhang L, Han X, Shi Y. Association of MUC16 mutation with response to immune checkpoint inhibitors in solid tumors[J]. JAMA Netw Open, 2020, 3(8). |
| [13] |
Abe T, Koi C, Kohi S, et al. Gene variants that affect levels of circulating tumor markers increase identification of patients with pancreatic cancer[J]. Clin Gastroenterol Hepatol, 2020, 18(5): 1161-1169. DOI:10.1016/j.cgh.2019.10.036 |
| [14] |
Shen H, Guo M, Wang L, et al. MUC16 facilitates cervical cancer progression via JAK2/STAT3 phosphorylation-mediated cyclooxygenase-2 expression[J]. Genes Genomics, 2020, 42(2): 127-133. DOI:10.1007/s13258-019-00885-9 |
| [15] |
Aigner T, Hambach L, Söder S, et al. The C5 domain of Col6A3 is cleaved off from the Col6 fibrils immediately after secretion[J]. Biochem Biophys Res Commun, 2002, 290(2): 743-748. DOI:10.1006/bbrc.2001.6227 |
| [16] |
谢春英. COL6A3在结直肠癌中的表达及相关临床意义[D].吉林: 吉林大学医学院, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10183-1018218693.htm
|
| [17] |
Ao R, Guan L, Wang Y, et al. Silencing of COL1A2, COL6A3, and THBS2 inhibits gastric cancer cell proliferation, migration, and invasion while promoting apoptosis through the PI3k-Akt signaling pathway[J]. J Cell Biochem, 2018, 119(6): 4420-4434. DOI:10.1002/jcb.26524 |
| [18] |
Li Y, Sun Y, Yang Q, et al. Variants in COL6A3 gene influence susceptibility to esophageal cancer in the Chinese population[J]. Cancer Genet, 2019, 238: 23-30. DOI:10.1016/j.cancergen.2019.07.003 |
| [19] |
黄晓丹, 张发明, 季国忠. Smad4在肿瘤侵袭和转移中的作用[J]. 世界华人消化杂志, 2009, 17(9): 849-853. |
| [20] |
Wasserman I, Lee LH, Ogino S, et al. SMAD4 loss in colorectal cancer patients correlates with recurrence, loss of immune infiltrate, and chemoresistance[J]. Clin Cancer Res, 2019, 25(6): 1948-1956. DOI:10.1158/1078-0432.CCR-18-1726 |
| [21] |
Wang F, Xia X, Yang C, et al. SMAD4 gene mutation renders pancreatic cancer resistance to radiotherapy through promotion of autophagy[J]. Clin Cancer Res, 2018, 24(13): 3176-3185. DOI:10.1158/1078-0432.CCR-17-3435 |
| [22] |
Yatagai N, Saito T, Akazawa Y, et al. Frequent loss of heterozygosity of SMAD4 locus and prognostic impacts of SMAD4 immunohistochemistry in gastric adenocarcinoma with enteroblastic differentiation[J]. Hum Pathol, 2019, 88: 18-26. DOI:10.1016/j.humpath.2019.03.005 |
| [23] |
Ritterhouse LL, Wu EY, Kim WG, et al. Loss of SMAD4 protein expression in gastrointestinal and extra-gastrointestinal carcinomas[J]. Histopathology, 2019, 75(4): 546-551. DOI:10.1111/his.13894 |
| [24] |
Nikolic A, Ristanovic M, Zivaljevic V, et al. SMAD4 gene promoter mutations in patients with thyroid tumors[J]. Exp Mol Pathol, 2015, 99(1): 100-103. DOI:10.1016/j.yexmp.2015.06.005 |
| [25] |
Rohini M, Arumugam B, Vairamani M, et al. Stimulation of ATF3 interaction with Smad4 via TGF-β1 for matrix metalloproteinase 13 gene activation in human breast cancer cells[J]. Int J Biol Macromol, 2019, 134: 954-961. DOI:10.1016/j.ijbiomac.2019.05.062 |
| [26] |
Ge W, Hu H, Cai W, et al. High-risk stage Ⅲ colon cancer patients identified by a novel five-gene mutational signature are characterized by upregulation of IL-23A and gut bacterial translocation of the tumor microenvironment[J]. Int J Cancer, 2020, 146(7): 2027-2035. DOI:10.1002/ijc.32775 |
| [27] |
马捷, 张学军. 丝聚蛋白代谢的相关研究进展[J]. 中国皮肤性病学杂志, 2018, 9: 1081-1083. |
| [28] |
Mlitz V, Latreille J, Gardinier S, et al. Impact of filaggrin mutations on Raman spectra and biophysical properties of the stratum corneum in mild to moderate atopic dermatitis[J]. J Eur Acad Dermatol Venereol, 2012, 26(8): 983-990. DOI:10.1111/j.1468-3083.2011.04198.x |
| [29] |
Leick KM, Rodriguez AB, Melssen MM, et al. The barrier molecules junction plakoglobin, filaggrin, and dystonin play roles in melanoma growth and angiogenesis[J]. Ann Surg, 2019, 270(4): 712-722. DOI:10.1097/SLA.0000000000003522 |
| [30] |
Baeg MK, Choi MG, Jung YD, et al. Esophageal squamous cell carcinoma patients have an increased risk of coexisting colorectal neoplasms[J]. Gut Liver, 2016, 10(1): 76-82. DOI:10.5009/gnl14381 |
 2020, Vol. 35
2020, Vol. 35


