文章信息
- 王立东, 李留玉, 赵学科, 宋昕, 吉佳佳, 郑树
- Wang Lidong, Li Liuyu, Zhao Xueke, Song Xin, Ji Jiajia, Zheng Shu
- 食管鳞癌与结直肠腺癌关系研究进展
- Progress on correlation between esophageal squamous cell carcinoma and colorectal adenocarcinoma
- 实用肿瘤杂志, 2020, 35(5): 387-395
- Journal of Practical Oncology, 2020, 35(5): 387-395
基金项目
- 国家重点研发计划项目(2016YFC0901403);国家自然科学基金项目(81872032,U1804262);中央引导地方科技发展专项(20200715)
-
作者简介
-
王立东(1958-), 男, 河南获嘉县人, 教授, 博士, 从事食管/贲门癌变机制和防治研究
王立东 师从郑树教授获医学博士学位(2003年)。现任郑州大学第一附属医院教授,博士生导师,省部共建食管癌防治国家重点实验室主任;中国抗癌协会食管癌专业委员会常委,中国抗癌协会肿瘤病因专业委员会副主任委员,河南省抗癌协会副理事长。国家杰出青年科学基金获得者,先后获得国务院有突出贡献专家、全国优秀科技工作者、河南省中原学者、河南省首届杰出专业技术人才和河南卫生科技创新突出贡献奖等称号。从事食管癌防治研究35年,建立50万例食管癌和贲门癌临床诊疗、病理和44年随访信息数据库和生物样品库研究队列和5.4万例高发区无症状居民33年内镜活检随访队列;发现15个食管癌和贲门癌易感基因(Nature Genetics,2010、2014;Human Molecular Genetics,2012年;Gut,2016;Proceedings of the National Academy of Sciences of United States of America,2017)和3个突变基因(Cancer Discovery,2012),从遗传学角度阐明老一代科学家发现的维生素和微量元素缺乏及亚硝胺暴露等食管癌高危因素的分子基础,揭示“环境-遗传-基因互作”对食管癌发生的影响。主持13项国家自然科学基金项目(3项重点项目)、6项863项目、1项973项目、1项美国国立癌症研究所(National Cancer Institute,NCI)项目(子课题)和1项香港特区重点项目。出版专著9部,发表论文596篇,科学引文索引(Science Citation Index,SCI)收录论文131篇,其中期刊引用报告(Journal Citation Reports,JCR)1区30篇,SCI他引6 229次;13篇SCI论文他引 > 100次。获4项省部级科技进步一等奖(2001、2014、2015和2017)。培养300余名硕士和博士研究生. -
通信作者
-
王立东, E-mail:ldwang2007@126.com
郑树, E-mail:zhengshu@zju.edu.cn
-
文章历史
- 收稿日期:2020-09-03
2. 郑州大学基础医学院病理学与病理生理学教研室, 河南 郑州 450001;
3. 浙江大学第二附属医院恶性肿瘤预警与干预教育部重点实验室, 浙江 杭州 310009
2. Department of Pathology and Pathophysiology, School of Basic Medical Sciences, Zhengzhou University, Zhengzhou 450001, China;
3. Cancer Institute(Key Laboratory of Cancer Prevention and Intervention, China National Ministry of Education), The Second Affiliated Hospital, School of Medicine, Zhejiang University, Hangzhou 310009, China
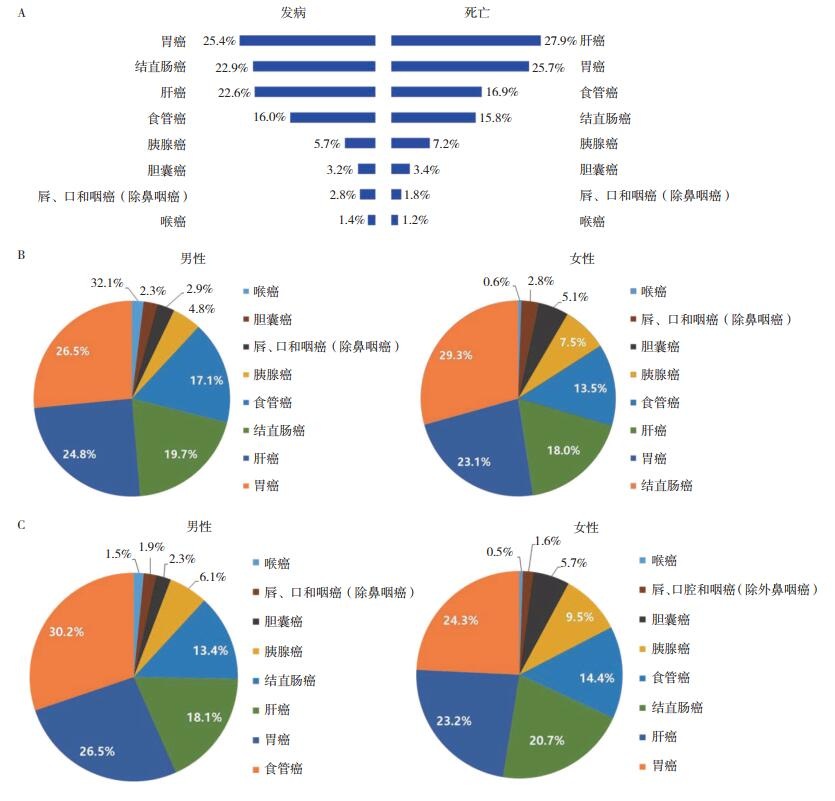
食管癌和结直肠癌是中国最常见的消化道肿瘤(图 1)[1]。食管癌是极具中国特色的恶性肿瘤,每年全世界新发约50万例食管癌患者中,2/3发生在中国。显著的地域性分布和明显的家族聚集是中国食管癌突出的流行特征,形成明显的食管癌高低发区。河南、河北和山西交界的太行山地区,特别是河南的林县(现林州)是中国,也是世界上食管癌发病率和死亡率最高的地区。近年的研究提示,食管癌并发其他消化道肿瘤(包括结直肠癌等)并非罕见[2-4]。随着食管癌变分子机制、高危人群分子分型和早期发现研究的深入,临床上早期食管癌检出率明显升高,继而食管癌5年生存率发生明显改善,这可能是近年食管癌并发其他恶性肿瘤报道增多的原因之一。此外,因为人体消化道解剖学结构的连续性,导致人体从口腔到结直肠消化道黏膜上皮可能暴露相似的环境致癌因素,进而同时或先后发生区域癌变的风险增加,这可能是食管癌并发其他消化道肿瘤发病率升高的又一原因。
对河南食管癌高发现场60年的研究发现,食管癌同时或先后并发贲门癌最常见(54%),其次是消化道恶性肿瘤中的胃窦癌(16%)和结直肠癌(1%)[2]。进一步的研究提示,食管癌和结直肠癌具有相似的致病危险因素和分子变化。阐明食管癌并发其他消化道肿瘤发生的分子机制,对食管癌综合防控具有重要临床意义。本文就食管癌与结直肠癌关系研究最新进展作一简要述评,为食管癌和结直肠癌综合防控策略提供依据。
1 中国食管癌和结直肠癌具有相似的地域性和家族聚集流行特征并因此导致二者具有相似的研究思路和可以互相借鉴的研究成果 1.1 食管癌和结直肠癌地域性分布对比食管癌是世界上最常见的六大恶性肿瘤之一。在中国,食管癌发病率居第6位,死亡率居第4位[1]。中国食管癌具有显著的地域性分布特征,形成明显的高发区,主要包括:华北太行山高发区,主要集中在河南、河北和山西三省交界的太行山南段,包括河南林县、河北磁县和山西阳城等;陕、豫、鄂秦岭高发区,主要集中在陕西、河南和湖北三省交界的秦岭东部山区;鄂、豫、皖大别山高发区,主要包括河南省南部的信阳地区、湖北省北部的孝感地区及安徽省西南部的六安地区等;川北高发区,以盐亭县为中心,包括阆中、基溪、广元、南充、剑阁、梓潼和射洪等县;闽、粤高发区,主要是指广东省东部的汕头地区、梅县地区和福建省西部的南安县等;苏北高发区,以扬中县为中心,包括淮安、秦兴和建湖等县;此外,我国西北部新疆维吾尔自治区的新源县和托里县以及甘肃省的金塔县和肃北蒙古自治县等地也较高发[5]。特别需要指出的是,浙江省的仙居县和天台县也是中国食管癌发病率和死亡率较高的地区[6-7]。
结直肠癌是世界上最常见的四大恶性肿瘤之一。在中国,结直肠癌发病率居第4位,死亡率居第5位[1]。与食管癌相似,中国结直肠癌也呈现明显的地域性分布特征。但是,结直肠癌高发地区多分布于东南沿海,如上海市、广州市、沈阳市和浙江省等经济较发达地区[8],与食管癌高发区主要位于农村和山区等经济相对落后地区的特点形成明显反差。特别值得指出的是,浙江省的嘉善县和海宁市等地区大肠癌发病率非常高[9],特别是嘉善县女性大肠癌发病率高于其他地区(22.8/10万)[10]。令人惊奇的是,农村地区结直肠癌发病率和死亡率调查发现,河南省林县食管癌高发区人群结直肠癌发病率和死亡率也高于其他农村地区[10]。河南林县农村地区同时并存食管癌和结直肠癌高发病率的独特地域分布现象的意义尚不清楚,进一步了解这些不同地区人群的食管癌和结直肠癌分子变化特征对揭示这二种肿瘤是否具有相似的发病危险因素具有重要意义。
1.2 食管癌和结直肠癌家族聚集发病特征对比食管癌家族聚集发生非常明显,食管癌高发区家族史阳性(连续三代内发生≥2例食管癌患者,或先证者为食管癌患者,三代成员中发生≥1例食管癌或其他恶性肿瘤)占40%左右,高于低发区(30%)。换言之,约1/3的食管癌患者具有明显遗传易患性。一组同卵双胞胎食管癌调查显示,1/3的同卵双胞胎食管癌患者为2位成员同时或先后发生食管癌,进一步提示环境因素对食管癌发生的影响大于遗传因素[11]。食管癌高、低发区食管癌患者核心家系(连续二代一级亲属中发生≥2例食管癌患者)调查发现,在食管癌家族史阳性患者中,> 80%符合核心家系[12]。河南研究小组2010年发现2个食管癌易感基因phospholipase C epsilon 1(PLCE1)和核黄素转运基因2(riboflavin transporter 2,RFT2)][13-14],其中,RFT2变异直接影响核黄素的吸收。早期的研究证明,核黄素缺乏是食管癌重要致病危险因素[13]。补充核黄素能明显降低食管癌发生风险。这些研究成果不但从分子学角度揭示食管癌遗传易患性的物质基础,同时阐明环境和遗传因素交互作用对食管癌发生的影响,进一步提示食管癌个体化预防的新理念。
值得注意的是,近年的研究提示食管癌易感基因PLCE1与结直肠癌高易患性有关[15]。同时,PLCE1蛋白高表达能够促进结肠癌的侵袭和转移,进而影响患者的生存[16]。与食管癌相似,人群研究发现,膳食补充核黄素可降低结直肠癌的发病风险[17]。这些研究提示进一步阐明RFT2在结直肠癌发生和发展过程中的变化特征和规律是非常有意义的研究课题。结直肠癌家族聚集现象也较明显,但结直肠癌患者家族史阳性率(25%)低于食管癌家族史阳性率[18]。深入研究这些家族史,特别是核心家系的分子基础将有助于阐明环境和遗传因素交互作用对食管癌和结直肠癌的影响,进一步为中国人消化道肿瘤综合防控策略提供依据。
1.3 食管癌并发结直肠癌如前所述,随着食管癌发病危险因素及其作用机制的阐明和临床防治水平的提高,早期食管癌发现率升高,中晚期食管癌患者的5年生存率也明显升高。值得警惕的是,因5年生存率的提高,这些食管癌患者发生其他器官的原发恶性肿瘤的风险也升高。本研究组对50万例食管癌患者随访研究发现,食管癌同时或先后并发其他消化道器官原发恶性肿瘤最常见的部位是贲门(54%),其次是胃窦(16%)和结直肠(1%)[2]。如前所述,食管和结直肠是一个解剖学上连续的消化管道,黏膜上皮暴露相似的环境致癌因素,这可能是食管癌并发结直肠癌的主要原因。
1.4 食管癌和结直肠癌迁徙流行病学史书记载,历史上曾发生3次大型与战祸有关的中国北方中原居民南迁的事件,包括公元304年西晋时期因永嘉之乱(90万人)[19]、公元755年唐朝时期因安史之乱(100万人)[20]和公元1127年北宋末年因靖康之乱(450万人)[21]所引发的大规模迁徙。这些人群一路南迁,滞留在包括现在的浙江、安徽、江苏、广东、福建、江西、湖南、广西、四川、海南和中国台湾地区等地,逐渐形成独特的客家人文化至今。1900年至今,河南食管癌高发区林县和淅川部分居民分别迁徙到山西长治和湖北钟祥等地[22-23],形成迁徙史非常清晰的新移民。
非常有意义的是,现代肿瘤流行病学调查发现,这些客家人居住区多数是食管癌高发区,发病率和死亡率都高于当地居民。最典型的例子是广东潮汕地区以及福建安溪、惠安和南安等地区[24]。对湖北钟祥和山西长治等河南移民食管癌发病危险因素流行病学调查提示,这些移民人群食管癌发病率和死亡率高于当地居民[22-23]。更重要的是,这些人群食管内镜普查和黏膜活检病理检查发现其食管癌前病变的组织细胞形态和发生率都与迁徙地高发区居民相似。这些研究提示,遗传因素可能是食管癌发生重要危险因素之一。近年这些移民的分子生物学研究不但从分子遗传学角度证实这些移民与北方中原河南居民有相似的遗传背景,进一步为这些移民的出发地提供了更明确的分子学阐释,同时发现,这些移民与原住地居民具有相似的食管癌易感基因变异。
综上所述,浙江等结直肠癌高发区居民部分可能来自中原迁徙移民的后裔,有助于解释食管癌和结直肠癌存在相似遗传易患性分子改变的现象。
2 食管癌和结直肠癌发病危险因素食管癌和结直肠癌具有相似的致病危险因素,包括维生素缺乏(如核黄素、维生素A及叶酸等)、亚硝胺暴露及某些病毒[如人乳头瘤病毒(human papilloma virus,HPV)]和细菌感染[如幽门螺杆菌(Helicobacter pylori,Hp)和牙龈卟啉单胞菌(Porphyromonas gingivalis,PG)]等。这些研究进展为食管癌和结直肠癌综合防控提供了重要依据。
2.1 维生素与食管癌和结直肠癌20世纪60年代,我国食管癌老一代科学家对食管癌高发区河南林县居民营养和膳食结构与食管癌的关系研究发现,维生素和微量元素缺乏是食管癌主要危险因素,特别是核黄素、维生素A中间代谢产物维甲酸和叶酸的缺乏以及锌、硒和钙等缺乏,均能提高食管癌患病风险;膳食补充这些营养素能有效促进食管上皮增生,降低癌前病变发生率,并据此在河南林县、河北磁县和四川盐亭开展大规模膳食维生素补充干预研究[14]。长期膳食补充这些维生素(如核黄素盐)后发现,对食管癌的发生存在明显干预作用,但个体差异显著[25]。本团队研究发现3个中国人食管癌高风险易感基因分别与RFT2基因、叶酸体内正常代谢基因[亚甲基四氢叶酸还原酶(methylene tetrahydrofolate reductase,MTHFR)]和维甲酸与受体结合相关基因[维甲酸受体基因β(retinoic acid receptor beta,RARβ)]发生多态性改变或基因启动子区域甲基化有关,从而导致基因异常表达,进一步导致这些维生素利用障碍,最终引起细胞增生紊乱和癌变[26-27]。MTHFR是叶酸代谢的关键酶,是甲基供体,参与DNA甲基化和基因组启动子甲基化过程,参与细胞内嘌呤合成。近年的研究提示,MTHFR C677T位点变异能够影响结肠癌发病风险,因此进一步阐明叶酸及其关键代谢酶MTHFR基因变异关系对有效实施食管癌和结直肠癌防控具有重要意义[28]。维甲酸是维生素A的中间代谢产物,是类维生素A的活性形式,在其细胞增殖和分化过程中通过RARβ发挥着生物学功能。RARβ在结直肠癌肿瘤生物学中的抗癌作用,包括抑制细胞增殖、凋亡和迁移。因此RARβ可作为结直肠癌的一种预后指标,可能是一种新的结直肠癌靶向治疗药物。膳食补充维生素A和叶酸同样能够降低食管癌和结直肠癌的发病风险[28-29]。有关RFT2基因变异与结直肠癌发生关系的研究尚未见报道。综上所述,食管癌和结直肠癌具有相似的致病危险因素,纠正这些因素能有效降低食管癌和结直肠癌的发病风险。维生素代谢关键酶基因变异是导致维生素利用障碍,进一步影响食管癌和结直肠癌的易患性的分子基础。进一步阐明这些酶基因变异与食管癌和结直肠癌发病风险关系,对实施食管癌和结直肠癌个体化预防具有重要意义。
2.2 亚硝胺与食管癌和结直肠癌老一代科学家在食管癌高发区河南林州的人群和实验室研究已发现,亚硝胺暴露是该地区食管癌又一重要的致癌因素。亚硝胺主要是通过DNA烷基化损伤,进一步导致DNA合成异常,最终诱导癌变发生。本研究团队发现,河南林州高发区人群发生明显O6-烷基鸟嘌呤-DNA烷基转移酶基因多态改变(O6-alkylguanine-DNA alkyltransferase,AGT),导致亚硝胺引起的烷基修复缺陷,从而增加食管癌易患性[30]。近年研究提示,O6-烷基鸟嘌呤-DNA烷基转移酶的活性与结肠癌化疗的耐药性有关,但是O6-烷基鸟嘌呤-DNA烷基转移酶基因多态与结肠癌的发病风险关系的研究尚未见报道。
2.3 HPV与食管癌和结直肠癌HPV最早发现与子宫颈癌发生关系密切,HPV疫苗也较早用于子宫颈癌的预防。Syrjänen等[31]发现,食管鳞状细胞乳头瘤与HPV感染的生殖系统湿疣具有相似的组织细胞病理变化,包括细胞体积增大、胞质出现空泡样变(挖空细胞)和核深染等特点,首次提出HPV感染可能与食管鳞状细胞乳头瘤的发生有关。随后的研究证明,食管癌和癌前病变组织均检测到HPV感染,并与食管癌变进展相关[32],因此HPV与食管癌关系的研究越来越受到学者的关注。但是,目前食管癌与HPV关系研究报道差异较大,特别是食管癌组织HPV感染率的报道从0%~90%不等[32]。这一现象的机制尚不清楚。不同人群和种族的易患性、组织的异质性、不同生活习惯和检测方法等都可能是造成这种差异的原因。HPV是一种嗜上皮性病毒,目前发现有200多种亚型[33],其中HPV16和18亚型与食管癌发生关系密切[32]。一个有趣的现象是,人正常食管上皮细胞传代培养非常困难,但当在细胞中增加HPV16和18型联合培养时,很容易建立永生化细胞[34]。目前对HPV与食管癌关系的认识是,HPV是食管癌变重要危险因素之一,但HPV对食管癌的影响远没有像HPV对子宫颈癌发生影响那么严重。进一步阐明HPV感染对食管癌发生影响的分子机制是一个重要研究课题。值得重视的是,Kirgan等[35]研究发现,结直肠癌组织中HPV感染率高达97%,并被多项研究验证[36-37]。越来越多的研究提示,HPV对结直肠癌的发生也产生重要影响[36-37]。这些研究加深了对消化道肿瘤生物致癌危险因素的认识,为消化道肿瘤综合防控策略制定提供了重要参考依据。
HPV可编码的开放阅读框E1-7可通过编码多种病毒蛋白进一步影响DNA的复制、转录和翻译调控及细胞转化[38]。例如,E6可以抑制p53的表达,导致p53-Rb信号传导通路改变和对DNA的自我修复作用障碍,进一步诱导癌变发生[25];E6蛋白还可以通过激活端粒酶活性导致细胞永生,最终导致细胞癌变。E7蛋白是HPV的主要转化蛋白,可以通过与Rb蛋白和一些激酶p33 CDK2等结合,激活E2F,促进细胞增殖[38]。最近研究表明,导入E7基因的NIH 3T3细胞可导致连续地表达cyclin E和cyclin A,而这2个周期蛋白的表达有明显的促癌作用[38]。
2.4 Hp与食管癌和结直肠癌Hp感染阳性与胃癌高发病风险的关系引起食管癌和结直肠癌研究学者的重视。值得指出的是,目前有关Hp与食管癌关系的研究结果与胃癌的研究结果完全不同:Hp感染,特别是贲门部位的Hp感染,与食管鳞癌和癌前病变发生风险呈负相关,相似的结果也见于食管腺癌[26]。这种食管癌和胃癌结果不一致的原因可能是因为Hp不同亚型所致。此外,根治幽门螺杆菌感染可能使血清中ghrelin增加,导致肥胖的发生[39],体质量增加又使得食管下括约肌松弛,导致反流性食管炎,而后者是西方国家食管腺癌主要危险因素。与食管癌不同,Hp感染能增加患结直肠癌的风险[40]。Hp感染改变消化道的正常菌群可能是导致结直肠癌发病风险增加的原因,但尚缺乏可靠的证据。
2.5 PG与食管癌和结直肠癌近年的研究发现,革兰阴性厌氧菌PG与食管鳞癌密切相关[41-42]。食管癌组织PG感染阳性率高于癌旁组织和正常食管组织(60%vs 12%、0%)[42]。同时,在结直肠癌患者肠道菌落也发现大量PG,并能增加结直肠癌的发病风险[43]。有关PG与食管癌和结直肠癌发生和发展的关系及临床防治应用尚需更多研究支持。
2.6 互隔交链孢霉与食管癌和结直肠癌的关系20世纪70年代研究发现,河南食管癌高发区粮食中的互隔交链孢霉污染率高于食管癌低发区[44]。研究证实,互隔交链孢霉产生2种主要毒素:交链孢酚单甲醛(alternariol monomethyl ether,AME)和交链孢酚(alternariol,AOH)。AME和AHO具有明显的诱变性和致癌性[45]。这些研究提示,互隔交链孢霉在食管癌发生中起重要作用[44-45]。在结直肠癌发生和发展的相关研究中发现,AME可以通过诱导线粒体凋亡达到抗癌的效果[46],其意义尚需更多研究证实。
3 食管癌和结直肠癌中相似的分子改变 3.1 RFT2与食管鳞癌和结直肠癌中国食管癌高发区人群全基因组关联分析和外显子测序发现,RFT2是食管鳞癌的重要易感基因[26]。NOTCH1基因突变是食管癌变的重要分子事件[14]。最新研究发现,RFT2不仅是一个重要的易感基因,可能还是一个重要致病基因[14];RFT2基因多态变异和基因突变所导致的核黄素利用障碍,进一步加剧了高发区人群因核黄素缺乏而引发的食管癌患病风险及其他肿瘤相关分子改变,如Notch同源物1(Notch homolog 1,NOTCH1)和p53-Rb通路等[14]。核黄素在肠细胞中的转运主要由3个转运蛋白介导:位于根尖膜上的核黄素转运体3(riboflavin transporter 3,RFVT3)和位于基底外侧膜上的RFVT1和RFVT2。Tutino等[47]在人结肠腺癌细胞株(CaCo2、DLD-1和HT-29)和结直肠癌患者的组织中,通过实时聚合酶链反应和蛋白质印迹法评估基因和蛋白质表达水平,通过高效液相色谱法测定细胞内黄素含量,结果发现与正常肠黏膜比较,在结直肠癌患者的肿瘤组织中,RFVT1的含量在蛋白质和mRNA水平上均降低,RFVT3和RFVT2基因表达水平增加,而蛋白质表达减少,核黄素含量略有下降。这项研究证明,CRC组织与正常结直肠黏膜组织中RFT的转录/翻译存在差异。
3.2 NOTCH1与食管鳞癌和结直肠癌中西方食管鳞状细胞癌全基因组外显子的测序结果发现,NOTCH1基因突变发生在食管癌前病变组织,并与这些病变的恶性进展有关;同时发现中西方食管鳞状细胞癌组织均发生NOTCH1基因突变,而在食管腺癌中未检测到[48]。随后在Nature和Nature Genetics上连续发表的3篇有关中国人食管鳞状细胞癌测序研究报道均重复验证了这一重要发现[49-51]。免疫组织化学、实时定量PCR及蛋白质印迹法方法检测结直肠癌组织、癌旁正常组织和正常结直肠黏膜组织中NOTCH1的表达发现,结直肠癌组织NOTCH1表达高于正常结直肠黏膜组织。结直肠癌细胞株也支持这些结果。
3.3 钙黏素17(cadherin 17,CDH17)与食管鳞癌和结直肠癌CDH17是黏附分子家族中的一员,在细胞正常结构和生理功能的维持及肿瘤发生过程中具有重要作用。CDH17是同源框转录因子2(caudal-type homeobox transcription factor 2,CDX2)的转录靶点之一,在早期分化和维持肠道上皮细胞正常生理功能中具有重要作用[52]。利用瞬时CDH17-转染的细胞,通过免疫荧光染色和细胞增殖等试验发现,CDH17有助于将食管鳞癌细胞停滞在G1-S检查点,而不会诱导细胞凋亡[53]。在食管鳞癌中,CDH17 CpG岛甲基化状态增强,CDH17表达水平降低,即CDH17 CpG岛的甲基化状态与CDH17的表达呈负相关[53]。通过启动子高甲基化或其他机制沉默PCDH17的表达,会导致CDH17对食管鳞癌细胞的抑制活性。研究表明,CDH17在原发性结直肠癌组织中的表达水平较低,使得肿瘤发生及进展时肿瘤细胞间的黏附减弱,导致结直肠癌细胞的浸润和转移。应用RNA干扰技术下调结肠癌细胞中CDH17基因的表达水平发现,沉默CDH17基因表达可以抑制结肠癌细胞的侵袭和转移过程[54]。
3.4 生长激素释放激素(growth hormone-releasing hormone,GHRH)及剪接变异体(splice variants 1,SV-1)与食管鳞癌和结直肠癌最新证据表明,GHRH在各种癌症中作为自分泌/旁分泌生长因子起着作用,特别是在胃肠道(gastrointestinal,GI)肿瘤中[55]。人正常组织中存在GHRH-R和GHRH-R截短剪接变体(splice variants,SV),在4种截短的变体中,SV-1与GHRH-R结构最相似。GHRH的致癌作用可能是由GHRH受体(GHRH receptor,GHRH-R)剪接变体SV-1和垂体型GHRH-R介导的。免疫组织化学和反转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检测发现,食管鳞癌中GHRH-R和SV-1呈阴性,而Barrett's黏膜与食管腺癌中2种受体都有很强的表达[55]。从正常结肠上皮到腺瘤结肠癌的多阶段演进过程中,GHRH-R的表达增加,而正常的结直肠黏膜不表达SV-1受体[55]。
4 展望食管癌、贲门癌、胃癌和结直肠癌是中国人消化道常见恶性肿瘤。食管癌并发贲门癌、胃癌和结直肠癌并不罕见。分子生物学研究技术的进步加深了对食管癌变分子机制的了解,也发现了许多中国人食管癌变多阶段演进过程中的关键畸变分子。利用这些重要分子标志物对高发区无症状人群进行高危人群分子分型,进一步进行食管色素内镜和黏膜靶向活检病理学检查,明显提高了食管癌前病变和早期癌的检出率,降低了食管癌死亡率。加上临床诊疗水平的提高,中晚期食管癌5年生存率也发生明显改善。但同时,食管癌并发其他恶性肿瘤(包括结直肠癌等)的报道也明显增多。人体消化道解剖学结构的连续性,导致人体从口腔到结直肠消化道黏膜上皮可能暴露相似的环境致癌因素,进而同时或先后发生区域癌变的风险增加。这可能是食管癌并发其他消化道肿瘤发病率升高的又一原因。阐明这些多原发肿瘤发生的危险因素和分子基础的异同,对建立消化道肿瘤综合防控策略具有重要指导意义。
食管鳞癌和结直肠腺癌在致病危险因素、分子基础和遗传易患性等方面非常相似,二者研究思路可以相互借鉴,甚至成果也可共享。阐明这些消化道不同部位、常见肿瘤的环境和遗传因素交互作用对癌变多阶段演进的影响,进一步建立多种分子分型方案,对这些肿瘤的早期发现和高危人群预警筛查等均具有重要指导意义。
目前,有关中国人常见消化道肿瘤多维组学对比研究报道甚少。这些常见、并发肿瘤的分子变化特征和规律亟待阐明,并为建立用于高危人群预警和早期发现的科学、简便和无创的分子分型体系奠定理论依据和关键技术支撑。这也正是目前中国消化道常见肿瘤研究领域又一关键科学问题和重要研究方向。
| [1] |
Chen W, Sun K, Zheng R, 等. Cancer incidence and mortality in China, 2014[J]. 中国癌症研究:英文版, 2018, 30(1): 1-12. |
| [2] |
樊冰雨, 鲍启德, 孙雷, 等. 食管癌高、低发区食管鳞癌相关多原发癌的临床特点[J]. 郑州大学学报:医学版, 2019, 54(2): 160-164. |
| [3] |
樊冰雨.高、低发区食管鳞癌相关多原发癌的临床特点分析及p53在两组患者中的表达和临床意义[D].郑州: 郑州大学医学科学院, 2019. https://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&filename=1019115153.nh
|
| [4] |
Zhang B, Guo K, Zheng X, et al. Risk of second primary malignancies in colon cancer patients treated with colectomy[J]. Front Oncol, 2020, 10: 1154. DOI:10.3389/fonc.2020.01154 |
| [5] |
杜百廉. 食管癌[M]. 2版北京: 中国科学技术出版社, 1994: 56-53.
|
| [6] |
蔡红卫, 应江伟, 吴武军. 浙江省仙居县2010~2014年上消化道癌发病、死亡分析及早诊早治效果评价[J]. 中国肿瘤, 2017, 26(10): 762-768. |
| [7] |
徐金昌, 黄一均, 王绍干, 等. 颈段食管癌手术治疗体会[J]. 河北医学, 1998, 4(8): 3-5. |
| [8] |
郑树, 黄彦钦. 结直肠癌早诊筛查[J]. 中华内科杂志, 2014, 53(7): 505-507. |
| [9] |
陈琼, 刘曙正, 郭兰伟, 等. 2016年河南省恶性肿瘤的发病与死亡分析[J]. 中国肿瘤, 2020, 29(8): 571-578. |
| [10] |
郑树, 蔡善荣. 中国大肠癌的病因学及人群防治研究[J]. 中华肿瘤杂志, 2004, 26(1): 1-3. |
| [11] |
王立东. 同卵双胞胎与食管癌[J]. 郑州大学学报:医学版, 2009, 44(4): 698-700. |
| [12] |
澹会芳, 赵学科, 高社干, 等. 食管癌核心家系患者临床病理特征及术后预后分析[J]. 郑州大学学报:医学版, 2019, 54(2): 164-168. |
| [13] |
Wang LD, Zhou FY, Li XM, et al. Genome-wide association study of esophageal squamous cell carcinoma in Chinese subjects identifies susceptibility loci at PLCE1 and C20orf54[published correction appears in Nat Genet. 2014 Sep; 46(9):1041][J]. Nat Genet, 2010, 42(9): 759-763. DOI:10.1038/ng.648 |
| [14] |
王立东, 杜丹凤, 宋昕, 等. 食管癌"环境-遗传-基因互作"组学研究:核黄素、核黄素转运基因2和NOTCH1-P53-Rb互作关系[J]. 郑州大学学报:医学版, 2018, 53(1): 1-5. |
| [15] |
Li X, Li X, Jiang M, et al. Single nucleotide polymorphisms in PLCE1 for cancer risk of different types:A meta-analysis[J]. Front Oncol, 2018, 8: 613. DOI:10.3389/fonc.2018.00613 |
| [16] |
Wang X, Zhou C, Qiu G, et al. Phospholipase C epsilon plays a suppressive role in incidence of colorectal cancer[J]. Med Oncol, 2012, 29(2): 1051-1058. DOI:10.1007/s12032-011-9981-1 |
| [17] |
罗贤懋, 林培中, 刘雨菁, 等. 核黄素预防恶性肿瘤的研究进展[J]. 癌症进展, 2020, 18(4): 325-330. |
| [18] |
Giardiello FM, Allen JI, Axilbund JE, et al. Guidelines on genetic evaluation and management of Lynch syndrome:a consensus statement by the US Multi-Society Task Force on colorectal cancer[J]. Gastroenterology, 2014, 147(2): 502-526. DOI:10.1053/j.gastro.2014.04.001 |
| [19] |
胡阿祥. 《晋永嘉丧乱后之民族迁徙》申论[J]. 安徽大学学报:哲学社会科学版, 2010, 34(5): 100-111. |
| [20] |
林立平. 唐后期的人口南迁及其影响[J]. 江汉论坛, 1983, 9: 69-73. |
| [21] |
张显运, 顾飞. 靖康之乱时期中原人南迁闽南述论[J]. 中原文化研究, 2016, 4(6): 68-72. |
| [22] |
胡安冬.环境因素与钟祥地区移民食管癌高发相关性的研究[D].武汉: 华中科技大学公共卫生学院, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10487-1011275922.htm
|
| [23] |
纪爱芳, 魏武, 王金胜, 等. 山西长治地区健康林州移民及食管鳞癌患者血浆核黄素水平的比较及其意义[J]. 中华内科杂志, 2011, 50(12): 1048-1050. |
| [24] |
彭仙娥, 杨秀惠, 史习舜, 等. 福建省食管癌地理流行病学研究[J]. 中国慢性病预防与控制, 2003, 11(5): 212-213, 231. |
| [25] |
王立东, 宋昕, 赵学科, 等. 食管癌环境和遗传危险因素交互作用的分子基础和精准预防[J]. 中国肿瘤临床, 2016, 43(12): 515-520. |
| [26] |
Wang LD, Guo RF, Fan ZM, et al. Association of methylenetetrahydrofolate reductase and thymidylate synthase promoter polymorphisms with esophageal and cardia cancer risk[J]. Dis Esophagus, 2005, 18(3): 177-184. DOI:10.1111/j.1442-2050.2005.00492.x |
| [27] |
Wang Y, Fang MZ, Liao J, et al. Hypermethylation-associated inactivation of retinoic acid receptor beta in human esophageal squamous cell carcinoma[J]. Clin Cancer Res, 2003, 9(14): 5257-5263. |
| [28] |
Fernández-Peralta AM, Daimiel L, Nejda N, et al. Association of polymorphisms MTHFR C677T and A1298C with risk of colorectal cancer, genetic and epigenetic characteristic of tumors, and response to chemotherapy[J]. Int J Colorectal Dis, 2010, 25(2): 141-151. DOI:10.1007/s00384-009-0779-y |
| [29] |
Wang W, Liu S, Jiang C, et al. High expression of RARβ is a favorable factor in colorectal cancer[J]. Dis Markers, 2019, 2019: 7138754. |
| [30] |
Deng C, Xie D, Capasso H, et al. Genetic polymorphism of human O6-alkylguanine-DNA alkyltransferase:identification of a missense variation in the active site region[J]. Pharmacogenetics, 1999, 9(1): 81-87. DOI:10.1097/00008571-199902000-00011 |
| [31] |
Syrjänen K, Pyrhönen S, Aukee S, et al. Squamous cell papilloma of the esophagus:a tumour probably caused by human papilloma virus (HPV)[J]. Diagn Histopathol, 1982, 5(4): 291-296. |
| [32] |
Ding GC, Ren JL, Chang FB, et al. Human papillomavirus DNA and P16INK4A expression in concurrent esophageal and gastric cardiacancers[J]. World J Gastroenterol, 2010, 16(47): 5901-5906. |
| [33] |
Burd EM, Dean CL. Human papillomavirus[J]. Microbiol Spectr, 2016, 4(4): 1-17. |
| [34] |
李健, 齐义军, 王立东. 食管上皮永生化细胞系研究进展[J]. 世界华人消化杂志, 2005, 13(11): 1317-1321. |
| [35] |
Kirgan D, Manalo P, Hall M, et al. Association of human papillomavirus and colon neoplasms[J]. Arch Surg, 1990, 125(7): 862-865. DOI:10.1001/archsurg.1990.01410190060009 |
| [36] |
左灵妮, 刘康, 马晓勤. HPV16、18感染与结直肠癌的相关性[J]. 实用癌症杂志, 2020, 35(8): 1262-1265. |
| [37] |
靳大川, 武淑芳, 郭师, 等. 国人结直肠癌与HPV感染关系的系统评价和meta分析[J]. 现代医药卫生, 2020, 36(1): 8-12. |
| [38] |
陆哲明, 柯杨. HPV与食管癌关系研究进展[J]. 国外医学:肿瘤学分册, 2000, 27(4): 241-245. |
| [39] |
张颖, 齐凤祥, 张志广, 等. Hp相关上消化道疾病中生长激素调素水平的临床意义[J]. 天津医药, 2013, 41(8): 766-768. |
| [40] |
Yang F, Xu YL, Zhu RF. Helicobacter pylori infection and the risk of colorectal carcinoma:a systematic review and meta-analysis[J]. Minerva Med, 2019, 110(5): 464-470. |
| [41] |
李硕果, 贾瑞诺, 高社干. 牙龈卟啉单胞菌与食管癌临床病理特征和预后的关系[J]. 重庆医学, 2018, 47(28): 3614-3617. |
| [42] |
孟倩倩, 原翔, 刘怡文, 等. 牙龈卟啉单胞菌在食管癌变过程中的作用研究[J]. 食管疾病, 2020, 2(2): 121-124. |
| [43] |
邝融, 李江, 潘永生, 等. 牙龈卟啉单胞菌对消化系统肿瘤的影响[J]. 医学综述, 2020, 26(16): 3211-3215, 3220. |
| [44] |
甄应中, 杨文献, 杨胜利, 等. 河南省食管癌五个高发县和三个低发县粮食中霉菌的分离培养[J]. 中华肿瘤杂志, 1984, 6(1): 27-29. |
| [45] |
刘桂亭, 苗健, 甄应中, 等. 真菌类及其毒素在人食管癌中的病因学意义互隔交链孢霉与食管癌发生关系的研究[J]. 河南医学研究, 1992, 1(1): 1-2. |
| [46] |
Bensassi F, Gallerne C, el Dein OS, et al. Mechanism of Alternariol monomethyl ether-induced mitochondrial apoptosis in human colon carcinoma cells[J]. Toxicology, 2011, 290(2/3): 230-240. |
| [47] |
Tutino V, Defrancesco ML, Tolomeo M, et al. The expression of riboflavin transporters in human colorectal cancer[J]. Anticancer Res, 2018, 38(5): 2659-2667. |
| [48] |
Agrawal N, Jiao Y, Bettegowda C, et al. Comparative genomic analysis of esophageal adenocarcinoma and squamous cell carcinoma[J]. Cancer Discov, 2012, 2(10): 899-905. DOI:10.1158/2159-8290.CD-12-0189 |
| [49] |
Gao YB, Chen ZL, Li JG, et al. Genetic landscape of esophageal squamous cell carcinoma[J]. Nat Genet, 2014, 46(10): 1097-1102. DOI:10.1038/ng.3076 |
| [50] |
Lin DC, Hao JJ, Nagata Y, et al. Genomic and molecular characterization of esophageal squamous cell carcinoma[J]. Nat Genet, 2014, 46(5): 467-473. DOI:10.1038/ng.2935 |
| [51] |
Altree-Tacha D, Tyrrell J, Haas T. CDH17 is a more sensitive marker for gastric adenocarcinoma than CK20 and CDX2[J]. Arch Pathol Lab Med, 2017, 141(1): 144-150. DOI:10.5858/arpa.2015-0404-OA |
| [52] |
Haruki S, Imoto I, Kozaki K, et al. Frequent silencing of protocadherin 17, a candidate tumour suppressor for esophageal squamous cell carcinoma[J]. Carcinogenesis, 2010, 31(6): 1027-1036. DOI:10.1093/carcin/bgq053 |
| [53] |
韩峥, 黄晓东, 刘蒙, 等. 敲低钙黏素17(CDH17)抑制那可丁耐药性SW480人结肠癌细胞的增殖并促进其凋亡[J]. 细胞与分子免疫学杂志, 2017, 33(5): 606-610. |
| [54] |
Hohla F, Moder A, Mayrhauser U, et al. Differential expression of GHRH receptor and its splice variant 1 in human normal and malignant mucosa of the oesophagus and colon[J]. Int J Oncol, 2008, 33(1): 137-143. |
 2020, Vol. 35
2020, Vol. 35