文章信息
- 陆健美, 葛建钢, 王静, 刘强, 顾峰
- Lu Jianmei, Ge Jiangang, Wang Jing, Liu Qiang, Gu Feng
- 联合应用3.0T磁共振T2WI、DWI及DCE-MRI成像诊断前列腺癌
- Diagnosis of prostate cancer with 3.0T magnetic resonance T2WI, DWI and DCE-MRI
- 实用肿瘤杂志, 2020, 35(4): 355-359
- Journal of Practical Oncology, 2020, 35(4): 355-359
基金项目
- 南通市市级科技计划(指导性)项目(MSZ18152)
-
作者简介
- 陆健美(1978-), 女, 江苏启东人, 副主任医师, 从事腹部及神经影像诊断研究.
-
通信作者
- 顾峰,E-mail:2905521007@qq.com
-
文章历史
- 收稿日期:2019-07-19
2. 南通市第二人民医院病理科, 江苏 南通 226002;
3. 南通市第二人民医院泌尿外科, 江苏 南通 226002
2. Pathology Department, The Second People's Hospital of Nantong, Nantong 226002, China;
3. Urology Surgery Department, The Second People's Hospital of Nantong, Nantong 226002, China
前列腺癌(prostate cancer,PCa)是一种发病率较高的男性生殖系统恶性肿瘤,多数患者由于出现骨痛以及尿路症状而就诊,但此时病情已发展为晚期,耽误最佳治疗时机[1-2]。临床选择合理有效的治疗方案有赖于早期诊断及术前分期的准确。核磁共振是临床常用的成像检查技术,特点为多参数和多序列,较高的软组织分辨率,且无电离辐射,不仅能将前列腺病变的一般形态学变化清楚呈现,还能通过信号特征对病变的主要成分进行判定,可以有效鉴别诊断PCa[3-4]。但不同扫描序列对该病的诊断能效不同,常规T2加权成像(T2 weighted image,T2WI)、扩散加权成像(diffusion-weighted imaging,DWI)及动态对比增强磁共振成像(dynamic contrast enhancement magnetic resonance imaging,DCE-MRI)单独应用时都具有一定的局限性,联合应用T2WI、DWI及DCE-MRI多模态成像技术,从不同方面反映前列腺疾病的形态及功能表现,可能有利于早期发现PCa。本文回顾性分析联合应用3.0T磁共振T2WI、DWI及DCE-MRI成像诊断PCa的效能。
1 资料与方法 1.1 一般资料选择南通市第二人民医院2017年5月至2019年4月期间因血清前列腺特异度抗原(prostate-specific antigen,PSA)增高、经穿刺活检或手术病理证实为前列腺疾病的患者79例为研究对象,其中PCa患者48例,非PCa患者31例。所有患者在MRI检查前均未行内分泌治疗和放疗等非手术治疗。患者年龄58~94岁,(76.3±12.4)岁。临床症状表现为排尿困难、尿频、尿急、尿痛和血尿等。
1.2 方法 1.2.1 检查前准备所有患者入组前均填写知情同意书,与患者进行沟通,避免因检查时间较长而出现的不配合现象,检查前1 d少渣饮食,检查时适度充盈膀胱。
1.2.2 设备、扫描范围及序列采用Philips公司的Ingenia 3.0T全数字磁共振扫描仪实施检查。受检者取仰卧位。横断面扫描范围为前列腺、精囊及膀胱。矢状面及冠状面扫描范围为盆底至腹主动脉分叉处。扫描序列为AX-T1W、AX-T2W、AX-T2-SPAIR、SAG及COR-T2-SPAIR。DWI采用单次激发自旋回波平面成像,b值取2 000 s/mm2进行扫描,利用本机软件自动生成表现弥散系数(apparent dispersion coefficient,ADC)图。动态增强使用轴位DIXON序列扫描,层厚4 mm,层数40层,连续进行24期扫描,对比剂使用钆喷酸葡胺注射液,剂量0.2 mL/kg,采用双筒高压注射器,扫描结束后经自带软件工作站处理得到病灶区时间-信号强度曲线,对病灶局部测量时采用同样大的感兴趣区。
1.3 指标测定和分析根据前列腺大小及临床需要进行前列腺穿刺活检或手术活检。穿刺活检及手术位置由泌尿外科医师记录。固定液采用4%甲醛,HE染色制片,观察报告由病理医师负责,并Gleason评分进行标明。采用双盲法,阅片时选择由2位有经验的磁共振高级医师共同进行,对疾病检查结果进行评价,判定为癌灶与否,并对照病理结果。当T2WI分别和DWI、DCE-MRI联用,诊断结果出现不一致时以DWI和DCE-MRI诊断结果为准。当T2WI、DWI和DCE-MRI三者联用出现诊断结果差异时,以任何2种方法结果一致为准。计算T2WI、T2WI+DWI、T2WI+DCE-MRI和T2WI+DWI+DCE-MRI对PCa诊断的敏感度及特异度,其计算公式参照文献[5]进行。
1.4 诊断标准T2WI及DWI图像依据PI-RADS V2诊断标准[6]进行判断,采用5分制。DCE-MRI序列仅对阳性结果和阴性结果进行区分。阳性结果:病变局限性强化,早前于周围正常组织或与邻近正常前列腺同时强化,相应T2WI和(或)DWI能发现对应病灶;阴性结果:与周围组织对比病灶早期弥漫性强化或不强化,强化部分在T2WI和(或)DWI上无对应病灶。
T2WI联合DWI、T2WI联合DCE-MRI以及T2WI联合DWI和DCE-MRI的评分依据PI-RADS V2诊断标准进行判断,采用5分制,评分标准见表 1和表 2。
| PI-RADS | T2WI+DWI | T2WI+DCE-MRI | |||
| T2WI | DWI | T2WI | DCE-MRI | ||
| 1 | 1 | 1~5 | 1 | 阳性或阴性 | |
| 2 | 2 | 1~5 | 2 | 阳性或阴性 | |
| 3 | 3 | ≤4 | 3 | 阴性 | |
| 4 | 3 | 5 | 3 | 阴性 | |
| 4 | 4 | 1~5 | 4 | 阳性或阴性 | |
| 5 | 5 | 1~5 | 5 | 阳性或阴性 | |
| 注PI-RADS:前列腺影像报告和数据系统(prostate imaging reporting and data system);DWI:扩散加权成像(diffusion-weighted imaging);DCE-MRI:动态对比增强磁共振成像(dynamic contrast enhancement magnetic resonance imaging) | |||||
| PI-RADS | 外周带病变 | 移行带病变 | |||||
| DWI | T2WI | DCE-MRI | DWI | T2WI | DCE-MRI | ||
| 1 | 1 | 1~5 | 阳性或阴性 | 1 | 1~5 | 阳性或阴性 | |
| 2 | 2 | 1~5 | 阳性或阴性 | 2 | 1~5 | 阳性或阴性 | |
| 3 | 3 | 1~5 | 阴性 | 3 | ≤4 | 阳性或阴性 | |
| 4 | 3 | 1~5 | 阴性 | 3 | 5 | 阳性或阴性 | |
| 4 | 4 | 1~5 | 阳性或阴性 | 4 | 1~5 | 阳性或阴性 | |
| 5 | 5 | 1~5 | 阳性或阴性 | 5 | 1~5 | 阳性或阴性 | |
| 注PI-RADS:前列腺影像报告和数据系统(prostate imaging reporting and data system);DWI:扩散加权成像(diffusion-weighted imaging);DCE-MRI:动态对比增强磁共振成像(dynamic contrast enhancement magnetic resonance imaging) | |||||||
使用SPSS 19.0统计学软件进行数据分析。T2WI、T2WI+DWI、T2WI+DCE-MRI和T2WI+DWI+DCE-MRI对PCa诊断的敏感度、特异度和准确度采用配对四方格资料的χ2检验进行分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 MRI及病理79例扫描患者中,PCa 48例,其中外周带癌33例,同时累及中央区(中央叶和移行带)和外周带15例(图 1);非PCa 31例,其中前列腺增生22例(图 2),前列腺炎9例。
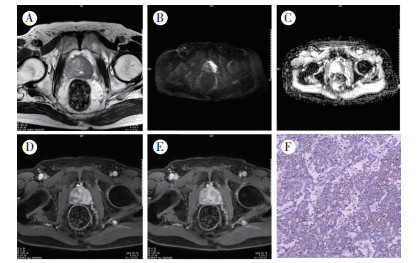
|
| 注 A:T2WI示,左外周带及移行带较大范围低信号区;B:DWI(b=2 000 s/mm2)对应部位明显高信号,边缘清晰;C:ADC图示,对应部位呈显著低信号;D:MRI动态增强早期示,该病变区明显强化;E:MRI动态增强延迟期示强化灶信号明显减低;F:病理证实为PCa(Gleason评分=3+3;EnVision×20) 图 1 78岁Pca患者的MRI及病理检查结果 Fig.1 MRI and pathological examination of a 78-year-old patient with PCa |
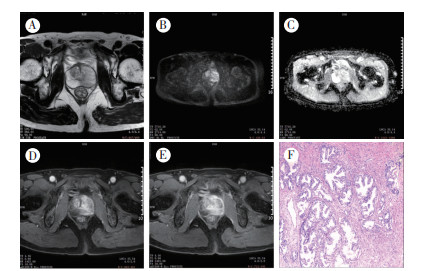
|
| 注 A:T2WI示,左外周带信号不均匀减低,移行带呈高低混杂信号;B:DWI(b=2 000 s/mm2)示移行带及左外周带较高信号,境界欠清;C:ADC图示对应部位大部分呈低信号;D:MRI动态增强早期示,异常信号区明显不均匀强化;E:MRI动态增强延迟期示,部分强化灶信号明显减低,部分有延迟强化;F:病理证实为前列腺增生(术前诊断为PCa;HE×20) 图 2 60岁前列腺增生患者的MRI及病理检查结果 Fig.2 MRI and pathological examination of a 60-year-old patient with prostatic hyperplasia |
T2WI诊断PCa 31例,非PCa 27例;T2WI+DWI诊断PCa 40例,非PCa 26例;T2WI+DCE-MRI诊断PCa 36例,非PCa 27例;T2WI+DWI+ DCE-MRI诊断PCa 44例,非PCa 29例。
2.3 4种方法诊断PCa的效能4种检查方法对PCa诊断的敏感度和准确度比较,差异均具有统计学意义(χ2=11.506、10.244,P=0.009、0.017)。T2WI+DWI+DCE-MRI对PCa诊断的敏感度及准确度均高于T2WI(χ2=10.301、10.051,P=0.001、0.002)和T2WI+DCE-MRI(χ2=4.800、5.281,P=0.028、0.022),与T2WI+DWI比较差异均无统计学意义(χ2=1.524,2.931,P=0.217、0.087;表 3)。
| 诊断方法 | 敏感度 | 特异度 | 准确度 |
| T2WI | 64.6%(31/48) | 87.1%(27/31) | 73.4%(58/79) |
| T2WI+DWI | 83.3%(40/48) | 83.9%(26/31) | 83.5%(66/79) |
| T2WI+DCE-MRI | 75.0%(36/48) | 87.1%(27/31) | 79.7%(63/79) |
| T2WI+DWI+DCE-MRI | 91.7%(44/48) | 93.5%(29/31) | 92.4%(73/79) |
T2WI能够将PCa检出和定位。该病在外周带高信号区会出现为域典型的低信号灶,具有较高的诊断敏感度[7]。但这一特征并不是PCa的特异度表现,大量良性疾病或症状也会出现相同的检测结果,如间质型前列腺增生结节就会出现与PCa类似的表现。从而降低T2WI的诊断特异度[8]。由于中央腺体组织的低信号表现,从而使得采用该方法很难将发生在中央腺体的肿瘤与正常组织区别,尤其是并发组织增生者。而且PCa在T2WI也可表现为等信号或高信号,导致癌灶不易被检出,同样对检测结果造成影响。本研究结果显示,T2WI对外周带癌的检出率较高,误诊PCa 17例,敏感度为64.6%,特异度为87.1%,与国外研究结果一致[9]。
3.2 T2WI+DWI诊断PCaDWI具有不需要注射对比剂,并且能快速成像的特点,是目前MR功能中仅有的能对活体组织内水份输布进行检测的成像方法。DWI主要依赖于水分子的布朗运动,而生物膜和组织中大分子会对这一扩散运动的方向和幅度产生影响,因而一旦发生炎性反应和肿瘤等疾病都会出现不同程度受限现象,所以单独应用DWI鉴别前列腺炎性反应或癌具有局限性。应用DWI诊断恶性肿瘤对病灶的敏感度为57%~93%,特异度为57%~100%[10]。本研究中T2WI+DWI对PCa的敏感度和准确度均高于T2WI,达到83.3%和83.5%,这可能是由于癌的ADC值变化比出血、炎性反应以及纤维化等引起的改变要大[11]。但在特异度表现方面,T2WI+DWI诊断略低于T2WI。
3.3 T2WI+DCE-MRI诊断PCaDCE-MRI进行检测前需要经肘静脉注射钆喷替酸葡甲胺(Gadolinium- diethylene triaminepenta acetate,Gd-DTPA)对比剂,对比剂经心和肺进入动脉系统后通过追踪其分布,能有效且敏感地反映活体组织的血液动力学情况。DCE-MRI一般通过以下2种方法对PCa进行定性或定量分析。(1)应用时间-信号强度曲线(time-intensity curve,TIC)形态进行定量分析,即把TIC按形态分为速升速降型、速升平台型及缓慢升高型3种类型。多数PCa在动态增强时表现为早期、快速和明显强化,TIC形态表现为速升速降型,前列腺增生表现为早期不均匀强化,且强化时间较长,对比剂流出较晚,增强晚期仍为较高信号,TIC形态多呈速升平台型或缓慢升高型。(2)基于时间-信号强度曲线进行相关血液动力学参数相对值对组织强化特点进行半定量分析,如峰值时间、峰值强度和最大强化斜率等。国外学者研究显示,T2WI+DCE-MRI诊断PCa的准确度高于T2WI,且敏感度 > 20%[12]。本研究结果显示,T2WI+DCE-MRI诊断PCa的敏感度和准确度分别为75.0%和79.7%,较单独应用T2WI均提高。
3.4 T2WI+DWI+ DCE-MRI诊断PCa分析研究结果可以发现,与T2WI进行单独检查比较,T2WI联合DWI或者DCE-MRI诊断的敏感度和准确度都有所提高,而且T2WI+DCE-MRI诊断PCa的敏感度和准确度高于T2WI+DWI。在敏感度、特异度和准确度表现3个方面,T2WI+DWI+DCE-MRI都一定程度优于T2WI+DWI,但差异均无统计学意义(均P > 0.05),提示这2种检查方法结果一致,因此一些对于长时间检查不耐受的患者,可以T2WI+DWI作为常规检查。
3.5 PI-RADS诊断PCa的价值自PI-RADS诊断标准出版以来[6],关于其诊断准确度方面的研究一直是关注的热点。有研究报道,PI-RADS V1诊断PCa的敏感度和特异度可达到80.0%和92.0%,外周带癌需要重点参考DWI序列,中央带及移行带癌则需要重点参考T2WI序列[13]。研究指出,PI-RADS V1诊断PCa能够达到较高准确度,但同时也指出DCE序列在移行带癌中的诊断价值需要重新评估[14]。本研究结果中PI-RADS V2诊断PCa的准确度略低于前述报道,分析原因可能与本研究中部分患者是通过穿刺明确诊断、但因癌灶较小且未在磁共振引导下进行、导致穿刺未能成功穿入理想靶位有关,另外由于经验不足,对于交界区病灶的分带不够准确,导致诊断准确度下降。近年来提出对临床显著性癌[Gleason评分≥7分和(或)癌灶 > 0.5 mm3和(或)有前列腺外侵犯]的诊断,研究显示,PI-RADS V2诊断前列腺外周带癌且阈值≥4时,其诊断Gleason评分≥7分的癌灶可以获得较为理想的敏感度和特异度;对于前列腺移行带Gleason评分≥7分的癌灶,PI-RADS V2诊断的敏感度较高,但是特异度较低[15]。分析原因,认为前列腺外周带中很少有其他病灶像癌性病灶一样在DWI上表现为弥散明显受限,因此DWI在外周带中的敏感度和特异度较高。而移行带是前列腺增生主要发生的位置,并且其内部成分不同,在T2WI上可有1~4分的跨度,一些良性增生结节由于细胞成分致密,DWI上可出现4分的表现,造成诊断特异度下降[16]。基于PI-RADS诊断标准诊断PCa有以下问题需要注意:(1)进行前列腺扫描时各序列方位、层厚和层间距要绝对保持一致;(2)观察分析图像时应各序列同步进图,相互严格比对(本研究中1例前列腺增生患者术前误诊为PCa,究其原因为观察分析不够仔细);(3)明确分带非常重要,交界处有时分带困难,应多序列对照明确。
综上所述,对于前列腺疾病,单一的磁共振成像方法均存在一定局限性,基于PI-RADS诊断标准的联合应用多种磁共振成像方法可以反映前列腺疾病的不同形态和功能表现,从而实现PCa更准确诊断和鉴别诊断,具有很好的临床应用价值。
| [1] |
Guzel E, Karatas OF, Semercioz A, et al. Identification of microRNAs differentially expressed in prostatic secretions of patients with prostate cancer[J]. Int J Cancer, 2015, 136(4): 875-879. |
| [2] |
Kohestani K, Chilov M, Carlsson SV. Prostate cancer screening-when to start and how to screen?[J]. Transl Androl Urol, 2018, 7(1): 34-45. DOI:10.21037/tau.2017.12.25 |
| [3] |
闵祥德, 王良, 冯朝燕, 等. 前列腺癌磁共振分子影像学研究进展[J]. 中国医学影像技术, 2016, 32(11): 1769-1772. |
| [4] |
顾峰, 袁海燕, 陆健美, 等. 前列腺癌诊断中多模态MR技术的应用及展望[J]. 实用肿瘤杂志, 2020, 35(2): 120-122. |
| [5] |
梁洁, 季建伟, 樊子健, 等. 3.0T磁共振T2WI联合DWI及DCE对前列腺癌的诊断价值[J]. 磁共振成像, 2016, 7(5): 377-341. |
| [6] |
Weinreb JC, Barentsz JO, Choyke PL, et al. PI-RADS prostate imaging-reporting and data system:2015, version 2[J]. Eur Urol, 2016, 69(1): 16-40. |
| [7] |
Liu Y, Wang W, Qin XB, et al. The applied research of simultaneous image acquisition of T2-weighted imaging (T2WI) and diffusion-weighted imaging (DWI) in the assessment of patients with prostate cancer[J]. Asian J Androl, 2019, 21(2): 177-182. DOI:10.4103/aja.aja_82_18 |
| [8] |
Türkbey B, Bernardo M, Merino MJ, et al. MRI of localized prostate cancer:coming of age in the PSA era[J]. Diagn Interv Radiol, 2012, 18(1): 34-35. |
| [9] |
Kirkham APS, Emberton M, Allen C. How good is MRI at detecting and characterising cancer within the prostate?[J]. Eur Urol, 2006, 50(6): 1163-1175. |
| [10] |
单颖婵, 周建军. 扩散加权成像技术在辅助前列腺癌临床诊治中的进展[J]. 实用肿瘤杂志, 2020, 35(2): 115-119. |
| [11] |
Jendoubi S, Wagner M, Montagne S, et al. MRI for prostate cancer:can computed high b-value DWI replace native acquisitions?[J]. Eur Radiol, 2019, 29(10): 5197-5204. DOI:10.1007/s00330-019-06085-z |
| [12] |
Bloch BN, Genega EM, Costa DN, et al. Prediction of prostate cancer extracapsular extension with high spatial resolution dynamic contrast-enhanced 3-T MRI[J]. Eur Radiol, 2012, 22(10): 2201-2210. DOI:10.1007/s00330-012-2475-5 |
| [13] |
Baur ADJ, Maxeiner A, Franiel T, et al. Evaluation of the prostate imaging reporting and data system for the detection of prostate cancer by the results of targeted biopsy of the prostate[J]. Invest Radiol, 2014, 49(6): 411-420. DOI:10.1097/RLI.0000000000000030 |
| [14] |
Polanec S, Helbich TH, Bickel H, et al. Head-to-head comparison of PI-RADS v2 and PI-RADS v1[J]. Eur J Radiol, 2016, 85(6): 1125-1131. DOI:10.1016/j.ejrad.2016.03.025 |
| [15] |
牛翔科, 刘伟, 肖建明, 等. PI-RADS v2在前列腺癌中的诊断价值分析[J]. 四川大学学报(医学版), 2016, 47(5): 796-799. |
| [16] |
Chatterjee A, Gallan AJ, He D, et al. Revisiting quantitative multi-parametric MRI of benign prostatic hyperplasia and its differentiation from transition zone cancer[J]. Abdom Radiol, 2019, 44(6): 2233-2243. DOI:10.1007/s00261-019-01936-1 |
 2020, Vol. 35
2020, Vol. 35


