文章信息
- 于敬坤, 陈俊卯, 孙雅涵, 何玛莉, 张琪, 王长友
- Yu Jingkun, Chen Junmao, Sun Yahan, He Mali, Zhang Qi, Wang Changyou
- 3-溴丙酮酸对人乳头瘤状甲状腺癌TPC-1细胞迁移和侵袭能力的影响
- Effect of 3-bromopyruvate on migration and invasion of TPC-1 human papillary thyroid cancer cells
- 实用肿瘤杂志, 2020, 35(3): 210-216
- Journal of Practical Oncology, 2020, 35(3): 210-216
基金项目
- 中国煤炭工业协会2017年度科学技术研究指导性计划项目(MTKJ2017-331);河北省2013年医学科学研究课题计划(20130068)
-
作者简介
- 于敬坤(1991-), 男, 山东聊城人, 住院医师, 硕士, 从事普通外科学基础与临床研究.
-
通信作者
- 王长友, E-mail:fhbj-2004@163.com
-
文章历史
- 收稿日期:2019-02-21
2. 华北理工大学医学实验研究中心, 河北 唐山 063000
2. Medical Research Center, North China University of Science and Technology, Tangshan 063000, China
我国恶性肿瘤的发生率及死亡率均居世界前列[1]。甲状腺癌是常见的腺体肿瘤之一, 其中甲状腺乳头状癌占甲状腺癌的60%以上。多数甲状腺乳头状癌患者经手术治疗后预后良好, 但仍有部分患者会发生复发, 且>80%的患者在早期明确诊断时已发生淋巴转移或侵犯周围组织[2]。3-溴丙酮酸是一种强烷化剂。近年来, 国外研究指出, 适当剂量的3-溴丙酮酸可通过抑制肿瘤细胞内糖酵解过程减少细胞内三磷酸腺苷(adenosine triphosphate, ATP)供能, 从而促进肿瘤细胞凋亡, 达到抑癌效果, 与此同时, 对正常组织细胞几乎无不良反应[3-5]。本研究观察3-溴丙酮酸对人乳头瘤状甲状腺癌TPC-1细胞增殖活性、迁移和侵袭能力的影响, 探究影响迁移和侵袭能力的机制, 为3-溴丙酮酸的临床抗癌应用及预防乳头瘤状甲状腺癌转移提供实验基础依据。
1 材料与方法 1.1 实验材料 1.1.1 肿瘤细胞株TPC-1细胞获自华北理工大学医学实验中心细胞库。
1.1.2 主要试剂及仪器DMEM完全培养液购自赛默飞世尔[苏州]仪器有限公司; 四季青胎牛血清购自杭州浙江天杭生物公司; 青链霉素混合液与2.5 g/L的胰蛋白酶购自美国Gibco公司; 3-溴丙酮酸购自大连美仑生物公司; BCA蛋白浓度测定试剂盒、组织细胞裂解液、PMSF和SDS-PAGE凝胶配制试剂盒购自北京索莱宝科技有限公司; MTT试剂盒、HRP标记山羊抗兔IgG(H+L)、HRP标记山羊抗小鼠IgG(H+L)和DAB显影液购自上海Beyotime公司; 酶标仪、显影仪及电泳和转膜相关器材购自上海Bio-Rad公司; Ⅰ型膜型基质金属蛋白酶(membrane-type 1 matrix metalloproteinase, MT1- MMP)和人源葡萄糖转运蛋白1(glucose transporter 1, Glut1)抗体购自上海Arigo公司; 基质金属蛋白酶2(matrix metalloproteinase 2, MMP-2)和MMP-9抗体购自美国Cell Signaling Technology公司; β-actin抗体购自天徳悦[北京]生物科技有限责任公司。
1.2 实验技术及方法 1.2.1 细胞培养在37℃恒温相对湿度95%、95%O2、5%CO2环境下, 用细胞培养液(约含10%的胎牛血清、1%的青链霉素混合液及90%的DMEM完全培养液)体外培养TPC-1细胞。TPC-1细胞多呈梭形, 贴壁单层生长, 待细胞密度较高时(细胞密度>70%), 可在25 cm2细胞培养瓶内加入约0.5 mL浓度为2.5 g/L的胰蛋白酶解离细胞外基质, 使其成为均散游离的单一细胞, 并按适宜比例传代。实验时取生长状态良好的TPC-1细胞进行实验。
1.2.2 MTT实验观察3-溴丙酮酸对TPC-1细胞增殖活性的影响将TPC-1细胞均匀地种殖于96孔板中, 每孔约含细胞104个, 待细胞贴壁良好后, 给予100 μL含不同浓度3-溴丙酮酸(0、20、40、60、80、100、120、140、160、180和200 μmol/ L)的细胞培养液培养24 h, 然后轻轻移除细胞培养液后PBS液轻轻洗涤细胞2次, 每孔内加入100 μL不含药物的细胞培养液及10 μL浓度为5 mg/ mL的MTT溶液, 37℃恒温箱内孵化4 h, 倒置显微镜下观察蓝紫色结晶形成情况, 待结晶形成完全后小心移除上清液, 每孔加入100 μL二甲基亚砜(dimethyl sulfoxide, DMSO), 并置于摇摆机上晃动10 min, 使结晶完全溶解, 调定酶标仪波长为490 nm, 测各孔的吸光度(absorbance, A)值, 注意设置空白孔(空白孔内加入100 μL PBS液)。
根据TPC-1细胞的3-溴丙酮酸药物剂量依赖性实验结果, 可选用0、100和200 μmol/L为之后各实验中3-溴丙酮酸的药物浓度, 并将0、100和200 μmol/L 3-溴丙酮酸处理的TPC-1细胞分别设置为空白对照组(control check, CK)、实验组1(experimental check 1, EG1)和实验组2(experimental check 1, EG2)。
1.2.3 划痕实验观察3-溴丙酮酸对TPC-1细胞迁移能力的影响实验操作前, 在超净台内用预先消毒过的记号笔在清洁的6孔板背面画直线, 每孔≥ 3道, 且尽量笔直、均匀, 操作过程中避免污染6孔板内部。将TPC-1细胞均匀地种植于6孔板中, 给予细胞培养液并置于37℃恒温箱内常规培养, 细胞密度达80%左右时用无菌的200 μL枪头垂直并比着预先标记的线作划痕, 移除细胞培养液并用PBS液轻轻冲去脱落的细胞, 将6孔板各孔分成3组, 分别给予含0、100和200 μmol/L 3-溴丙酮酸的细胞培养液(即为CK、EG1和EG2组)培养。划痕后0、24和48 h时在倒置显微镜下观察细胞形态、生长状况及划痕宽度变化并摄影。用PhotoLine处理划痕照片, 计算划痕宽度, 并用SPSS 17.0处理数据结果, 判断划痕宽度的变化情况。细胞迁移速度可用细胞迁移指数(migration index, MI)表示:MI=100%(W0-Wt)/W0, 其中W0指划痕后即测得的划痕区域宽度, Wt指划痕后t h测得的划痕区域宽度。
1.2.4 Transwell观察3-溴丙酮酸对TPC-1细胞侵袭能力的影响实验前准备:在超净台内, 将Matrigel胶均匀平铺在无菌transwell小室的微膜上, 等胶凝固后备用; 将TPC-1细胞分成3组(CK、EG1和EG2组), 分别给予含0、100和200 μmol/L 3-溴丙酮酸的细胞培养液培养48 h, 然后用2.5 g/L的胰蛋白酶消化细胞外基质, 使其形成均一游离的细胞并离心弃除上清, 加入无血清的DMEM完全培养液混匀细胞形成TPC-1细胞单悬液。实验:将制备好的TPC-1细胞单悬液移入transwell上室中, transwell下室中加含血清的细胞培养液, 放入37℃恒温箱内培养48 h后, 取出小室并在洁净的PBS液中轻轻洗涤3遍, 然后用95%甲醇固定细胞, 细胞固定后结晶紫染色, 在倒置显微镜下随机选取3个视野观察透膜细胞量并记录, SPSS 17.0统计软件处理数据, 观察3组侵袭细胞量。
1.2.5 Western blot观察3-溴丙酮酸对TPC-1细胞蛋白表达活性的影响将3组TPC-1细胞对应培养48 h后冰上操作如下:移除细胞培养液, 预冷的PBS洗涤细胞3遍, 加入含1%二甲基亚砜(dimethyl sulfoxide, PMSF)的组织细胞裂解液冰上裂解细胞30 min, 刮下附壁细胞, 在4℃低温高速离心机内12 000 r/min离心15 min, 并收集上清液。用BCA蛋白定量盒测定蛋白上样量, 配平蛋白溶液并高温变性。依次制备8%或10%的SDS-聚丙烯酰胺凝胶进行电泳, 蛋白湿转膜法将蛋白转到硝酸纤维素膜(polyvinglidene fluoride, PVDF)上, 配制蛋白封闭液封闭PVDF膜2 h, TBST液洗膜3次; 将PVDF膜置于一抗稀释液中并于4℃冰箱内过夜, 次日TBST洗膜3次, 并将PVDF膜置于二抗稀释液中室温孵化4 h, TBST再次洗膜3次, 将DAB显影液滴在PVDF膜上并使其均匀覆着后, 置于Bio-Rad显影仪内显影, 观察显影状况并记录; 以β-actin为内参照, 观察各组细胞各蛋白的表达活性。Image J处理条带显影、SPSS 17.0处理数据, 以蛋白相对灰度值为统计指标, 分析各组蛋白表达差异情况。
1.3 统计学分析每组实验重复>3次。采用SPSS 17.0软件分析数据。计量资料采用均数±标准差(
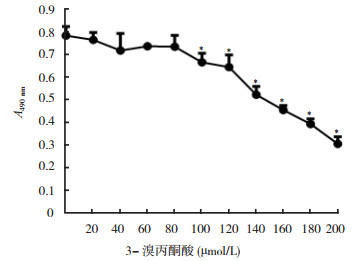
MTT实验显示, 随着3-溴丙酮酸药物浓度的增加, TPC-1细胞的增殖能力减弱。培养24 h后, 与无药物作用组比较, 20、40、60和80 μmol/L 3-溴丙酮酸处理组细胞增殖活性差异均无统计学意义(P=0.567、0.061、0.172、0.155), 而100、120、140、160、180和200 μmol/L 3-溴丙酮酸处理组细胞增殖活性均减弱, 差异均具有统计学意义(均P < 0.01, 图 1)。
|
| 注 *与0 μmol/L比较,P < 0.01 图 1 3-溴丙酮酸作用24 h对人乳头瘤状甲状腺癌TPC-1细胞增殖能力的影响 Fig.1 Effect of 3-bromopyruvate on the proliferation of TPC-1 human papillary thyroid cancer cells at 24 h |
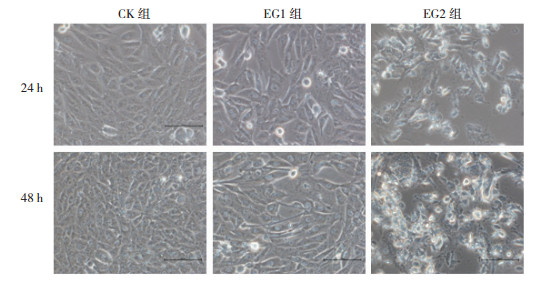
不同浓度的3-溴丙酮酸作用于体外TPC-1细胞24 h时, CK组TPC-1细胞表现大小均一, 界限清晰, 形状多呈梭形, 部分细胞内可见明显分裂核, 胞质内未见有明显空泡, 视野中死亡细胞少; EG1组的TPC-1细胞体积增大, 细胞边缘尚清晰可见, 多核细胞、死亡细胞和形态异形化细胞较CK组明显增多, 胞质空泡化明显; EG2组TPC-1细胞形态不规则, 细胞界限不清, 死亡细胞比例较高, 正常细胞少见。药物作用48 h后, CK组细胞较24 h时体积减小, 细胞密度增加, 细胞分裂状态明显; EG1组的TPC-1细胞较24 h时细胞形态无明显变化, 细胞密度增加, 死亡细胞略有增多但不明显; EG2组TPC-1细胞未见明显正常细胞。在一定范围内, 随着药物浓度的增加及作用时间的延长, TPC-1细胞形状不规则化增多, 死亡细胞比例增高, 胞质空泡化越明显(图 2)。
|
| 图 2 3-溴丙酮酸对人乳头瘤状甲状腺癌TPC-1细胞的生长状态的影响(×200) Fig.2 Effect of 3-bromopyruvate on the growth status of TPC-1 human papillary thyroid cancer cells (×200) |
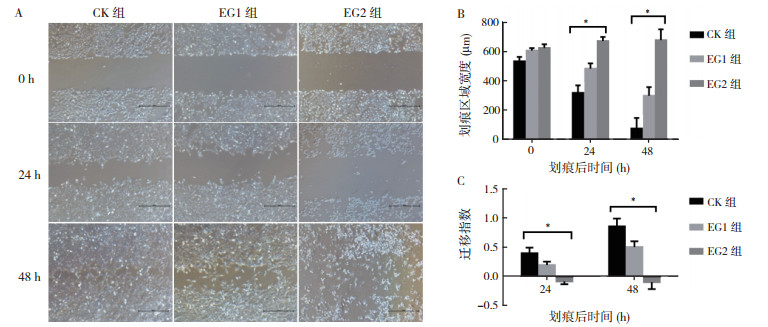
划痕后24和48 h时, CK组和EG1组的划痕宽度均逐渐变小(均P < 0.05);EG2组的划痕宽度各时间点比较, 差异无统计学意义(P>0.05)。当3-溴丙酮酸药物浓度过高时, TPC-1细胞死亡增多, 细胞未出现迁移表现(图 3)。划痕后24 h和48 h, CK组划痕宽度均小于EG1组, EG1组均小于EG2组(均P < 0.05, 图 3B)。MI可反映细胞迁移的速度, CK组和EG1组划痕后24 h时MI均小于48 h时(均P < 0.01);EG1组于划痕后24和48 h的MI均小于CK组(均P < 0.05);划痕后24和48 h, EG2组的MI均低于CK和EG1组(均P < 0.05), 且EG2组MI均为负值, 提示划痕宽度增加(图 3C)。
|
| 注 A:划痕实验倒置显微镜下观察结果(×40);B:划痕区域宽度比较;C:迁移指数比较;*三组比较,P < 0.05 图 3 3-溴丙酮酸对人乳头瘤状甲状腺癌TPC-1细胞迁移能力的影响 Fig.3 Effect of 3-bromopyruvate on the migration of TPC-1 cells |
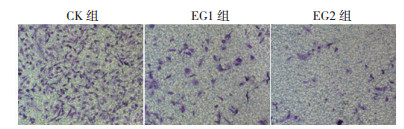
Transwell实验显示, 随着3-溴丙酮酸作用浓度的增高, 透膜细胞数量减少, CK组、EG1组和EG2组间比较差异具有统计学意义[(229.33±31.50)μm、(74.67±6.11) μm vs(19.33±5.51) μm, F=100.59, P < 0.01;图 4]。
|
| 图 4 3-溴丙酮酸对人乳头瘤状甲状腺癌TPC-1细胞的侵袭能力的影响(×40) Fig.4 Effect of 3-bromopyruvate on the invasion of TPC-1 human papillary thyroid cancer cells (×40) |
不同浓度3-溴丙酮酸作用于体外TPC-1细胞48 h后, Western Blot研究显示, 随着3-溴丙酮酸作用浓度的增加, TPC-1细胞MMP-2、MMP-9、Glut1和MT1-MMP的表达均减少; 以CK组蛋白作为参考(设定CK组的各蛋白相对灰度值为1), EG2组的MMP-2、MMP-9、Glut1和MT1-MMP的相对灰度值分别为(0.752 0±0.060 7)、(0.406 4±0.121 6)、(0.442 6±0.131 4)和(0.542 3±0.075 2), 低于EG1组的(0.897 4±0.059 7)、(0.818 9±0.085 1)、(0.592 6±0.153 0)和(0.799 2±0.050 4), EG1组低于CK组, 组间比较, 差异均具有统计学意义(均P < 0.05, 图 5~6)。
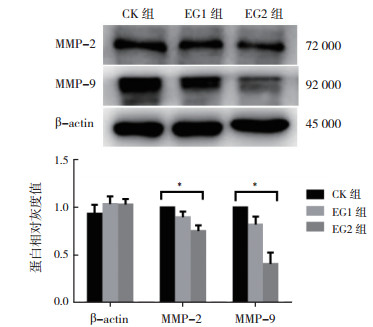
|
| 注 *三组比较,P < 0.05 图 5 3-溴丙酮酸对人乳头瘤状甲状腺癌TPC-1细胞MMP-2和MMP-9表达活性的影响 Fig.5 Effect of 3-bromopyruvate on the expression of MMP- 2 and MMP-9 in TPC-1 cells |
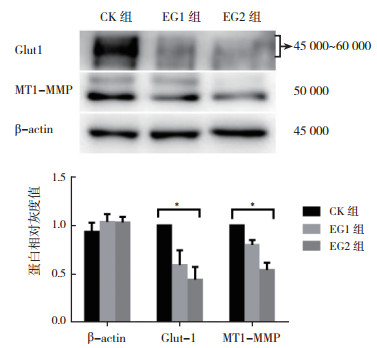
|
| 注 *三组比较,P < 0.05 图 6 3-溴丙酮酸对人乳头瘤状甲状腺癌TPC-1细胞Glut1和MT1-MMP表达活性的影响 Fig.6 Effect of 3-bromopyruvate on the expression of Glut1 and MT1-MMP in TPC-1 cells |
甲状腺癌是常见的腺体肿瘤之一, 发病率约占恶性肿瘤的1.3%~1.5%, 女性高发。近些年来甲状腺癌发病率增长较快, 年增长率约为6.2%;甲状腺癌多起源于滤泡上皮细胞, 病理分型分为乳头状癌、滤泡样癌、髓样癌和未分化癌4类, 其中乳头状癌最常见, 约占甲状腺癌的60%, 滤泡样癌次之, 约占20%, 未分化癌和髓样癌较前2种类型少, 但肿瘤恶性程度较高[6]。多数甲状腺乳头状癌患者经手术治疗后预后良好, 极少复发, 但甲状腺乳头状癌的淋巴转移率可达83.3%, 即使触诊未触及肿大淋巴结, 仍有46%~72%的患者存在隐匿性淋巴结转移[2]。甲状腺乳头状癌的发生风险与缺碘、颈部放射线照射和结节性甲状腺肿等有关, 预防甲状腺癌变, 控制甲状腺癌转移和扩散成为防治甲状腺癌的重点。
肿瘤细胞生长代谢所需能量主要来源于葡萄糖氧化, 但肿瘤细胞生长迅速, 需要能量较多, 其能量来源占比也有一定差异, 肿瘤细胞耗能较正常细胞高, 在利用葡萄糖氧化功能途径外, 也对糖酵解供能比较依赖, 这种依赖性与肿瘤的恶性程度有一定正相关[7]。3-溴丙酮酸是一种强烷化剂, 可通过作用糖酵解限速酶发挥抑制糖酵解的作用, 达到抑制肿瘤细胞生长代谢并促进肿瘤细胞凋亡的作用, 对正常组织细胞无明显不良反应[8-12]。给予含不同浓度3-溴丙酮酸的细胞培养液体外培养TPC-1细胞24 h, 可见随着药物作用浓度的增加, TPC-1细胞形态异变增多, 死亡细胞比例增高, 细胞增殖活性逐渐降低, 表明3-溴丙酮酸可抑制体外TPC-1细胞的增殖活性(100 μmol/L 3-溴丙酮酸具有抑制细胞增殖作用, 细胞毒性较低, 杀伤TPC-1细胞作用较弱; 200 μmol/L 3-溴丙酮酸细胞毒性较强, 对TPC-1细胞具有明显杀伤作用; 100 μmol/L 3-溴丙酮酸细胞毒性弱, 影响细胞增殖活性差, 可排除细胞增殖活性降低对迁移和侵袭能力的影响; 200 μmol/L剂量的3-溴丙酮酸细胞毒性高, 可与100 μmol/L组作比较)。肿瘤细胞低分化、生长增殖速度快和已发生细胞远处转移是区别于人体正常组织细胞重要表现。肿瘤细胞迁移扩散程度是选择治疗方案和判断患者预后的重要指标; 肿瘤细胞转移越早、侵犯其他脏器越多, 患者的预后越差。观察划痕后24 h和48 h的TPC-1细胞划痕区域宽度发现, 随着药物浓度的增加, TPC-1细胞迁移速度越慢, 划痕区域宽度越宽, MI越小。Transwell实验中透膜细胞的数量也随着3-溴丙酮酸浓度的增加而减少, 表明3-溴丙酮酸可抑制体外TPC-1细胞的增殖、迁移和侵袭能力。
MMPs是一组锌和镁依赖性且具有降解细胞外基质的酶系, 常分为6类, 明胶酶、胶原酶、基质降解素、间质溶解素、MT-MMPs以及其他MMPs[13]。MMP-2和MMP-9是MMPs中重要的组成成员, 可通过降解细胞外基质和基底膜等破坏细胞屏障、改变组织细胞内多种生长因子的生物活性和降低细胞之间的粘附性从而促进细胞的迁移及侵袭; MMP-2和MMP-9在肿瘤细胞内的表达远高于正常组织细胞, 被认为与肿瘤细胞的转移和扩散有密切联系[13-16]。本研究中, TPC-1细胞经含3-溴丙酮酸的细胞培养液培养后, 相对于无药物处理的细胞, 其MMP-2和MMP-9的表达活性降低, 表明3-溴丙酮酸可能通过抑制MMP-2和MMP-9的表达活性降低体外TPC-1细胞的迁移和侵袭能力。MT1-MMP(又称MMP-14)也是MMPs的重要组成, 可参与机体细胞多种病理生理过程, 同时还可以激活MMPs的其他组成部分如MMP-2等[6]。Gluts是哺乳动物细胞进行葡萄糖转运的重要载体, 而Glut1是人体中含量最多和分布最为广的Glut, 参与机体多种病理生理活动, 并在肿瘤进展中发挥重要作用, 在多种肿瘤细胞中过量表达, 肿瘤细胞代谢快且耗能高, 主要通过Glut1增加葡萄糖的摄入量来实现为肿瘤细胞自身生长增殖提供充足的能量, 且Glut1的表达活性与肿瘤恶性程度有一定的正相关关系[17-21]。Glut1不仅在肿瘤细胞内高表达, 并与肿瘤侵袭能力有密切相关性。肿瘤侵袭性种植灶高表达Glut1, 而非侵袭种植灶不表达[22]。低分化且有淋巴结转移的肺腺癌组织中Glut1高表达[23], Glut1在肿瘤细胞的迁移和侵袭中发挥着重要作用。给予3-溴丙酮酸处理后的TPC-1细胞, MT1-MMP和Glut1的表达活性降低。研究显示, Glut1、MT1-MMP和MMP-9可能是影响肿瘤细胞侵袭和迁移能力的一条信号通路[24]。
综上所述, 3-溴丙酮酸可降低体外TPC-1细胞的增殖、迁移和侵袭能力, 并可能通过下调Glut1、MT1-MMP、MMP-2和MMP-9信号通路抑制TPC-1细胞的迁移和侵袭能力。
| [1] |
陈万青, 孙可欣, 郑荣寿, 等. 2014年中国分地区恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2018, 27(1): 1-14. |
| [2] |
华特波, 孟宪瑛, 张强, 等. COX-2、MMP-9、VEGF在甲状腺肿瘤中的表达[J]. 中国老年学杂志, 2011, 31(09): 1520-1522. DOI:10.3969/j.issn.1005-9202.2011.09.011 |
| [3] |
Ko YH, Pedersen PL, Ceschwind JF. Glucose catabolism in the rabbit VX2 tumor model for liver cancer:characterization and targeting hexokinase[J]. Cancer Lett, 2001, 173(1): 83-91. DOI:10.1016/S0304-3835(01)00667-X |
| [4] |
Geschwind JF, Ko YH, Torbenson MS, et al. Novel therapy for liver cancer:dirct intraarterial in jection of potent inhibitor of ATP production[J]. Cancer Res, 2002, 62(14): 3909-3913. |
| [5] |
曾常茜, 吴思宇. 3-溴丙酮酸抗肿瘤作用及机制研究[J]. 中国新药杂志, 2009, 18(9): 793-796. DOI:10.3321/j.issn:1003-3734.2009.09.008 |
| [6] |
王小清, 王金莲, 林帅, 等. miR-369-3p靶向MMP14调节乳头状甲状腺癌细胞侵袭、迁移和上皮间质转化的作用[J]. 中国免疫学杂志, 2019, 35(21): 2576-2581. DOI:10.3969/j.issn.1000-484X.2019.21.004 |
| [7] |
孙一鸣. 3-溴丙酮酸诱导结肠癌细胞死亡的作用及机制[D].蚌埠: 蚌埠医学院药理学, 2016.
|
| [8] |
Chen Z, Zhang H, Lu WQ, et al. Role of mitochondria-associated hexokinaseⅡin cancer cell death induced by 3-bromopyruvate[J]. Biochim Biophys Acta, 2009, 1787(5): 553-560. DOI:10.1016/j.bbabio.2009.03.003 |
| [9] |
Kim W, Yoon JH, Jeong JM, et al. Apoptosis-inducing antitumor efficacy of hex okinase Ⅱ inhibitor in hepatocellular carcinoma[J]. Mol Cancer Ther, 2007, 6(9): 2554-2562. DOI:10.1158/1535-7163.MCT-07-0115 |
| [10] |
Zhang HL, Zeng CQ, Zheng XF. The effects of 3-bromopyruvate on the proliferation and apoptosis in HepG-2 cell line[J]. J Guangxi Med Univ, 2010, 27(2): 183-187. |
| [11] |
黄小艳, 余进进, 潘敏, 等. 3-溴丙酮酸对人宫颈癌HeLa细胞增殖的抑制作用[J]. 现代肿瘤医学, 2012, 20(5): 921-924. DOI:10.3969/j.issn.1672-4992.2012.05.15 |
| [12] |
刘晓红, 王绍志, 刘晓梅, 等. 3-溴丙酮酸对人结肠癌SWⅢ-C细胞增值和凋亡的影响[J]. 肿瘤药学, 2012, 2(6): 417-421. DOI:10.3969/j.issn.2095-1264.2012.06.004 |
| [13] |
Radenkovic S, Konjevic G, Jurisic V, et al. Values of MMP-2 and MMP-9 in tumor tissue of basal-like breast cancer patients[J]. Cell Biochem Biophysics, 2014, 68(1): 143-152. |
| [14] |
肖士渝, 周丽雅. 葡萄糖饥饿对胃癌细胞MMP-2、MMP-9表达的影响及意义[J]. 胃肠病学和肝病学杂志, 2019, 28(10): 1097-1101. DOI:10.3969/j.issn.1006-5709.2019.10.002 |
| [15] |
Chen YJ, Lee LY, Chao YK, et al. DSG3 facilitates cancer cell growth and invasion through the DSG3-plakoglobin-TCF/LEF-Myc/Cyclin D1/MMP signaling pathway[J]. PLoS One, 2013, 8(5): e64088. DOI:10.1371/journal.pone.0064088 |
| [16] |
Chen F, Bai J, Li W, et al. RUNX3 suppresses migration, invasion and angiogenesis of human renal cell carcinoma[J]. PLoS One, 2013, 8(2): e56241. DOI:10.1371/journal.pone.0056241 |
| [17] |
杜诗琦, 李博. 葡萄糖转运体1(GLUT1)靶向药物的研究进展[J]. 广东化工, 2018, 45(09): 116-118. DOI:10.3969/j.issn.1007-1865.2018.09.051 |
| [18] |
俞晓燕, 孙子林. GLUT1的研究进展[J]. 现代中西医结合杂志, 2012, 21(30): 3411-3414. DOI:10.3969/j.issn.1008-8849.2012.30.062 |
| [19] |
Lee ES, Hua SW, Bell DH. Differences in cell proliferation and prognostics significance of prolifetating cell nuclear antigen and Ki-67 antigen immunoreaction in situ and invasive carcinomas of the extrahepatic tract[J]. Cancer, 2005, 78(5): 1001-1005. |
| [20] |
KleesPies A, Guba M, Jaueh KW, et al. Vaseular endothelial growth faetor in esophageal cancer[J]. J Surg Oneol, 2004, 87(2): 95-104. |
| [21] |
Chen L, Ren GS, LI F, et al. ExPression of Livin and vaseular endothelial growth factor in different clinieal stages of human esophageal eareinoma[J]. World J Gastroenterol, 2008, 14(37): 5749-5754. DOI:10.3748/wjg.14.5749 |
| [22] |
Kalir T, Wang BY, Coldfischer M, et al. Immunohistochemical staining of GLUT1 in benign, borderline and malignant ovarian epithelia[J]. Cancer, 2002, 94(4): 1078-1082. DOI:10.1002/cncr.10280 |
| [23] |
Meijer TW, Schuurbiers OC, Kaanders JH, et al. Differences in metabolism between adeno-and squamous cell non-small cell lung carcinomas:Spatial distribution and prognostic value of GLUT1 and MCT4[J]. Lung Cancer, 2012, 76(3): 316-323. |
| [24] |
Liao Hh, Wang ZQ, Deng ZP, et al. Curcumin inhibits lung cancer invasion and metastasis by attenuating GLUT1/MT1-MMP/MMP2 pathway[J]. Int J Clin Exp Med, 2015, 6(8): 8948-8957. |
 2020, Vol. 35
2020, Vol. 35


