文章信息
- 高照, 闫文星, 刘林林
- 腔内插植放射治疗Ⅱ期阴道(后穹窿部)恶性肿瘤一例
- 实用肿瘤杂志, 2020, 35(1): 75-78
-
作者简介
- 高照(1993-), 男, 吉林四平人, 住院医师, 硕士生, 从事恶性肿瘤综合治疗研究.
-
通信作者
- 刘林林, E-mail:2660424632@qq.com
-
文章历史
- 收稿日期:2019-03-05
原发性阴道癌约占女性生殖器恶性肿瘤的1%~2%[1]。国际上目前尚无明确的治疗标准。肿物位于阴道上三分之一的早期(Ⅰ+Ⅱ期)患者,一般首选手术治疗,尤其适用于青年女性[2]。但位于阴道后穹窿早期肿物,由于该处临近阴道直肠隔和盆腔最低处,手术治疗比较慎重[3]。本文报道1例Ⅱ期阴道癌患者,肿物位于上段阴道后穹窿处,由于解剖部位特殊,手术难以完全切除,因此在本院行外照射及自由针插植放疗,期间同步单药洛铂增敏,后序贯紫杉醇+洛铂方案化疗的综合治疗,效果良好。现报道如下。
1 病例资料患者女性,36岁,缘于阴道不规则流血1周于2017年11月6日就诊于本院。查体:阴道后穹隆见扁平菜花样肿物,大小约2.0 cm×3.5 cm,距离阴道口4 cm,阴道右侧壁见溃疡型肿物,大小约1.0 cm×1.5 cm。行盆腔MRI检查(图 1):阴道后穹窿软组织影明显增厚,病变侵及子宫颈后壁。双侧髂血管旁见结节状等T1稍长T2信号影,较大者短径12 mm,增强扫描左侧淋巴结呈环形强化。诊断提示:阴道后穹窿占位侵及子宫颈后壁。双侧髂血管旁淋巴结显示,不除外左侧髂血管旁淋巴结转移。病理检查提示为中分化鳞癌。子宫颈组织病理检查(3、6、9、12点):(阴道)鳞状上皮增生,局部考虑见有低度鳞状上皮内病变。故明确诊断为阴道癌Ⅱ期。妇外科会诊:因患者解剖位置特殊,局部手术范围较大,难于彻底切除。2017年11月15日给予调强适形放射治疗及同步单药洛铂(12 mg/m2,d1,每周1次,共5周)化疗增敏,外照射靶区剂量:50.4 Gy/28 F(图 2),腔内插植放疗靶区剂量:30 Gy/5 F(图 3)。靶区体积和危及器官总剂量最终转换成2 Gy分次等效生物剂量(equivalent dose in 2 Gy/F,EQD2)来计算(其中正常组织α/β=3,肿瘤组织α/β=10),高危临床靶区(high-risk clinical target volume,HR-CTV)的D90(90%靶体积内获得的最小剂量)=89.85 Gy,膀胱的D2cc(受到最大辐射剂量的2 cm3危及器官体积内的最小剂量)=74.9 Gy,,直肠的D2cc=69.31 Gy,放疗于2017年12月13日治疗结束。后患者序贯3个周期紫杉醇+洛铂(紫杉醇150 mg/m2,d1+洛铂30 mg/m2,d2,21 d为1个周期)方案化疗。于2018年9月25日复查,查体:子宫颈形态消失,未见新生物。盆腔MRI(图 4)回报:阴道上段及阴道后穹窿黏膜增厚,呈稍长T2信号,增强扫描略强化。诊断提示:阴道黏膜变薄,强化减弱;左侧髂血管旁淋巴结未见显示,余未见明显变化。现治疗后18个月,局部无复发,健康生存,性生活满意。
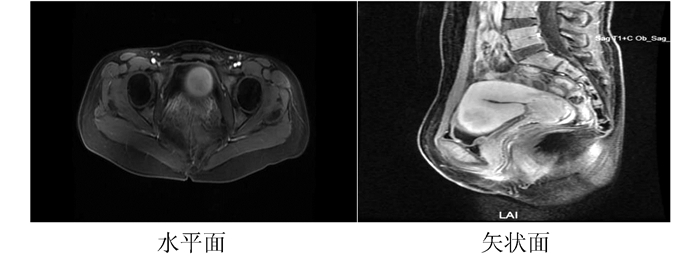
|
| 图 1 治疗前盆腔MRI检查示阴道后穹窿占位侵及子宫颈后壁 |
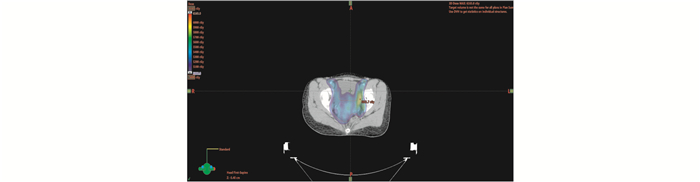
|
| 图 2 外照射靶区剂量分布图 |
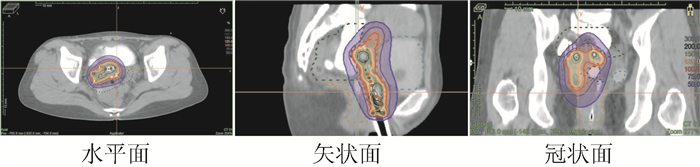
|
| 图 3 腔内插植放疗靶区剂量分布 |
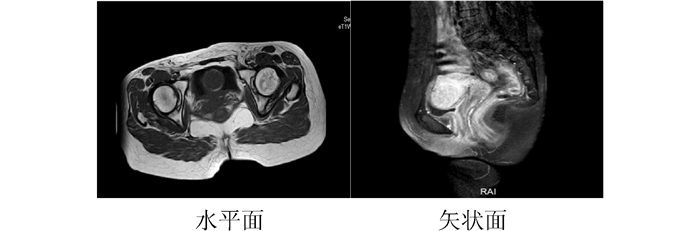
|
| 图 4 治疗后10个月盆腔MRI检查示子宫颈形态消失及未见新生物 |
阴道癌由于病例少见,国内尚无规范化的治疗标准[4],其治疗方式多数参考子宫颈癌和外阴癌的治疗方式。治疗原则应强调个体化对待,主要取决于病变分期及阴道受累的部位。对于Ⅰ和Ⅱ期阴道癌患者,应用手术和放疗治疗目前尚有争议[2, 5],但一般首选手术切除。Stock等[6]对58例Ⅱ期阴道癌患者的生存数据进行分析显示,手术治疗较单纯放疗患者有更长的5年无瘤生存(disease free survival,DFS)率(68% vs 31%,P=0.000 4)。一些研究显示,对于早期(Ⅰ+Ⅱ期)阴道癌患者,如果肿瘤位于阴道上三分之一,手术切除较放疗有更好的预后[7-8]。Shah等[9]比较早期阴道癌患者接受手术、术后辅助放疗和放疗的治疗效果显示,手术治疗的5年疾病特异性生存率更佳。Jain等[2]的研究表明,接受手术治疗的早期原发性阴道癌,1年的DFS率和总生存(overall survival,OS)率分别为89%和100%。因此,对于早期阴道癌患者,选取手术治疗预后更好。
对于阴道受累区域与治疗方式和预后的关系,Prameela等[10]的回顾性研究并未发现阴道癌解剖部位与患者的预后有相关性。Platta等[11]认为,原发性阴道癌的预后与肿瘤的发生部位和体积有关。Frank等[12]研究发现,与其他阴道壁比较,后壁肿物损伤的预后更差。可能由于后壁临近直肠,控制范围不够导致。从解剖角度看,阴道壁较薄,周围的组织疏松,血运丰富,容易向周围的组织器官蔓延浸润,且阴道与膀胱、尿道及直肠紧密相连。以往认为,阴道后穹窿肿物治疗同子宫颈癌。研究显示,阴道穹窿浸润阳性的患者主韧带浸润的风险是阴道穹窿浸润阴性者的6.012倍,而主韧带受侵必然增加手术切除范围,这对阴道周围组织损伤加重[13]。同时手术切除部分受累的后穹窿阴道壁时,应先钝性分离直肠窝的黏连,打开阴道直肠隔,向后方推离直肠,给予病灶切除。但暴露直肠阴道间隙时,常因恐惧损伤肠管而过高选择在子宫直肠反折之上切入,造成分离困难、创面出血,且极易损伤直肠,手术难度极大。当病变位于阴道后壁时,需仔细将病变从肛门括约肌和直肠黏膜上分离下来,必要时需切除一段直肠和肛门括约肌[14]。阴道直肠间隙仅5 mm,而手术切缘距病灶要>1 cm,直接行手术治疗的安全范围较小,容易导致副损伤[15]。本文中患者阴道癌病灶位于阴道后穹窿处,且向黏膜下呈浸润性生长,若直接行手术治疗可能会导致直肠损伤或病灶的残留。且是盆腔的最低位,可出现经血流内膜种植、肿瘤细胞的浸润和术后炎性渗出的潴留等[14]。
因此本文选用放疗作为肿瘤位于阴道后穹窿的Ⅱ期阴道癌患者的治疗模式。对于原发病灶,当靶区剂量达到80 Gy时可提高局部控制率[16],而常规腔内施源器对于肿物巨大、位于阴道穹窿处及阴道狭窄的患者,难以达到目标剂量[17]。多孔阴道柱施源器由于其操作简单和创伤小等优点而备受关注,但对于阴道后穹窿的肿物,数据表明,采用组织间插植放疗能达到更优的剂量学分布[18]。笔者采用的是宫腔管和自由金属针组成的“混合”施源器,金属针(长度16 cm,直径1.3 mm,瑞典医科达公司)是在CT引导下被徒手植入肿瘤组织中,位置灵活,插植结束后将纱布固定自由针和宫腔管,同时可以推开直肠和膀胱。通过多次CT扫描成像,对自由金属针的角度及深度的调整,得到满意的金属针布局。此项技术已经在局部晚期子宫颈癌中有很好的应用[19-21],但在原发性阴道癌中少有报道。插植针分布与肿瘤区域相一致,金属针之间的距离满足1 cm左右(图 5)。这样能够使靶区剂量分布更加合理、均匀。金属针插植过程中可出现阴道壁的出血,给予纱布填塞效果良好。放疗期间及放疗后规律的阴道冲洗,防止阴道狭窄及粘连,有助于恢复患者性生活质量。
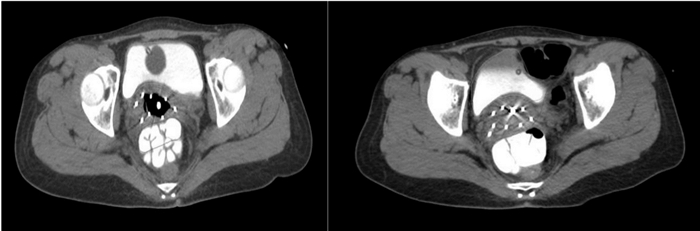
|
| 图 5 腔内插植放疗金属自由针分布情况 |
有关同步放化疗治疗原发性阴道癌的效果目前尚有争议[22]。Ghia等[23]检索美国国立癌症研究所监测、流行病学和结果数据库1991~2005年确诊为原发性阴道癌患者的数据,其中250例患者接受放疗,76例接受同步放化疗,结果显示,同步放化疗与单纯放疗比较并不能改善患者的OS(HR=1.34,P=0.21)。Miyamoto等[24]对原发性阴道癌患者接受放疗和同步化疗进行对比研究,结果显示,同步化疗组(n=20)较单纯放疗组(n=51)的3年DFS率(79% vs 56%,P=0.037)和OS率(73% vs 43%,P=0.011)提高,多因素分析显示,同步化疗可以改善DFS率(HR=0.31,95%CI:0.10~0.97,P=0.04)。Rajagopalan等[25]对美国国家癌症数据库的数据进行分析显示,同步放化疗较单纯放疗可使阴道癌患者有更长的中位OS(56.2个月vs 41.2个月,P < 0.000 5),多因素分析显示,同步化疗是影响预后的独立因素之一。原发性阴道癌同步化疗增敏的药物选择、用药剂量和间隔尚无统一标准。Mabuchi等[26]采用紫杉醇(35 mg/m2)联合卡铂同步放疗治疗2例阴道癌患者,获得完全缓解。本文患者采用单药洛铂周疗同步增敏,取得很好疗效。对于阴道癌同步放化疗后是否给予巩固化疗目前尚无个案报道,笔者借鉴子宫颈癌治疗方式,考虑阴道是一个血管丰富的器官,淋巴引流丰富,同时左侧髂血管可疑淋巴结阳性,给予巩固3个周期紫杉醇+洛铂方案化疗,杀灭放疗野外可能存在的隐匿性病灶。
对于年轻且有性生活要求的早期阴道癌患者,肿物位于阴道后穹窿处,相对于根治性手术切除,选用同步放化疗+徒手插植放疗后巩固化疗或许可以得到更好的治疗效果。但考虑到本文例数单一,还需更多的临床病例来证实。
| [1] |
Kombathula SH, Rapole PS, Prem SS, et al. Primary small cell carcinoma of the vagina:a rare instance of prolonged survival[J]. BMJ Case Rep, 2019, 12(3): e227100. DOI:10.1136/bcr-2018-227100 |
| [2] |
Jain V, Sekhon R, Giri S, et al. Role of radical surgery in early stages of vaginal cancer-our experience[J]. Int J Gynecol Cancer, 2016, 26(6): 1176-1181. DOI:10.1097/IGC.0000000000000743 |
| [3] |
Gadducci A, Fabrini MG, Lanfredini N, et al. Squamous cell carcinoma of the vagina:natural history, treatment modalities and prognostic factors[J]. Crit Rev Oncol Hematol, 2015, 93(3): 211-224. DOI:10.1016/j.critrevonc.2014.09.002 |
| [4] |
林仲秋, 姚婷婷, 谢玲玲, 等. 外阴癌诊治进展和争议问题[J]. 实用肿瘤杂志, 2016, 31(6): 491-493. |
| [5] |
Damast S, Takiar V, McCarthy S, et al. Treatment of early stage vaginal cancer with EBRT and MRI-based intracavitary brachytherapy:A retrospective case review[J]. Gynecol Oncol Rep, 2016, 17(4): 89-92. |
| [6] |
Stock RG, Chen AS, Seski J. A 30-year experience in the management of primary carcinoma of the vagina:analysis of prognostic factors and treatment modalities[J]. Gynecol Oncol, 1995, 56(1): 45-52. DOI:10.1006/gyno.1995.1008 |
| [7] |
Saito T, Tabata T, Ikushima H, et al. Japan Society of Gynecologic Oncology guidelines 2015 for the treatment of vulvar cancer and vaginal cancer[J]. Int J Clin Oncol, 2018, 23(2): 201-234. DOI:10.1007/s10147-017-1193-z |
| [8] |
Yagi A, Ueda Y, Kakuda M, et al. Descriptive epidemiological study of vaginal cancer using data from the Osaka Japan population-based cancer registry:Long-term analysis from a clinical viewpoint[J]. Medicine (Baltimore), 2017, 96(32): e7751. DOI:10.1097/MD.0000000000007751 |
| [9] |
Shah CA, Goff BA, Lowe K, et al. Factors affecting risk of mortality in women with vaginal cancer[J]. Obstet Gynecol, 2009, 113(5): 1038-1045. DOI:10.1097/AOG.0b013e31819fe844 |
| [10] |
Prameela CG, Ravind R, Gurram BC., et al. Prognostic factors in primary vaginal cancer:a single institute experience and review of literature[J]. J Obstet Gynaecol India, 2016, 66(5): 363-371. DOI:10.1007/s13224-015-0697-6 |
| [11] |
Platta CS, Anderson B, Geye H, et al. Adjuvant and definitive radiation therapy for primary carcinoma of the vagina using brachytherapy and external beam radiation therapy[J]. J Contemp Brachytherapy, 2013, 5(2): 76-82. |
| [12] |
Frank SJ, Jhingran A, Levenback C, et al. Definitive radiation therapy for squamous cell carcinoma of the vagina[J]. Int J Radiat Oncol Biol Phys, 2005, 62(1): 138-147. DOI:10.1016/j.ijrobp.2004.09.032 |
| [13] |
邓凯贤, 李维丽, 陈春林, 等. ⅠA2~ⅡA2期宫颈癌主韧带浸润情况调查及危险因素分析[J]. 重庆医学, 2016, 45(12): 1641-1644. DOI:10.3969/j.issn.1671-8348.2016.12.018 |
| [14] |
梁海燕, 凌斌. 阴道癌腹腔镜广泛宫旁切除与阴道重建[J]. 实用妇产科杂志, 2012, 28(12): 1006-1008. DOI:10.3969/j.issn.1003-6946.2012.12.007 |
| [15] |
刁玉超, 宋克娟, 吕腾, 等. 新辅助化疗联合手术治疗早期阴道鳞状细胞癌1例报道[J]. 中国内镜杂志, 2016, 22(12): 107-109. |
| [16] |
Beriwal S, Demanes DJ, Erickson B, et al. American Brachytherapy Society consensus guidelines for interstitial brachytherapy for vaginal cancer[J]. Brachytherapy, 2012, 11(1): 68-75. DOI:10.1016/j.brachy.2011.06.008 |
| [17] |
Glaser SM, Beriwal S. Brachytherapy for malignancies of the vagina in the 3D era[J]. J Contemp Brachytherapy, 2015, 7(4): 312-318. |
| [18] |
Mendez LC, Paudel M, Wronski M, et al. Dosimetric comparison of interstitial brachytherapy with multi-channel vaginal cylinder plans in patients with vaginal tumors[J]. Radiat Oncol, 2017, 12(1): 84. DOI:10.1186/s13014-017-0821-0 |
| [19] |
Liu ZS, Guo J, Zhao YZ, et al. Computed tomography-guided interstitial brachytherapy for locally advanced cervical cancer:Introduction of the technique and a comparison of dosimetry with conventional intracavitary brachytherapy[J]. Int J Gynecol Cancer, 2017, 27(4): 768-775. DOI:10.1097/IGC.0000000000000929 |
| [20] |
Frohlich G, Vizkeleti J, Nguyen AN, et al. Comparative analysis of image-guided adaptive interstitial brachytherapy and intensity-modulated arc therapy versus conventional treatment techniques in cervical cancer using biological dose summation[J]. J Contemp Brachytherapy, 2019, 11(1): 69-75. DOI:10.5114/jcb.2019.82999 |
| [21] |
Murakami N, Kobayashi K, Shima S, et al. A hybrid technique of intracavitary and interstitial brachytherapy for locally advanced cervical cancer:initial outcomes of a single-institute experience[J]. BMC Cancer, 2019, 19(1): 221. DOI:10.1186/s12885-019-5430-x |
| [22] |
Ikushima H, Wakatsuki M, Ariga T, et al. Radiotherapy for vaginal cancer:a multi-institutional survey study of the Japanese Radiation Oncology Study Group[J]. Int J Clin Oncol, 2018, 23(2): 314-320. DOI:10.1007/s10147-017-1205-z |
| [23] |
Ghia AJ, Gonzalez VJ, Tward JD, et al. Primary vaginal cancer and chemoradiotherapy:a patterns-of-care analysis[J]. Int J Gynecol Cancer, 2011, 21(2): 378-84. DOI:10.1097/IGC.0b013e3182072e44 |
| [24] |
Miyamoto DT, Viswanathan AN. Concurrent chemoradiation for vaginal cancer[J]. PLoS One, 2013, 8(6): e65048. DOI:10.1371/journal.pone.0065048 |
| [25] |
Rajagopalan MS, Xu KM, Lin JF, et al. Adoption and impact of concurrent chemoradiation therapy for vaginal cancer:a National Cancer Data Base (NCDB) study[J]. Gynecol Oncol, 2014, 135(3): 495-502. DOI:10.1016/j.ygyno.2014.09.018 |
| [26] |
Mabuchi S, Kawano M, Isohashi F, et al. First two cases of primary carcinoma of the vagina successfully treated with concurrent weekly carboplatin plus paclitaxel, external beam radiotherapy and high-dose-rate interstitial brachytherapy:a case report and published work review[J]. J Obstet Gynaecol Res, 2015, 41(1): 156-61. DOI:10.1111/jog.12492 |
 2020, Vol. 35
2020, Vol. 35


