文章信息
- 李毅, 刘成, 许晓平, 程竞仪, 张建岗, 王春梅, 徐俊彦
- 磷酸盐尿性间叶肿瘤患者99mTc-HYNIC-TOC显像二例
- 实用肿瘤杂志, 2020, 35(1): 69-74
-
作者简介
- 刘成(1992-), 男, 安徽淮南人, 住院医师, 硕士, 从事核医学临床研究.
-
通信作者
- 徐俊彦, E-mail:junyan233@aliyun.com
-
文章历史
- 收稿日期:2018-08-19
2. 复旦大学生物医学影像研究中心, 上海 200032;
3. 上海市质子重离子医院核医学科, 上海 201315;
4. 上海分子影像探针工程技术研究中心, 上海 200032
患者女性,44岁,2017年3月因全身多处骨痛8年余,且逐渐加重,于外院就诊;既往自2009年起无明显诱因全身活动性进行性骨痛,起初疼痛部位为两侧髋关节,最后逐渐发展至全身,伴显著肌无力,活动明显受限;该患者身材无畸形,无明显变矮;2010年1月至2010年7月曾间断口服碳酸钙(900 mg/d),未见明显好转,无其他长期服用药物史。
2017年3月外院检查结果显示:血磷为0.59 mmol/L(参考值为0.8~1.6 mmol/L),血钙为2.15 mmol/L(参考值为2.08~2.60 mmol/L),甲状旁腺激素(parathyroid hormone, PTH)为146.7 pg/mL (15.0~65.0 pg/mL),降钙素原(procalcitonin, PCT)为2.7 ng/mL(参考值男性<8.4 ng/L,女性<5 ng/L),总25-羟基维生素D[1.25-dihydroxyvitamin D, 1.25-(OH)2D]为11.63 ng/mL(< 20 ng/mL为不足),碱性磷酸酶(alkaline phosphatase, ALP)202 U/L(参考值为15~112 U/L),24 h尿磷51.80 mmol/24 h(参考值16.15~41.98 mmol/24 h)。X线片提示胸椎、腰椎骨小梁稀疏模糊,多发椎体边缘稍模糊,符合骨软化表现。骨扫描提示双侧肋骨代谢异常,结合病史可符合低磷骨软化表现。外院拟诊为肿瘤源性骨软化症,但无法找到原发灶,同月转至复旦大学附属肿瘤医院进一步检查,临床考虑行奥曲肽显像寻找肿瘤。
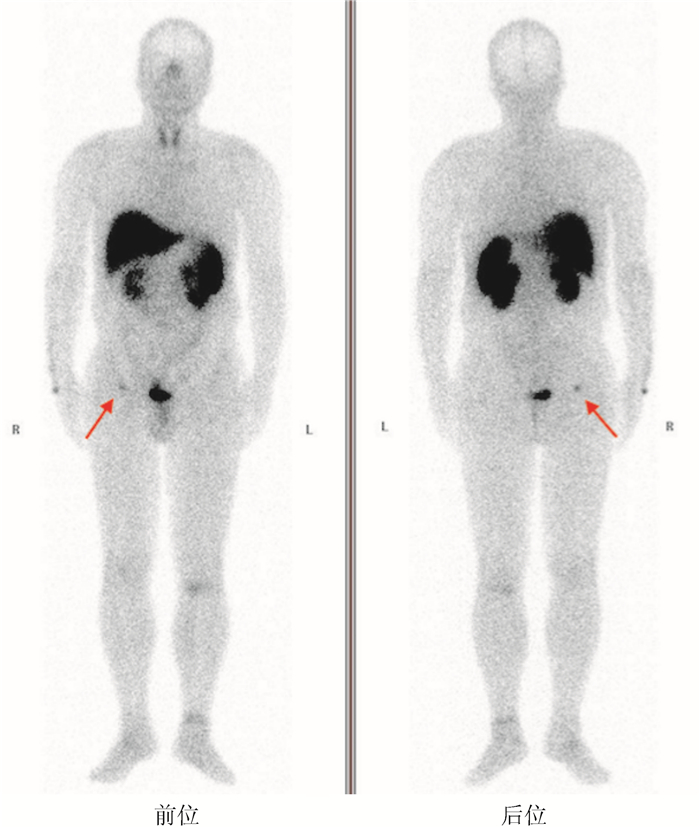
患者2017年3月7日于复旦大学附属肿瘤医院核医学科行99mTc-联肼尼科酰胺-奥曲肽(99mTc-hydrazinonicotinamide-octreotide, 99mTc-HYNIC-TOC)显像。具体方法如下:静脉注射10 mCi 99mTc-HYNIC-TOC,约2 h后显像,先进行全身平面显像,采集矩阵为256×1 024, 扫描速度为10 cm/min, 放大倍数为1。本例患者平扫未见明显阳性病灶(图 1),但图像中患者膀胱充盈,考虑到病灶可能位于平面上和膀胱重叠的位置,而显像剂潴留在膀胱内会干扰病灶的探测。

|
| 注 平面显像可见甲状腺双叶对称性放射性摄取增高,肝脏、脾脏及泌尿系统见生理性放射性摄取(箭头示);胸腹盆区域未见明显放射性摄取异常增高灶 图 1 例199mTc-HYNIC-TOC全身平面显像图 |
对盆腔部位采取SPECT-CT断层显像,具体为:先行SPECT采集,矩阵为128×128, 放大倍数为1, 探头旋转360°, 30 s/帧, 共60帧,然后行低剂量CT采集,迭代重建后通过软件eNTEGRA(GE Medical Systems)处理。结果发现,左侧臀部1枚软组织结节,放射性浓聚,生长抑素受体高表达(图 2A~D)。1个月内在局部麻醉下行左侧臀部肿物切除术,病理检查显示:(臀部肿块)间叶性肿瘤, 镜下为高分化脂肪组织,富含巨细胞和血管,结合临床诊断,可符合磷酸盐尿性间叶肿瘤;免疫组织化学检查显示:CD31(+),CD34(血管+),ERG(血管+),Kp1(+),PGM1(+),Ki-67(10%+),CK(-),Vimentin(+),S100(-),Calponin(-)。
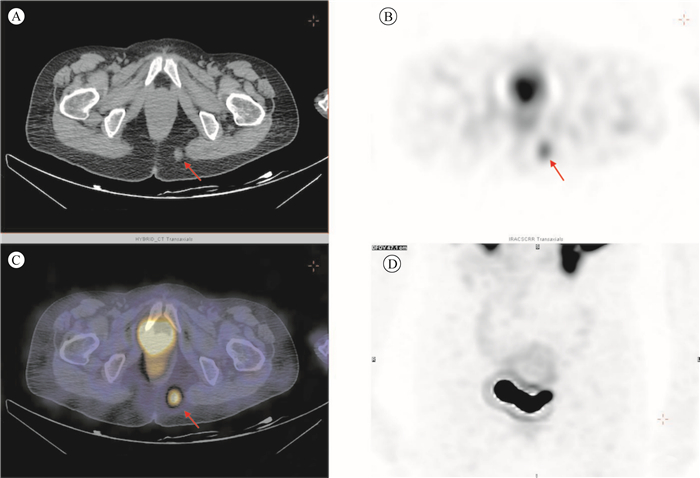
|
| 注A:CT平扫发现左侧臀部见1枚软组织结节影(箭头示),大小约1.3 cm×1.1 cm,边缘模糊;B:SPECT断层;C:SPECT/CT断层融合图;D:SPECT最大投影图;B~D均提示该结节放射性浓聚(箭头示),考虑生长抑素受体高表达;术后病理符合磷酸盐尿性间叶肿瘤 图 2 例1盆腔部位99mTc-HYNIC-TOC SPECT断层显像图 |
术后1个月复查,血磷为0.82 mmol/L,甲状旁腺激素为92.3 pg/mL,总25-羟基维生素D为17.4 ng/mL,碱性磷酸酶130 U/L,24 h尿磷40.7 mmol/24 h。
1.2 例2患者患者男性,45岁,2016年1月因全身多处骨痛近2年,于外院就诊;既往自2014年12月起全身关节游走性疼痛,最初疼痛部位为右侧髋关节,后发展为两侧髋关节及多根肋骨疼痛,四肢乏力,日常生活受限;2015年1月至2015年8月曾口服中性磷酸溶液(50 mL/d),未见明显好转,无其他长期服药史。
2016年1月外院检查结果显示:血磷为0.47 mmol/L,血钙为2.50 mmol/L,碱性磷酸酶为408 U/L,降钙素为3.04 ng/L,甲状旁腺激素为27.38 pg/mL,总25-羟基维生素D为15.69 ng/mL,24 h尿磷59.6 mmol/24 h。外院因诊断不明确,同月转至复旦大学附属肿瘤医院进一步检查,拟诊为肿瘤源性骨软化症,建议进行奥曲肽显像寻找肿瘤病灶。
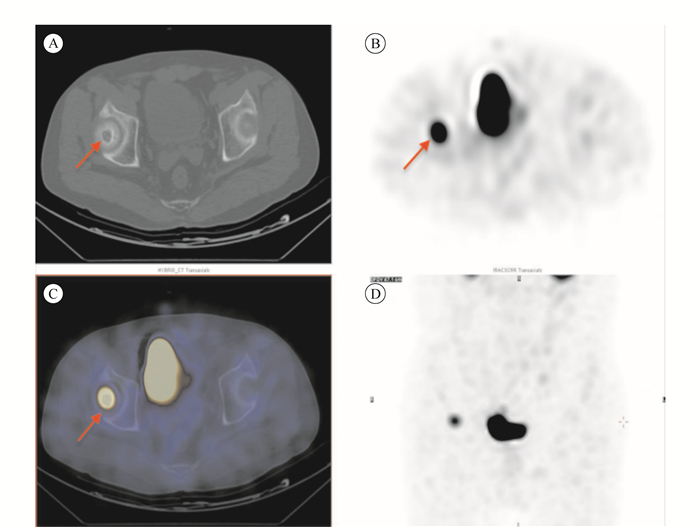
该患者2016年1月15日于复旦大学附属肿瘤医院核医学科行99mTc-HYNIC-TOC显像,方法同例1。全身平扫发现,右侧股骨上端1枚放射性浓聚灶(图 3),针对该部位行断层扫描,结果如图 4A~D)。1个月内在全身麻醉下行右侧股骨肿瘤刮除术,病理检查显示:(右侧股骨头)磷酸盐尿性间叶性肿瘤;免疫组织化学检查显示:CD34(血管+), S100(-), D2-40(-), F8(血管+), ERG(血管+), CD31(血管+), Ki-67<1%+, CD99(-), SMA(-), CK(-), EMA(-)。手术2个月后复查,血磷为0.94 mmol/L,碱性磷酸酶为97 U/L,24 h尿磷31.44 mmol/24 h。
|
| 注 A:CT平扫发现左侧臀部见1枚软组织结节影(箭头示),大小约1.5 cm×1.3 cm,边缘骨质硬化;B:SPECT断层;C:SPECT/CT断层融合图;D:SPECT最大投影图;B~D均提示该结节放射性浓聚(箭头示),考虑生长抑素受体高表达;术后病理符合磷酸盐尿性间叶肿瘤 图 3 例299mTc-HYNIC-TOC全身平面显像图 |
|
| 注 平面显像可见右侧盆部区域见1枚放射性摄取异常增高灶(箭头示); 甲状腺双叶对称性放射性摄取增高, 肝脏、脾脏及泌尿系统见生理性放射性摄取胸腹盆区域未见明显放射性摄取异常增高灶 图 4 例2盆腔部位99mTc-HYNIC-TOC SPECT断层显像图 |
磷酸盐尿性间叶肿瘤(phosphaturic mesenchymal tumor, PMT)是所有能产生低磷骨软化(tumor-induced osteomalacia,TIO)的间叶组织来源肿瘤的统称,这一独立的病理类型于2004年被提出,并在2013年被WHO作为新的病种收录[1-2],包括4种亚型:混合结缔组织型(mixed connective tissue type, MCT)、骨化纤维型、非骨化纤维瘤样型以及骨母细胞样型,后3种为第1种的特异性反映形式。PMT主要由星形细胞或梭形纤维母样细胞组成,有黏液样、骨样或软骨样背景基质,可存在钙盐沉积,肿瘤内有丰富的脂肪组织和畸形血管,血管多数呈“鹿角状”或“窦隙样”并伴有周围组织的黏液样变,部分肿瘤有软骨组织包饶,虽然为浸润性生长,但大部分为良性;因较为罕见且病理形态存在多样化,至今仍未得到病理诊断医师的共识[3-4]。
PMT导致的低血磷骨软化(tumor induced osteomalacia,TIO)属于副瘤综合征,至今机制仍不明确,主要可能是肿瘤组织内的梭形细胞大量分泌1种和磷代谢相关的蛋白质,即成纤维细胞生长因子-23(fibroblast growth factor-23, FGF-23);FGF-23能够作用于肾脏近曲小管上皮细胞,减少位于细胞膜的Ⅱ型钠-磷协同转运蛋白(type Ⅱ sodium-dependent phosphosphate cotransporters,NaPi Ⅱ)表达,降低磷的重吸收,导致尿磷增多,血磷减少,但不影响血钙的重吸收;此外,肾脏能够通过1α羟化酶催化合成1.25-(OH)2D来抑制甲状旁腺激素(parathyroid hormone, PTH)的产生,促进肠道对磷的吸收,而成纤维细胞生长因子-23(fibroblast growth factor-23, FGF-23)能够抑制肾脏1α羟化酶的活性,从而减少1.25-(OH)2D的产生,并且刺激甲状旁腺产生PTH,使肠道对磷的吸收减少,因此也有学者指出可能存在骨-肾脏-甲状旁腺内分泌轴,并且推断通过检测可疑部位周围血液中的FGF-23含量,对于PMT的诊断有一定的价值[5-7]。PMT患者都存在的TIO,主要临床表现为进行性骨或关节痛伴骨质疏松、频繁骨裂或骨折,四肢乏力甚至显著肌无力,严重者步态异常、行走困难,活动受限。实验室检查一般为血磷降低,但尿磷及碱性磷酸酶升高,而维生素D或PTH可正常或降低,其中顽固性低磷血症伴血钙正常或轻度较低为本病诊断的关键,须十分警惕[8]。2例患者术后1个月明显感觉四肢有力,生活质量显著提高。
PMT多见于成年人,由于大部分体积小且生长缓慢,虽然有研究提出好发于长骨的肢端,但迄今为止发现的部位有腘窝、咽旁间隙和大鱼际等,十分隐蔽[9-12];患者一般存在全身任意部位多发骨痛、骨折,而临床大多只针对疼痛部位进行X线片或MRI检查,从而难以发现原发灶,虽然部分学者建议患者进行全身MRI扫描,但原发灶在传统影像学检查上仍缺乏特异性,且无法从分子水平上来判断其性质[13-14]。
奥曲肽显像又称为生长抑素受体(somatostatin receptor, SSTR)显像,临床通过放射性核素标记生长抑素类似物奥曲肽(octreotide),与神经内分泌肿瘤(neuroendocrine neoplasm,NEN)细胞表面的大量表达的生长抑素受体SSTR2特异性结合来使肿瘤显像[15-16]。早在20世纪90年代初,美国食品药品管理局(Food and Drug Administration, FDA)就批准111In标记的奥曲肽显像剂(111In-TOC)用于诊断NEN患者,但111In生产成本高且需要加速器,半衰期长,一直限制其在临床的推广。99mTc则相对性价比高,半衰期短(约为6 h),发出的γ射线能量约为140 keV, 更适合核医学显像。99mTc通过双功能螯合剂肼基烟酰胺标记而成的99mTc-HYNIC-TOC目前已经广泛应用于消化系统经内分泌肿瘤、甲状腺髓样癌、垂体瘤和小细胞肺癌等NEN患者的原发灶、转移灶探测[17-20]。研究报道,对于分化程度较高(Ki-67≤20%)的胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine tumors, GEP-NETs),99mTc-HYNIC-TOC SPECT/CT的敏感度及特异度能达到93.2%和97.4%[15]。NEN的分化程度还与99mTc-HYNIC-TOC的摄取程度存在相关性,因此还能够通过测量病灶的靶本比来指导临床治疗方案制定和早期的疗效评价[21]。
研究发现,间叶组织来源的肿瘤,细胞膜表面也大量表达SSTR2,因此奥曲肽等生长抑素类似物也能够与该类肿瘤细胞特异性结合来达到显像和靶向治疗的目的[22]。Seufert等[23]则通过RT-PCR技术证实PMT肿瘤细胞内存在SSTR2表达相关的mRNA,这为99mTc-HYNIC-TOC用于PMT病灶的探测奠定理论基础,同时也对间叶肿瘤引起的低磷骨软化患者提供新的治疗方法。患者可通过服用奥曲肽来短期控制低磷血症,也可通过99mTc-奥曲肽显像来寻找原发灶,且敏感性较高[24-26]。一直以来,PMT肿瘤位置的探测一直困扰临床,直到1999年Nguyen等[27]首次提出用111In-TOC来探测引起低磷骨软化的间质肿瘤。随着99mTc-HYNIC-TOC的普及,Jiang等[9]对39例PMT患者作回顾性分析后发现,99mTc-HYNIC-TOC对于该肿瘤的敏感度能达到95%。本次研究中,例1患者肿瘤病灶位于膀胱后方,平扫时受膀胱散射干扰(图 1),因此建议PMT患者常规行盆腔断层,防止假阴性结果产生。
由于PMT非常罕见,病理诊断时也需密切结合临床症状,虽然患者血磷降低、高尿磷及全身多发骨折较为典型,但要同以下2种情况鉴别。
(1) 甲状旁腺亢进患者也能出现低血磷和全身多发骨折的情况,这是由于甲状旁腺激素(parathyroid hormone,PTH)能促进肾小管对钙离子的重吸收和磷酸盐的排泄,长期分泌过多则会刺激破骨细胞生长,并造成高血钙和低血磷的现象,而且骨组织在修复过程中部分会被血管和纤维组织取代,甚至出现黏液变性和反复出血,最终形成密度不均的软组织肿块,即棕色瘤;由于棕色瘤也能够位于机体任何部位的骨骼中,而患者也会出现血磷升高和多发骨折,严重的甲状旁腺功能亢进患者也具有全身多发骨折、骨痛的临床表现,容易和PMT混淆[28],但由于多数甲状旁腺亢进是由高功能甲状旁腺腺瘤分泌过多激素引起的,所以可以通过超声或CT来探查颈部是否存在可疑的软组织结节,再结合血清PTH及钙离子浓度升高来鉴别,例1患者血钙位于正常水平,且双侧甲状旁腺区域未见异常占位,基本能排除甲状旁腺亢进所致的骨软化,但PTH水平升高,可能原因是PMT导致患者骨-肾-甲状旁腺轴的调节发生紊乱,刺激PTH分泌,这也与文献[10]推断相符;虽然影像学表现上棕色瘤可能会被误诊为肿瘤,但其并不表达SSTR2,所以不会摄取99mTc-HYNIC-TOC。
(2) 慢性乙肝患者一般首选阿德福韦酯(adefovir dipivoxil, ADV)治疗,ADV能通过抑制乙肝(hepatitis B virus, HBV)病毒的反转录酶及DNA合成酶来阻止疾病进展,但是该药物具有一定的肾毒性,能够抑制肾脏近曲小管上皮细胞线粒体内DNA的合成,导致细胞坏死,从而降低肾脏对磷的重吸收,产生类似PMT生化特征的低血磷和高尿磷,长期大剂量服用也会有骨软化和肌无力,因此临床诊断时需要结合患者的长期服药史来判断[29-30]。除此之外,某些胃肠道疾病如非热带性口炎性腹泻和克罗恩病,胃肠循环中维生素D代谢出现紊乱,导致血磷下降,或染色体遗传性低磷佝偻病甚至严重营养不良都会导致低血磷和骨痛,诊断时要结合慢性病史及家族史来判断[31]。
手术切除是本病首选的治疗方案;由于PMT常呈浸润式生长,容易复发,因此在明确原发灶位置的情况下,排除其他禁忌后,均应行扩大切除术,防治复发,术后应短期密切监视血磷和碱性磷酸酶等指标的动态变化,并建议手术3~5个月后再次行奥曲肽显像来评价术区情况[32]。
综上所述,奥曲肽显像对于探测磷酸盐尿性间叶肿瘤的位置较为敏感;低磷骨软化患者,在排除遗传性佝偻病、克罗恩病和甲状旁腺亢进等疾病时,均建议行全身奥曲肽显像来诊断是否为磷酸盐尿性间叶肿瘤。
| [1] |
Folpea L, Fanburg-Smith JC, Billings SD, et al. Most osteomalacia-associated mesenchymal tumors are a single histopathologic entity:an analysis of 32 cases and a comprehensive review of the literature[J]. Am J Surg Pathol, 2004, 28(1): 1-30. DOI:10.1097/00000478-200401000-00001 |
| [2] |
Fletcher CDM. WHO classification of tumours of soft tissue and bone[M]. Lyon: IARC Press, 2013: 239-394.
|
| [3] |
Uramoto N, Furukawa M, Yoshizaki T. Malignant phosphaturic mesenchymal tumor, mixed connective tissue variant of the tongue[J]. Auris Nasus Larynx, 2009, 36(1): 104-105. DOI:10.1016/j.anl.2008.01.003 |
| [4] |
William J, Laskin W, Nayar R, et al. Diagnosis of phosphaturic mesenchymal tumor (mixed connective tissue type) by cytopathology[J]. Diagn Cytopathol, 2012, 40(S2): E109-113. DOI:10.1002/dc.21647 |
| [5] |
Tsagalis G, Psimenou E, Manios E, et al. Fibroblast growth factor 23(FGF23) and the kidney[J]. Int J Artif Organs, 2009, 32(4): 232-239. DOI:10.1177/039139880903200407 |
| [6] |
Liu P, Bai X, Wang H, et al. Hypophosphatemia-mediated hypotension in transgenic mice overexpressing human FGF-23[J]. Am J Physiol Heart Circ Physiol, 2009, 297(4): H1514. DOI:10.1152/ajpheart.00581.2009 |
| [7] |
Razzaque MS, Lanske B. The emerging role of the fibroblast growth factor-23-klotho axis in renal regulation of phosphate homeostasis[J]. J Endocrinol, 2007, 194(1): 1-10. |
| [8] |
Arai R, Onodera T, Terkawi MA, et al. A rare case of multiple phosphaturic mesenchymal tumors along a tendon sheath inducing osteomalacia[J]. BMC Musculoskelet Disord, 2017, 18(1): 79. DOI:10.1186/s12891-017-1446-z |
| [9] |
Jiang Y, Xia W, Xing X, et al. Tumor-induced osteomalacia:an important cause of adult-onset hypophosphatemic osteomalacia in China:Report of 39 cases and review of the literature[J]. J Bone Miner Res, 2012, 27(9): 1967-1975. DOI:10.1002/jbmr.1642 |
| [10] |
Chong WH, Yavuz S, Patel SM, et al. The importance of whole body imaging in tumor-induced osteomalacia[J]. J Clin Endocrinol Metab, 2011, 96(12): 3599-3600. DOI:10.1210/jc.2011-1757 |
| [11] |
Jan DE, Beur SM. Tumor-induced osteomalacia[J]. JAMA, 2005, 294(10): 1260-1267. DOI:10.1001/jama.294.10.1260 |
| [12] |
Jing H, Li F, Zhuang H, et al. Effective detection of the tumors causing osteomalacia using[J]. Eur J Radiol, 2013, 82(11): 2028-2034. DOI:10.1016/j.ejrad.2013.04.006 |
| [13] |
Agrawal K, Bhadada S, Mittal BR, et al. Comparison of 18F-FDG and 68Ga DOTATATE PET/CT in localization of tumor causing oncogenic osteomalacia[J]. Clin Nucl Med, 2015, 40(1): e6-10. |
| [14] |
Kawai S, Ariyasu H, Furukawa Y, et al. Effective localization in tumor-induced osteomalacia using (68)Ga-DOTATOC-PET/CT, venous sampling and 3T-MRI[J]. Endocrinol Diabetes Metab Case Rep, 2017, 2017(4): 1-6. |
| [15] |
李毅, 徐俊彦, 许晓平, 等. 99mTc-HYNIC-TOC SPECT/CT显像探测结直肠神经内分泌肿瘤的临床价值[J]. 肿瘤影像学, 2017, 26(1): 67-71. |
| [16] |
蒋津津, 徐俊彦, 许晓平, 等. 99mTc-HYNIC-TOC SPECT/CT显像探测神经内分泌肿瘤肝转移灶的临床价值[J]. 肿瘤影像学, 2014, 23(1): 14-18. |
| [17] |
Mikolajczak R, Maecke HR. Radiopharmaceuticals for somatostatin receptor imaging[J]. Nucl Med Rev Centr Eastern Eur, 2016, 19(2): 126-132. DOI:10.5603/NMR.2016.0024 |
| [18] |
Opalinska M, Hubalewska-Dydejczyk A, Sowa-Staszczak A, et al. NEN-the role of somatostatin receptor scintigraphy in clinical setting[J]. Nucl Med Rev Centr Eastern Eur, 2016, 19(2): 118-125. DOI:10.5603/NMR.2016.0023 |
| [19] |
王峰, 王自正, 姚薇萱, 等. 99Tcm-生长抑素受体显像对肺癌的诊断价值[J]. 中华结核和呼吸杂志, 2005, 28(4): 218-220. DOI:10.3760/j:issn:1001-0939.2005.04.002 |
| [20] |
景红丽, 李方. 99Tcm-HYNIC-TOC显像诊断生长抑素受体阳性肿瘤[J]. 中国医学影像技术, 2004, 20(10): 1490-1493. DOI:10.3321/j.issn:1003-3289.2004.10.006 |
| [21] |
Garai I, Barna S, Nagy G, et al. Limitations and pitfalls of 99mTc-EDDA/HYNIC-TOC (Tektrotyd) scintigraphy[J]. Nucl Med Rev Centr Eastern Eur, 2016, 19(2): 93-98. DOI:10.5603/NMR.2016.0019 |
| [22] |
Reubi JC, Waser B, Laissue JA, et al. Somatostatin and vasoactive intestinal peptide receptors in human mesenchymal tumors:in vitro identification[J]. Cancer Res, 1996, 56(8): 1922-1931. |
| [23] |
Seufert J, Ebert K, Muller J, et al. Octreotide therapy for tumor-induced osteomalacia[J]. New Engl J Med, 2001, 345(26): 1883-1888. DOI:10.1056/NEJMoa010839 |
| [24] |
Houang M, Clarkson A, Sioson L, et al. Phosphaturic mesenchymal tumors show positive staining for somatostatin receptor 2A (SSTR2A)[J]. Human Pathol, 2013, 44(12): 2711-2718. DOI:10.1016/j.humpath.2013.07.016 |
| [25] |
Duet M, Kerkeni S, Sfar R, et al. Clinical impact of somatostatin receptor scintigraphy in the management of tumor-induced osteomalacia[J]. Clin Nucl Med, 2008, 33(11): 752-756. DOI:10.1097/RLU.0b013e31818866bf |
| [26] |
Kulshreshtha B, Sharma LK, Sharma N, et al. Octreotide and cinacalcet have limited role managing surgically incurable tumor induced osteomalacia[J]. Acta Endocrinologica, 2015, 11(4): 517-523. DOI:10.4183/aeb.2015.517 |
| [27] |
Nguyen BD, Wang EA. Indium-111 pentetreotide scintigraphy of mesenchymal tumor with oncogenic osteomalacia[J]. Clin Nucl Med, 1999, 24(2): 130-131. |
| [28] |
Chang HH, Chang CC, Liu JL, et al. Brown tumor of the tibia as an initial manifestation of primary hyperparathyroidism:case report[J]. Acta Nephrologica, 2010, 24(3): 167-169. |
| [29] |
Yoo KD, Jeong JH, Cho SK, et al. A case of hypophosphatemic osteomalacia associated with low-dose adefovir dipivoxil treatment[J]. Korean J Med, 2010, 78(2): 261-265. |
| [30] |
Lee HJ, Choi JW, Kim TN, et al. A case of severe hypophosphatemia related to adefovir dipivoxil treatment in a patient with liver cirrhosis related to hepatitis B virus[J]. Korean J Hepatol, 2008, 14(3): 381-386. DOI:10.3350/kjhep.2008.14.3.381 |
| [31] |
Hautmann AH, Hautmann MG, Kölbl O, et al. Tumor-induced osteomalacia:an up-to-date review[J]. Curr Rheumatol Rep, 2015, 17(6): 37. DOI:10.1007/s11926-015-0512-5 |
| [32] |
Shi X, Jing H, Li F, et al. 99mTc-HYNIC-TOC in the evaluation of recurrent tumor-induced osteomalacia[J]. Clin Nucl Med, 2019, 44(3): 209-213. DOI:10.1097/RLU.0000000000002458 |
 2020, Vol. 35
2020, Vol. 35


