文章信息
- 胡静, 赵明芳
- 驱动基因阴性晚期NSCLC一线免疫治疗精彩纷呈:雾里看花
- 实用肿瘤杂志, 2020, 35(1): 19-24
基金项目
- 国家重点研发项目(2016YFC1303800)
-
作者简介
- 胡静(1995-), 女, 四川泸州人, 硕士生, 从事肿瘤学临床研究.
-
通信作者
- 赵明芳, E-mail:zhaomf618@126.com
-
文章历史
- 收稿日期:2019-12-04
2011年Nature发表的《Cancer immunotherapy comes of age》点燃了免疫治疗的燎原之火[1],众多研究陆续推出,上演百家争鸣的盛况,主要集中于程序性死亡受体1(programmed death 1,PD-1)、程序性死亡配体1(programmed death-ligand 1,PD-L1)和细胞毒性T淋巴细胞相关抗原-4(cytotoxic T lymphocyte-associated antigen 4,CTLA-4)抑制剂。自2013年美国《科学》杂志将癌症免疫治疗评为“重大突破”以来,PD-1/PD-L1抑制剂作为免疫治疗中的主力军,在癌症治疗领域备受瞩目。2014年美国食品药品监督管理局(Federal Food and Drug Adminstration,FDA)首先批准pembrolizumab和nivolumab用于晚期黑色素瘤治疗,其适应证不扩大。其中,对非小细胞肺癌(non-small-cell lung cancer,NSCLC)治疗的不断探索:从二线[2-7]到一线,从晚期到局部晚期[8]再到早期,从单药到联合,从泛人群到精准治疗,使得免疫治疗遍地开花,捷报频传。本文就驱动基因阴性的NSCLC一线免疫治疗的进展以及未来探索方向进行梳理,为临床诊疗及转化研究提供依据。
1 晚期非鳞NSCLC一线免疫治疗进展:百花齐放 1.1 一线单药免疫检查点抑制剂的治疗进展:乱花渐欲迷人眼还是尘埃落定?2016年从Keynote-010研究[9]到Keynote-024研究[10],入组人群从PD-L1阳性缩小至PD-L1≥50%,将视线从泛人群治疗转换到精准治疗。对于表皮生长因子受体(epidermal growth factor receptor,EGFR)基因和间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)基因等驱动基因阴性的PD-L1高表达(PD-L1≥50%)的Ⅳ期NSCLC患者,Keynote-024[10]中pembrolizumab一线治疗以30.0个月的中位OS较化疗提升1倍,中位PFS达10.3个月,完胜含铂双药化疗,获批PD-L1≥50%晚期NSCLC患者一线治疗适应证,成为驱动基因阴性晚期NSCLC治疗发展过程重要的里程碑事件,让肿瘤治疗“chemo-free”成为可能;其以42个月高达41.0%的生存率表明免疫治疗的持久生存获益,几乎实现肺癌“慢病化”;同时45.5%的客观缓解率(objective response rate,ORR)显示该人群对免疫治疗的高疗效。尽管早期进行的Ⅰ期Checkmate012研究显示,nivolumab单药一线治疗安全有效,疗效持久[11]。但是Ⅲ期的Checkmate026研究则以失败告终,即使PD-L1≥50%的亚组人群依然没有获得阳性结果[12]。
2019年ESMO公布的CheckMate-227结果nivolumab对比化疗在PD-L1≥50%亚组生存时间延长[13],扭转CheckMate-026研究的困局,为nivolumab一线治疗提供可行性证据,但是还没有得到FDA的批准。Ⅲ期Keynote042研究[14],扩展人群到PD-L1≥1%的驱动基因阴性的复发转移性NSCLC患者,该研究依然达到其主要研究终点,单药pembrolizumab优于标准含铂双药化疗[中位生存期(overall survival,OS) 16.7个月vs 12.1个月,HR=0.81,P=0.001 8]。再次奠定pembrolizumab在晚期NSCLC一线治疗的地位。但亚组分析显示,PD-L1表达在1%~49%的患者并未观察到pembrolizumab单药优于化疗(OS 13.4个月vs 12.1个月,P=0.92),但是不良反应小,对于不愿意接受化疗的患者,依然是个可选方案。对于PD-L1≥50%的患者重复出Keynote024一致的结果,提示单药pembrolizumab获益最大的人群仍是PD-L1≥50%的患者。2019年WCLC公布的Keynote-042中国人群的数据[15],显示出与全球数据一致甚至更好的趋势。
2019年ESMO公布的全球多中心Ⅲ期、开放性、随机对照的IMpower-110研究结果[16],atezolizumab单药对比铂类(顺铂或卡铂)联合培美曲塞或吉西他滨用于经PD-L1筛选的Ⅳ期NSCLC初治患者,与标准化疗比较,atezolizumab改善PD-L1高表达(TC3/IC3-WT;TC3:肿瘤细胞PD-L1表达≥50%;IC3:肿瘤浸润免疫细胞的PD-L1表达≥10%,WT:EGFR/ALK野生型)Ⅳ期NSCLC初治患者的中位OS(20.2个月vs 13.1个月,HR=0.59,P=0.010 6)和PFS(8.1个月vs 5.0个月,HR=0.63,P=0.007)。这是首次在Ⅲ期研究中证实在PD-L1高表达人群(TC3/IC3-WT)中单药atezolizumab一线治疗完胜化疗。期待atezolizumab能够尽快获批PD-L1高表达人群一线治疗适应证。
多项研究显示多种药物一线免疫单药治疗优于化疗。而现有数据显示,各种PD-1/PD-L1药物不同,疗效不同,毒性不完全一致。抗PD-1/PD-L1单药治疗获益人群少,长期缓解率仍较低,约10%~40%[17]。其免疫检查点抑制剂的原发耐药率为40%~65%[18]。约10%的患者还存在超进展或快速进展,如何提高缓解率降低超进展患者比例是关注重点。免疫联合化疗是否可以克服超进展进一步提高疗效引起关注。
1.2 一线免疫检查点抑制剂联合化疗的治疗进展:锦上添花?在单药的基础上,Keynote-021研究将pembrolizumab联合化疗(卡铂和培美曲塞)的ORR提高到55%,中位PFS为13个月[19]。同样的结果在Ⅲ期临床试验Keynote-189[20]和Keynote-407[21]中得到证实。FDA于2017年5月批准pembrolizumab联合培美曲塞+铂类用于初治无EGFR/ALK突变的晚期非鳞NSCLC患者的治疗,把晚期NSCLC治疗带入免疫联合化疗模式的全新时代。
在非鳞状NSCLC患者中,免疫治疗联合化疗的Ⅲ期研究主要有Keynote-189和IMpower130、IMpower132和Checkmate227等研究。KEYNOTE-189是一项随机双盲安慰剂对比的Ⅲ期临床研究[20]。研究结果显示,EGFR或ALK阴性的初治晚期非鳞NSCLC患者无论PD-L1表达状态高低,培美曲塞加铂联合pembrolizumab对比培美曲塞联合铂类均能延长患者OS(22.0个月vs 10.7个月,HR=0.56,P < 0.01)和PFS(9.0个月vs 4.9个月,HR=0.48,P < 0.01)。目前NCCN指南将pembrolizumab联合培美曲塞加卡铂/顺铂作为1类推荐治疗晚期非鳞NSCLC[22]。而具有相似设计的IMpower132研究在2018WCLC报告的结果仅PFS(7.6个月vs 5.2个月,HR=0.60,P < 0.01)获益,OS(59.6个月vs 55.4个月,HR=0.81,P=0.079 7)为阴性结果,一线atezolizumab联合化疗与单独化疗比较不能使非鳞状NSCLC患者OS获益。IMpower130研究是第一项证实PD-L1抗体联合化疗一线治疗晚期NSCLC获益的大型多中心随机对照Ⅲ期临床研究[23],结果显示,atezolizumab联合白蛋白紫杉醇加卡铂化疗组和单纯化疗组中位OS(18.5个月vs 13.9个月,HR=0.79,P=0.033)和PFS(7.0个月vs 5.5个月,HR=0.64,P < 0.01)比较,差异均具有统计学意义。
鉴于免疫联合化疗对比单药免疫治疗在客观缓解率上的优势,对于PD-L1≥50%这类患者,2020第1版NCCN指南同时推荐pembrolizumab单药及pembrolizumab联合培美曲塞+铂类化疗作为一线治疗的选择[22]。除免疫联合方案所带来的生存获益以外,其不良反应同样值得重视。在Keynote-189[20]和Keynote-407[21]研究中3~5级不良反应发生率分别为71.9%和69.8%,远高于单药免疫的最高值31.2%。面对如此高概率的不良反应风险,权衡其带来的生存获益,笔者认为,在PD-L1高表达人群中,pembrolizumab联合化疗对比单药pembrolizumab的疗效缺乏头对头的临床研究,该研究中1和2年生存率(73.3%和51.9%),与Keynote-024研究[10]相似(70.3%和51.7%),说明两种治疗方案带来的长期生存获益可能相似。但联合方案客观缓解率最高达62.1%,高于pembrolizumab或atezolizumab单药免疫治疗,这一优势可加以利用。因此体能状态较差、高龄、基础疾病多、肿瘤负荷小的患者以及没有已知可能与超进展相关基因表达的患者优先选择单药治疗,而年轻、体能状态好、肿瘤负荷较大、颅脑转移、肿瘤异质性可能较大、期待快速缓解症状以及可能有超进展风险的患者进行化疗联合免疫治疗,可能是更好的选择。不过,笔者认为4~6个周期的联合治疗可能足矣,后续以免疫治疗单药维持可能更佳,但是关于这一点还缺乏前瞻性的临床研究证据。
1.3 一线免疫检查点抑制剂联合抗血管生成药物和化疗的治疗进展:理想很丰满!抗肿瘤血管治疗在非鳞NSCLC中取得重要成绩,一线抗血管生成治疗基础上联合免疫治疗能否进一步提高有效率,改善患者生存,Impowerl50研究设计意在回答这一问题[24]。IMpower150研究是一项非鳞NSCLC患者一线治疗的随机对照Ⅲ期临床试验,随机分配至ACP组(atezolizumab+卡铂+紫杉醇)、ABCP组(atezolizumab+贝伐珠单抗+卡铂+紫杉醇)或BCP组(贝伐珠单抗+卡铂+紫杉醇)。共同主要研究终点为研究者评估的意向性分析人群WT(EGFR/ALK野生型)型患者的PFS和OS。结果显示,ABCP组的PFS及OS长于BCP组(中位PFS:8.3个月vs 6.8个月,HR=0.62,P < 0.01;mOS:19.2个月vs 14.7个月,HR=0.78,P=0.02),分层分析显示,无论PD-L1表达状态如何,肝转移和EGFR/ALK阳性突变TKI耐药后驱动基因阴性亚组四药联合治疗均优于三药联合,其中TC3/IC3患者,四药联合组生存期达到25.2个月,与Keynote-024研究[10]中pembrolizumab治疗带来的生存获益势均力敌。目前四药联合治疗方案也是NCCN指南[22]推荐的晚期非鳞NSCLC一线治疗方案。然而四药联合的豪华方案所要面临的问题就是治疗相关的不良反应增加和治疗经济负担加重,临床医师在选择联合治疗方案时需综合考虑患者基础合并疾病、体能状态及经济条件。笔者认为四药联合的方案临床可行性差,未来还是应该通过免疫组学的方法精准诊断筛分患者,找到真正四药联合获益的患者。
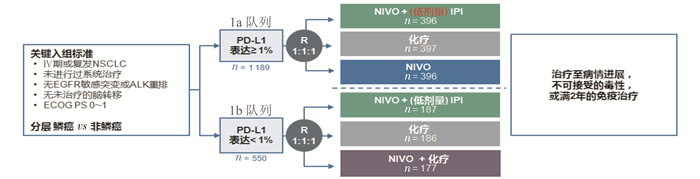
1.4 一线免疫检查点抑制剂双药联合的治疗进展:乱花渐欲迷人眼?一线单药还是联合治疗,临床研究似乎正要给出答案,2019年9月末ESMO公布的CheckMate 227第1部分研究结果让肺癌的免疫治疗再次陷入乱花渐欲迷人眼的状态[13]。CheckMate 227是一项设计复杂(图 1)的多中心开放性Ⅲ期临床研究,评估以nivolumab联合低剂量ipilimumab对比单纯化疗/免疫单药或者免疫联合化疗用于晚期一线NSCLC患者(包括鳞癌和非鳞癌组织学类型)。结果显示,无论PD-L1表达水平如何,nivolumab联合低剂量ipilimumab一线双免疫联合治疗均能为患者带来长期生存获益,40%的患者生存期>2年,优于对应化疗组的33%和23%。ORR和持续缓解时间(duration of response,DOR)均优于化疗,双免疫联合治疗的ORR为37.9%,化疗组为23.1%。与化疗比较,有更多患者达到完全缓解(complete response,CR),在PD-L1≥1%及PD-L1<1%的患者中,联合治疗的CR率为5.8%及2.1%,对比化疗组分别提高3倍及2倍。PD-L1表达患者的中位DOR为化疗患者的近4倍。双免疫联合治疗为肺癌患者带来更深更持久的疗效,在晚期NSCLC治疗蓝图中画出浓墨重彩的一笔!
CheckMate 227第2部分研究针对非鳞NSCLC患者,与化疗比较,nivolumab联合化疗的疗效未达到总生存期的主要终点(8.83个月vs 15.57个月,HR=0.86)。Checkmate227研究是首个也是唯一显示与化疗比较,双免疫联合治疗用于NSCLC一线治疗能够为患者带来生存获益的临床研究[26]。低剂量ipilimumab双免疫联合治疗安全性优于化疗,所有治疗相关性不良事件发生率更低(77% vs 82%),3~4级治疗相关性不良事件发生率为33%和36%。但目前FDA尚未批准nivolumab联合低剂量ipilimumab治疗晚期NSCLC。
既往NSCLC“chemo-free”免疫治疗方案受限于PD-L1表达水平,只有PD-L1阳性的部分患者可能获益。CheckMate 227研究中显示,nivolumab联合低剂量ipilimumab在EGFR/ALK驱动基因阴性的晚期NSCLC患者中,无论PD-L1表达水平如何,均可带来长期生存获益及持久的深度缓解,具有重要的临床意义[13, 24]。这个结果的公布,引起巨大的轰动和业界的广泛讨论,这是首个在广泛患者人群中“chemo-free”一线方案的成功,或可为晚期NSCLC患者的系统治疗提供新的解决方案,代表晚期NSCLC患者的一个全新治疗格局。未来,期待各项临床研究的深入开展,在生物标志物及人群的筛选方面获得更多提示,为肺癌患者带来精准的免疫治疗选择。
2 晚期肺鳞癌一线免疫治疗进展:靶向无缘,免疫接棒!化疗在晚期肺鳞癌中有着不可替代的地位,经典的ECOG1594研究证实,含铂双药化疗ORR为25%~35%,中位PFS为4~6个月,中位OS为8~10个月[13, 24]。白蛋白紫杉醇、EGFR-TKI、EGFR单克隆抗体和抗肿瘤血管药物在鳞癌的临床试验中获益有限,鳞癌的治疗尚未有突破性进展。免疫检査点抑制剂为肺鳞癌治疗带来新的曙光。2019ESMO更新的Keynote-407研究数据显示[21],在转移性肺鳞癌的一线治疗上,pembrolizumab联合卡铂和紫杉类化疗对比单纯化疗,可以延长OS(比化疗组延长4.6个月)和PFS并提高ORR(首次高达64.4%),无论患者接受哪种类型的紫杉类化疗。
Checkmate227研究[24]中的肺鳞癌患者,nivolumab联合化疗成功延长6.31个月的OS(18.27个月vs 11.96个月,HR=0.69),这也为突变率较少的鳞癌患者带来新希望。Nivolumab联合化疗与pembrolizumab单药治疗数据比较,也不逊色。在Keynote 407研究中pembrolizumab联合化疗一线治疗鳞癌的OS延长4.6个月(15.9个月vs 11.3个月)[21]。从OS的相对延长值来看,Checkmate 227一线治疗的优势似乎更大。
IMpower131研究卡铂+紫杉醇/白蛋白紫杉醇联合或不联合atezolizumab用于晚期鳞状NSCLC一线治疗疗效的结果显示,两组患者的OS比较,差异无统计学意义(P=0.158),只在PD-L1高表达的人群中显示出OS获益[27]。2018年ASCO大会上公布的Impower131研究[27]结果显示,免疫联合化疗对比单纯化疗PFS分别为5.6个月和3.0个月(P=0.000 1),亚组分析提示免疫联合化疗获益明显的是PD-L1高表达人群(PFS 10.1个月vs 5.5个月),目前OS数据尚不成熟,第1次中期分析OS为14个月和13.9个月(P=0.693 1),亚组分析同样提示,PD-L1高表达人群免疫联合化疗OS获益更明显(OS 23.6个月vs 14个月,HR=0.56),期待进一步相关数据公布。CTLA-4抑制剂ipilimumab较早在复发转移性晩期肺鳞癌中进行一线免疫联合化疗的探索,然而,研究最终是阴性结果(OS 13.4个月vs 12.4个月,P=0.25)。
3 展望回溯免疫治疗长达百年的发展史,自1893年美国外科医师William Coley首次尝试应用化脓性链球菌Coley毒素激活非特异性免疫反应治疗肿瘤,开启肿瘤免疫治疗的先河,到1991年Weissman首次报道细胞因子诱导性杀伤细胞(cytokine induced killer cells,CIK)细胞抗肿瘤疗效的评估数据[28],再到免疫检查点抑制剂的诞生,肿瘤免疫治疗才真正实现飞速发展。免疫治疗从实验室到临床研究、从二线治疗到一线治疗、从单药治疗到多药联合的不断探索,PD-1/PD-L1和CTLA-4抑制剂在晚期NSCLC的治疗中日渐羽翼丰满,并描绘了驱动基因阴性患者的个体化精准治疗蓝图。对于驱动基因阳性的患者,靶向治疗失败之后,免疫联合治疗依然还有一席之地,众多的临床研究进行当中。特别是近来晚期NSCLC免疫治疗研究结果陆续公布,免疫治疗可谓高歌猛进,使晚期肺癌患者的治疗策略和理念不断推陈出新,可以说肿瘤免疫治疗魅力十足、潜力无限!同时也给临床应用提出许多挑战:如适宜人群的筛选、肿瘤免疫标志物的选择、确切的cut-off值和检测平台的选择、免疫微环境的精准诊断、免疫状态的动态监测以及如何应对免疫治疗不良反应等。目前对免疫治疗的认识仍是冰山一角,免疫治疗个体化应用任重而道远。只有不断深入研究探索,一步一步解决现在已有和未来即将出现的问题,逐步拨开笼罩在晚期NSCLC患者免疫治疗的重重迷雾,才能摘得免疫精准治疗的明日之花!
| [1] |
Mellman I, Coukos G, Dranoff G. Cancer immunotherapy comes of age[J]. Nature, 2011, 480(7378): 480-489. DOI:10.1038/nature10673 |
| [2] |
Brahmer J, Reckamp KL, Baas P, et al. Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer[J]. N Engl J Med, 2015, 373(2): 123-135. DOI:10.1056/NEJMoa1504627 |
| [3] |
Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus docetaxel in advanced non-squamous non-small-cell lung cancer[J]. N Engl J Med, 2015, 373(17): 1627-1639. DOI:10.1056/NEJMoa1507643 |
| [4] |
Wu YL, Lu S, Cheng Y, et al. Nivolumab versus docetaxel in a predominantly Chinese patient population with previously treated advanced NSCLC:CheckMate 078 randomized phase Ⅲ clinical trial[J]. J Thorac Oncol, 2019, 14(5): 867-875. DOI:10.1016/j.jtho.2019.01.006 |
| [5] |
Fehrenbacher L, Spira A, Ballinger M, et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR):a multicentre, open-label, phase 2 randomised controlled trial[J]. Lancet, 2016, 387(10030): 1837-1846. DOI:10.1016/S0140-6736(16)00587-0 |
| [6] |
Rittmeyer A, Barlesi F, Waterkamp D, et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK):a phase 3, open-label, multicentrerandomised controlled trial[J]. Lancet, 2017, 389(10066): 255-265. DOI:10.1016/S0140-6736(16)32517-X |
| [7] |
Garon EB, Rizvi NA, Hui R, et al. Pembrolizumab for the treatment of non small cell lung cancer[J]. N Engl J Med, 2015, 372(21): 2018-2028. DOI:10.1056/NEJMoa1501824 |
| [8] |
Antonia SJ, Villegas A, Daniel D, et al. Durvalumab after chemoradiotherapy in stage Ⅲ non-small-cell lung cancer[J]. N Engl J Med, 2017, 377(20): 1919-1929. DOI:10.1056/NEJMoa1709937 |
| [9] |
Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010):a randomised controlled trial[J]. Lancet, 2016, 387(10027): 1540-1550. DOI:10.1016/S0140-6736(15)01281-7 |
| [10] |
Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer[J]. N Engl J Med, 2016, 375(19): 1823-1833. DOI:10.1056/NEJMoa1606774 |
| [11] |
Gettinger S, Rizvi NA, Chow LQ, et al. Nivolumab monotherapy for first line treatment of advanced non-small-cell lung cancer[J]. J Clin Oncol, 2016, 34(25): 2980-2987. DOI:10.1200/JCO.2016.66.9929 |
| [12] |
Carbone DP, ReckM, Paz-Ares L, et al. First-line nivolumab in stage Ⅳ or recurrent non-small-cell lung cancer[J]. N Engl J Med, 2017, 376(25): 2415-2426. DOI:10.1056/NEJMoa1613493 |
| [13] |
Hellmann MD, Paz-Ares L, Bernabe Caro R, et al. Nivolumab plus ipilimumab in advanced non-small-cell lung cancer[J]. N Engl J Med, 2019, 381(21): 2020-2031. DOI:10.1056/NEJMoa1910231 |
| [14] |
Mok TSK, Wu YL, Kudaba I, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042):a randomised, open-label, controlled, phase 3 trial[J]. Lancet, 2019, 393(10183): 1819-1830. DOI:10.1016/S0140-6736(18)32409-7 |
| [15] |
Wu Y, Zhang L, Fan Y, et al. KEYNOTE-042 China study:First-line pembrolizumab vs chemotherapy in Chinese patients with advanced NSCLC with PD-L1 TPS≥1%[J]. J Thorac Oncol, 2019, 14(10): S290-291. |
| [16] |
Spigel D, De Marinis F, Giaccone G, et al. IMpower110:Interim overall survival (OS) analysis of a phase Ⅲ study of atezolizumab (atezo) vs platinum-based chemotherapy (chemo) as first-line (1L) treatment (tx) in PD-L1-selected NSCLC[J]. Ann Oncol, 2019, 30: 915. DOI:10.1093/annonc/mdz293 |
| [17] |
Duan J, Wang Y, Jiao S. Checkpoint blockade-based immunotherapy in the context of tumor microenvironment:Opportunities and challenges[J]. Cancer Med, 2018, 7(9): 4517-4529. DOI:10.1002/cam4.1722 |
| [18] |
Festino L, Vanella V, Trojaniello C, et al. Selecting immuno-oncology based drug combinations-what should we be considering?[J]. Exp Rev Clin Pharmacol, 2018, 11(10): 971-985. DOI:10.1080/17512433.2018.1518713 |
| [19] |
Langer CJ, Gadgeel SM, Borghaei H, et al. Carboplatin and pemetrexed with or without pembrolizumab for advanced, non-squamous non-small-cell lung cancer:a randomised, phase 2 cohort of the open-label KEYNOTE-021 study[J]. Lancet Oncol, 2016, 17(11): 1497-1508. DOI:10.1016/S1470-2045(16)30498-3 |
| [20] |
Gandhi L, Rodríguez-Abreu D, Gadgeel S, et al. Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer[J]. N Engl J Med, 2018, 378(22): 2078-2092. DOI:10.1056/NEJMoa1801005 |
| [21] |
Paz-Ares L, Luft A, Vicente D, et al. Pembrolizumab plus chemotherapy for squamous non-small-cell lung cancer[J]. N Engl J Med, 2018, 379(21): 2040-2051. DOI:10.1056/NEJMoa1810865 |
| [22] |
National Comprehensive Cancer Network. Non-small cell lung cancer(version 1.2020)[EB/OL]. (2019-11-06)[2019-12-04]. https://www.nccn.org/professionals/physician_gls/pdf/sclc.pdf.
|
| [23] |
West H, McCleod M, Hussein M, et al.Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer (IMpower130): a multicentre, randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2019, [Epub].
|
| [24] |
Socinski MA, Jotte RM, Cappuzzo F, et al. Atezolizumab for first-line treatment of metastatic nonsquamous NSCLC[J]. N Engl J Med, 2018, 378(24): 2288-2301. DOI:10.1056/NEJMoa1716948 |
| [25] |
Solange P, Suresh R, Luis PA, et al.Nivolumab+low-dose ipilimumab versus platinum-doublet chemotherapy as first-line treatment for advanced non-small cell lung cancer: CheckMate 227 Part 1 final analysis[C]. Lugano: ESMO, 2019.
|
| [26] |
Beck M, Schenker M, Lee KH, et al. Nivolumab plus ipilimumab versus chemotherapy as first-line treatment in advanced non-small-cell lung cancer with high tumour mutational burden:patient-reported outcomes results from the randomised, open-label, phase Ⅲ CheckMate 227 trial[J]. Eur J Cancer, 2019, 116: 137-147. DOI:10.1016/j.ejca.2019.05.008 |
| [27] |
Socinski MA, Rittmeyer A, Shapovalov D, et al. LBA65 IMpower131: Progression-free survival (PFS) and overall survival (OS) analysis of a randomised phase Ⅲ study of atezolizumab+ carboplatin+ paclitaxel or nab-paclitaxel vs carboplatin+ nab-paclitaxel in 1L advanced squamous NSCLC[J]. Ann Oncol, 2018, 9(suppl 8): mdy424. 077.
|
| [28] |
吴一龙, 钟文昭, 张潮, 等. 肺癌免疫治疗2.0时代:全面战争[J]. 循证医学, 2017, 17(1): 1-4. |
 2020, Vol. 35
2020, Vol. 35