文章信息
- 张欣伟, 王勇, 罗辉, 刘琴, 李勇
- Zhang Xinwei, Wang Yong, Luo Hui, Liu Qin, Li Yong
- 自噬相关蛋白在EGFR-TKI耐药NSCLC患者中的表达及其相关性
- Expression and correlation of autophagy-related proteins in EGFR-TKI resistant non-small-cell lung cancer patients
- 实用肿瘤杂志, 2019, 34(6): 508-512
- Journal of Practical Oncology, 2019, 34(6): 508-512
基金项目
- 国家自然科学基金(81560379);江西省自然科学基金面上项目(20181BAB205046);江西省科技支撑计划项目(2015BBG70236);江西省教育厅重点项目(GJJ170012)
-
作者简介
- 张欣伟(1995-), 女, 江西上饶人, 硕士生, 从事肺癌基础与临床研究.
-
通信作者
- 李勇, E-mail:liyongcsco@email.ncu.edu.cn
-
文章历史
- 收稿日期:2019-07-19
2. 赣州市人民医院肿瘤科, 江西 赣州 341000;
3. 南昌大学第一附属医院呼吸与危重症医学科, 江西 南昌 330006
2. Department of Medical Oncology, Ganzhou People's Hospital, Ganzhou 341000, China;
3. Department of Respiratory and Critical Care Medicine, the First Affiliated Hospital of Nanchang University, Nanchang 330006, China
肺癌是最常见恶性肿瘤之一。在我国,肺癌是第1位癌症死因,也是人群死亡率上升最快的癌症,其中80%为非小细胞肺癌(non-small-cell lung cancer,NSCLC)。表皮生长因子酪氨酸激酶受体抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI)在EGFR突变的NSCLC中具有良好的疗效,选择高,不良反应较小,不仅能够改善患者预后,还可以延缓肿瘤进展。EGFR-TKI是通过抑制酪氨酸激酶的活性,阻断肿瘤细胞增殖和生长的通路,从而抑制肿瘤细胞的生长、迁移和加快其凋亡。但不同个体疗效差异很大,最终EGFR-TKI耐药的出现和疾病的进展还是难以避免。自噬是在饥饿、缺氧和应激等条件下细胞内部分物质降解的现象,普遍发生在真核细胞内[1]。自噬与肿瘤EGFR-TKI抑制剂耐药有关,通过调控自噬的表达可能逆转肿瘤细胞对EGFR-TKI的耐药[2]。但目前关于自噬与NSCLC患者出现EGFR-TKI耐药的关系及其机制尚不明确。本研究初步探讨自噬相关蛋白在EGFR-TKI耐药NSCLC患者中的表达水平及与EGFR-TKI耐药的相关性,为后续机制深入探究及NSCLC患者出现EGFR-TKI耐药寻找有效标志物提供理论依据。
1 资料与方法 1.1 一般资料标本来自于2018年2月至2019年2月南昌大学第一附属医院52例和赣州市人民医院28例晚期肺腺癌患者,所有患者均经支气管镜或经皮肺穿刺活检获取足量组织标本。患者分为EGFR敏感(EGFR-S)组40例与EGFR耐药(EGFR-R)组40例。EGFR-S组为经基因检测确定为EGFR敏感突变患者;EGFR-R组为经基因检测确定为EGFR原发耐药突变患者,或敏感突变患者口服吉非替尼出现进展,再次活检经基因检测确定为继发耐药患者。80例肺腺癌患者均为Ⅳ期,其中男性47例,女性33例,年龄48~78岁,(62.18±7.69)岁。EGFR-S组40例,男性25例,女性15例,年龄(61.40±7.40)岁;EGFR-R组40例,男性22例,女性18例,年龄50~78岁,(62.95±7.90)岁。两组在性别、年龄和分期方面比较,差异均无统计学意义(均P>0.05)。
蛋白质提取试剂盒购自美国Pierce公司。Beclin1抗体购自上海Abcam公司。LC3Ⅱ抗体购自美国Sigma公司。p62抗体购自美国BD bioscience公司。兔抗多克隆抗体购自美国Cell Signaling公司。羊抗兔二抗抗体购自美国Proteintech公司。ECL发光试剂盒购自上海碧云天公司。Trizol购自法国Transgene公司。逆转录试剂盒和2×SYBR试剂盒购自日本Takara公司。
1.2 免疫组织化学法4%多聚甲醛常规灌注固定,取材置于20%蔗糖溶液4℃中固定过夜。放入包埋盒,脱水透明处理,然后石腊浸腊2次,制作包埋块,切片与贴片后进行脱蜡,抗原修复,3%H2O2灭活内源性过氧化氢酶,10%羊血清、4℃过夜封闭,一抗4℃孵育过夜,TBST洗膜,二抗37℃孵育1 h,洗膜,滴加DAB显色液显色,苏木精复染,脱水透明,中性树胶封固,拍照。
1.3 Western blot检测冷PBS洗2遍,加入细胞裂解液,组织破碎仪破碎,4℃下2 000 r/min离心,20 min,取上清,提取细胞总浓度,BCA法测蛋白浓度,取20 μg样品煮沸变性,然后进行Tricine-SDS-PAGE电泳,转膜,5%脱脂奶粉37℃封闭2 h,一抗4℃孵育过夜,TBST洗膜,二抗37℃孵育1 h,洗膜,ECL显色,分析条带灰度值,以目的条带与β-actin调对灰度比值来表示蛋白质表达量。
1.4 RT-qPCR检测自噬相关蛋白mRNA分子表达采用RNA提取试剂盒抽提组织中RNA,检测RNA浓度,使用反转录试剂盒将RNA反转录为cDNA,经过染色后进行荧光实时定量PCR反应。PCR反应:95℃ 30 s,60℃ 30 s,40个循环。Beclin1正向引物为5′-TACCACAGCCCAGGCGAAAC-3′,反向引物为5′-CCAGTGACCTTCAGTCTTCGGC-3′;LC3Ⅱ正向引物为5′-TCAGACCGGCCTTTCAAGCA-3′,反向引物为5′-CTCGATGATCACCGGGATTTTG-3′;p62正向引物为5′-TTCCAGCACAGAGGAGAAGAGC-3′,反向引物为5′-GATTCTGGCATCTGTAGGGACTG-3′;GAPDH正向引物为5′-TGAAGGTCGGAGTCAACGGAT-3′,反向引物为5′-CCTGGAAGATGGTGATGGGAT-3′。以GAPDH作为内参。
1.5 统计学分析采用SPSS 25.0软件分析数据。计量资料以均数±标准差(x±s)表示。组间比较采用t检验。蛋白阳性表达在EGFR-S组和EGFR-R组的差异用χ2检验(或Fisher精确检验)。采用Spearman相关分析评估自噬相关蛋白表达与EGFR耐药的相关性。以P < 0.05为差异具有统计学意义。
2 结果 2.1 自噬相关蛋白在EGFR-S组与EGFR-R组中的表达情况免疫组织化学法检测发现,与EGFR-S组比较,自噬相关蛋白Beclin1和LC3Ⅱ在EGFR-R组中表达更低;p62在EGFR-R组中表达更高(图 1)。在EGFR-S组和EGFR-R组中,Beclin1阳性表达率分别为92.5%(37/40)和12.5%(5/40),LC3Ⅱ阳性表达率分别为95.0%(38/40)和15.0%(6/40),自噬负性相关蛋白p62阳性表达率分别为5.0%(2/40)和90.0%(36/40),差异均具有统计学意义(均P<0.01,表 1)。

|
| 图 1 免疫组织化学法检测自噬相关蛋白Beclin1、LC3Ⅱ和p62在EGFR-S组和EGFR-R组中的表达(HE×200) Fig.1 Immunohistochemisty detecting the expression of autophagy-related proteins in the EGFR-S and EGFR-R groups(HE×200) |
| 检测蛋白 | 总例数 | EGFR-S组 (n=40) |
EGFR-R组 (n=40) |
P值 |
| Beclin1 | ||||
| -~+ | 38 | 3(7.5) | 35(87.5) | <0.01 |
| ++~+++ | 42 | 37(92.5) | 5(12.5) | |
| LC3Ⅱ | ||||
| -~+ | 36 | 2(5.0) | 34(85.0) | <0.01 |
| ++~+++ | 44 | 38(95.0) | 6(15.0) | |
| p62 | ||||
| -~+ | 42 | 38(95.0) | 4(10.0) | <0.01 |
| ++~+++ | 38 | 2(5.0) | 36(90.0) | |
Western blot检测EGFR敏感及耐药肺腺癌患者组织中自噬相关蛋白的表达发现,EGFR-R组较EGFR-S组Beclin1蛋白质表达下调为(0.23±0.09);LC3Ⅱ蛋白表达下调为(0.39±0.15);自噬负性相关蛋白p62蛋白表达上调为(2.76±0.21)倍,差异均具有统计学意义(均P<0.05,图 2)。
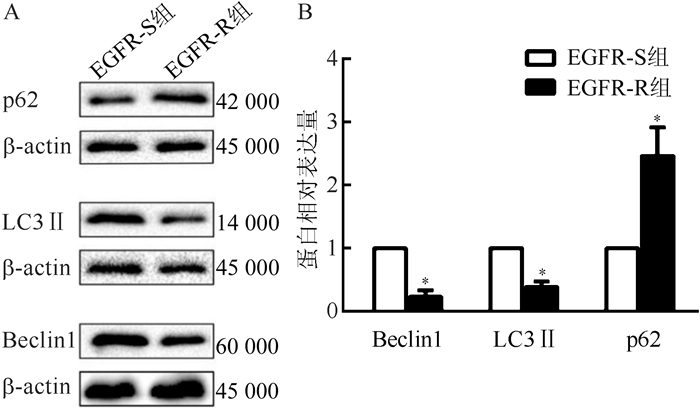
|
| 注 A:采用Western blot检测Beclinl、LC3Ⅱ和p62蛋白表达; B:QuanlityOne软件半定量分析Beclinl、LC3Ⅱ和p62蛋白表达倍数变化; *与EGFR-S组比较,P < 0.05 图 2 Western blot检测自噬相关蛋白Beclin1、LC3Ⅱ和p62在EGFR-S组和EGFR-R组中的表达 Fig.2 Western blot detecting the expression of autophagy-related proteins in the EGFR-S and EGFR-R groups |
EGFR-R组较EGFR-S组Beclin1 mRNA表达下调为(0.55±0.65),LC3 Ⅱ mRNA表达下调(0.54± 0.43),p62 mRNA表达上调(2.54±0.86),差异均具有统计学意义(均P<0.05,图 3)。
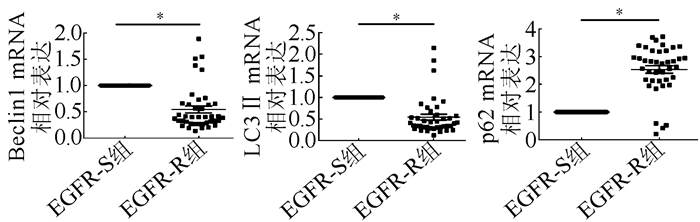
|
| 注 *P < 0.05 图 3 RT-qPCR检测Beclin1、LC3Ⅱ和P62 mRNA在EGFR-S和EGFR-R组中的表达 Fig.3 Expression of autophagy-related proteins in the EGFR-S and EGFR-R groups detected by RT-qPCR |
应用Spearman相关分析表明,通过免疫组织化学法检测自噬相关蛋白,EGFR耐药与Beclin1(r=-0.723, P < 0.01)、LC3Ⅱ(r= -0.705, P < 0.01)呈负相关,与p62呈正相关(r=0.742, P < 0.01);通过RT-PCR检测自噬相关蛋白mRNA,EGFR耐药与Beclin1(r= -0.462, P < 0.01)、LC3Ⅱ(r= -0.417, P < 0.01)呈低度负相关,与p62呈低度正相关(r=0.460, P < 0.01)。
3 讨论随着分子靶向药物的出现,以EGFR为靶点的EGFR-TKI为晚期NSCLC患者的治疗带来希望[3-4]。但是,不同个体对于EGFR-TKI疗效差异很大,而且无论其短期疗效如何,几乎所有的患者最终都不可避免地出现EGFR-TKI耐药和疾病进展[5-6]。因此,寻找可预测EGFR-TKI耐药的标志物将有助于筛选适合应用EGFR-TKI治疗的NSCLC患者。目前临床上对EGFR突变的检测是对吉非替尼疗效和是否出现耐药有力的预测手段。EGFR突变与吉非替尼的疗效具有相关性,EGFR突变使EGFR活性增加,下游增殖通路激活。其中外显子19缺失和21点突变是最常见的EGFR突变类型[7-8]。EGFR耐药机制非常复杂,最主要机制是T790M突变,占50%~60%,其他机制包括人类表皮生长因子受体2(epidermal growth factor receptor 2,HER2)扩增、c-Met扩增和磷脂酰肌醇-3-激酶催化亚基α(phosphatidylinositol 3-kinase catalytic subunit α,PIK3CA)突变[9]。
自噬是细胞内受损、变性或衰老的蛋白质和细胞器运输到溶酶体,被溶酶体消化降解的细胞自我消化过程。近年来因自噬异常与肿瘤的能量代谢、细胞死亡及抗癌治疗的反应相联系而受到广泛关注[9-10]。自噬过程复杂多样,通过多种自噬相关基因表达来调节不同的细胞信号通路。Beclin1、LC3Ⅱ和p62是自噬的重要标志蛋白,参与自噬相关信号通路调控自噬水平。其中,Beclin1和LC3Ⅱ参与自噬的起始阶段,激活多种细胞信号通路而上调自噬;而p62可以下调自噬,其表达与自噬水平呈负相关[11-12]。自噬与EGFR-TKI的耐药密切相关,但目前的观点存在极大分歧。本研究结果显示,在对EGFR敏感的肺腺癌组织中,自噬正性相关蛋白Beclin1和LC3Ⅱ蛋白及其mRNA高表达,负性相关蛋白p62及其mRNA低表达;而在EGFR耐药的肺腺癌组织中,表达却成相反趋势。表明在对EGFR-TKI敏感的NSCLC组织中自噬处于高表达水平,而出现耐药的组织中自噬处于低表达水平。并通过相关性分析发现,自噬表达水平与EGFR耐药的出现呈现负性相关。激活与自噬相关的PI3K/Akt和mTOR信号通路后下调细胞自噬水平,能够造成EGFR-TKI耐药的产生[13]。在使用雷帕霉素上调自噬水平后,EGFR-TKI的抗癌作用明显增强[14]。但也有研究则持相反观点,即激活自噬,能够减弱EGFR-TKI的药效,引起耐药[15]。另外,也有观点表示自噬对EGFR-TKI的耐药影响有双重作用,这取决于肿瘤的类型[12]。
有学者认为,自噬对EGFR-TKI的作用取决于自噬水平,当自噬低水平时,对肿瘤细胞起到保护作用,帮助细胞清除残骸而促进其生长,引起耐药;当自噬达到高水平时,能够诱导肿瘤细胞凋亡,提高EGFR-TKI的敏感性,增强药物疗效[16-17]。该观点与本研究结果一致。可见,自噬水平的低下可能与EGFR-TKI耐药的出现密切相关。自噬相关蛋白及其mRNA的表达水平高低可能可以作为肺腺癌患者对EGFR-TKI是否敏感的预测分子,但这也有待进一步大量研究样本的证实。
综上所述,自噬在EGFR-TKI耐药的肺腺癌组织中处于低水平表达,自噬表达水平与EGFR-TKI耐药的出现呈负性相关。可见细胞自噬水平的变化与EGFR-TKI的耐药有着密切的关系。但其具体机制尚不清楚,仍有待于进一步研究。
| [1] |
Kenific CM, Debnath J. Cellular and metabolic functions for autophagy in cancer cells[J]. Trends Cell Biol, 2015, 25(1): 37-45. DOI:10.1016/j.tcb.2014.09.001 |
| [2] |
Liu Z, He K, Ma Q, et al. Autophagy inhibitor facilitates gefitinib sensitivity in vitro and in vivo by activating mitochondrial apoptosis in triple negative breast cancer[J]. PLoS One, 2017, 12(5): e0177694. DOI:10.1371/journal.pone.0177694 |
| [3] |
Ramalingam SS, Owonikoko TK, Khuri FR. Lung cancer:New biological insights and recent therapeutic advances[J]. CA Cancer J Clin, 2011, 61(2): 91-112. DOI:10.3322/caac.20102 |
| [4] |
Cataldo VD, Gibbons DL, Pérez-Soler R, et al. Treatment of non-small-cell lung cancer with erlotinib or gefitinib[J]. N Engl J Med, 2011, 364(10): 947-955. DOI:10.1056/NEJMct0807960 |
| [5] |
Gainor JF, Shaw AT. Emerging paradigms in the development of resistance to tyrosine kinase inhibitors in lung cancer[J]. J Clin Oncol, 2013, 31(31): 3987-3996. DOI:10.1200/JCO.2012.45.2029 |
| [6] |
Wheeler DL, Dunn EF, Harari PM. Understanding resistance to EGFR inhibitors-impact on future treatment strategies[J]. Nat Rev Clin Oncol, 2010, 7(9): 493-507. DOI:10.1038/nrclinonc.2010.97 |
| [7] |
Rosell R, Moran T, Queralt C, et al. Screening for epidermal growth factor receptor mutations in lung cancer[J]. N Engl J Med, 2009, 361(10): 958-967. DOI:10.1056/NEJMoa0904554 |
| [8] |
Tanaka T, Matsuoka M, Sutani A, et al. Frequency of and variables associated with the EGFR mutation and its subtypes[J]. Int J Cancer, 2010, 126(3): 651-655. DOI:10.1002/ijc.24746 |
| [9] |
Scott RC, Juh sz G, Neufeld TP. Direct induction of autophagy by Atg1 inhibits cell growth and induces apoptotic cell death[J]. Curr Biol, 2007, 17(1): 1-11. DOI:10.1016/j.cub.2006.10.053 |
| [10] |
Chen T, Stephens PA, Middleton FK, et al. Targeting the S and G2 checkpoint to treat cancer[J]. Drug Discov Today, 2012, 17(5/6): 194-202. |
| [11] |
何沛敏, 童欣, 李冠武. EGFR抑制剂耐药拮抗策略在非小细胞肺癌治疗中的进展[J]. 汕头大学学报:自然科学版, 2019, 34(2): 62-70. |
| [12] |
Sun Q, Fan W, Zhong Q, et al. Regulation of Beclin1 in autophagy[J]. Autophagy, 2009, 5(5): 713-716. DOI:10.4161/auto.5.5.8524 |
| [13] |
Bjornsti MA, Houghton PJ. The TOR pathway:a target for cancer therapy[J]. Nat Rev Cancer, 2004, 4(5): 335-348. DOI:10.1038/nrc1362 |
| [14] |
Fung C, Chen X, Grandis JR, et al. EGFR tyrosine kinase inhibition induces autophagy in cancer cells[J]. Cancer Biol Ther, 2012, 13(14): 1417-1424. DOI:10.4161/cbt.22002 |
| [15] |
Han W, Pan H, Chen Y, et al. EGFR tyrosine kinase inhibitors activate autophagy as a cytoprotective response in human lung cancer cells[J]. PLoS One, 2011, 6(6): e18691. DOI:10.1371/journal.pone.0018691 |
| [16] |
Tang Z, Hu B, Zang F, et al. Nrf2 drives oxidative stress-induced autophagy in nucleus pulposus cells via a Keap1/Nrf2/p62 feedback loop to protect intervertebral disc from degeneration[J]. Cell Death Dis, 2019, 10(7): 510. DOI:10.1038/s41419-019-1701-3 |
| [17] |
叶侠栋, 吴凤英, 任涛. 非小细胞肺癌EGFR-TKI耐药后的治疗策略[J]. 实用肿瘤杂志, 2017, 32(3): 204-207. |
 2019, Vol. 34
2019, Vol. 34


