文章信息
- 李委佳, 贾朝阳, 冯书君, 刘巍, 张顺今, 王瑞雪, 谭文华
- Li Weijia, Jia Zhaoyang, Feng Shujun, Liu Wei, Zhang Shunjin, Wang Ruixue, Tan Wenhua
- NDRG4通过Wnt/β-catenin信号转导通路抑制卵巢癌细胞的迁移和侵袭能力
- NDRG4 inhibits ovarian cancer cell migration and invasion via Wnt/β-catenin signaling pathway
- 实用肿瘤杂志, 2019, 34(6): 497-502
- Journal of Practical Oncology, 2019, 34(6): 497-502
基金项目
- 黑龙江省卫生计生委科研课题(2016-059)
-
作者简介
- 李委佳(1983-), 女, 黑龙江哈尔滨人, 主治医师, 硕士生, 从事卵巢癌基础与临床研究.
-
通信作者
- 谭文华, E-mail:tanwenhua1962@126.com
-
文章历史
- 收稿日期:2018-10-11
N-myc downstream regulated gene 4(NDRG4)是NDRG家族中的一员,位于染色体16q21-q22.3,在乳腺癌、结肠癌、肝癌和胃癌等癌症中,NDRG4被认为可以参与癌症的增殖、凋亡、迁移、侵袭和应激反应等生物学过程,具有抑癌效果。在前期实验中,本课题组发现在卵巢癌组织中NDRG4的表达水平低于正常卵巢组织,并与患者的病理分化、国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期和预后水平相关[1]。基于此研究结果,本研究构建可以上调NDRG4表达的pcDNA3.1质粒,用以观察改变了NDRG4表达后对卵巢癌迁移、侵袭和上皮间质转化(epithelial-mesenchymal transition,EMT)等能力的影响,评价NDRG4在卵巢癌发生和发展中发挥的生物学作用。
1 材料与方法 1.1 材料人卵巢癌细胞株SKOV3源自于黑龙江转化医学中心馈赠,胎牛血清购自于杭州四季青公司,RPMI-1640培养液购自美国Hyclone公司,细胞消化胰酶、BCA试剂盒购自上海市碧云天公司,OPTI-MEM和转染试剂Lipo2000购自美国Invitrogen公司,NDRG4、E-cadherin、N-cadherin和Vimentin抗兔克隆单抗购自美国Cell Signaling Technology公司,β-actin抗鼠克隆单抗购自北京中杉金桥公司,羊抗鼠IRDyeTM800二抗和羊抗鼠IRDyeTM800二抗购自美国Rockland公司, PDVF膜购自美国Millipore公司,transwell小室购自美国Corning公司。
1.2 细胞培养人卵巢癌细胞株SKOV3细胞使用含10%胎牛血清及1%双抗的RPMI-1640培养液进行细胞传代培养,在含有5%CO2的37℃细胞孵箱内培养,细胞融合度达到80%时行细胞传代。
1.3 细胞转染用于上调NDRG4表达的pcDNA3.1质粒由广州赛业公司构建,无意义序列质粒为空白质粒组。将SKOV3细胞按1×105个/孔的密度种植于6孔板上,37℃细胞孵箱内常规培养至细胞融合度60%时进行细胞转染,将8 μg上调NDRG4表达的pcDNA3.1质粒(pcDNA3.1-NDRG4质粒组)或8 μg无意义空白序列质粒(空白质粒组)与Opti-MEM混合,转染试剂Lipo2000与Opti-MEM混合,静止5 min后将2种混合物混匀,再次静止20 min后加入不含血清的RPMI-1640培养液中,6 h后更换培养液为不含双抗的10%胎牛血清的PRMI-1640培养液,转染72 h后提取蛋白进行Western blot试验,检测转染结果。所有实验均重复3次。
1.4 定量即时聚合酶链锁反应实验(quantitative real time polymerase chain reaction,qRT-PCR)SKOV3细胞转染48 h后加入1 mL Trizol研磨至完全溶解,按实验步骤提取组织RNA后于分光光度计测量RNA浓度,调节RNA浓度至200~500 ng/μL,RNA纯度A260 nm/A280 nm为1.8~2.0时可进行下一步实验。按试剂盒要求分别加入5×扩增缓冲液、聚合酶、引物和RNA进行反转录,反转录条件为37℃ 5 min、95℃ 15 min以及4℃低温循环。cDNA置于-20℃保存。qRT-PCR反应体系按SYBR qPCR Mix试剂说明书(TOYOBO公司, 日本)配置。用于qRT-PCR实验的NDRG4正向引物为5′-GGCCTCAACCACAAACTATGC-3′, 反向引物为5′- CCAATCACATACTTGAACCCGAA-3′。用作内参的GAPRH正向引物为5′-CATGTTCGTCATGGGTGTGAACCA-3′, 反向引物为5′-AGTGATGGCATGGACTGTGGTCAT-3′。2-ΔΔct法计算qRT-PCR结果,比较pcDNA3.1-NDRG4转染组和空白质粒组中目标RNA的表达差异。所有实验均重复3次。
1.5 Transwell小室实验检测细胞迁移能力时应用不含Matrigel基质胶的transwell小室,检测细胞侵袭能力时应用含Matrigel基质胶的transwell小室。铺胶时将Matrigel基质胶应用RPMI-1640培养液按1 :8的浓度稀释后均匀铺在transwell小室内,37℃细胞培养箱内无菌孵育6 h,将转染后的SKOV3细胞消化后,用不含血清的RPMI-1640培养液充分悬浮,以5×104个/孔的浓度加入transwell小室上室,下室内加入含有10%FBS的RPMI-1640培养液600 μL,置于含有5%CO2的细胞孵箱内培养48 h。冷甲醇固定30 min后对小室进行苏木精和伊红染料染色。棉签轻柔擦去上室细胞,倒置显微镜下随机选取5个视野进行拍照,计算进入下室的细胞数目。所有实验均重复3次。
1.6 Western blot实验RIPA蛋白裂解液裂解提取pcDNA3.1-NDRG4转染组和空白质粒组细胞蛋白,BCA试剂盒测定蛋白的浓度,计算后混入上样缓冲液,100℃加热变性。处理后蛋白样按每组80 μg浓度,进行10%的SDS-PAGE凝胶电泳后,半转至PVDF膜上。羊奶粉封闭PVDF膜2 h后,4℃一抗孵育过夜。一抗浓度分别为:兔抗人NDRG4单克隆一抗1 :800,兔抗人E-cadherin单克隆一抗1 :500,兔抗人N-cadherin单克隆一抗1 :500,兔抗人Vimentin单克隆一抗1 :1 000,兔抗人p21单克隆一抗1 :1 000,兔抗人c-myc单克隆一抗1 :1 000,鼠抗人β-actin单克隆一抗1 :1 000。于TBST漂洗PVDF膜后,置于室温下避光孵育二抗(1 :10 000)1 h,再次用TBST漂洗,并用化学发光法检测目的蛋白的强度。所有实验均重复3次。
1.7 统计学分析采用SPSS 22.0软件进行数据分析。计量资料采用均数±标准差(x±s)表示。多组间均数比较采用单因素方差分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 pcDNA3.1-NDRG4可以上调SKOV3细胞中的表达水平将NDRG4与pcDNA3.1连接后测序正确并成功连接到pcDNA 3.1载体。pcDNA3.1-NDRG4质粒组SKOV3细胞转染pcDNA3.1-NDRG4质粒,空白质粒组细胞转染pcDNA3.1空白质粒。转染48 h后应用qRT-PCR法及转染72 h后应用Western blot法检测细胞内NDRG4的表达情况显示,pcDNA3.1-NDRG4质粒组细胞内NDRG4 mRNA和蛋白表达水平均较空白质粒组上调(P=0.007,P=0.025;图 1~2)。
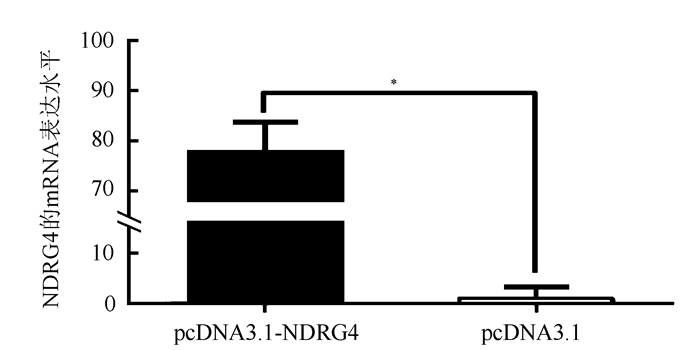
|
| 注 *P < 0.01 图 1 pcDNA3.1-NDRG4质粒组和空白质粒组转染48 h后卵巢癌SKOV3细胞中NDRG4的mRNA表达水平 Fig.1 mRNA expression level of NDRG4 in ovarian cancer SKOV3 cells after 48 h transfection in pcDNA3.1-NDRG4 plasmid group and blank plasmid group |
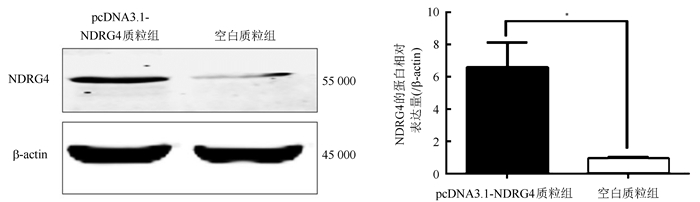
|
| 注 *P < 0.05 图 2 pcDNA3.1-NDRG4质粒组和空白质粒组转染72 h后卵巢癌SKOV3细胞中NDRG4的蛋白表达水平 Fig.2 Protein expression of NDRG4 in ovarian cancer SKOV3 cells after 72 h transfection in pcDNA3.1-NDRG4 plasmid group and blank plasmid group |
Transwell小室实验检测NDRG4对卵巢癌细胞迁移能力的影响。转染48 h后,pcDNA3.1-NDRG4质粒组进入下室的细胞数为(87.23±5.33)个,而空白质粒组为(135.93±8.67)个(P=0.006,图 3)。上调NDRG4表达抑制卵巢癌细胞的迁移能力。
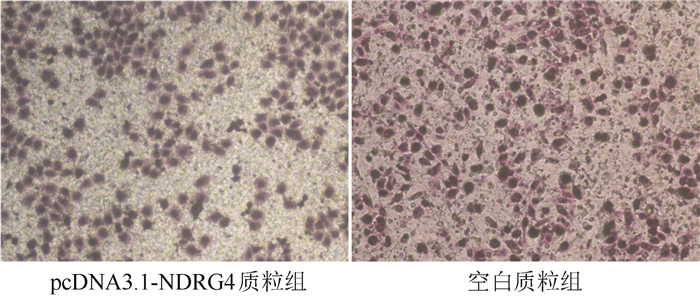
|
| 图 3 pcDNA3.1-NDRG4质粒转染48 h抑制卵巢癌SKOV3细胞的迁移能力(×100) Fig.3 The migration ability of SKOV3 cells was inhibited after 48 h transfection of pcDNA3.1-NDRG4 plasmid (×100) |
含基质胶的transwell小室实验检测NDRG4对卵巢癌SKOV3细胞侵袭能力的影响。转染48 h后,pcDNA3.1-NDRG4质粒组进入下室的细胞数为(61.81±7.12)个,空白质粒组为(103.34±9.82)个(P=0.023,图 4)。上调NDRG4的表达可以抑制卵巢癌SKOV3细胞的侵袭能力。
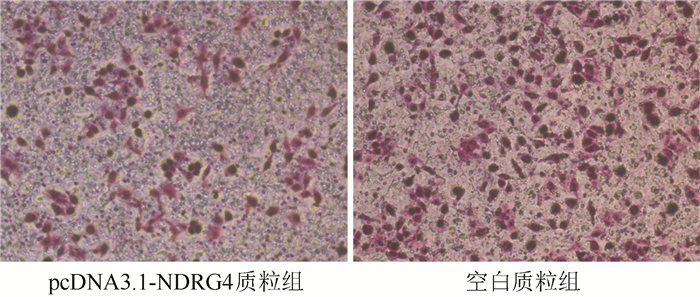
|
| 图 4 pcDNA3.1-NDRG4转染48 h抑制卵巢癌SKOV3细胞的侵袭能力(×100) Fig.4 The invasion ability of SKOV3 cells was inhibited after 48 h transfection of pcDNA3.1-NDRG4 plasmid (×100) |
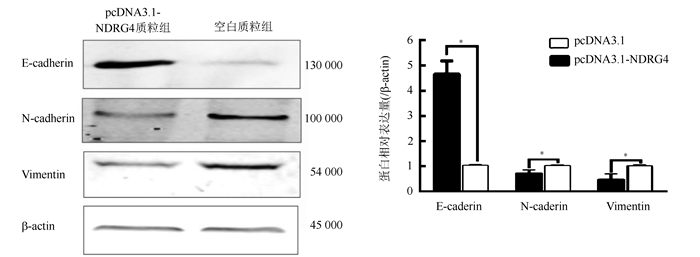
Western blot法检测pcDNA3.1-NDRG4质粒组和空白质粒组中卵巢癌SKOV3细胞EMT过程相关蛋白E-cadherin、Vimentin和N-cadherin的表达水平。转染72 h后提取蛋白,与空白质粒组比较,pcDNA3.1-NDRG4质粒组中E-cadherin蛋白表达水平上升(P=0.023),而Vimentin和N-cadherin表达水平均下调(P=0.013,P=0.021;图 5)。上调NDGR4的表达后可以抑制卵巢癌SKOV3细胞EMT过程。
|
| 注 *P < 0.05 图 5 Western blot法检测pcDNA3.1-NDRG4转染72 h后卵巢癌SKOV3细胞中的EMT相关蛋白的表达水平 Fig.5 Western blot analysis of epithelial-mesenchymal transition related protein expression in ovarian cancer SKOV3 cells after 72 h transfection of pcDNA3.1-NDRG4 plasmid |
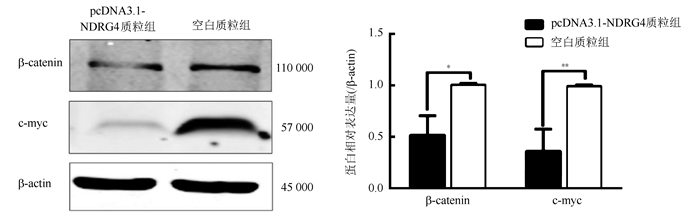
Western blot法检测Wnt/β-catenin信号通路相关蛋白β-catenin和c-myc的表达水平。转染72 h后,与空白质粒组比较,pcDNA3.1-NDRG4质粒组中β-catenin和c-myc蛋白的表达水平均下调(P=0.035, P=0.006;图 6)。上调NDGR4表达抑制卵巢癌SKOV3细胞中Wnt/β-catenin细胞信号转导通路的活性。
|
| 注 *P < 0.05;**P < 0.01 图 6 Western blot法检测pcDNA3.1-NDRG4转染72 h后卵巢癌SKOV3细胞Wnt/β-catenin信号通路相关蛋白的表达水平 Fig.6 Western blot analysis of Wnt/β-catenin pathway related protein expressions in ovarian cancer SKOV3 cells after 72 h transfection of pcDNA3.1-NDRG4 plasmid |
卵巢癌是女性病死率最高的恶性肿瘤之一,在女性肿瘤死亡原因中居于第5位[2],具有发病隐匿、高转移性和治疗后易发生化疗耐药的特点。尽管手术联合化疗辅以放疗的治疗方案在临床上已经得到广泛推广,但是卵巢癌患者的5年生存率仍 < 30%。
NDRG4在多种癌症中被认为发挥抑癌效果,包括结肠癌、胃癌和淋巴癌等[3-5]。本课题组在前期研究中发现,NDRG4在卵巢癌组织中的表达水平低于正常卵巢组织,NDRG4的表达水平与患者的预后不良和化疗耐药呈负相关[1]。本研究进一步讨论NDRG4与卵巢癌侵袭和转移之间的相互关系及发挥该作用的分子生物学机制。肿瘤细胞的迁移和转移是癌症转移最重要的因素之一,是指原发部位的肿瘤细胞脱离原发部位,通过侵袭、细胞外基质降解和血管生成等过程进入血管和淋巴管等,随着体液循环,到达身体的其他部位,而后转移出血管,在该部位定植并长出继发性肿瘤的全过程[6-7]。本研究应用transwell小室实验在上调NDGR4表达水平的卵巢癌细胞中检测细胞的迁移和侵袭能力,结果证明NDRG4的表达水平越高,卵巢癌细胞的迁移和侵袭能力越低。EMT是一种经典的癌症转移参与机制,是指具有极性的上皮细胞转化为运动性较强的间质细胞的过程[8],被认为是促进肿瘤迁移和侵袭的最重要机制之一。本研究显示,上调NDRG4的表达后,卵巢癌细胞中EMT过程受到抑制,提示NDRG4具有抑制卵巢癌迁移和侵袭能力的作用,并通过调节EMT过程发挥这种生物学功能。
Wnt家族参与≥3条细胞信号转导通路,包括经典Wnt/β-catenin细胞信号通路、平板细胞极性信号通路和Wnt/Ca2+细胞信号通路[9]。经典Wnt/β-catenin细胞信号转导通路是目前公认的癌症发生和发展的重要机制之一。当经典Wnt/β-catenin细胞信号转导通路激活后,Wnt分泌蛋白穿过细胞膜,使GSK-3β/APC/Axin/CKIα复合体降解,从而终止该复合物对β-catenin的磷酸化作用,导致细胞质中β-catenin堆积,当β-catenin堆积达到一定水平时,将会转移至细胞核内,与转录因子T细胞因子(T cell factor, TCF)/淋巴样增强子结合因子(lymphoid enhancer-binding factor,LEF)结合,形成转录复合物,从而激活其下游的靶基因MMPs、p21和c-myc等[10-12]。经典Wnt细胞信号通路被认为是影响癌细胞的迁移和侵袭能力的关键细胞信号通路之一。本研究显示,上调NDRG4表达后卵巢癌细胞中的Wnt/β-catenin细胞信号通路的活性下调,说明NDRG4对卵巢癌迁移和侵袭能力的影响是通过影响Wnt/β-catenin信号通路实现的。Liu等[13]研究显示,NDRG家族成员NDRG1可以通过靶向低密度脂蛋白受体相关蛋白6(low-density lipoprotein receptor related protein 6, LRP6)的表达影响Wnt/β-catenin信号通路的活性。这说明NDRG家族成员对Wnt/β-catenin信号通路的影响可能是通过不同途径进行的。NDRG4激活Wnt细胞信号通路的具体机制是下一步的研究目标。
综上所述,NDRG4蛋白可能通过抑制Wnt/β-catenin细胞信号通路的活性影响卵巢癌细胞中EMT的过程,从而抑制卵巢癌细胞的迁移和侵袭。本研究揭示NDRG4对卵巢癌发生和发展的抑制作用,但是深入的分子生物学机制则有待进一步研究,从而为卵巢癌免疫治疗和靶向治疗提供新的理论基础和研究思路。
| [1] |
曹雪娇, 董丽娜, 谭文华, 等. NDRG4在卵巢癌中的表达[J]. 哈尔滨医科大学学报, 2017, 5(51): 434-437. |
| [2] |
Jemal A, Siegel R, Xu J, et al. Cancer statistics[J]. CA Cancer J Clin, 2010, 60(13): 277-300. |
| [3] |
Hong Q, Chen X, Ye H, et al. Chemotherapy-induced hypomethylation of N-myc downstream-regulated gene 4 in the bone marrow of patients with acute myeloid leukemia[J]. Oncol Lett, 2017, 13(5): 3309-3313. DOI:10.3892/ol.2017.5839 |
| [4] |
Zhang Z, She J, Yang J, et al. NDRG4 in gastric cancer determines tumor cell proliferation and clinical outcome[J]. Mol Carcinog, 2018, 57(6): 762-771. DOI:10.1002/mc.22798 |
| [5] |
Park SK, Baek HL, Yu J, et al. Is methylation analysis of SFRP2, TFPI2, NDRG4, and BMP3 promoters suitable for colorectal cancer screening in the Korean population?[J]. Intest Res, 2017, 15(4): 495-501. DOI:10.5217/ir.2017.15.4.495 |
| [6] |
丁祥黎, 龚泉, 颜汝平, 等. lncRNA在调控膀胱癌上皮-间质转化中作用的研究进展[J]. 实用肿瘤杂志, 2017, 32(3): 275-278. |
| [7] |
Srivastava SK, Ahmad A, Zubair H, et al. MicroRNAs in gynecological cancers:Small molecules with big implications[J]. Cancer Lett, 2017, 28(407): 123-138. |
| [8] |
Bilyk O, Coatham M, Jewer M, et al. Epithelial-to-mesenchymal transition in the female reproductive tract:from normal functioning to disease pathology[J]. Front Oncol, 2017, 5(7): 145. |
| [9] |
Cui C, Zhou X, Zhang W, et al. Is β-catenin a druggable target for cancer therapy?[J]. Frends Biochem Sci, 2018, 43(8): 623-634. DOI:10.1016/j.tibs.2018.06.003 |
| [10] |
Wiese KE, Nusse R, Van Amerongen R. Wnt signalling:conquering complexity[J]. Development, 2018, 145(12): 456-461. |
| [11] |
Tai D, Wells K, Arcaroli J, et al. Targeting the WNT signaling pathway in cancer therapeutics[J]. Oncologist, 2015, 20(10): 1189-1198. DOI:10.1634/theoncologist.2015-0057 |
| [12] |
杨坚, 阿不都吉力力. β-catenin及c-myc在食管癌中的表达及临床病理意义[J]. 实用肿瘤杂志, 2017, 32(2): 152-156. |
| [13] |
Liu W, Xing F, Iiizumi-Gairani M, et al. N-myc downstream regulated gene 1 modulates Wnt-β-catenin signalling and pleiotropically suppresses metastasis[J]. EMBO Mol Med, 2012, 4(2): 93-108. DOI:10.1002/emmm.201100190 |
 2019, Vol. 34
2019, Vol. 34


