文章信息
- 钱玥, 饶良懿
- QIAN Yue, RAO Liangyi
- 盐碱胁迫对枸杞幼苗生长与叶绿素荧光特性的影响
- Effects of saline-alkali stress on the growth and chlorophyll fluorescence characteristics of Lycium barbarum seedlings
- 森林与环境学报,2022, 42(3): 271-278.
- Journal of Forest and Environment,2022, 42(3): 271-278.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2022.03.006
-
文章历史
- 收稿日期: 2021-12-12
- 修回日期: 2022-03-25
2. 林业生态工程教育部工程研究中心, 北京 100083
2. Engineering Research Center of the Ministry of Education of Forestry Ecological Engineering, Beijing 100083, China
土壤盐碱化是当今世界面临的严重的生态环境问题之一,受不合理的灌溉措施等人类开发利用活动的影响,我国土壤盐碱化问题日益突出。内蒙古河套平原位于我国西北干旱半干旱区,是该地最主要的农区与生态脆弱区,灌区土壤次生盐碱化严重,导致耕地产能减弱,成为制约当地社会经济发展的突出问题。盐碱地土壤含盐量高,而较高的土壤溶液浓度抑制了植物吸收水分和养分的能力,严重影响了植物的正常生长[1]。当土壤处于中等盐碱化水平时,农作物会减产95%左右,重度盐碱地的作物收获形势更加严峻。在内蒙古河套平原土壤盐碱化地区,农作物死亡比例平均每年达到了20%以上,最严重的年份甚至高达30%[2]。
光合作用是植物生长发育的生理基础,作物产量很大程度上取决于光合效率的高低。当植物光合作用受到抑制时,叶绿体光系统Ⅱ (photosystem Ⅱ, PSⅡ) 是最先受到影响的[3]。PSⅡ的变化能较好地反映光合能力受胁迫的程度,了解PSⅡ在胁迫下的调节机制可较为有效地反映植物在逆境下的生存策略[4]。其中,叶绿素荧光参数的变化以一种快速、非侵入的方式发现各种胁迫条件下不同植物光合能力的变化[5]。因此,叶绿素荧光动力学技术被称为研究植物光合生理状况及植物与逆境胁迫关系的理想探针[6]。目前,有关盐碱胁迫对植物荧光特性的影响的研究主要集中在一些常规叶绿素荧光参数上,但很少研究涉及到类囊体质子动力势(proton motive force, PMF) 在遭受胁迫时如何变化响应。有研究表明,在叶绿体中,类囊体质子动力势的形成是三磷酸腺苷(adenosine triphosphate, ATP) 合成和防止光合机构发生光抑制现象的关键[7]。
枸杞(Lycium barbarum L.) 是茄科(Solanaceae) 枸杞属(Lycium) 的落叶灌木,主要分布在宁夏、新疆、甘肃和青海等地,高1.5 m左右,主茎粗壮,分枝较密,人工栽培历史悠久,其果实枸杞子为名贵中药材,是较耐盐的植物。目前,关于枸杞耐盐碱性的研究多集中于盐碱胁迫对其外部形态、生长指标[8-9]、生理特性[10]及光合作用[11-12]等方面的影响,只有少数研究涉及了盐碱胁迫下枸杞的一些较为常规的叶绿素荧光参数的变化[13-14],而盐碱胁迫下枸杞类囊体质子动力势特性的响应研究鲜见报道。鉴于此,本研究选择宁夏枸杞1号为研究对象,通过室内模拟试验,研究枸杞在不同盐碱强度、不同时长胁迫下的生长状况、PMF及叶绿素荧光参数[包括PSⅡ最大光化学量子产量(Fv/Fm)、PSⅡ光反应中心开放数目(qL)、非光化学猝灭系数(qN)等指标] 的变化,尤其是PMF的变化特征,为进一步阐明枸杞的耐盐碱机理提供理论依据。
1 材料与方法 1.1 供试材料盐碱土土样采集于内蒙古自治区巴彦淖尔市乌拉特前旗乌梁素海流域附近的一处盐碱弃耕地(108°43′E,40°46′N),采集0~20 cm土层的土样作为供试土壤。该地属于典型的温带大陆性气候,光热资源丰富,昼夜温差大,雨水集中,雨热同期。由于该地处于河套灌区下游,受地下水位、气候条件和灌溉方式等影响,土壤盐渍化和次生盐渍化问题突出。试验土壤pH值8.31,质量含水量15.01%,土壤容重1.58 g · cm-3,平均电导率178.60 mS · m-1。
试验在北京林业大学三顷园苗圃进行,所选植物为人工栽植于花盆内的宁夏枸杞1号3年生成苗,平均株高50 cm,地径5.3 mm。花盆口内直径22 cm,外直径29 cm,高23 cm;花盆内土深13 cm,埋根深度10 cm,培养基质为购买的专业营养土和采集的盐碱土。为保证作物的正常生长,予以一般性浇水和管理。
1.2 试验设计设置3个处理组,按照土壤基质的比例设定不同的盐碱强度,分为完全营养土组(CK)、一半盐碱土一半营养土的半盐碱土组(BK) 以及完全盐碱土组(AK),各处理组分别设置4个重复。其中,AK组的土壤平均含盐量为0.33%,BK组的土壤平均含盐量为0.20%。2021年6月1日—7月31日每隔8 d测定1次试验指标。
1.3 指标测定 1.3.1 植物生长状况统计采用米尺和游标卡尺测定枸杞幼苗的株高和地径,计算株高增长量和地径增长量。
1.3.2 叶绿素荧光参数和类囊体质子动力势参数测定从试验开始后每间隔8 d,选择晴天上午8:00—10:00,采用Multispe Q便携式叶绿素荧光仪(Photosynq,美国) 对植物的叶绿素荧光参数进行测定。尽量选择从顶部数第3至5片展开叶,用仪器夹取叶片的中部15 s即完成一次测量。测定的叶绿素荧光参数包括叶绿素相对含量SPAD值、PSⅡ最大光化学量子产量(Fv/Fm)、PSⅡ光反应中心开放数目(qL)、非光化学猝灭系数(qN)、非调节性能量耗散的量子产额(quantum yield of the unregulated energy dissipation, YNO)、调节性能量耗散的量子产额(quantum yield of the regulated energy dissipation, YNPQ);测定的类囊体质子动力势参数包括类囊体质子传导率(gH+)、电致变色带移衰退总幅度(electrochromic bandshift decay amplitude, ECSt),试验过程中每次测量重复3次。
1.4 数据处理用SPSS 23.0软件对数据进行单因素分析,用Duncan法进行差异显著性检验(α=0.05),用Excel 2010软件制图。
2 结果与分析 2.1 不同盐碱胁迫下枸杞幼苗生长状况差异不同盐碱胁迫下枸杞生长状况的变化如表 1所示。8 d时,盐碱胁迫下的处理组平均株高增长量较CK组大;但随着胁迫时间的延长,16~24 d时,CK组的平均株高增长量明显大于其他两组(P < 0.05)。32 d时,CK组和BK组平均株高增长量显著大于AK组(P < 0.05);40 d时,BK组的株高增长量达到最大值,且显著大于其他两组(P < 0.05),随后降低。到56 d时,AK组的平均株高增长量显著大于其他两组(P < 0.05)。在整个试验阶段,CK组的平均株高增长量集中在8~40 d,增长较快,到40 d之后增长放缓;BK组的平均株高增长量则集中在8~40 d,同样到40 d之后增长放缓;AK组平均株高增长则总体较为缓慢。
| 胁迫时间 Stress time /d |
平均株高增长量Average height increase/cm | 平均地径增长量Average diameter increase/mm | |||||
| 完全营养土组 CK |
半盐碱土组 BK |
完全盐碱土组 AK |
完全营养土组 CK |
半盐碱土组 BK |
完全盐碱土组 AK |
||
| 8 | 4.80±0.59Bc | 8.25±1.27Ac | 7.17±0.95Aa | 0.34±0.10Bc | 0.42±0.09Bab | 1.11±0.63Aa | |
| 16 | 11.08±3.76Aab | 3.25±1.43Bd | 4.67±0.40Bc | 0.40±0.09Bc | 0.44±0.05Bab | 1.47±0.73Aa | |
| 24 | 9.29±1.19Ab | 2.85±0.48Bd | 1.53±0.33Cd | 0.09±0.01Bd | 0.17±0.04Ac | 0.11±0.01Bb | |
| 32 | 11.83±2.39Aab | 10.40±2.02Ab | 6.13±0.62Bb | 0.21±0.07Bd | 0.35±0.06Ab | 0.18±0.03Bb | |
| 40 | 13.43±2.45Ba | 22.20±2.08Aa | 1.74±0.14Cd | 1.29±0.15Aa | 0.50±0.09Ba | 0.08±0.01Cb | |
| 48 | 3.87±0.58Ac | 0.80±0.08Be | 0.60±0.08Be | 0.79±0.01Ab | 0.53±0.11Ba | 0.15±0.04Cb | |
| 56 | 0.33±0.09Bd | 0.63±0.20Be | 4.90±0.29Ac | 0.15±0.05Ad | 0.20±0.04Ac | 0.14±0.04Ab | |
| 注:不同大写字母表示同一时期不同处理组的平均值(N=3) 差异显著(P < 0.05),不同小写字母表示同一处理组不同时期的平均值(N=4) 差异显著(P < 0.05)。Note: different majuscules indicate significant differences (P < 0.05) in the mean numbers (N=3) of different treatments in the same period, and different lowercase letters indicate significant differences (P < 0.05) in the mean numbers (N=4) of different periods in the same treatment group. | |||||||
从表 1可以看出,地径平均增长量的变化与株高平均增长量的变化有所区别。8~16 d时,AK组的地径平均增长量显著大于BK组和CK组(P < 0.05);随着胁迫时间的延长,24~32 d时,BK组地径平均增长量显著大于其他两组(P < 0.05),但所有处理的增长速度均较为缓慢;而40~48 d时,CK组的地径增长速度最快,BK组次之,AK组最慢。56 d时,枸杞幼苗的地径增长量变化均趋于平缓。总体来看,CK组地径的增长主要集中在8~48 d,而AK组主要集中在8~16 d,BK组地径的增长速度保持相对平稳。
2.2 盐碱胁迫对枸杞幼苗叶绿素荧光参数的影响盐碱胁迫对枸杞幼苗叶绿素荧光参数的影响如图 1所示。从图 1 (a)可以看出,除24~32 d外,枸杞叶绿素含量(以SPAD值表示) 在3个处理组间总体表现为:CK组>BK组>AK组,但是各组间差异基本不显著(P>0.05)。CK组叶绿素SPAD值总体表现出先增大后减小的趋势,在16 d时达到最大值。BK组和AK组的叶绿素SPAD值波动较大,胁迫40 d时的叶绿素SPAD值较峰值(0 d) 降低了26.67%,且差异达到显著水平(P < 0.05);而AK组则在24 d时达到最大值,在40 d时较峰值显著降低了29.21% (P < 0.05)。
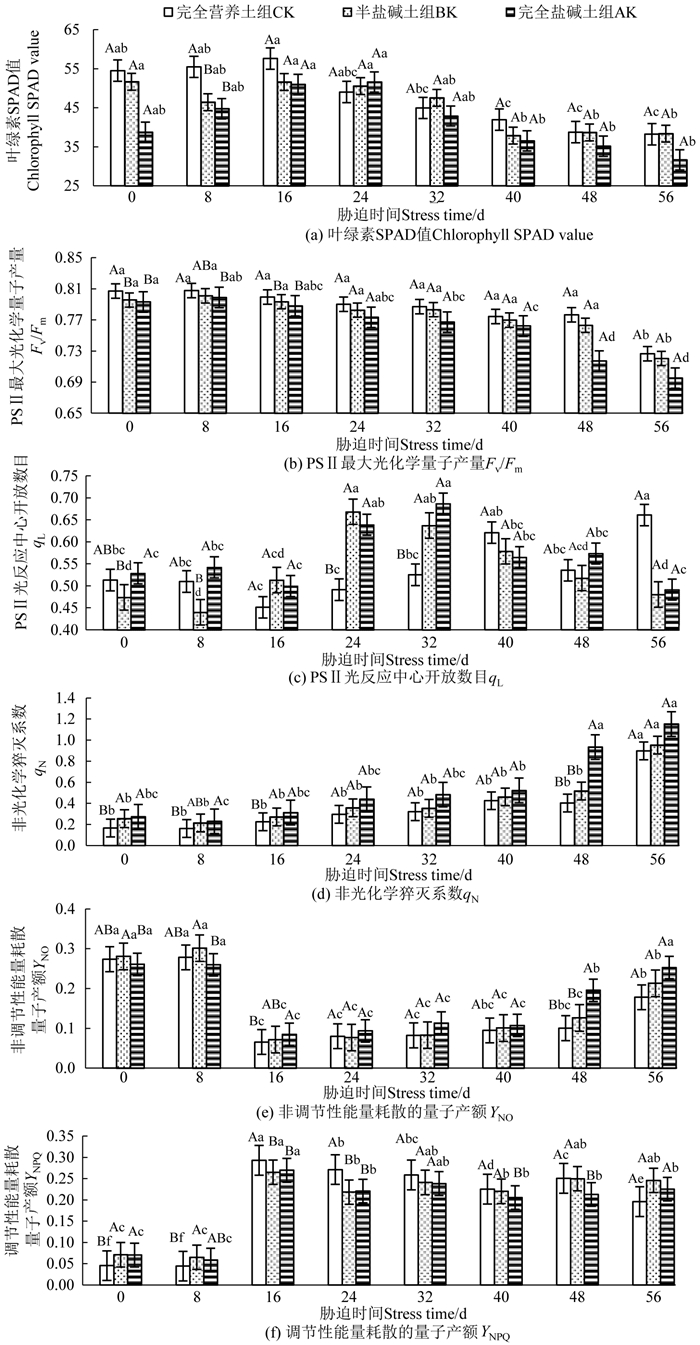
|
注:不同大写字母表示同一时期不同处理组的平均值(N=3) 差异显著(P < 0.05),不同小写字母表示同一处理组不同时期的平均值(N=4) 差异显著(P < 0.05)。 Note: different majuscules indicate significant differences (P < 0.05) in the mean numbers (N=3) of different treatments in the same period, and different lowercase letters indicate significant differences (P < 0.05) in the mean numbers (N=4) of different periods in the same treatment group. 图 1 盐碱胁迫对枸杞幼苗叶绿素荧光参数的影响 Fig. 1 Effects of saline-alkali stress on chlorophyll fluorescence parameters of L.barbarum |
从图 1 (b)可以看出,CK组和BK组枸杞叶片的Fv/Fm在0~48 d变化不明显,56 d时下降较明显,AK组的Fv/Fm则是0~40 d变化不明显,48 d时开始下降,且各个时期的Fv/Fm值均表现为:CK组>BK组>AK组。随着胁迫时间的延长,AK组较CK组的差距总体呈现明显增大的趋势,胁迫48 d时,AK组的Fv/Fm较CK组显著低了7.66% (P < 0.05)。不同强度盐碱胁迫下,枸杞Fv/Fm的下降幅度不同,CK组和BK组具有相似的变化趋势,56 d时的Fv/Fm较48 d时显著降低了6.47%、5.59% (P < 0.05)。AK组的Fv/Fm在48 d时发生了显著性变化,比40 d时降低了5.92% (P < 0.05)。
由图 1 (c)可以看出,随着胁迫时间的延长,CK组qL呈先减少后增加的波动变化趋势,BK组和AK组则总体呈先增加后减少的趋势,两组峰值分别出现在胁迫24和32 d时,较0 d时显著增加了41.07%和30.01% (P < 0.05);而后在40 d时出现显著变化,分别降低了18.72%和17.76% (P < 0.05)。从图 1 (d)可以看出,枸杞幼苗叶片的qN在胁迫期间均表现为CK组<BK组<AK组, 且0~16 d时CK组较AK组就存在显著差异(P < 0.05)。随胁迫时间延长,CK组和BK组的qN在56 d时显著升高,而AK组在48 d时就先发生了显著变化,较40 d增大了78.93% (P < 0.05),比0 d时增大了242.25% (P < 0.05),在56 d时达到最大值。
图 1 (e)为不同强度盐碱胁迫下枸杞幼苗叶片YNO随胁迫时间的变化情况, 在整个试验过程中,各处理组YNO均呈现随着时间的延长先显著降低(P < 0.05),而后呈现升高的趋势,但变化趋势随盐碱胁迫强度的增加而有所不同。16 d时,CK、BK、AK组的YNO较0 d时显著降低76.00%、74.45%、67.43% (P < 0.05),随后均保持了一段时间的相对稳定,略有升高但无显著差异(P>0.05);到48 d时,CK、BK、AK组的YNO较40 d时分别升高了5.98%、25.21%、82.58%,其中AK组变化较为显著(P < 0.05),且此时AK组YNO显著大于其他两组(P < 0.05)。56 d时,BK组和AK组的YNO较之前又发生了显著变化(P < 0.05)。总的来看,0~8 d时,YNO表现为:BK组>CK组>AK组,且BK组和AK组间存在显著差异(P < 0.05);而8 d后,AK组大于其他两组,但基本无显著差异(除48 d外,P>0.05)。
由图 1 (f)可以看出,16 d时,与YNO相反,所有处理的YNPQ较0 d时均有显著升高(P < 0.05)。随后CK组YNPQ基本呈现持续下降的趋势(除48 d外),且变化较为显著;而BK组和AK组则在一定的波动中保持相对的稳定。具体来看,16 d之前,CK组YNPQ要显著低于盐碱胁迫处理组(P < 0.05);16 d后YNPQ在组间具体表现为:16~24 d,CK组YNPQ显著大于其他两组(P < 0.05),32 d时,组间均不存在显著差异(P>0.05);而后AK组YNPQ显著低于其他两组(P < 0.05),到56 d时,组间差异又变为不显著(P>0.05)。
2.3 盐碱胁迫对枸杞幼苗类囊体质子动力势的影响盐碱胁迫对枸杞幼苗类囊体质子动力势参数的影响如图 2所示。图 2 (a)显示,在整个胁迫过程中,CK组枸杞gH+保持相对稳定,总体在波动中呈略微下降的趋势,未有显著变化(P>0.05)。BK组和AK组的gH+呈总体下降的趋势,但是下降过程有所差异。BK组的gH+在40 d前和CK组相似,无显著变化,直到胁迫48 d时,较0 d时才显著降低了67.43% (P < 0.05)。AK组的gH+变化幅度比其他两组大,胁迫8 d时与0 d时相比就显著降低了47.54% (P < 0.05),胁迫48 d时较24 d时又显著降低了53.50% (P < 0.05)。到胁迫56 d时,CK、BK、AK组gH+较0 d时分别下降了0.99%、27.74%、58.77%,其中BK组和AK组存在显著差异(P < 0.05)。
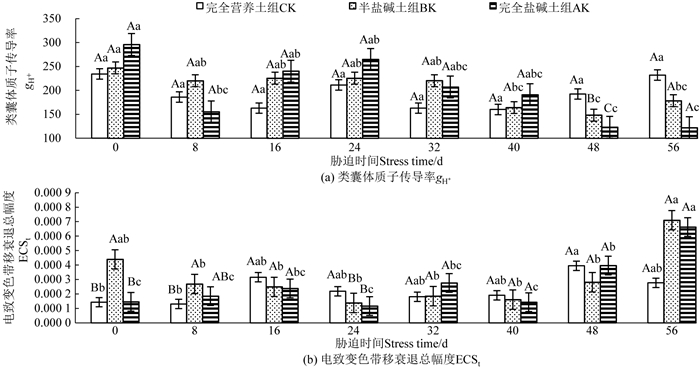
|
注:不同大写字母表示同一时期不同处理组的平均值(N=3) 差异显著(P < 0.05),不同小写字母表示同一处理组不同时期的平均值(N=4) 差异显著(P < 0.05)。 Note: different majuscules indicate significant differences (P < 0.05) in the mean numbers (N=3) of different treatments in the same period, and different lowercase letters indicate significant differences (P < 0.05) in the mean numbers (N=4) of different periods in the same treatment group. 图 2 盐碱胁迫对枸杞幼苗类囊体质子动力势的影响 Fig. 2 Effects of saline-alkali stress on thylakoid proton motive force of L.barbarum |
从图 2 (b)可以看出,CK组的ECSt总体呈波动上升的趋势,胁迫48 d时与0 d时相比,显著升高了176.22% (P < 0.05)。胁迫56 d时,BK组的ECSt较0 d时升高了61.73%,较48 d时则显著升高了152.67% (P < 0.05)。AK组的ECSt增长趋势更加明显,胁迫48 d时较0 d时升高了171.92%;胁迫56 d时较48 d时又升高了67.00%,较0 d时则升高了354.11%,变化都较为显著(P < 0.05)。但与随胁迫时间延长各组的变化趋势相比,同一时期不同处理组的枸杞ECSt大体上无显著差异(P>0.05)。
3 讨论与结论 3.1 盐碱胁迫对枸杞幼苗生长状况的影响植物耐盐碱胁迫研究中的相关形态指标是评价其耐盐碱能力最为直接的判断依据,生长状况是代谢过程在形态上的综合表现[15]。随着生长时期的延长,各生长指标依次升高,总体来说,CK组和BK组的生长情况相近且明显好于AK组,但平均增长量各时期有所差异,这可能是由于各自的生长发育阶段受盐碱胁迫差异而导致的。在0~8 d时,盐碱土处理下枸杞的株高、地径平均增长量较CK组大,这说明在短期的盐碱胁迫下,枸杞幼苗的生长并不会受到显著影响,且可能因为受胁迫刺激而加速生长。但随着盐碱程度的加强和胁迫时间的延长,植物生长会受到明显抑制,这与罗君等[16]的研究结果一致。
3.2 盐碱胁迫对枸杞幼苗叶绿素荧光参数的影响叶绿素含量是衡量植物耐盐性的重要指标之一,叶绿素的丧失通常伴随着光化学反应的失活,尤其是那些在盐胁迫下由PSⅡ介导的光化学反应。本研究结果表明,各处理组叶绿素含量均呈先升高后下降的趋势,32 d后CK组的下降趋势可能是受到该处理组枸杞果实6月初便开始成熟结果,且生长季降雨较多的影响。在32和56 d时,CK组和BK组的枸杞叶绿素含量相近且高于AK组,且BK组略高于CK组,这说明在盐碱胁迫下,叶绿素含量会发生下降,但低浓度胁迫不会造成显著变化,反而可能促进叶绿素的合成,这可能是因为低浓度盐碱胁迫会促使细胞积累脯氨酸而有利于叶绿素的合成[17]。
Fv/Fm反映了PSⅡ的最大光化学量子产量,有研究发现,当Fv/Fm值小于0.6时,PSⅡ的性能受到严重干扰[18],光合作用能力也随之下降。本研究中,Fv/Fm在各个时期均表现为:CK组>BK组>AK组;16 d前,AK组和CK组间均存在显著差异(P < 0.05),这说明较高浓度的盐碱胁迫对枸杞幼苗的光合机构活性影响更大。24~40 d时,组间差异变得不太显著,且Fv/Fm值均大于0.75,这说明枸杞具有一定的耐盐碱能力,通过自调节能够维持自身的光合作用能力。但在胁迫48 d时,AK组Fv/Fm值又显著低于其他两组,且较40 d时的下降趋势十分明显,这可能是因为此时枸杞幼苗受到了光抑制,光合机构活性降低,说明其PSⅡ能量吸收和耗散平衡发生了变化,且较高浓度、长时间的盐碱胁迫会对植物的光反应中心造成更为严重的破坏。
qL反映了PSⅡ反应中心的开放程度,是其吸收的光能用于光化学电子传递的份额。qN反映的是PSⅡ吸收的光能不能用于光合电子传递而以热的形式耗散掉的部分,是PSⅡ的一种自我保护机制[19]。qN是一个非常敏感的压力指标,非常轻微的压力就可以引起qN相对较大的变化[20]。相较于CK组qL的增加趋势,受盐碱胁迫的处理组qL总体表现为先增加后减少的趋势。这说明在胁迫初期,随着枸杞幼苗的生长,叶片PSⅡ反应中心的开放程度和电子传递能力提升,光能利用效率也随之提高,但胁迫40 d后qL的显著减少则表明盐碱胁迫会促使枸杞叶片PSⅡ受体一侧的QA向QB的电子传递受到抑制,反应中心捕获激发能下降[8]。盐碱胁迫下处理组的qN均高于CK组,且AK组qN的增大幅度更大,这表明植物可以通过提高qN及时耗散过剩光能来减轻盐碱胁迫对PSⅡ的影响,且随着盐碱胁迫强度的增强和胁迫时间的延长,热耗散保护作用进一步增强。
PSⅡ反应中心吸收的光量子主要通过光化学途径转化为能量(YⅡ)、PSⅡ调节性能量耗散(YNPQ) 及非调节性能量耗散(YNO) 3条途径消耗掉,且YⅡ+YNPQ+YNO=1。YNPQ是植物的一种自我保护机制,它是指PSⅡ吸收的光能以热形式耗散掉的部分。在本研究中,各处理组的YNPQ在0~8 d均保持较低水平,这可能是因为此时枸杞幼苗接受的光能并没有处于过剩状态;而后各组均出现显著升高,但32 d后,CK组的YNPQ呈现下降的趋势,而其他两组在波动中保持一个稳定且较高的水平,这说明盐碱胁迫下枸杞幼苗光合机构吸收的光强在此时处于过剩状态,并启动调节机制以耗散过剩光能[21]。YNO则是光损伤的重要指标,YNO值高,说明过剩的光能不能被光化学能量转换和保护性的调节机制完全消耗掉[21]。本研究结果显示,各处理组的YNO在试验0~8 d均保持较高水平,可能是因为此时未产生过剩光能;而后各组保持了一段时间较低水平的稳定后迅速升高,且AK组的YNO的变化比其他两组更早,幅度也更大。这说明在产生过剩光能后,随着胁迫时间的延长,光合机构受到了一定的损伤;且盐碱胁迫程度越强,光合机构受到的损伤更大。
3.3 盐碱胁迫对枸杞幼苗类囊体质子动力势的影响在外界环境压力或其他非生物因素胁迫下,植物的新陈代谢会受到抑制,此时可以通过一系列的反馈调节机制来改善这些效应,这些反馈调节机制可以减少光能的捕获并调节电子和质子的转移,一些关键的调节机制涉及PMF[22]。线性电子流与质子移位耦合,形成质子的类囊体电化学梯度,称为PMF,由跨膜质子梯度和跨膜电势两部分组成[23]。PMF的快速形成对于保护PSⅠ和PSⅡ免受过剩光能的影响十分重要。电致变色带移(ECS) 吸收位移的暗弛豫动力学可以用来监测影响光诱导的电子和质子转移反应,这些反应会引起PMF的变化[23]。ECS分析中的gH+参数被认为主要代表ATP合酶中H+的电导率,其大小的变化是由ATP合酶的调节或控制引起的[24]。
相比在整个试验阶段基本无显著变化的CK组,盐碱胁迫下的两组gH+在40 d后均有比较明显的降低;ECSt的变化则相反,尤其是AK组在40 d后呈显著升高的趋势。这说明枸杞幼苗在长时间的胁迫下通过降低ATP合酶活性和积累PMF来降低光抑制对PSⅠ和PSⅡ的损伤,提高其对盐碱胁迫的防御能力。其中,胁迫48 d时,AK组的gH+与其他两个处理组之间存在显著差异,可能是由于随着胁迫时间的延长,在给定的质子通量下,减少gH+能有效减少质子外流,从而积累大量PMF,以此降低管腔pH值并有助于激活qN[17];到56 d时,随着AK组枸杞的成熟,处理组间的差异又变得不显著。而ECSt在0、8、24 d存在组间的显著差异,可能是由盐碱胁迫强度的差异导致。由于ECSt指标的灵敏性,在试验开始阶段,较低浓度的盐碱胁迫可能使质子传输变化的响应更为迅速,而后逐渐放缓;随着胁迫时间的延长,ECSt在应激条件下的升高通常归因于类囊体质子梯度的增大,这是由于碳同化减少时对ATP合成的需求降低,从而导致类囊体腔中H+的积累[25]。
3.4 结论低浓度盐碱胁迫对枸杞幼苗的生长和叶绿素含量并不会产生显著影响,反而可能促进叶绿素的合成,而较高浓度、长时间的盐碱胁迫则会抑制其生长,并使叶绿素含量显著降低。随着盐碱胁迫时间的延长,枸杞幼苗光合机构活性降低,PSⅡ能量吸收和耗散平衡发生了变化。在反馈调节机制下,枸杞幼苗通过积累大量的PMF来降低光抑制对PSⅠ和PSⅡ的损伤。基于此,在一定程度上揭示了枸杞的耐盐碱机理,可以在研究区域及其他相似盐碱地上配套种植枸杞,以恢复其土地生产力。本研究对生长季内短期盐碱胁迫下的枸杞幼苗生长和叶绿素荧光特性变化进行了研究,今后有必要在对土壤基质的盐碱程度定性、定量化的基础上开展长期研究。
| [1] |
刘全凤, 刘永震, 曹金锋, 等. 控释氮肥用量对环渤海潮土区棉花产量及氮肥利用率的影响[J]. 浙江农业学报, 2018, 30(2): 275-279. DOI:10.3969/j.issn.1004-1524.2018.02.14 |
| [2] |
丁绍武, 张鹏. 盐碱地改良研究现状及微生物菌肥应用分析[J]. 现代农业科技, 2019(7): 175-176. |
| [3] |
RAPACZ M. Chlorophyll a fluorescence transient during freezing and recovery in winter wheat[J]. Photosynthetica, 2007, 45(3): 409-418. DOI:10.1007/s11099-007-0069-2 |
| [4] |
张璐颖, 文笑, 林勇明, 等. 盐胁迫对台湾桤木幼苗光合作用和荧光特性的影响[J]. 福建林学院学报, 2013, 33(3): 193-199. |
| [5] |
黄承建, 魏刚, 徐建俊, 等. 干旱胁迫对苎麻叶绿素荧光特性的影响[J]. 中国麻业科学, 2014, 36(1): 41-45. |
| [6] |
吴雪霞, 查丁石. NaCl胁迫对茄子幼苗叶片叶绿素荧光参数和能量分配的影响[J]. 华北农学报, 2009, 24(6): 83-87. |
| [7] |
HUANG W, ZHANG S B, LIU T. Moderate photoinhibition of photosystem Ⅱ significantly affects linear electron flow in the shade-demanding plant Panax notoginseng[J]. Frontiers in Plant Science, 2018, 9: 637. DOI:10.3389/fpls.2018.00637 |
| [8] |
詹振楠, 马青, 王文娟, 等. 混合盐碱胁迫对黑果枸杞种子萌发的影响[J]. 江苏农业科学, 2018, 46(24): 119-122. |
| [9] |
潘平新, 倪强, 马瑞, 等. 不同盐分处理对黑果枸杞种子萌发和幼苗生长的影响[J]. 草地学报, 2021, 29(2): 342-348. |
| [10] |
毛桂莲, 郑国琦, 戴珍珍. NaCl和Na2CO3胁迫对枸杞愈伤组织生理效应的影响[J]. 西北农业学报, 2006, 15(6): 153-157. |
| [11] |
张潭, 唐达, 李思思, 等. 盐碱胁迫对枸杞幼苗生物量积累和光合作用的影响[J]. 西北植物学报, 2017, 37(12): 2474-2482. |
| [12] |
毛桂莲, 梁文裕, 王盛, 等. 碱性盐胁迫对宁夏枸杞生长、结构及光合参数的影响[J]. 干旱地区农业研究, 2017, 35(4): 236-242. |
| [13] |
毛桂莲, 许兴, 张渊. NaCl胁迫对枸杞叶绿素荧光特性和活性氧代谢的影响[J]. 干旱地区农业研究, 2005, 23(5): 118-121. |
| [14] |
张士权, 米文精, 赵勇刚. 新疆杨、枸杞等耐盐碱树种叶绿素荧光特性分析[J]. 东北林业大学学报, 2011, 39(2): 31-37. |
| [15] |
李峰, 谢永宏, 覃盈盈. 盐胁迫条件下湿地植物的适应策略[J]. 生态学杂志, 2009, 28(2): 314-321. |
| [16] |
罗君, 彭飞, 王涛, 等. 黑果枸杞(Lycium ruthenicum)种子萌发及幼苗生长对盐胁迫的响应[J]. 中国沙漠, 2017, 37(2): 261-267. |
| [17] |
KANAZAWA A, KRAMER D M. In vivo modulation of nonphotochemical exciton quenching (NPQ) by regulation of the chloroplast ATP synthase[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(20): 12789-12794. |
| [18] |
钱永强, 周晓星, 韩蕾, 等. Cd2+胁迫对银芽柳PSⅡ叶绿素荧光光响应曲线的影响[J]. 生态学报, 2011, 31(20): 6134-6142. |
| [19] |
RITCHIE G A. Chlorophyll fluorescence: what is it and what do the numbers mean?[J]. USDA Forest Service Proceedings RMRS-P, 2006, 43: 34-43. |
| [20] |
尹海龙, 田长彦. 氮调控对盐环境下甜菜功能叶光系统Ⅱ荧光特性的影响[J]. 植物生态学报, 2013, 37(2): 122-131. |
| [21] |
李治鑫, 李鑫, 范利超, 等. 高温胁迫对茶树叶片光合系统的影响[J]. 茶叶科学, 2015, 35(5): 415-422. |
| [22] |
KANAZAWA A, OSTENDORF E, KOHZUMA K, et al. Chloroplast ATP synthase modulation of the thylakoid proton motive force: implications for photosystem Ⅰ and photosystem Ⅱ photoprotection[J]. Frontiers in Plant Science, 2017, 8: 719. |
| [23] |
AVENSON T J, CRUZ J A, KANAZAWA A, et al. Regulating the proton budget of higher plant photosynthesis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(27): 9709-9713. |
| [24] |
KRAMER D M, AVENSON T J, EDWARDS G E. Dynamic flexibility in the light reactions of photosynthesis governed by both electron and proton transfer reactions[J]. Trends in Plant Science, 2004, 9(7): 349-357. |
| [25] |
CHOVANCEK E, ZIVCAK M, BRESTIC M, et al. The different patterns of post-heat stress responses in wheat genotypes: the role of the transthylakoid proton gradient in efficient recovery of leaf photosynthetic capacity[J]. Photosynthesis Research, 2021, 150(1/2/3): 179-193. |

 2022, Vol. 42
2022, Vol. 42


