文章信息
- 叶碧欢, 陈友吾, 李海波, 宋其岩, 胡传久, 沈建军
- YE Bihuan, CHEN Youwu, LI Haibo, SONG Qiyan, HU Chuanjiu, SHEN Jianjun
- 香榧假种皮精油对病原菌和病原藻的抑制活性
- Inhibitory activity of the essential oil of Torreya grandis aril against pathogens and a green alga
- 森林与环境学报,2021, 41(6): 637-642.
- Journal of Forest and Environment,2021, 41(6): 637-642.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2021.06.010
-
文章历史
- 收稿日期: 2021-08-09
- 修回日期: 2021-08-30
植物精油是储存在特殊植物不同部位的具有挥发性的一类复杂植物次生代谢混合物,由不同的化合物质组成,具有广谱的抑菌、抗癌、抗氧化等不同的功能,已应用于医药和工业等不同领域,在对病原微生物的防御工作中也起着重要作用[1-3]。国内外学者已展开了迷迭香(Rosmarinus officinalis Linn.)、山茶(Camellia japonica Linn.)、香樟[Cinnamomum camphora (Linn.) Presl.]、香茅[Cymbopogon citratus (DC.) Stapf.]、绿薄荷(Mentha spicata Linn.)、伊朗蒿(Artemisia persica Boiss.) 等诸多植物精油对不同微生物的抑制活性和机理研究[4-10]。香榧(Torreya grandis Fort. ex Lindl. ‘Merrillii’ Hu) 是我国一种特色的经济林树种,其种子具有药用价值,且营养价值高,独具风味,是一种非常受欢迎的干果[11]。香榧种子由假种皮、外种皮和种子构成,其假种皮约占新鲜种子重量的50%[12],成分分析结果表明,假种皮也具有多种抑菌、抗氧化、抗肿瘤和抗病毒作用的化合物[13-14],可作为新型植物源药剂进一步开发利用,然而在香榧生产过程当中假种皮通常作为废料丢弃,大量资源未得到充分利用。
本研究以香榧假种皮为材料进行精油提取,并以立枯丝核菌(Rhizoctonia solani Kuhn.)、链格孢[Alternaria alternate (Fries) Keissler.]、胶孢炭疽菌[Colletotrichum gloeosporioides (Penz.) Penz. et Sacc.]、尖孢镰刀菌(Fusarium oxysporum Sch1.) 和葡萄座腔菌[Botryosphaeria dothidea (Moug.) Ces. et De Not.] 这5种常见的病害真菌和1种病原藻——裂丝藻(Stichcoccus sp.) 为试验对象,测定香榧假种皮精油对其抑制活性,旨在为创制和发展新型植物源药剂提供参考信息,为植物病虫害的绿色防控提供技术支持,也为香榧生产中的假种皮这一废弃物资源的开发利用提供理论依据。
1 材料与方法 1.1 供试材料供试的病原菌、藻为立枯丝核菌、链格孢、胶孢炭疽菌、尖孢镰刀菌、葡萄座腔菌和裂丝藻,保存于浙江省林业科学研究院森林保护实验室。
1.2 香榧假种皮精油的制备香榧假种皮粉碎后,称取500 g样品放入精油提取器,按料液体积比(V∶V) 1∶10的比例加入纯水,浸泡2 h,开启冷却水并把水加热到沸腾,精油随着水蒸气一起蒸发,冷却于分液管,回流5~10 h后直至挥发油不再增加,停止加热,分离上层精油,密封保存备用[15]。
1.3 抑制活性测定采用生长速率法测定香榧假种皮精油对各病原菌的抑制效果。将香榧精油与葡萄糖琼脂培养基(potato dextrose agar,PDA) 按体积比(V∶V) 1∶25和1∶200的比例充分摇匀,凝固前向每个平板(9 cm) 倒15 mL的含精油PDA。对照(CK) 组添加等体积无菌水,每个样品设3个重复。接种供试菌株菌饼(直径6 mm) 于PDA平板中央,置于生化培养箱中,25 ℃培养,分别于7、11和15 d用十字交叉法测量菌落直径,利用Excel软件分析抑菌率。抑菌率/%= (对照菌落直径-处理菌落直径) / (对照菌落直径-菌饼直径) ×100。
将待测病原藻用BG-11培养液制成2.0×106个·mL-1浓度的悬浮液。将香榧精油与BG-11培养液按体积比(V∶V) 1∶26 667和1∶267的比例配制混合培养液。CK1组接种3 mL的病原藻悬浮液于7 mL的BG-11纯培养液中,处理组(T) 与CK1组接种等量的病原藻悬浮液于7 mL的含精油BG-11液体培养基中,CK2组为含精油的BG-11,不接种病原藻,3 mL悬浮液用BG-11纯培养液补足。25 ℃光照条件下摇床(150 r·min-1) 培养15 d,紫外可见分光光度计(UV-8000,上海精密仪器仪表有限公司,中国) 测定680 nm波长处光密度(optical density,OD) 值,设4个重复。利用光学显微镜(BX51,OLYMPUS公司,日本) 观察病原藻的形态变化。病原藻抑制率/%= [CK1-(T-CK2)] /CK1×100。
1.4 室内毒力测定将香榧假种皮精油与已融化的PDA培养基按不同体积比(V∶V) 1∶25、1∶50、1∶100、1∶150和1∶200配制成5个浓度梯度,充分摇匀,每个平板倒入等量(15 mL) 的含精油PDA,其余条件同1.3所述,十字交叉法测量菌落直径。将精油与BG-11培养液按不同体积比(V∶V) 1∶26 667、1∶8 000、1∶2 667、1∶800和1∶267配制成5个浓度梯度,其余条件同1.3所述,紫外可见分光光度计测定680 nm波长处OD值。利用Excel和SPSS 19.0软件对数据进行方差分析、毒力回归方程和有效中浓度(median effective concentration,EC50) 计算。
2 结果与分析 2.1 香榧假种皮精油对5种病原菌的抑制作用采用生长速率法测定香榧假种皮精油对立枯丝核菌、链格孢、胶孢炭疽菌、尖孢镰刀菌和葡萄座腔菌的抑制作用。由表 1可知,当精油与培养基体积比(V∶V) 为1∶25时,对5种病原菌均有较强的抑制效果,7~15 d时的抑菌率均为100.00%;当精油与培养基体积比(V∶V) 为1∶200时,,对立枯丝核菌和链格孢仍具有100%抑制率,对其它3种病原菌的抑制率均随着培养时间的延长而逐渐下降。7 d时对胶孢炭疽菌、尖孢镰刀菌和葡萄座腔菌的抑制率分别为58.00%、55.00%和42.75%;11d时分别为46.00%、48.75%和3.00%;15 d时对胶孢炭疽菌和尖孢镰刀菌的抑制率分别为28.50%和45.75%,对葡萄座腔菌已不具有抑制性。精油对不同菌株的菌落形态影响如图 1所示。精油不同浓度对不同菌株的菌落大小和菌丝疏密程度的影响不同,当精油与培养基体积比(V∶V) 为1∶25时,5种病原菌均未见其菌落生长;而当精油与培养基体积比(V∶V) 为1∶200时,可见胶孢炭疽菌、尖孢镰刀菌和葡萄座腔菌的菌落生长,但菌落的菌丝密度较对照组稀疏,颜色也较浅。结果表明,香榧假种皮精油对5种病原菌均具有抑制性,但不同菌株间存在一定差异;抑菌效率与精油浓度呈正相关,而与培养时间呈负相关。
| 病原菌Pathogens | 抑制率Inhibitory rate/% | ||||||
| V精油∶V培养基=1∶25 Vessential oil∶Vmedium=1∶25 | V精油∶V培养基=1∶200 Vessential oil∶Vmedium=1∶200 | ||||||
| 7 d | 11 d | 15 d | 7 d | 11 d | 15 d | ||
| 立枯丝核菌Rhizoctonia solani | 100.00±0.00a | 100.00±0.00a | 100.00±0.00a | 100.00±0.00a | 100.00±0.00a | 100.00±0.00a | |
| 链格孢Alternaria alternate | 100.00±0.00a | 100.00±0.00a | 100.00±0.00a | 100.00±0.00a | 100.00±0.00a | 100.00±0.00a | |
| 胶孢炭疽菌Colletotrichum gloeosporioides | 100.00±0.00a | 100.00±0.00a | 100.00±0.00a | 58.00±2.61b | 46.00±3.49cd | 28.50±3.23e | |
| 尖孢镰刀菌Fusarium oxysporum | 100.00±0.00a | 100.00±0.00a | 100.00±0.00a | 55.00±2.35bc | 48.75±2.17cd | 45.75±2.21cd | |
| 葡萄座腔菌Botryosphaeria dothidea | 100.00±0.00a | 100.00±0.00a | 100.00±0.00a | 42.75±4.27d | 3.00±1.73f | 0.00±0.00f | |
| 注:不同小写字母表示不同培养时间和不同体积比条件下精油对5种病原菌的抑制率差异显著(P<0.05)。Note: lowercase letters indicate significant differences of inhibitory rate of essential oil to 5 pathogens at the level of P<0.05 under different culture time and volume ratio. | |||||||

|
注:A、B、C、D和E分别代表CK组5种菌(立枯丝核菌、链格孢、胶孢炭疽菌、尖孢镰刀菌和葡萄座腔菌) 的生长情况,F、G、H、I和J分别代表处理组(V精油∶V培养基=1∶ 25) 5种菌的生长情况,K、L、M、N和O分别代表处理组(V精油∶V培养基=1∶200) 5种菌的生长情况。 Note: A, B, C, D and E represent the growth of 5 pathogens [Rhizoctonia solani, Colletotrichum gloeosporioides, Fusarium oxysporum and Botryosphaeria dothidea] in the control group, respectively. F, G, H, I and J represent the growth of those 5 pathogens in the treatment group (Vessential oil∶Vmedium=1∶25), respectively. K, L, M, N and O represent the growth of those five pathogens in the treatment group (Vessential oil∶ Vmedium=1∶200), respectively. 图 1 香榧假种皮精油对5种病原菌的抑制效果 Fig. 1 Inhibitory effects of the essential oil of T. grandis aril against 5 pathogens |
利用分光光度计测定了裂丝藻不同处理组的680 nm波长处OD值,分析香榧假种皮精油对该病原藻的抑制作用。当精油与培养液体积比(V∶V) 为1∶26 667时,7和15 d时精油对裂丝藻的抑制率分别为7.52%和6.27%,抑制率小于10%,抑制效果不明显。当精油与培养液体积比(V∶V) 为1∶267时,7和15 d时精油对裂丝藻的抑制率,分别为52.97%和53.08%,抑制率均大于50%,抑制效果明显。在精油与培养液不同比例条件下,7和15 d的抑制效果均差异不显著(表 2)。精油浓度较高时,可明显致死裂丝藻,精油处理组的裂丝藻7 d时已明显死亡(图 2),15 d时显微镜观察裂丝藻的形态变化,发现精油处理组的绿藻明显失绿,死亡(图 3)。结果表明,香榧假种皮精油在一定浓度条件下对裂丝藻具有抑制性,抑制效率与精油浓度呈正相关。
| 时间 Time/d |
抑制率Inhibitory rate/% | |
| V精油∶V培养基=1∶26 667Vessential oil∶Vmedium=1∶26 667 | V精油∶V培养基=1∶267Vesential oil∶Vmedium=1∶267 | |
| 7 | 7.52±0.29b | 52.97±0.86a |
| 15 | 6.27±0.14b | 53.08±0.15a |
| 注:不同小写字母表示不同培养时间和不同体积比条件下精油对病原藻的抑制率差异显著(P<0.05)。Note: lowercase letters indicate significant difference of inhibitory rate of essential oil to green alga at the level of P<0.05 under different culture time and volume ratio. | ||

|
注:A和C分别表示7和15 d时对照组裂丝藻的生长情况;B和D分别表示7和15 d时处理组裂丝藻的生长情况;黑色箭头表示从左往右香榧外种皮精油稀释梯度递减。 Note: A and C represent the growth of Stichcoccus sp. in the control group at 7 and 15 d, respectively. B and D represente the growth of Stichcoccus sp. in the treatment group at 7 and 15 d, respectively. the black arrows indicate that the dilution gradient of the essential oil of .T. grandis aril decreases from left to right. 图 2 香榧假种皮精油对裂丝藻的抑制效果 Fig. 2 Inhibitory effects of the essential oil of T. grandis aril against the green alga Stichcoccus sp. |
|
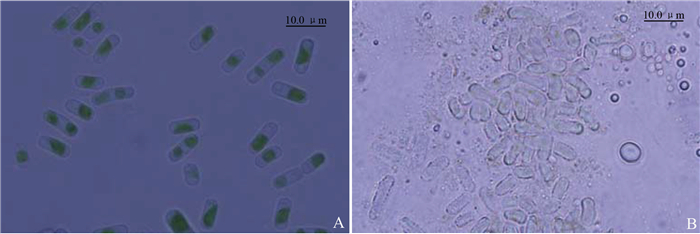
注:A和B分别代表 15 d时CK组和处理组的裂丝藻形态。 Note: A and B show the morphology of Stichcoccus sp. in control and treatment groups at 15 d, respectively. 图 3 精油处理前后裂丝藻的形态变化 Fig. 3 Morphological changes in Stichcoccus sp. following treatment with the essential oil of T. grandis aril |
由表 3可知,香榧假种皮精油对5种病原菌均具有较好的抑制性,15 d时,链格孢的EC50值最小,为3.38 mL·L-1,葡萄座腔菌的EC50值最大,为10.74 mL·L-1,说明精油对链格孢的抑制性最强,对葡萄座腔菌的抑制效果相对较差。精油对裂丝藻也具有较好的抑制性,裂丝藻7和15 d的EC50值分别为2.93和3.51 mL·L-1。这几种病原菌和裂丝藻15 d时的EC50值均较7 d时高,说明精油的作用效果随着时间延长而减弱,推测可能与精油的挥发性有关。
| 病原物Pathogen | 7 d | 15 d | |||||
| 毒力回归方程 Regression equation |
相关系数 R2 |
有效中浓度 EC50 /(mL·L-1) |
毒力回归方程 Regression equation |
相关系数 R2 |
有效中浓度 EC50 /(mL·L-1) |
||
| 立枯丝核菌Rhizoctonia solani | y=1.223 5x-0.499 0 | 0.974 8 | 2.56 | y=1.208 5x-0.767 1 | 0.984 0 | 4.31 | |
| 链格孢Alternaria alternate | y=1.121 8x-0.404 7 | 0.975 6 | 2.29 | y=1.521 8x-0.804 7 | 0.977 1 | 3.38 | |
| 胶孢炭疽菌Colletotrichum gloeosporioides | y=4.855 4x-3.269 1 | 0.985 6 | 4.71 | y=6.224 9x-5.340 9 | 0.983 3 | 7.21 | |
| 尖孢镰刀菌Fusarium oxysporum | y=1.585 8x-1.117 7 | 0.961 2 | 5.07 | y=1.834 7x-1.414 3 | 0.989 4 | 5.90 | |
| 葡萄座腔菌Botryosphaeria dothidea | y=11.271 0x-8.395 1 | 0.990 0 | 5.56 | y=2.112 3x-2.177 6 | 0.993 8 | 10.74 | |
| 裂丝藻Stichcoccus sp. | y=0.758 6x-2.630 3 | 0.999 8 | 2.93 | y=0.786 1x-2.787 4 | 0.993 7 | 3.51 | |
病虫草害的有效防控是农林业健康发展的重要条件,为了减少化学药剂的危害作用,人们越来越关注具有生物活性的天然产物在病原物管理中的应用[3]。精油是来源于植物的挥发性化合物,在植物对病原微生物的防御机制中起着重要作用[1]。人们陆续已对许多植物精油的抗菌活性展开了大量研究,许多精油对病原菌具有抑制或致死作用,可作为合成杀菌剂的有效替代物质[16-23]。
香榧是一种中国的本土树种,主产于江浙等地,其花、种子、假种皮、外种皮和叶片不同部位的化学成分、生物活性和应用潜力等逐步被报道和挖掘[12, 15, 24-25]。香榧种子的乙醇提取物具有抗氧化和抗炎活性[26]。香榧假种皮提取物对大肠杆菌[Escherichia coli (Migula) Castellani et Chalmers]、金黄色葡萄球菌( Staphylococcus aureus Rosenbach)、枯草芽孢杆菌[Bacillus subtilis (Ehrenberg) Cohn]、黑曲霉[Aspergillus niger (L.) Van Tieghem] 和青霉( Penicillium sp.) 等均有良好的抑制作用[27-28]。香榧叶精油对大肠杆菌、金黄色葡萄球菌、黑曲霉、枯草芽孢杆菌和蜡样芽胞杆菌( Bacillus cereus Frankland et Frankland) 都具有较强的抗菌活性[15]。
本研究利用水提法提取香榧假种皮精油,并测定其对立枯丝核菌、链格孢、炭疽病、尖孢镰刀菌和葡萄座腔菌的抑菌活性。结果表明,香榧假种皮精油对5种病原菌均具有较好的抑制性,抑制效率与精油浓度呈正相关,结果进一步证实了香榧假种皮精油具有作为一种高效抗菌剂的潜力。但香榧假种皮精油对不同菌株的抑制效果存在差异,仍有必要展开对其它菌的抑制活性测定,进一步了解该精油的可适对象,以便日后更好地开发和应用。研究结果还表明,香榧假种皮精油的抑菌效果与培养时间呈负相关,推测与精油的发挥性有关。精油挥发性的特性导致了其贮藏运输的不便,也会影响其作用的持久性以及限制其应用范围,而微胶囊等技术则可以有效延缓精油的挥发、延长精油的缓释,已成功应用于多种植物精油[29-32]。此外,本研究首次测定了香榧假种皮精油对植物病原藻——裂丝藻的抑制活性,结果表明,对该病原藻也具有较好的抑制性,可使裂丝藻明显失绿,具有作为植物源灭藻剂的开发潜力,而关于香榧精油的灭藻机理仍需进一步的研究。
| [1] |
LIU W T, CHU C L, ZHOU T. Thymol and acetic acid vapors reduce postharvest brown rot of apricots and plums[J]. HortScience, 2002, 37(1): 151-156. DOI:10.21273/HORTSCI.37.1.151 |
| [2] |
许春平, 李萌姗, 谭兰兰, 等. 不同产地烟草花蕾精油的抑菌和抗氧化能力比较研究[J]. 中国烟草学报, 2016, 22(3): 72-78. |
| [3] |
MOGHADDAM M, MEHDIZADEH L. Essential oil and antifungal therapy[M]//BASAK A, CHAKRABORTY R, MANDAL S M. Recent Trends in Antifungal Agents and Antifungal Therapy. New Delhi, India: Springer, 2016: 29-74.
|
| [4] |
ANGIONI A, BARRA A, CERETI E, et al. Chemical composition, plant genetic differences, antimicrobial and antifungal activity investigation of the essential oil of Rosmarinus officinalis L.[J]. Journal of Agricultural and Food Chemistry, 2004, 52(11): 3530-3535. DOI:10.1021/jf049913t |
| [5] |
张赟彬, 缪存铅, 宋庆, 等. 荷叶精油对肉类食品中常见致病菌的抑菌机理[J]. 食品科学, 2010, 31(19): 63-66. |
| [6] |
SHAABAN H A, RAMADAN M M, AMER M M, et al. Chemical composition of Cymbopogon citratus essential oil and antifungal activity against some species of mycotoxigenic aspergillus fungi[J]. Journal of Applied Sciences Research, 2013, 9(11): 5770-5779. |
| [7] |
KEDIA A, PRAKASH B, MISHRA P K, et al. Antifungal, antiaflatoxigenic, and insecticidal efficacy of spearmint (Mentha spicata L.) essential oil[J]. International Biodeterioration & Biodegradation, 2014, 89: 29-36. |
| [8] |
李桥妹, 黎冬明, 洪艳平, 等. 山茶油抑菌性能和机理的研究[J]. 中国粮油学报, 2019, 34(5): 62-67. DOI:10.3969/j.issn.1003-0174.2019.05.012 |
| [9] |
袁康, 胡振阳, 陈可欣, 等. 紫苏精油抑制灰绿曲霉的活性与机理[J]. 食品科学, 2020, 41(23): 63-69. DOI:10.7506/spkx1002-6630-20191103-022 |
| [10] |
陈可欣, 骆郑航, 李玲, 等. 香樟精油抑制灰绿曲霉的活性与机理研究[J]. 中国粮油学报, 2021, 36(3): 71-78. DOI:10.3969/j.issn.1003-0174.2021.03.013 |
| [11] |
王向阳, 修丽丽. 香榧的营养和功能成分综述[J]. 食品研究与开发, 2005, 26(2): 20-22. DOI:10.3969/j.issn.1005-6521.2005.02.007 |
| [12] |
SUN X H, MANTRI N, GE J, et al. Inhibition of plant pathogens in vitro and in vivo with essential oil and organic extracts of Torreya grandis 'Merrilli' aril[J]. Plant Omics, 2014, 7(5): 337-344. |
| [13] |
黎章矩, 骆成方, 程晓建, 等. 香榧种子成分分析及营养评价[J]. 浙江林学院学报, 2005, 22(5): 540-544. |
| [14] |
田鑫, 穆文碧, 张建永. 香榧不同部位的化学成分和药理活性研究进展[J]. 天然产物研究与开发, 2021, 33(4): 691-715, 637. |
| [15] |
曾琳, 林秋美, 韩成云, 等. 香榧叶精油的化学成分、抗氧化及抑菌活性的研究[J]. 中国粮油学报, 2020, 35(2): 98-104. DOI:10.3969/j.issn.1003-0174.2020.02.017 |
| [16] |
BAKKALI F, AVERBECK S, AVERBECK D, et al. Biological effects of essential oils: a review[J]. Food & Chemical Toxicology, 2008, 46(2): 446-475. |
| [17] |
GWINN K D, OWNLEY B H, GREENE S E, et al. Role of essential oils in control of Rhizoctonia damping-off in tomato with bioactive monarda herbage[J]. Phytopathology, 2010, 100(5): 493-501. DOI:10.1094/PHYTO-100-5-0493 |
| [18] |
BANIHASHEMI Z, ABIVARDI C. Evaluation of fungicidal and fungistatic activity of plant essential oils towards plant pathogenic and saprophytic fungi[J]. Phytopathologia Mediterranea, 2011, 50(2): 245-256. |
| [19] |
ABBASSY M A, MAREI G I. Antifungal and chemical composition of essential oils of Juniperus communis L.and Thymus vulgaris L.against two phytopathogenic fungi[J]. Journal of Applied Sciences Research, 2013, 9(8): 4584-4588. |
| [20] |
BADEA M L, DELIAN E. In vitro antifungal activity of the essential oils from Artemisia spp. L. on Sclerotinia sclerotiorum[J]. Romanian Biotechnological Letters, 2014, 19(3): 9345-9352. |
| [21] |
YU C Y, ZHANG J F, WANG T. Star anise essential oil: chemical compounds, antifungal and antioxidant activities: a review[J]. Journal of Essential Oil Research, 2021, 33(1): 1-22. DOI:10.1080/10412905.2020.1813213 |
| [22] |
OUKNIN M, MAJIDI L, CHIBANE E M, et al. Chemical profile, antioxidant and antifungal activity of essential oil from Cladanthus eriolepis[J]. Journal of Essential Oil Bearing Plants, 2020, 23(6): 1296-1305. DOI:10.1080/0972060X.2020.1868349 |
| [23] |
BOCATE K P, EVANGELISTA A G, LUCIANO F B. Garlic essential oil as an antifungal and anti-mycotoxin agent in stored corn[J]. LWT, 2021, 147: 111600. DOI:10.1016/j.lwt.2021.111600 |
| [24] |
郭磊. 香榧不同组织挥发性成分分析及果壳活性炭的制备[D]. 合肥: 安徽农业大学, 2014: 21-31. http://cdmd.cnki.com.cn/Article/CDMD-10364-1015403249.htm
|
| [25] |
段芳芳. 香榧假种皮化学成分及生物活性研究[D]. 杭州: 浙江农林大学, 2017: 13-39. https://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&filename=1018086378.nh
|
| [26] |
CHEN B Q, CUI X Y, ZHAO X, et al. Antioxidative and acute antiinflammatory effects of Torreya grandis[J]. Fitoterapia, 2006, 77(4): 262-267. DOI:10.1016/j.fitote.2006.03.019 |
| [27] |
鲍建峰. 香榧假种皮提取物成分分析及功能研究[D]. 杭州: 浙江大学, 2010: 47-60. http://cdmd.cnki.com.cn/Article/CDMD-10335-2010063909.htm
|
| [28] |
李彪, 倪伟超, 倪穗. 新鲜与干燥香榧假种皮精油成分及抑菌效果比较研究[J]. 中国野生植物资源, 2017, 36(3): 14-17. DOI:10.3969/j.issn.1006-9690.2017.03.004 |
| [29] |
陈敏杰. 三种植物精油微胶囊的制备及其性能研究[D]. 广州: 华南农业大学, 2016: 22-72. http://cdmd.cnki.com.cn/Article/CDMD-10564-1016923463.htm
|
| [30] |
李娜. 紫苏精油提取及其防腐复合材料的制备和性能研究[D]. 太原: 中北大学, 2018: 72-97. http://cdmd.cnki.com.cn/article/cdmd-10110-1018186486.htm
|
| [31] |
HASHEMINEJAD N, KHODAIYAN F, SAFARI M. Improving the antifungal activity of clove essential oil encapsulated by chitosan nanoparticles[J]. Food Chemistry, 2019, 275: 113-122. DOI:10.1016/j.foodchem.2018.09.085 |
| [32] |
MAHAJAN R, TANDON R, KALIA A, et al. Nanoemulsion formulation of Ocimum gratissimum essential oil and its antifungal activity against Penicillium digitatum[J]. Journal of Nanoscience and Nanotechnology, 2021, 21(6): 3556-3565. DOI:10.1166/jnn.2021.19008 |

 2021, Vol. 41
2021, Vol. 41


