文章信息
- 陈伟楠, 曹磊, 冷平生, 胡增辉
- CHEN Weinan, CAO Lei, LENG Pingsheng, HU Zenghui
- 北京地区槲树外生菌根真菌群落特征
- Community composition of ectomycorrhizal fungi associated with Quercus dentata in Beijing, China
- 森林与环境学报,2021, 41(6): 629-636.
- Journal of Forest and Environment,2021, 41(6): 629-636.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2021.06.009
-
文章历史
- 收稿日期: 2021-06-26
- 修回日期: 2021-09-24
2. 中国林业科学研究院森林生态环境与保护研究所, 北京 100091;
3. 北京三元绿化工程有限公司, 北京 100026;
4. 城乡生态环境北京实验室, 北京 102206
2. Research Institute of Forest Ecology, Environment and Protection, Chinese Academy of Forestry, Beijing 100091, China;
3. Beijing Sanyuan Green Engineering Co., Ltd, Beijing 100026, China;
4. Beijing Laboratory for Urban and Rural Ecological Environment, Beijing 102206, China
外生菌根是土壤中外生菌根真菌与宿主植物根系形成的互惠共生有机体,是生态系统重要组成部分。外生菌根能增加植物根系吸收面积,增强对水分和营养元素的吸收,在促进林木生长发育,提升植物抗逆性,改善土壤微生物群落结构方面发挥着重要作用。据统计,目前已经发现超过20 000种担子菌和子囊菌能够与近7 000种植物共生形成外生菌根[1]。
我国是壳斗科栎属植物分布中心之一,共有60余种,广泛分布于南北各地。栎类树种是我国天然林中第一大类树木,是我国山区森林群落的建群种和优势种。外生菌根在栎类树种生长发育中起着重要作用,对于栎树外生菌根真菌在国内也有一些研究。包括北京东灵山辽东栎(Quercus liaotungensis Koidz) [2]、辽宁冰砬山蒙古栎(Quercus mongolica Fisch. ex Ledeb.) [3]、秦岭辛家山林区锐齿栎(Quercus aliena Bl. var. acuteserrata Maxim. ex Wenz.) [4]、太行山片麻岩区栓皮栎(Quercus variabilis Bl.) [5]、引种到浙江的弗吉尼亚栎(Quercus virginiana Mill.) [6]等在内的不同栎树外生菌根真菌多样性已被检测和报道,但由于我国栎类树种分布范围广,对不同地区外生菌根真菌群落分布特征还缺少足够了解。槲树(Quercus dentata Thunb.) 是我国北温带和亚热带北部山地森林群落的重要组成树种,是北京山区森林群落的建群种。槲树具有抗逆性强、寿命长、观赏价值高等特点,是优良的多功能生态景观树,在北京平原园林绿化中已有少量应用。近年来,在槲树繁育[7-8]、抗逆性[9-10]等方面有了少量研究,但对其外生菌根真菌的组成、特点及作用等尚缺乏了解。
传统的菌根真菌多样性研究以子实体和外生菌根形态及解剖观察为主,在鉴定形态特征相似的真菌时缺乏准确性。近年来,随着分子生物学技术的发展,聚合酶链式反应(polymerase chain reaction,PCR)、限制片段长度多态性(restriction fragment length polymorphism,RFLP)、随机扩增多态性DNA (random amplified polymorphic DNA,RAPD) 等技术,特别是高通量测序技术的应用,为外生菌根真菌多样性研究提供了技术支撑[1]。目前,高通量测序技术已广泛应用到红松(Pinus koraiensis Sieb. et Zucc.) [11]、云杉(Picea crassifolia Kom.) [12]、樟子松(Pinus sylvestris Linn. var. mongolica Litv.) [13-14]、马尾松(Pinus massoniana Lamb.) [15]、白桦(Betula platyphylla Suk.) [16]等林木外生菌根真菌多样性研究中,并在栎属植物中也开始应用[5-6]。因此,高通量测序技术为探索槲树外生菌根真菌群落特征提供了有力工具。
本研究以上方山国家森林公园、百望山国家森林公园、云蒙山国家森林公园和黄松峪国家地质公园4个槲树山区分布地,及陶然亭公园1个槲树平原引种地为采样地,采集土壤和根部样品,测定土壤的理化指标,利用高通量测序技术分析根部外生菌根真菌多样性,分析外生菌根真菌类群与环境因子的关系,为进一步揭示槲树外生菌根真菌群落特征和分布规律提供了参考与支撑。
1 材料与方法 1.1 采样地概况上方山国家森林公园(115°49′E,39°40′N,SH)、百望山国家森林公园(116°15′E,40°1′N,BH)、云蒙山国家森林公园(116°40′E,40°35′N,YH)、黄松峪国家地质公园(117°15′E,40°14′N,HH) 和陶然亭公园(116°22′E,39°52′N,TH) 均位于北京境内,属于暖温带半湿润季风性气候。各采样地主要生态因子及林分特征见表 1。上方山采样地林分为原始次生林,主要伴生树种有槲栎(Quercus aliena Bl.、青檀(Pteroceltis tatarinowii Maxim.)、栓皮栎、侧柏[Platycladus orientalis (L.) Franco]、大叶朴(Celtis koraiensis Nakai)、大叶白蜡(Fraxinus rhynchophylla Hance)、构树[Broussonetia papyrifera (L.) Vent.]。百望山采样地林分为人工林,主要伴生树种有侧柏、油松(Pinus tabuliformis Carr.)、黄栌(Cotinus coggygria Scop.)、元宝枫(Acer truncatum Bunge)、火炬树(Rhus typhina L.)、柿树(Diospyros kaki Thunb.)、栓皮栎。云蒙山采样地林分为原始次生林,主要伴生树种有山杨(Populus davidiana Dode)、元宝枫、蒙椴(Tilia mongolica Maxim.)、华北落叶松(Larix principis-rupprechtii Mayr)、蒙古栎、白桦、蒙桑[Morus mongolica (Bur.) Schneid.]、糠椴(Tilia mandshurica Rupr. et Maxim.)、槲栎。黄松峪采样地林分为原始次生林,主要伴生树种有山荆子[Malus baccata(L.) Borkh.]、山杏[Armeniaca sibirica (L.) Lam.]、君迁子(Diospyros lotus L.)、油松、栓皮栎、蒙桑、大果榆(Ulmus macrocarpa Hance)。陶然亭采样地为城市绿地,主要伴生树种有西府海棠(Malus micromalus Makino)、元宝枫、紫叶李[Prunus cerasifera Ehrhar f. atropurpurea (Jacq.) Rehd.]、栾树(Koelreuteria paniculata Laxm.)、国槐(Sophora japonica L.)、悬铃木[Platanus acerifolia (Ait.) Willd.]。
| 采样地 Sampling plot |
海拔 Altitude /m |
坡度 Slope gradient |
坡向 Slope direction |
年平均气温 Annual average temperature/℃ |
年降水量 Annual rainfall/mm |
腐殖层厚度 Thickness of soil humus/cm |
郁闭度 Canopy density |
平均胸径 Average diameter at breast height/cm |
| 上方山国家森林公园SH | 551 | 26°04′ | 北偏西41° 41° north by west | 10.8 | 710 | 4.4 | 0.7 | 16.1 |
| 百望山国家森林公园BH | 204 | 51° | 南偏东59° 59° south by east | 11.6 | 630 | 2.1 | 0.6 | 16.0 |
| 云蒙山国家森林公园YH | 475 | 26°05′ | 正北Due north | 10.9 | 700 | 2.4 | 0.4 | 39.3 |
| 黄松峪国家地质公园HH | 424 | 39°04′ | 正西Due west | 11.9 | 666 | 1.6 | 0.6 | 10.4 |
| 陶然亭公园TH | 8 | 0° | 12.0 | 450 | 1.2 | 0.7 | 17.5 |
2017年7月,在每个采样地内设置3个20 m×20 m标准地,每个标准地选择3棵距离相差10 m以上的槲树,采集土样和根样。每棵树分别于北、西南、东南3个方向距树干50 cm处设置直径20 cm的采样坑。使用抖落法采集根际土壤,取10~20 cm侧根,将附着土壤抖入自封袋内,置于冰盒中。剪切生有外生菌根的幼嫩细根10~15 cm,放入密封袋内,置于冰盒中。将每棵树的3份土壤样品混合,3份根样混合,分别作为一棵树的土样和根样,再将同一个标准地3份土样和3份根样进行混合,最后每个采样地得到3份土样和3份根样,即3个重复。土样置于阴凉处风干,研磨后0.25 mm孔径筛网过筛,分析理化性质。根段清洗干净后剪成2 cm小段,置于液氮中,进行高通量测序。
1.3 土壤理化性质测定参考乔胜英[17]的方法,测定土壤理化指标。土壤pH值测定采用电位法,经水土比5∶1浸提后,用台式pH计(DELTA320,Mettler-Toledo,瑞士) 测定;土壤电导率(electrical conductivity,EC) 采用电极法,经水土比5∶1浸提后,使用电导率仪(DDSJ-308A,上海盛磁仪器有限公司,中国) 测定;土壤全氮(total nitrogen,TN) 含量采用半微量凯式法测定;土壤全磷(total phosphorus,TP) 与全钾(total potassium,TK) 含量采用硫酸与高氯酸消煮法测定;土壤有机碳(total organic carbon,TOC) 含量采用重铬酸钾法测定。土壤蔗糖酶(invertase,INV) 活性采用Na2S2O3滴定法测定;脲酶(urease,URE) 活性采用靛酚蓝比色法测定;磷酸酶(phosphatase,PHO) 活性采用磷酸苯二钠比色法测定[18]。
1.4 DNA提取、PCR扩增与测序使用天根基因提取试剂盒(DP305) 提取基因组DNA,利用1%琼脂糖凝胶电泳检测完整性,使用正向引物ITS3_KYO2F:5′-GATGAAGAACGYAGYRAA-3′和反向引物ITS4R:5′-TCCTCCGCTTATTGATATGC-3′对ITS区域进行扩增。第1轮扩增体系为宏基因组DNA 10~30 ng、2×KAPA HiFi HotStart ReadyMix 12.5 μL、Specific PrimerF/R各0.25 μL、ddH2O补齐→震荡离心,按如下条件进行扩增:95 ℃ 3 min,95 ℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,之后至第2个温度循环25次,72 ℃ 5 min,4 ℃ 35 min,2%琼脂糖凝胶电泳检测,产物纯化。第2轮PCR扩增体系为纯化产物5 μL,2×KAPA HiFi HotStart ReadyMix 12.5 μL,index Primer 1 μL,index Primer 1 μL,ddH2O 5.5 μL,震荡离心,按第1轮扩增条件进行PCR扩增,电泳检测后,切胶回收。产物纯化后,委托北京源宜基因科技公司采用Illumina MiSeq平台进行高通量测序。所得的原始数据,去除Reads接头和barcode序列,去掉含有不确定碱基的序列、平均质量小于Q20等序列,去除非特异性扩增序列及嵌合体,得到有效序列数据。
1.5 生物信息学分析获得有效序列后,采用QIIME软件按97%的相似度阈值划分操作分类单元(operational taxonomic unit,OTU),通过将OTU序列与真菌ITS数据库的模板序列进行比对,获取每个OTU的分类学信息。根据OTU分类鉴定信息及相对丰度,使用QIIME软件获得每组样本在各分类水平的具体组成,通过柱状图进行展示。使用R软件计算各组共有或特有的OTU数量,采用韦恩图进行展示。使用QIIME软件分别对每组样本计算α多样性指数,包括Chao1、Ace、Simpson和Shannon指数。使用R语言(version 3.1.2) 的vegan软件包进行β多样性分析[6]。基于消除趋势的对应分析(detrended correspondence analysis,DCA) 分析,采用典范对应分析(canonical correspondence analysis,CCA) 分析确定环境因子对真菌群落影响程度,并通过Spearman分析明确菌根真菌与环境因子的相关性。
2 结果与分析 2.1 不同采样地土壤理化指标各采样地的土壤pH值、电导率、养分含量及酶活性等理化指标见表 2。不同采样地的土壤pH值存在显著差异。5个采样地的土壤pH值均呈现弱酸性,其中云蒙山的最低,较黄松峪的低13.07%。不同采样地的土壤电导率在20~60 μS·cm-1之间,也表现出较大差异,其中陶然亭的显著高于其他采样地,为云蒙山的2.68倍。上方山、百望山和黄松峪的全氮含量较高,显著高于云蒙山和陶然亭的,含量最低的陶然亭仅为上方山的23.21%。陶然亭的全磷含量显著高于其他采样地,达到黄松峪的2.86倍。各样地的全钾含量与全氮含量规律相似,上方山的最高,黄松峪的略低,但与上方山的无显著差异。上方山和百望山的总有机碳含量显著高于其他3个采样地,陶然亭的最低。对于碳氮比值,陶然亭的显著高于其他4个采样地,上方山、云蒙山和黄松峪的相对较低。上方山的脲酶活性最高,百望山和云蒙山的较低,上方山的为云蒙山的2.29倍。百望山、陶然亭和黄松峪的蔗糖酶活性显著高于上方山和云蒙山的,百望山的达到云蒙山的1.80倍。百望山和黄松峪的磷酸酶活性显著高于其他采样地,最高的百望山为陶然亭的10.60倍。
| 采样地 Sampling plot |
pH值 pH value |
电导率 EC /(μS·cm-1) |
全氮含量 TN content/(g·kg-1) |
全磷含量TP content/(g·kg-1) | 全钾含量TK content/(g·kg-1) |
| 上方山国家森林公园SH | 6.58±0.13ab | 45.23±2.62b | 2.93±0.27a | 0.34±0.04c | 6.73±0.37a |
| 百望山国家森林公园BH | 6.18±0.11bc | 43.19±3.44b | 2.57±0.21a | 0.42±0.03b | 5.49±0.30b |
| 云蒙山国家森林公园YH | 6.05±0.08c | 20.90±1.93d | 2.08±0.12b | 0.31±0.03c | 4.55±0.29c |
| 黄松峪国家地质公园HH | 6.96±0.13a | 28.83±2.26c | 2.69±0.22a | 0.28±0.02d | 6.71±0.40a |
| 陶然亭公园TH | 6.88±0.11a | 56.10±3.15a | 0.68±0.08c | 0.80±0.06a | 3.82±0.38d |
| 采样地 Sampling plot |
总有机碳含量 TOC content/(g·kg-1) |
碳氮比 C/N |
脲酶活性 URE activity/(mg·g-1·d-1) |
蔗糖酶活性 INV activity/(mg·g-1·d-1) |
磷酸酶活性 PHO activity/(mg·g-1·d-1) |
| 上方山国家森林公园SH | 71.73±6.31a | 14.22±1.51bc | 102.68±9.32a | 16.92±1.41b | 12.29±0.76b |
| 百望山国家森林公园BH | 72.59±6.84a | 16.61±1.33b | 44.90±3.23c | 21.30±2.34a | 15.47±1.17a |
| 云蒙山国家森林公园YH | 49.92±4.25c | 13.83±1.54c | 44.87±3.96c | 11.85±1.14c | 10.03±0.73c |
| 黄松峪国家地质公园HH | 60.51±5.11b | 12.96±1.84c | 81.45±6.94b | 20.38±1.95a | 14.56±1.23a |
| 陶然亭公园TH | 26.47±1.87d | 22.35±2.62a | 80.52±7.85b | 20.81±1.82a | 1.46±0.20d |
| 注:同列数据后不同小写字母表示各采样地间差异达0.05显著水平(P<0.05)。Note: values in the same column followed by the different lowercase letters are significantly different among different sampling plots at 0.05 level (P<0.05). | |||||
5个采样地样本测序得到的总序列数分别为上方山59 037,百望山61 799,云蒙山58 343,黄松峪61 334,陶然亭54 432,获得的有效序列数分别为上方山54 597,百望山58 994,云蒙山54 857,黄松峪54 893,陶然亭52 552,有效序列占比大于93%。聚类获得的OTU数分别为上方山103,百望山71,云蒙山28,黄松峪78,陶然亭91,排序为上方山>陶然亭>黄松峪>百望山>云蒙山。
槲树外生菌根真菌α多样性指数见表 3,Chao1和Ace指数表示群落丰富度。从表 3可以看出,5个样地的Chao1和Ace指数与OTU的数值相似,排序也与OTU一致。Simpson和Shannon指数表示群落多样性,上方山的Simpson指数最小,陶然亭的最大,达0.418 498;而对于Shannon指数,则是上方山的最大,陶然亭的最小。综合来看,上方山的外生菌根真菌丰富度和多样性最高,陶然亭的多样性最低,百望山的丰富度最低,云蒙山与黄松峪的丰富度和多样性中等。
| 采样地 Sampling plot |
α多样性指数α diversity index | |||
| Chao1 | Ace | Simpson | Shannon | |
| 上方山国家森林公园SH | 103 | 103 | 0.097 007 | 3.008 603 |
| 百望山国家森林公园BH | 71 | 72 | 0.240 671 | 2.029 422 |
| 云蒙山国家森林公园YH | 28 | 28 | 0.167 262 | 2.019 509 |
| 黄松峪国家地质公园HH | 78 | 78 | 0.098 747 | 2.742 990 |
| 陶然亭公园TH | 94 | 93 | 0.418 498 | 1.609 209 |
槲树外生菌根真菌在属水平的相对丰度见图 1。在5个采样地中,红菇属(Russula)和小菇属(Mycena) 在黄松峪中的比例相对较高,相对丰度分别达到15.98%、16.32%;上方山的各菌种相对较均匀,其中红菇属的相对丰度较高,达到6.43%;云蒙山的丝膜菌属(Cortinarius) 相对丰度达34.00%,高于其他采样地;百望山相对丰度最高的为棉革菌属(Tomentella),陶然亭相对丰度最高的为块菌属(Tuber)。
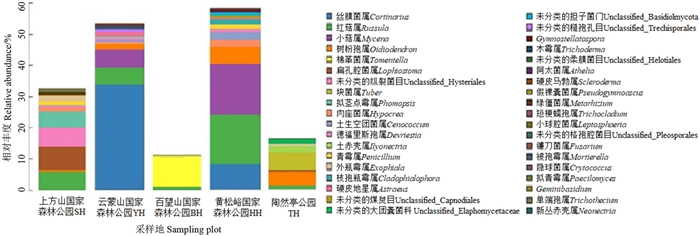
|
图 1 槲树外生菌根真菌在属水平的相对丰度 Fig. 1 Relative abundance of the ectomycorrhizal fungi associated with Q. dentata at the genus level |
槲树外生菌根真菌群落β多样性见图 2。百望山和陶然亭的群落组成差异最小,表现出较高的相似度,而其他采样地之间的外生菌根真菌群落组成差异较大,相似度较低。
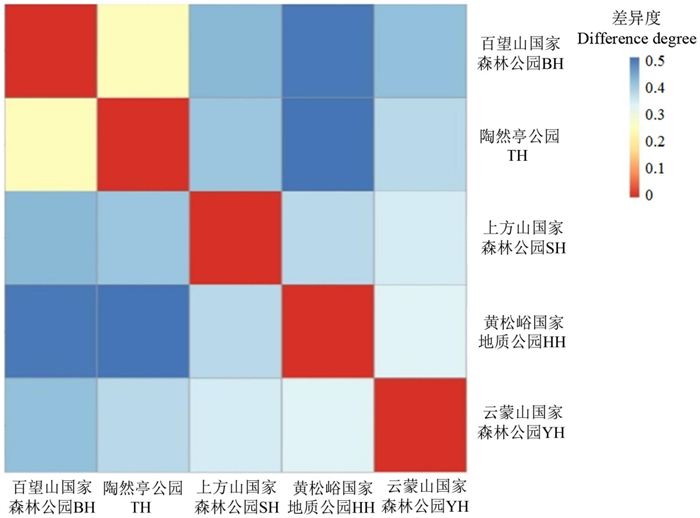
|
注:数值越大表明差异越大。 Note: the larger the value, the greater the difference. 图 2 槲树外生菌根真菌群落β多样性 Fig. 2 Differences in the β diversity of ectomycorrhizal fungal communities associated with Q. dentata |
图 3为环境因子与槲树外生菌根真菌群落的典范对应分析结果。第1轴可解释所有信息的15.7%,第2轴可解释14.4%,总解释率为30.1%。图中箭头长度越长,表示环境因子对群落影响越大。从图 3可以看出,坡度和碳氮比对槲树外生菌根真菌群落影响最大;其次是胸径、磷酸酶活性和全钾含量。样本点与箭头的距离表示该环境因子对样本作用的强弱,距离越近作用越强。从图 3还可以看出,全磷含量、胸径、脲酶活性、电导率值对上方山、百望山、陶然亭和云蒙山的作用相对较强,全氮和全钾含量对黄松峪的作用相对较强。
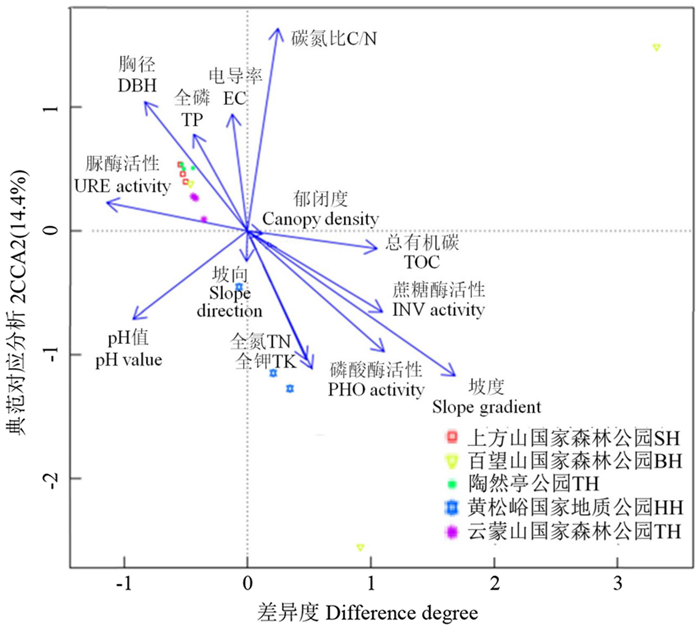
|
图 3 环境因子与外生菌根真菌群落典范对应分析 Fig. 3 CCA between environmental factors and ectomycorrhizal fungal communities |
图 4显示了门水平下相对丰度最大的6个外生菌根真菌与环境因子相关性。担子菌门(Basidiomycota) 与电导率、磷酸酶活性、全磷、全氮、碳氮比、胸径、坡度的相关性较高,其中与磷酸酶活性、全氮、坡度呈显著正相关,与全磷呈显著负相关,而与电导率、碳氮比、胸径呈极显著负相关。球囊菌门(Glomeromycota) 仅与坡度呈显著正相关。接合菌门(Zygomycota) 与全钾与脲酶活性呈显著正相关,与坡度表现出极显著的正相关性。

|
注:红色表示环境因子与菌种间呈正相关性; 蓝色表示环境因子与菌种间呈负相关性; *表示显著相关(P<0.05);**表示极显著相关(P<0.01);***表示极极显著相关(P<0.001)。 Note: red indicates a positive correlation between environmental factors and ectomycorrhizal fungi, whereas blue indicates a negative correlation, * indicates a significant correlation (P < 0.05), ** indicates an extremely significant correlation (P < 0.01), and *** indicates the highest significant correlation (P < 0.001). 图 4 门水平下外生菌根真菌与环境因子相关性 Fig. 4 Correlation between environmental factors and ectomycorrhizal fungi at the phylum level |
外生菌根在栎类树种生长发育及对环境适应中起着重要作用[19-22]。外生菌根真菌类型和群落组成受到环境因子影响[23-24]。槲树是北京山区森林群落的重要组成树种,但目前对其外生菌根真菌类群尚缺乏了解。本研究初步分析了北京地区槲树外生菌根真菌多样性和土壤理化性质,并对二者之间相关性进行了初步解析。从土壤理化指标来看,陶然亭公园的土壤全氮、全钾和总有机碳含量相对较低,而全磷含量则较高,可能与城市公园槲树林地枯枝落叶少,腐殖质层薄,以及养护管理措施有关。此外,陶然亭公园土壤磷酸酶活性极低,导致植物可利用态磷的转化量低,植物吸收磷的量少,从而造成较多的磷保留在土壤中。
红菇属、丝膜菌属、棉革菌属和块菌属为北京地区槲树主要外生菌根真菌类群,这4类真菌也是北京东灵山辽东栎的主要外生菌根真菌类群[2]。此外,魏松坡等[5]报道,红菇属是太行山片麻岩区阳坡栓皮栎的核心外生菌根真菌。红菇和棉革菌是浙江上虞滩涂盐碱地弗栎的主要外生菌根真菌[6]。在秦岭辛家山林区锐齿栎外生菌根真菌中,红菇属和块菌属为常见类群[4]。王晓冰[25]的研究也表明,棉革菌属、红菇属和块菌属是秦岭和黄土高原栎类树种主要的外生菌根真菌类群。可以看出,树种不同,地域不同,栎树外生菌根真菌主要类群也存在差异,这与树种本身特性和环境因子密切相关。
通过β多样性分析可以看出,百望山森林公园与陶然亭公园真菌群落组成较为相似,这是由于陶然亭公园位于城区平原,百望山森林公园也紧临城区,两地环境气候条件相似,受人为活动影响较为频繁,从而造成了相似的外生菌根真菌类型。
通过分析环境因子对外生菌根真菌群落的影响,发现碳氮比、坡度、胸径、全钾含量、磷酸酶活性的影响较为显著。土壤碳氮比是微生物生存环境良好的重要参考值[26]。ZHANG et al[27]在辽东栎中也发现,土壤碳氮比对外生菌根真菌的影响较大。坡度与土壤水分、养分密切相关,因此坡度可能是通过这些土壤因子间接影响真菌群落。DI MARINO et al[28]通过分析欧洲山毛榉(Fagus sylvatica) 外生菌根真菌群落,也发现坡度等因子影响作用较大。ZHANG et al[27]的研究也表明,黄土高原辽东栎外生菌根真菌类群分布与坡度等密切相关。胸径反映的是林木个体大小,即树龄。一般情况下,相较于成年树,幼树易受到真菌侵染,因而具有相对较高的外生菌根真菌多样性[29]。但也有不同的研究结果。ZHANG et al[30]发现,黄土高原上的辽东栎外生菌根真菌丰富度随着树龄的增加而升高。而WANG et al[2]的研究则认为北京东灵山辽东栎树龄对外生菌根真菌种类影响不大。树龄对外生菌根真菌的影响可能与地域环境关系密切。研究表明,土壤钾含量和磷含量与外生菌根关系密切[31]。云杉外生菌根真菌侵染率与土壤全钾含量具有显著的正相关性[32]。本研究中,与磷转化有关的磷酸酶活性对真菌群落具有较大影响。通过门水平下外生菌根真菌与环境因子关系的分析,发现担子菌门与电导率、碳氮比等多个环境因子显著相关,受环境因子影响较大。
本研究利用高通量测序技术首次对北京地区槲树外生菌根真菌多样性进行了探索,得到了能与槲树共生形成外生菌根的真菌类群,并初步明确了与环境因子的关系,为进一步揭示槲树外生菌根真菌的特征和分布奠定了基础。
| [1] |
冯邦, 杨祝良. 外生菌根共生: 共生真菌多样性及菌根形成的分子机制[J]. 中国科学: 生命科学, 2019, 49(4): 436-444. |
| [2] |
WANG Q, HE X H, GUO L D. Ectomycorrhizal fungus communities of Quercus liaotungensis Koidz of different ages in a northern China temperate forest[J]. Mycorrhiza, 2012, 22(6): 461-470. DOI:10.1007/s00572-011-0423-x |
| [3] |
王琴. 蒙古栎外生菌根真菌多样性研究[J]. 辽宁林业科技, 2013(3): 6-9, 14. DOI:10.3969/j.issn.1001-1714.2013.03.003 |
| [4] |
耿荣, 耿增超, 黄建, 等. 秦岭辛家山林区锐齿栎外生菌根真菌多样性[J]. 菌物学报, 2016, 35(7): 833-847. |
| [5] |
魏松坡, 宋怡静, 贾黎明, 等. 太行山片麻岩区栓皮栎外生菌根真菌多样性[J]. 菌物学报, 2018, 37(4): 422-433. |
| [6] |
靳微, 杨预展, 孙海菁, 等. 弗吉尼亚栎母树林外生菌根的真菌多样性[J]. 林业科学, 2020, 56(1): 120-132. |
| [7] |
李红德, 赵晓光. 槲树播种育苗技术[J]. 中国林业产业, 2007(3): 61. |
| [8] |
李学峰. 辽西地区槲树有性繁育与生态应用[J]. 防护林科技, 2018(2): 52, 58. |
| [9] |
曹磊, 陈伟楠, 胡增辉, 等. 盐碱胁迫对槲树幼苗生长与光合特性的影响[J]. 北京农学院学报, 2018, 33(4): 86-90. |
| [10] |
郝汉, 曹磊, 陈伟楠, 等. 盐胁迫对槲树(Quercus dentata)幼苗离子平衡及其生理生化特性的影响[J]. 生态学报, 2020, 40(19): 6897-6904. |
| [11] |
冀瑞卿, 高婷婷, 李冠霖, 等. 东北红松纯林菌根外生菌根真菌群落与环境因子的相关性[J]. 菌物学报, 2020, 39(4): 743-754. |
| [12] |
樊永军, 闫伟, 赵艳玲. 贺兰山地区青海云杉EM真菌群落组成与多样性[J]. 东北林业大学学报, 2019, 47(3): 89-93. |
| [13] |
赵敏, 郝龙飞, 张敏, 等. 红花尔基不同龄级天然樟子松外生菌根真菌群落结构特征[J]. 菌物学报, 2019, 38(9): 1420-1429. |
| [14] |
王家源, 殷小琳, 任悦, 等. 毛乌素沙地樟子松外生菌根真菌多样性特征[J]. 微生物学通报, 2020, 47(11): 3856-3867. |
| [15] |
涂晶晶, 吴峰, 孙学广, 等. 马尾松不同叶型幼苗外生菌根真菌群落特征[J]. 菌物学报, 2021, 40(1): 124-134. |
| [16] |
李敏, 高秀宏. 大青山白桦根围外生菌根真菌群落结构及其驱动因素[J]. 生态学杂志, 2021, 40(5): 1244-1252. |
| [17] |
乔胜英. 土壤理化性质实验指导书[M]. 武汉: 中国地质大学出版社, 2012.
|
| [18] |
关松荫. 土壤酶及其研究方法[M]. 北京: 中国农业出版社, 1986.
|
| [19] |
NARDINIA A, SALLEO S, TYREE M T, et al. Influence of the ectomycorrhizas formed by Tuber melanosporum Vitt. on hydraulic conductance and water relations of Quercus ilex L. seedlings[J]. Annals of Forest Science, 2000, 57(4): 305-312. DOI:10.1051/forest:2000121 |
| [20] |
阎秀峰, 王琴. 两种外生菌根真菌在辽东栎幼苗上的混合接种效应[J]. 植物生态学报, 2004, 28(1): 17-23. DOI:10.3321/j.issn:1005-264X.2004.01.003 |
| [21] |
孙云, 李柱军. 麻栎菌根化幼苗对水分胁迫的响应[J]. 四川林业科技, 2008, 29(6): 66-69. DOI:10.3969/j.issn.1003-5508.2008.06.014 |
| [22] |
付瑞, 郭素娟, 马履一. 菌根化栓皮栎苗木对不同土壤水分条件的形态和生理响应[J]. 西北林学院学报, 2011, 26(2): 101-104, 206. |
| [23] |
LIU H Y, CHEN H Y, DING G J, et al. Identification of candidate genes conferring tolerance to aluminum stress in Pinus massoniana inoculated with ectomycorrhizal fungus[J]. BMC Plant Biology, 2020, 20(1): 521. DOI:10.1186/s12870-020-02719-3 |
| [24] |
RUOTSALAINEN A L, MARKKOLA A M, KOZLOV M V. Mycorrhizal colonisation of mountain birch (Betula pubescens ssp. czerepanovii) along three environmental gradients: does life in harsh environments alter plant-fungal relationships?[J]. Environmental Monitoring and Assessment, 2009, 148(1/2/3/4): 215-232. |
| [25] |
王晓冰. 秦岭和黄土高原主要栎类外生菌根真菌群落研究[D]. 杨凌: 西北农林科技大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10712-1018007982.htm
|
| [26] |
QIAO C C, PENTON C R, LIU C, et al. Patterns of fungal community succession triggered by C/N ratios during composting[J]. Journal of Hazardous Materials, 2021, 401: 123344. DOI:10.1016/j.jhazmat.2020.123344 |
| [27] |
ZHANG J, TANIGUCHI T, TATENO R, et al. Ectomycorrhizal fungal communities of Quercus liaotungensis along local slopes in the temperate oak forests on the Loess Plateau, China[J]. Ecological Research, 2013, 28(2): 297-305. DOI:10.1007/s11284-012-1017-6 |
| [28] |
DI MARINO E, MONTECCHIO L, SCATTOLIN L, et al. The ectomycorrhizal community structure in European beech forests differing in coppice shoot age and stand features[J]. Journal of Forestry, 2009, 107(5): 250-259. |
| [29] |
傅深展. 欧洲山毛榉和油松外生菌根菌多样性研究[D]. 北京: 中国科学院微生物研究所, 2006. http://www.irgrid.ac.cn/handle/1471x/259022
|
| [30] |
ZHANG J, TANIGUCHI T, XU M, et al. Ectomycorrhizal fungal communities of Quercus liaotungensisalong different successional stands on the Loess Plateau, China[J]. Journal of Forest Research, 2014, 19(4): 395-403. DOI:10.1007/s10310-013-0433-y |
| [31] |
贺小香, 谭周进, 肖启明, 等. 外生菌根的功能及与环境因子的关系[J]. 中国生态农业学报, 2007, 15(2): 201-204. |
| [32] |
耿荣, 耿增超, 黄建, 等. 秦岭辛家山林区云杉外生菌根真菌多样性[J]. 微生物学报, 2015, 55(7): 905-915. |

 2021, Vol. 41
2021, Vol. 41


