文章信息
- 肖石红, 孙红斌, 张卫强, 黄芳芳, 甘先华, 唐成波
- XIAO Shihong, SUN Hongbin, ZHANG Weiqiang, HUANG Fangfang, GAN Xianhua, TANG Chengbo
- 干旱胁迫对银叶树幼苗光合生理特性的影响
- Effect of drought stress on photosynthetic physiology of Heritiera littoralis seedlings
- 森林与环境学报,2021, 41(6): 584-592.
- Journal of Forest and Environment,2021, 41(6): 584-592.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2021.06.004
-
文章历史
- 收稿日期: 2021-07-08
- 修回日期: 2021-10-05
2. 广东省林业科学研究院, 广东 广州 510520;
3. 深圳市野生动物救护中心, 广东 深圳 518040
2. Guangdong Academy Forestry, Guangzhou, Guangdong 510520, China;
3. Shenzhen Wildlife Rescue Center, Shenzhen, Guangdong 518040, China
近年来,随着全球气候异常变化加剧,干旱现象的发生频率、持续时间和严重程度日益严峻[1-2]。尽管广东省降水量丰富,但因雨量、时空分布不均,极端天气出现频率增加,气象干旱阶段性严重,尤其是夏季高温少雨天气导致气象干旱迅速发展[3],干旱问题已严重影响农林生产[4]。植物的光合生理过程是对干旱极为敏感的过程之一,干旱也是影响植物生长和代谢的首要因素[5],光合和叶绿素荧光参数是描述植物在干旱胁迫下生理状态的重要指标。在干旱条件下,植物叶片气孔关闭、水分平衡失调、叶肉细胞损伤或酶活性降低等,CO2的摄取和光合作用也随之降低,导致光能大量过剩,光合器官也因光能不能及时耗散而对植物器官造成潜在危害[6]。长期严重的干旱胁迫会抑制植物生长,并引起其表观形态不可逆的变化,最终导致植物死亡,从而影响生态系统平衡[7]。研究干旱胁迫对植物生长、光合生理特征等方面的影响,探索其响应规律,对揭示植物对干旱的适应能力和抗旱机理有重要意义。
银叶树(Heritiera littoralis Dryand.) 隶属于梧桐科银叶树属,常生长于热带、亚热带海滨地区,但它与典型红树植物不同的是其不具有耐高渗透压及气生根等特性[8],因此被称为半红树植物[9]。近年来,由于受到人为破坏,银叶树分布面积急剧下降,中国现存成年个体数在20株以上的银叶树种群仅见于深圳盐灶、海丰香坑、海南清澜港和广西防城港等沿海区域[10],而沿海区域立地条件较为恶劣,诸如淡水资源缺乏、土壤瘠薄、常年海风强度大、土壤水分蒸发快等干旱因素限制了沿海银叶树植被恢复的效果。目前,研究学者们已对银叶树生物学特性[11]、种群结构[12]、群落结构与多样性[13]、耐盐机理[14]和遗传多样性[15]等方面做了相关研究,而干旱胁迫处理下银叶树幼苗光合和叶绿素荧光研究鲜有报道。本研究以银叶树1.5年生实生苗为研究对象,采用盆栽控水模拟不同程度的土壤水分状况,研究干旱胁迫对银叶树幼苗光合生理特性的影响,了解其对干旱的适应能力,以期为银叶树的耐旱选育和推广提供科学依据。
1 材料与方法 1.1 供试材料2019年5月,在广东省林业科学研究院苗圃(广州) 开始进行试验,选用长势良好、生长基本一致、叶片数量接近的1.5年生银叶树生实生苗为试验材料,生长的土壤用黄心土和泥炭土按质量比(m : m) 5 : 1的比例配成,苗木统一使用塑料盆(上口径20 cm、下口径16 cm、高20 cm) 栽培,每盆1株定植。实生苗平均株高64.1 cm,平均地径0.88 cm,基质土壤pH值为6.1,全氮、全磷和全钾含量分别为0.79、0.48和5.90 mg · g-1,容器苗置于大棚(大棚四周留通风口,通风口宽度为1.0 m),进行常规水分管理。
1.2 试验设计试验植株正常水分管理1个月后,设置对照(CK,为土壤最大持水量的75%~80%)、轻度干旱(light drought stress,LS,为土壤最大持水量的55%~60%)、中度干旱(medium drought stress,MS,为土壤最大持水量的35%~40%) 和重度干旱(severe drought stress,SS,为土壤最大持水量的15%~20%) 4个水分处理。采用土壤水分速测仪测定土壤含水量,每个处理15个重复。试验期间,每天采用称重法对植株进行补水控水,以维持各处理所设定的土壤相对含水量,在整个试验过程中以大棚自然温度和光照为主,栽培基质保持自然肥力,不施肥。水分胁迫1个月后,测定植株株高、地径、相对叶绿素含量(relative chlorophyll content,SPAD值)、光合光响应参数和叶绿素荧光参数等指标。
1.3 光合光响应测定2019年7月中旬,每处理挑选4株长势一致的苗木,每株选取两片成熟、舒展的叶片测定光合参数。光合有效辐射(photosynthetic effective radiation,PAR) 强度设置为1 800、1 500、1 200、1 000、800、600、400、200、100、50、20、0 μmol · m-2 · s-1,CO2浓度设定为400 μmol · mol-1,每叶片重复3次,连续测定3 d,每天上午8 : 30—11 : 00测定,记录净光合速率(net photosynthetic rate,Pn)、蒸腾速率(transpiration rate,Tr)、胞间CO2浓度(intercellular CO2 concentration,Ci) 等参数,水分利用效率(water use efficiency,WUE) 利用公式WUE=Pn/Tr计算。采用非直角双曲线模型[16],对试验过程中测得的银叶树幼苗光响应曲线(Pn-PAR) 进行最大净光合速率(maximum net photosynthetic rate,Pn, max)、表观量子效率(apparent quantum yield,AQY)、暗呼吸速率(dark respiration rate,Rd) 等光合参数计算,并采用Photosyn Assistant软件计算光补偿点(light compensation point,LCP) 和光饱和点(light saturation point,LSP)。
1.4 叶绿素荧光参数测定叶绿素荧光参数测定与光合参数测定日期保持一致,每处理挑选4株长势一致的苗木,每株选取两片长势一致的叶片测定叶片荧光参数,测定时间均为8 : 30—11 : 00和14 : 30—17 : 00,每叶片重复3次,连续测定3 d。测定前采用铝箔纸包裹叶片暗适应,先测定初始荧光(initial fluorescence,F0) 和光系统Ⅱ中的最大光能转换效率(maximum photochemical efficiency,Fv/Fm)。光活化后,测定电子传递速率(electron transfer rate,ETR)、实际光化学量子效率(actual quantum efficiency,ΦPSⅡ)、光化学淬灭系数(photochemical quenching coefficient,qP)、非光化学猝灭系数(non-photochemical quenching coefficient,NPQ) 等参数。天线热耗散(fraction of photons dissipated in the antenna,D)、光化学耗散(fraction of photons utilized in PSⅡ photochemisty,P)、PSⅡ反应中心非光化学能量耗散(fraction of absorbed photons by PSⅡ neither used in photochemistry nor dissipated in the PSⅡ,E) 计算如下[17]:
| $ \begin{aligned} D / \%=\left(1-F_{\mathrm{v}} / F_{\mathrm{m}}\right) \times 100 \\ \end{aligned} $ | (1) |
| $ P / \%=q_{\mathrm{P}}\left(F_{\mathrm{v}} / F_{\mathrm{m}}\right) \times 100 $ | (2) |
| $ E / \%=\left(1-q_{\mathrm{P}}\right)\left(F_{\mathrm{v}} / F_{\mathrm{m}}\right) \times 100 $ | (3) |
分别采用游标卡尺和卷尺测定银叶树幼苗株高和地径;采用便携式叶绿素含量测定仪(SPAD-502,日本) 测定不同处理银叶树幼苗叶片中部SPAD值,每株测定3片叶片,取平均值。
1.6 数据分析与统计方法采用SPSS 16.0统计软件对所有数据进行单因素方差分析,利用Duncan法进行差异显著性检验(α=0.05),所有图用Excel 2016软件制作。
2 结果与分析 2.1 干旱胁迫对银叶树幼苗生长的影响从表 1可知,银叶树幼苗株高生长量随干旱胁迫加剧而下降,与CK相比,LS、MS和SS处理下株高生长量降幅分别为44.01%、75.30%和93.85%,CK处理下株高生长量显著高于其他处理(P < 0.05)。银叶树幼苗地径生长量随干旱胁迫的增强呈先上升后下降的趋势,与CK相比,LS处理下地径生长量增幅为7.08%,而MS和SS处理下地径生长量降幅分别为35.38%和53.77%,CK处理下地径生长量显著高于SS处理(P < 0.05)。银叶树幼苗叶片SPAD值随干旱胁迫的增强呈先升高后降低的趋势,与CK相比,LS处理的升高幅度为5.39%,MS和SS处理的降低幅度分别为1.85%和7.96%,LS处理下的叶片SPAD值显著高于MS与SS处理(P < 0.05),但与CK处理差异不显著。银叶树幼苗叶片数量随干旱胁迫的增强呈减少的趋势,与CK相比,叶片数量为LS处理减少6.45%、MS处理减少25.81%和SS处理减少48.39%,CK和LS处理下叶片数量显著多于MS和SS处理(P < 0.05)。
| 处理 Treatment |
株高生长量Increment of seedling height/cm |
地径生长量Increment of ground diameter/mm |
相对叶绿素含量 SPAD value |
叶片数量 Leaf number/piece |
| 对照CK | 9.27±0.90a | 2.12±0.32ab | 49.14±1.01ab | 31±2a |
| 轻度干旱LS | 5.19±0.78b | 2.27±0.29a | 51.79±1.19a | 29±2a |
| 中度干旱MS | 2.29±0.31c | 1.37±0.25bc | 48.23±1.02b | 23±1b |
| 重度干旱SS | 0.57±0.11c | 0.98±0.21c | 45.23±0.83c | 16±1c |
| 注:同列数据后不同小写字母表示处理间差异显著(P < 0.05)。Note: different lowercase letters in the same column indicate significant differences under different drought treatments(P < 0.05). | ||||
光合指标对判定植物在历经胁迫时光合作用能力及其受环境因子变化的影响程度具有重要作用[18]。从表 2可知,随着干旱胁迫的加剧,银叶树幼苗叶片的Pn, max逐渐下降,相对CK,LS、MS和SS处理下的Pn, max分别下降了14.68%、39.59%和63.07%,CK处理下的Pn, max显著高于MS和SS处理(P < 0.05)。银叶树幼苗叶片的AQY随胁迫强度的增加逐渐降低,与CK相比,下降幅度为LS处理的7.84%、MS处理的27.45%和SS处理的29.41%,CK处理下的AQY显著高于MS和SS处理(P < 0.05)。与CK相比,银叶树幼苗叶片的Rd在干旱胁迫下均有不同程度的降低,降幅最大的为SS处理,达14.50%,但各处理之间Rd无显著差异。银叶树幼苗叶片的LSP随干旱胁迫加剧而下降,下降幅度为LS处理的17.98%、MS处理的29.50%和SS处理的62.44%,CK处理下的LSP显著高于MS和SS处理(P < 0.05)。与CK相比,LS处理下银叶树幼苗叶片LCP表现为下降,MS和SS处理的则表现为增加,MS处理下的LCP显著高于CK和LS处理(P < 0.05)。
| 处理 Treatment |
最大净光合速率 Pn, max |
表观量子效率 AQY |
暗呼吸速率 Rd |
光补偿点 LSP |
光饱和点 LCP |
| 对照CK | 14.65±0.34a | 0.051±0.003a | 1.31±0.12a | 1071.0±112.3a | 24.3±1.7b |
| 轻度干旱LS | 12.50±0.48a | 0.047±0.002ab | 1.13±0.07a | 878.4±52.3ab | 23.4±1.0b |
| 中度干旱MS | 8.85±0.91b | 0.037±0.006b | 1.22±0.23a | 755.1±60.9b | 31.5±3.4a |
| 重度干旱SS | 5.41±0.69c | 0.036±0.004b | 1.12±0.12a | 402.3±49.8c | 26.1±0.9ab |
| 注:同列数据后不同小写字母表示处理间差异显著(P < 0.05)。Note: different lowercase letters in the same column indicate significant differences under different drought treatments (P < 0.05). | |||||
由图 1 (a) 可知,当PAR低于200 μmol · m-2 · s-1时,银叶树幼苗叶片的Pn随PAR的增强急剧上升;当PAR为200~600 μmol · m-2 · s-1时,Pn在CK与LS处理下随着PAR的增强其上升幅度大于MS和SS处理;当PAR>600 μmol · m-2 · s-1时,CK、LS和MS处理下的Pn上升速度逐渐降低,之后保持平缓趋势,而在SS处理下Pn则呈下降的趋势。
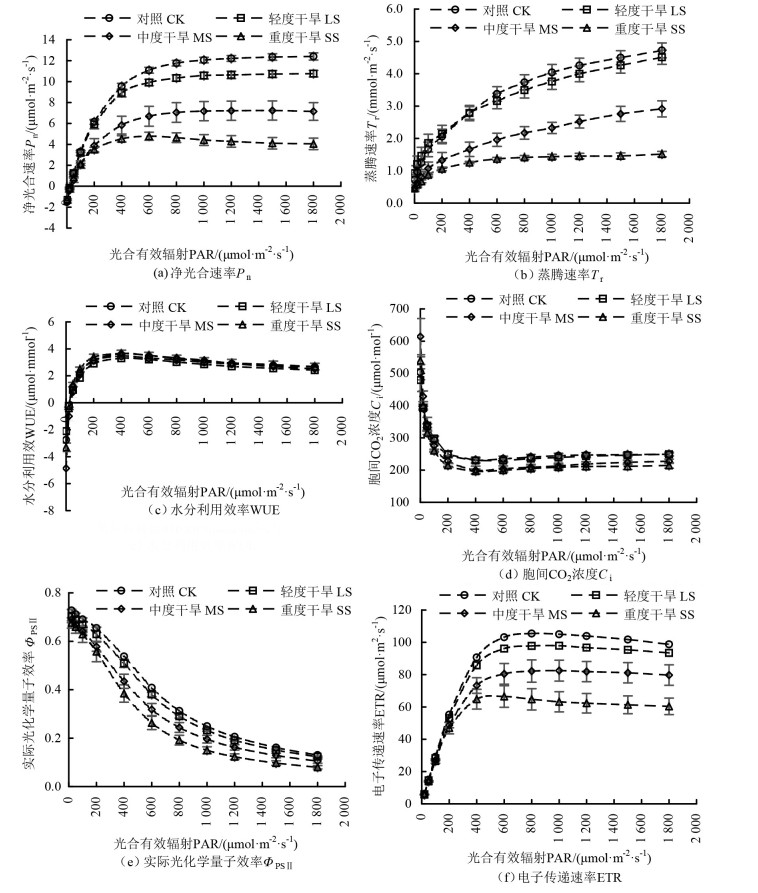
|
图 1 干旱胁迫下叶片气体交换参数的光响应曲线 Fig. 1 Light response curves of gas exchange parameters of H. littoralis seedlings under different drought treatments |
由图 1 (b) 可知,当PAR < 200 μmol · m-2 · s-1时,银叶树幼苗叶片的Tr随PAR的增强呈直线上升趋势,其在各处理表现为LS>CK>MS>SS;当PAR≥200 μmol · m-2 · s-1时,Tr在各处理的表现为CK>LS>MS>SS,Tr在SS处理下增幅较小,处于较低水平,其值介于1.25~1.51 mmol · m-2 · s-1之间。
由图 1 (c) 可知,当PAR为0~400 μmol · m-2 · s-1时,不同处理下银叶树幼苗叶片的WUE随PAR增强急剧上升;当PAR达到400 μmol · m-2 · s-1时,不同处理下的WUE均达到最大值,分别为3.47 (CK)、3.30 (LS处理) 和3.65 μmol · mmol-1 (MS和SS处理);之后WUE随PAR的增强呈缓慢下降趋势。这主要是由于在低光强下,随着PAR的增强,Pn上升的速度大于Tr上升的速度;当PAR>200 μmol · m-2 · s-1时,随着PAR的增强Pn变化缓慢,而Tr随光强增强增幅较快,造成WUE呈抛物线状变化。
由图 1 (d) 可知,在不同处理下,当0 < PAR < 200 μmol · m-2 · s-1时,银叶树幼苗叶片的Ci呈直线下降趋势;当200≤PAR≤400 μmol · m-2 · s-1时,Ci缓慢下降;当PAR>400 μmol · m-2 · s-1,Ci趋于稳定,这与Pn变化规律基本相反,在同一PAR下,Ci值在各处理中均表现为CK>LS>MS>SS。
由图 1 (e) 可知,当PAR为0~1 800 μmol · m-2 · s-1时,不同处理下,银叶树幼苗叶片的ΦPSⅡ随PAR的增强整体呈下降趋势,在同一PAR下,ΦPSⅡ值在各处理中均表现为CK>LS>MS>SS,表明干旱胁迫降低了ΦPSⅡ。
由图 1 (f) 可知,当PAR为0~400 μmol · m-2 · s-1时,银叶树幼苗叶片的ETR随PAR的增强呈急剧上升趋势;随着PAR的持续增强(400~600 μmol · m-2 · s-1),ETR增幅变缓;当PAR为600~1 000 μmol · m-2 · s-1时,ETR达到最大值,之后随PAR的持续增强,ETR呈缓慢下降的趋势;在同一PAR下,ETR值在各处理中均表现为CK>LS>MS>SS,表明干旱胁迫降低了ETR。
2.4 干旱胁迫对银叶树叶绿素荧光参数的影响由图 2 (a) 可知,银叶树幼苗叶片的F0随干旱胁迫的增强呈现出先升高后降低的趋势,与CK相比,不同处理下的F0增幅为1.23%~5.48%。
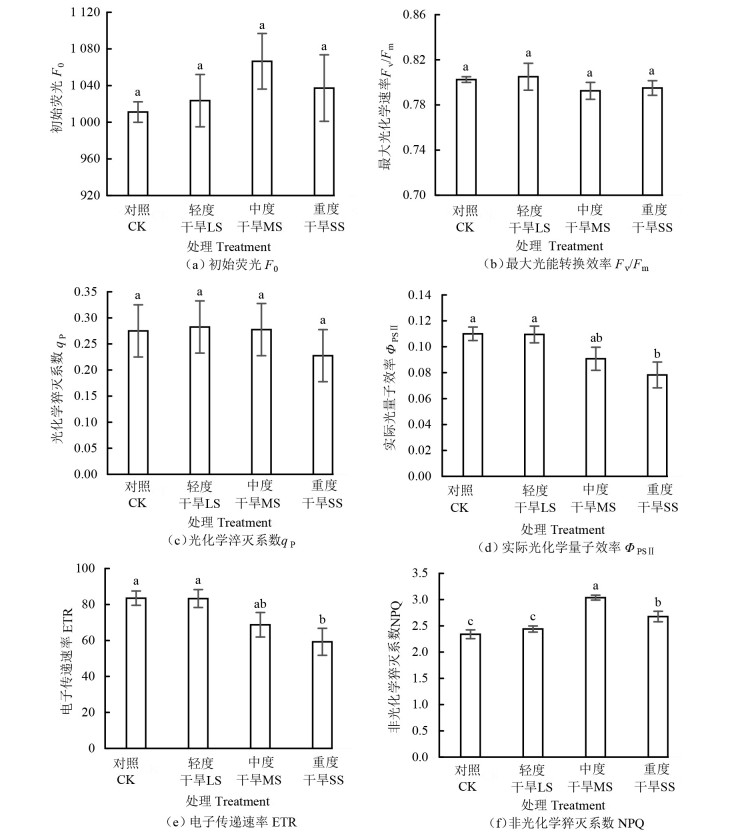
|
注:图中不同字母表示处理间差异达到0.05显著水平。 Note: letters indicate significant differences among different drought treatments at 0.05 level. 图 2 干旱胁迫对叶片叶绿素荧光参数的影响 Fig. 2 Effect of drought stress on chlorophyll fluorescence parameters of H. littoralis seedlings |
由图 2 (b) 可知,银叶树幼苗叶片的Fv/Fm随着干旱胁迫的增强整体变化不大,其值分别为0.803 (CK)、0.805 (LS处理)、0.793 (MS处理) 和0.795 (SS处理),基本上维持在0.800左右。
由图 2 (c) 可知,不同处理间银叶树幼苗叶片的qP差异不显著,与CK相比,LS与MS处理的qP增幅分别为2.73%和0.91%,而SS处理的qP降幅则达17.27%。不同处理间银叶树幼苗叶片的F0、Fv/Fm和qP均无显著差异。
由图 2 (d) 可知,随着干旱胁迫的加强,银叶树幼苗叶片的ΦPSⅡ呈下降趋势,与CK相比,LS、MS和SS处理的ΦPSⅡ下降幅度分别为0.45%、17.50%和28.86%,CK与LS处理下的ΦPSⅡ显著高于SS处理(P < 0.05)。
由图 2 (e) 可知,随着干旱胁迫的加强,银叶树幼苗叶片的ETR呈先升高后降低的趋势,与CK相比,各处理的下降幅度分别为0.27% (LS处理)、17.70% (MS处理) 和29.02% (SS处理),CK和LS处理下的ETR均显著高于SS处理(P < 0.05)。
由图 2 (f) 可知,银叶树幼苗叶片的NPQ随着干旱胁迫的加强呈先上升后下降趋势,在MS处理下达到最大值,MS处理下NPQ显著高于其他处理(P < 0.05),CK与LS处理下NPQ差异不显著。
从表 3可知,随着干旱胁迫的增强,银叶树幼苗叶片的D呈先上升后下降的趋势,MS处理下达到最高,热耗散比率的增加也说明此时光能捕获效率降低,推测此时银叶树幼苗叶片可能处于光抑制状态。随着干旱胁迫强度的增加,银叶树幼苗叶片的P呈下降趋势,与CK相比,LS、MS及SS处理下的P降幅分别为0.27%、17.71%及28.97%,说明银叶树幼苗在CK下能将吸收的光能较多地分配到光化学反应部分,叶片的光化学反应能量利用率较大。不同处理间E差异不显著,与CK和LS处理相比,MS和SS处理的E下降幅度分别为16.95%和9.92%。
| 处理Treatment | 天线热耗散D/% | 光化学耗散P/% | 非光化学耗散E/% |
| 对照CK | 60.27±0.67a | 11.01±0.53b | 28.72±0.56a |
| 轻度干旱LS | 60.30±2.52a | 10.98±0.65b | 28.72±2.66a |
| 中度干旱MS | 67.10±0.87b | 9.06±0.90a | 23.85±0.89a |
| 重度干旱SS | 66.31±1.47b | 7.82±0.99a | 25.87±1.40a |
| 注:同列数据后不同小写字母表示处理间差异显著(P < 0.05)。Note: different lowercase letters in the same column indicate significant differences under different drought treatments (P < 0.05). | |||
从表 4可知,干旱胁迫下银叶树幼苗生长与叶片光合生理特性及叶绿素荧光参数存在一定的相关关系,具体为株高生长量与Pn, max、AQY和LSP呈显著正相关(P < 0.05);地径生长量与Pn, max、AQY和Fv/Fm呈显著正相关(P < 0.05),与ΦPSⅡ和ETR呈极显著正相关(P < 0.01);叶片数量与AQY和LSP呈显著正相关(P < 0.05),与Pn, max、ΦPSⅡ和ETR呈极显著正相关(P < 0.01))。
| 指标Index | 最大净合 速率 Pn, max |
表观量子 效率 AQY |
暗呼吸速率 Rd |
光饱和点 LSP |
光补偿点 LCP |
初始荧光 F0 |
最大光能转换效率 Fv/Fm |
光化学淬灭系数 qP |
实际光化学量子效率 ΦPSⅡ |
电子传递速率 ETR |
非光化学猝灭系数 NPQ |
| 株高生长量 Increment of seedling height |
0.962* | 0.964* | 0.732 | 0.932* | -0.537 | -0.739 | 0.777 | 0.609 | 0.897 | 0.896 | -0.737 |
| 地径生长量 Increment of ground diameter |
0.946* | 0.928* | 0.349 | 0.885 | -0.609 | -0.654 | 0.920* | 0.785 | 0.991** | 0.992** | -0.702 |
| 相对叶绿素含量SPAD value | 0.798 | 0.713 | 0.136 | 0.767 | -0.393 | -0.356 | 0.774 | 0.881 | 0.897 | 0.898 | -0.429 |
| 叶片数量Leaf number | 0.992** | 0.924* | 0.586 | 0.980* | -0.438 | -0.567 | 0.805 | 0.85 | 0.989** | 0.988** | -0.599 |
| 注:*表示在0.05水平上显著相关;* *表示在0.01水平上显著相关。Note: * indicates significant differences at 0.05 level; * * indicates extremely significant differences at 0.01 level. | |||||||||||
干旱胁迫对植物的影响是多方面的,其中最直观的影响就是抑制植物正常的生长发育[19]。本研究结果显示,银叶树幼苗株高生长量和叶片数量随干旱胁迫加剧呈下降趋势,地径生长量随干旱胁迫的增强呈先增加后下降趋势,相对于CK,SS处理的变化幅度明显高于LS和MS处理,这与前人对黄檀(Dalbergia hupeana Hance)、蚬木[Excentrodendron hsienmu (Chun et How) H. T. Chang et R. H. Miau]、楸树(Catalpa bungee C. A. Mey.) 等幼苗的研究结果一致或类似,SS处理显著抑制了林木幼苗株高和地径的生长[20-21]。随着干旱胁迫程度的加强,银叶树幼苗叶片的SPAD值呈现先上升后下降的趋势,这与樟树[Cinnamomum camphora (L.) J. Presl]和泡桐(Paulownia duclouxii Dode) 幼苗干旱胁迫试验响应一致[22],其变化趋势可进一步指示植物叶绿素对水分胁迫的敏感性。在LS和SS处理下,银叶树幼苗能够通过减缓生长速率和叶片暂时性萎蔫运动以减小叶片蒸腾作用等方式来应付,但当干旱胁迫严重时,银叶树吸收的水分小于叶片蒸腾作用损耗的水分,无法维持其正常水分状况,银叶树正常的生理代谢活动遭受破坏,叶片掉落,甚至出现植株死亡迹象。株高生长量、地径生长量及叶片数量等主要生长指标与光合参数及叶绿素荧光参数也存在一定的相关关系。
3.2 干旱胁迫对银叶树幼苗叶片光合特性的影响LSP和LCP往往反映植物利用光能力的上限和下限,通常耐阴植物的LCP小于20 μmol · m-2 · s-1,LSP仅为50~1 000 μmol · m-2 · s-1[23-24]。在本研究中,正常供水条件下,银叶树幼苗叶片的LSP与LCP分别为1 071.0和24.3 μmol · m-2 · s-1,说明银叶树为阳生植物,其利用强光的能力较强,不易出现光抑制现象。前人研究发现,植物LCP在干旱胁迫下升高,而LSP则下降,使得叶片对弱光和强光的利用能力降低[25-26],本研究也得出相似的研究结果,银叶树幼苗叶片在SS处理下抵御强光能力明显下降。银叶树幼苗叶片的Pn, max在干旱胁迫下显著低于CK,说明干旱胁迫影响了银叶树电子传递速率,在SS处理下Pn, max降幅达63.07%,严重制约了银叶树光合潜力的发挥,叶片光能转化效率降低,光合作用受到影响。银叶树幼苗叶片的AQY在CK和LS处理下均无显著变化,在MS和SS处理下,AQY显著下降,表明银叶树幼苗遭遇干旱胁迫时,光能利用效率会降低。在SS处理下,银叶树幼苗叶片的Rd较低,说明银叶树通过降低呼吸作用来适应干旱的土壤条件[27]。但由于本研究采用人工盆栽试验,与滨海湿地环境相比往往养分含量偏低,多项研究表明,养分富集与干旱胁迫能够造成交互作用,致使植物光合能力进一步下降[27-28]。
3.3 干旱胁迫对银叶树叶绿素荧光特性的影响叶片叶绿素荧光动力学参数能快速反映植物对土壤水分变化的响应,因此可作为植物抗旱性评价的参考指标[29]。Fv/Fm是PSⅡ反应中心最大光能转换效率;ΦPSⅡ是PSⅡ反应中心在部分关闭情况下的实际光能捕获效率;ETR反映实际光照强度下的电子传递情况,即驱动PSⅡ的实际量子流量[30]。植物在未受逆境伤害情况下,当其经过充分暗适应时,植物叶片Fv/Fm一般介于0.80~0.85之间[31],是比较恒定的,在逆境或受伤害时会明显降低[32]。本研究结果表明,干旱胁迫对Fv/Fm影响不显著,均在0.79~0.81之间,说明银叶树幼苗叶片的该参数对干旱胁迫尚不敏感,其原因可能在于,Fv/Fm值相对较小时,并不能反映其在胁迫条件下的光能利用能力[33],在王琰等[30]对于不同种源油松(Pinus tabulifomis Carr.) 相关研究结果亦表现出该现象。历经LS与MS处理时,银叶树幼苗叶片的ΦPSⅡ和ETR均略有降低;在MS处理下,NPQ显著升高,且高于SS处理,说明此时银叶树幼苗对环境的适应能力较强,历经适度干旱时,植物幼苗光合作用PSⅡ反应中心进入关闭状态,通过增加热耗散来减少过剩光能的积累,保护光合机构免遭破坏[4]。在SS处理下, 银叶树幼苗叶片NPQ也较高,ΦPSⅡ、ETR和qP则随干旱程度的加剧逐渐下降,说明在SS处理下,电子捕获和传递能力受到抑制,光能转化效率降低,光合作用反应中心PSⅡ的光化学活性,造成积累的光能过剩,使其内部调控机制受损严重[30, 33]。
本研究由于试验材料和材料的限制,主要探讨了干旱胁迫下银叶树幼苗生长、叶片光合特性和叶绿素荧光参数的变化,下一步将开展持续性干旱及复水处理下银叶树幼苗的耐旱性及恢复能力等方面研究,揭示其内在联系,为沿海银叶树群落生态恢复和良种选择提供更好的理论支持。
银叶树在幼苗期仅在水分适宜的情况下生长良好,干旱胁迫在一定程度上制约了银叶树幼苗的生长。银叶树幼苗通过关闭气孔,降低Tr、Pn、AQY,提高WUE等来抵御不良的干旱逆境,提高自身的抗旱性。当土壤含水率低于20%时,银叶树幼苗叶片光合作用降低,对弱光和强光的利用能力均最弱,发生明显的光抑制现象,长期的SS处理可能出现银叶树幼苗枯死现象。本研究结果显示,LS和MS处理对银叶树幼苗的正常生长影响较小,表现出一定的适应性,SS处理下银叶树幼苗正常生理代谢受到较严重的影响。因此,在银叶树幼苗期,应特别注意防范季节性干旱的影响,加强对银叶树幼苗的水分管理,保持良好的水分供应,避免因水分亏缺对其造成伤害,不建议将其栽植在长期缺水地段。
| [1] |
ANDEREGG W R L, KANE J M, ANDEREGG L D L. Consequences of widespread tree mortality triggered by drought and temperature stress[J]. Nature Climate Change, 2013, 3(1): 30-36. DOI:10.1038/nclimate1635 |
| [2] |
IPCC. Climate change 2013: the physical science basis: the summary for policymakers of the working group Ⅰ contribution to the fifth assessment report[R]. Cambridge, UK: Cambridge University Press, 2013.
|
| [3] |
张柳红, 陈玉玮, 伍红雨, 等. 2020年广东省气候概况[J]. 广东气象, 2021, 43(4): 1-5. DOI:10.3969/j.issn.1007-6190.2021.04.001 |
| [4] |
李瑞姣, 陈献志, 岳春雷, 等. 干旱胁迫对日本荚蒾幼苗光合生理特性的影响[J]. 生态学报, 2018, 38(6): 2041-2047. |
| [5] |
曹恭祥, 刘新前, 季蒙, 等. 干旱胁迫下9种沙区适生灌木的光响应特性研究[J]. 西北林学院学报, 2021, 36(4): 18-25. DOI:10.3969/j.issn.1001-7461.2021.04.03 |
| [6] |
陈梦园, 李迎超, 王利兵, 等. 2个种源栓皮栎对干旱及复水的光合生理响应[J]. 生态学杂志, 2019, 38(10): 2950-2958. |
| [7] |
王凯, 沈潮, 孙冰, 等. 干旱胁迫对科尔沁沙地榆树幼苗C、N、P化学计量特征的影响[J]. 应用生态学报, 2018, 29(7): 2286-2294. |
| [8] |
曾聪, 范航清. 红树植物银叶树果实和种子的形态结构研究[J]. 广西科学, 2006, 13(2): 147-150. DOI:10.3969/j.issn.1005-9164.2006.02.019 |
| [9] |
简曙光, 韦强, 唐恬, 等. 深圳盐灶银叶树种群的生物学特性研究[J]. 华南农业大学学报, 2005, 26(4): 84-87, 91. DOI:10.3969/j.issn.1001-411X.2005.04.021 |
| [10] |
简曙光, 唐恬, 张志红, 等. 中国银叶树种群及其受威胁原因[J]. 中山大学学报(自然科学版), 2004, 43(S1): 91-96. |
| [11] |
庞庭才, 胡上英, 黄海, 等. 银叶树果壳棕色素提取及其稳定性和抗氧化性[J]. 北方园艺, 2020(23): 96-101. |
| [12] |
孙红斌, 肖石红, 蔡坚, 等. 深圳坝光银叶树种群生命表及生存力分析[J]. 热带作物学报, 2019, 40(11): 2160-2165. DOI:10.3969/j.issn.1000-2561.2019.11.009 |
| [13] |
陈晓霞, 李瑜, 茹正忠, 等. 深圳坝光银叶树群落结构与多样性[J]. 生态学杂志, 2015, 34(6): 1487-1498. |
| [14] |
张卫强, 黄芳芳, 甘先华, 等. 遮阴和盐分对银叶树幼苗光合特性与叶绿素荧光参数的影响[J]. 生态环境学报, 2020, 29(3): 438-446. |
| [15] |
HU W M, WANG S W, JIAN S G, et al. Discovery and comparative assessment of SNPs and SSRs for genetic diversity analysis of wild Heritiera littoralis Dryand (Sterculiaceae), an endangered mangrove tree species[J]. Conservation Genetics Resources, 2015, 7(3): 663-668. DOI:10.1007/s12686-015-0472-0 |
| [16] |
FARQUHAR D G, VON CAEMMERER S, BERRY J A. Models of photosynthesis[J]. Plant Physiology, 2001, 125(1): 42-45. DOI:10.1104/pp.125.1.42 |
| [17] |
EHLERT B, HINCHA D K. Chlorophyll fluorescence imaging accurately quantifies freezing damage and cold acclimation responses in Arabidopsis leaves[J]. Plant Methods, 2008, 4(1): 12. DOI:10.1186/1746-4811-4-12 |
| [18] |
陆燕元, 马焕成, 李昊民, 等. 土壤干旱对转基因甘薯光合曲线的响应[J]. 生态学报, 2015, 35(7): 2155-2160. |
| [19] |
武燕奇, 郭素娟. 5个板栗品种对干旱胁迫的生理响应及抗旱性评价[J]. 东北林业大学学报, 2017, 45(1): 20-24, 29. DOI:10.3969/j.issn.1000-5382.2017.01.005 |
| [20] |
赖小连, 颜玉娟, 颜立红, 等. 干旱胁迫对黄檀幼苗生长及生理特性的影响[J]. 东北林业大学学报, 2020, 48(7): 1-6. DOI:10.3969/j.issn.1000-5382.2020.07.001 |
| [21] |
WU J W, LI J Y, SU Y, et al. A morphophysiological analysis of the effects of drought and shade on Catalpa bungei plantlets[J]. Acta Physiologiae Plantarum, 2017, 39(3): 80. DOI:10.1007/s11738-017-2380-2 |
| [22] |
张雅梅, 茹广欣, 肖梦雨, 等. 干旱胁迫对泡桐幼苗生长和叶绿素荧光参数的影响[J]. 中南林业科技大学学报, 2021, 41(6): 22-30. |
| [23] |
蔡建国, 韦孟琪, 章毅, 等. 遮阴对绣球光合特性和叶绿素荧光参数的影响[J]. 植物生态学报, 2017, 41(5): 570-576. |
| [24] |
BOARDMAN N K. Comparative photosynthesis of sun and shade plants[J]. Annual Review of Plant Physiology, 1977, 28: 355-377. DOI:10.1146/annurev.pp.28.060177.002035 |
| [25] |
XIA J B, ZHANG S Y, ZHANG G C, et al. Critical responses of photosynthetic efficiency in Campsis radicans (L.) Seem to soil water and light intensities[J]. African Journal of Biotechnology, 2011, 10(77): 17748-17754. |
| [26] |
韩刚, 赵忠. 不同土壤水分下4种沙生灌木的光合光响应特性[J]. 生态学报, 2010, 30(15): 4019-4026. |
| [27] |
SAMUELSON L J, PELL C J, STOKES T A, et al. Two-year throughfall and fertilization effects on leaf physiology and growth of loblolly pine in the Georgia piedmont[J]. Forest Ecology and Management, 2014, 330: 29-37. DOI:10.1016/j.foreco.2014.06.030 |
| [28] |
BARTKOWIAK S M, SAMUELSON L J, MCGUIRE M A, et al. Fertilization increases sensitivity of canopy stomatal conductance and transpiration to throughfall reduction in an 8-year-old loblolly pine plantation[J]. Forest Ecology and Management, 2015, 354: 87-96. DOI:10.1016/j.foreco.2015.06.033 |
| [29] |
张国盛, 郝蕾, 闫子娟, 等. 6种树种叶片叶绿素荧光动力学参数对土壤水分变化的响应[J]. 生态学杂志, 2017, 36(11): 3079-3085. |
| [30] |
王琰, 陈建文, 狄晓艳. 不同油松种源光合和荧光参数对水分胁迫的响应特征[J]. 生态学报, 2011, 31(23): 7031-7038. |
| [31] |
吴甘霖, 段仁燕, 王志高, 等. 干旱和复水对草莓叶片叶绿素荧光特性的影响[J]. 生态学报, 2010, 30(14): 3941-3946. |
| [32] |
吴敏, 邓平, 赵英, 等. 喀斯特干旱环境对青冈栎叶片生长及叶绿素荧光动力学参数的影响[J]. 应用生态学报, 2019, 30(12): 4071-4081. |
| [33] |
NAEEM M, NAEEM M S, AHMAD R, et al. Foliar calcium spray confers drought stress tolerance in maize via modulation of plant growth, water relations, proline content and hydrogen peroxide activity[J]. Archives of Agronomy and Soil Science, 2018, 64(1): 116-131. DOI:10.1080/03650340.2017.1327713 |

 2021, Vol. 41
2021, Vol. 41


