文章信息
- 李宁, 潘辉, 李颖, 刘进山, 蔡昌棠, 何东进
- LI Ning, PAN Hui, LI Ying, LIU Jinshan, CAI Changtang, HE Dongjin
- 天宝岩4种湿地植被泥炭对Pb2+的吸附特征
- Adsorption characteristics of Pb2+ on peat of four wetland vegetation types in the Tianbaoyan National Nature Reserve of Fujian
- 森林与环境学报,2021, 41(5): 449-455.
- Journal of Forest and Environment,2021, 41(5): 449-455.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2021.05.001
-
文章历史
- 收稿日期: 2021-05-25
- 修回日期: 2021-07-06
2. 福建省南方森林资源与环境工程技术研究中心, 福建 福州 350002;
3. 福建天宝岩国家级自然保护区, 福建 永安 366032
2. Fujian Southern Forest Resources and Environmental Engineering Technology Research Center, Fuzhou, Fujian 350002, China;
3. Fujian Tianbaoyan National Nature Reserve, Yong'an, Fujian 366032, China
湿地是地球上重要的自然生态系统,具备很强的生态净化效用,在净化水、土和空气等方面起着关键作用[1-4]。泥炭是有机质积累和贮存在低分解条件下的产物,对金属和极性有机分子等溶解性固体的吸附能力强,作为净化金属污染废水的一种吸附剂具有广阔的应用前景。泥炭作为吸附重金属污染物的重要材料之一,与其具有多孔渗水性、较大的比表面积以及含有各种活性官能团有关[5-7]。随着进一步的研究表明泥炭可以固定重金属,净化重金属污染[8]。MARQUES et al[9]发现在土壤中添加20%的泥炭,可以提高对铅和镉的吸附能力,吸附率为铅>镉;NAWAB et al[10]用生物炭、泥炭藓等原料吸附土壤中的有害金属,降低蔬菜中的砷对人体健康的风险;LUBBAD et al[11]在加沙地带用泥炭藓泥炭去除水中的钙,达到软化自来水的效果;顾健民等[12]用泥炭和褐煤吸附Cu2+、Pb2+、Zn2+,吸附能力均为Zn2+>Cu2+>Pb2+。鉴于此,研究湿地植被泥炭对Pb2+的吸附特征,有助于理解和评价泥炭地的净化机制和功能。
天宝岩国家级自然保护区泥炭藓沼泽湿地于2001年被发现,是亚热带高山地区泥炭藓沼泽湿地生态系统中的典型代表。以天宝岩4种湿地植被泥炭为研究对象,探讨泥炭投入量、泥炭时间、pH值、Pb2+浓度等因素对4种湿地植被泥炭吸附Pb2+性能的影响,同时采用等温吸附模型的方法研究其对Pb2+的吸附特征,以期为天宝岩4种湿地植被泥炭的生态保护和Pb2+防控提供理论支撑和应用参考。
1 材料与方法 1.1 研究区概况研究区天宝岩国家级自然保护区(117°28′03″~111°73′528″E,25°50′51″~26°01′20″N),位于福建省永安市,全境绝大部分是中低山地貌,属于戴云山余脉,海拔为580~1 604.8 m[13]。该区属于中亚热带海洋性季风气候,年平均气温为15 ℃,年最低和最高气温分别为1月份的5 ℃和7月份的23 ℃,年平均降水量为2 039 mm。在研究区中泥炭藓泥炭沼泽主要分布在海拔1 110~1 190 m的山间盆地或洼地处,总面积约为30.7 hm2。该区泥炭藓泥炭沼泽无明显水层,周围地势偏高,泥炭层厚度为15~100 cm,其中泥炭藓层厚度为10~30 cm。保护区内植物生境较为原始,国家一级保护植物有南方红豆杉(Taxus chinensis var. mairei)、伯乐树(Bretschneidera sinensis Hemsl.)、银杏(Ginkgo biloba L.)等;国家二级保护植物有金钱松[Pseudolarix amabilis(J. Nelson) Rehd.]、闽楠[Phoebe bournei(Hemsl.) Yang]、香榧(Torreya grandis cv. Merrillii)等,该区内植被保护较好,具有较高的研究和保护价值[14]。
1.2 研究方法 1.2.1 样品采集根据研究区湿地泥炭的分布情况,在水竹(Phyllostachys heteroclada Oliver)、垂穗石松(Palhinhaea cernua)、灯芯草(Juncus effusus L.)和泥炭藓(Sphagnum magellanicum)4种植被群落内分别设置6、6、4和5块标准样地,样地大小为20 m×20 m,共计样地面积为8 400 m2。在样地内选择一条对角线,设置3个1 m×1 m的样方,用环刀取0~20 cm的表层土壤,并将样品混合装入自封袋,带回实验室进行分析。4种湿地植被泥炭的基本性质见表 1。
| 泥炭类型 Peat type |
腐殖酸含量 Humic acid content/% |
沥青含量 Asphalt content/% |
吸湿水 Hygroscopic water/% |
易水解物质量分数 Mass percentage of hydrolysable/% |
灰分含量 Ash content /% |
pH值 pH value |
| 水竹Pllostachys heteroclada | 21.79±4.76ab | 51.24±5.93b | 5.27±0.91b | 12.54±4.15ab | 23.52±4.56a | 3.88±0.11d |
| 垂穗石松Palhinhaea cernua | 20.88±3.82a | 56.45±7.48a | 3.31±1.03c | 7.40±2.34a | 18.45±5.01b | 5.05±0.53c |
| 灯芯草J. effuses | 24.45±4.50b | 44.32±6.81a | 5.35±1.19ab | 17.83±4.01a | 27.75±7.41ab | 6.33±0.07a |
| 泥炭藓S. magellanicum | 25.73±2.70a | 50.59±6.50b | 5.15±1.22b | 8.79±3.16b | 23.58±5.40ab | 5.44±0.06b |
| 注:同列数据后不同小写字母表示4种泥炭之间差异显著(P < 0.05).Note: different lowercase letters in the same column represent significant differences among the four types of peat(P < 0.05). | ||||||
在已知浓度的Pb2+溶液中,采用单因素对比方法,分别改变泥炭投入量、吸附时间、pH值及Pb2+浓度,待泥炭吸附稳定后,用原子吸收分析仪测出上清液中Pb2+的浓度。4种湿地植被泥炭对Pb2+的吸附率计算为:
| $X/\% = \frac{{{\rho _0} - {\rho _{\rm{e}}}}}{{{\rho _0}}} \times 100 $ | (1) |
吸附量计算为:
| $E = ({\rho _0} - {\rho _{\rm{e}}}) \cdot \frac{V}{W} $ | (2) |
式中:X为吸附率(%);E为吸附量(mg·g-1);ρ0为溶液的初始浓度(mg·L-1);ρe为平衡浓度(mg·L-1);W为试样的质量(20 g);V为试液的体积(1 L)。
1.2.3 等温吸附试验设置Pb2+溶液的初始浓度分别为5、10、15、20、25和30 g·L-1,用1 mol·L-1的NaNO3溶液作为背景电解质,称量0.1 g泥炭放入50 mL的离心管中,依次加入20 mL不同浓度的Pb2+溶液,使用1 mol·L-1的NaOH调制溶液的pH值至5.0,在20 ℃的恒温振荡器中以200 r·min-1振荡24 h,在8 000 r·min-1的离心机上离心2 min,取上清液过滤(0.22 μm),最后用原子吸收分光光谱仪进行溶液中Pb2+浓度的测定。用Langmuir和Freundlich等温吸附模型进行拟合[15]。按公式(3)、(4)进行计算:
| $\frac{{{E_{\rm{e}}}}}{{{E_{\max }}}} = \frac{{\gamma {\rho _{\rm{e}}}}}{{1 + \gamma {\rho _{\rm{e}}}}} $ | (3) |
| ${E_{\rm{e}}} = K\rho _{\rm{e}}^{\frac{1}{n}} $ | (4) |
式中:Ee为平衡吸附量(mg·g-1);Emax为最大吸附量(mg·g-1); ρe为吸附平衡时Pb2+的浓度(mg·L-1);γ为Langmuir模型参数(L·mg-1);n和K为Freundlich等温吸附方程的参数。
2 结果与分析 2.1 泥炭投入量对4种湿地植被泥炭Pb2+吸附的影响在不同泥炭投入量下4种湿地植被泥炭Pb2+吸附量和吸附率见图 1。4种湿地植被泥炭Pb2+的吸附率均随着泥炭投入量的增多,呈先上升后趋于平缓的趋势,但Pb2+吸附量却逐渐减少。从水竹和垂穗石松植被泥炭的变化曲线可看出,随着泥炭投入量的增加,泥炭Pb2+吸附率变化不大,几乎趋于一条直线,当泥炭投入量大于5 g·L-1时,泥炭Pb2+吸附率增长较为缓慢,此时水竹和垂穗石松植被泥炭Pb2+吸附率分别为95.56%和97.10%;当泥炭投入量达到6 g·L-1时,水竹和垂穗石松植被泥炭Pb2+吸附率达到最大值,分别为96.01%和97.22%,同时泥炭Pb2+吸附量达到最小值,分别为3.20和3.24 mg·g-1。从灯芯草和泥炭藓植被泥炭的变化曲线可以看出,随着泥炭投入量的不断增加,泥炭Pb2+吸附率变化较大,当泥炭投入量大于4 g·L-1时,泥炭Pb2+吸附率增长较为缓慢,此时灯芯草和泥炭藓植被泥炭Pb2+吸附率分别为86.80%和90.40%;当泥炭投入量达到6 g·L-1时,灯芯草和泥炭藓植被泥炭Pb2+吸附率达到最大值,分别为88.15%和92.53%,而Pb2+吸附量达到最小值,分别为2.94和3.08 mg·g-1。当泥炭投入量为1 g·L-1时,4种湿地植被泥炭Pb2+吸附量为垂穗石松(18.22 mg·g-1)>水竹(17.91 mg·g-1)>泥炭藓(15.50 mg·g-1)>灯芯草(13.63 mg·g-1),Pb2+吸附率为垂穗石松(91.11%)>水竹(89.56%)>泥炭藓(77.52%)>灯芯草(68.25%),其中垂穗石松植被泥炭的初始Pb2+吸附率和吸附量在4种植被泥炭中最高,如果选择少量的垂穗石松泥炭去除废水中的Pb2+,垂穗石松泥炭单位量中价值最大,是最为经济有效的选择。

|
图 1 不同泥炭投入量下4种湿地植被泥炭Pb2+吸附量和吸附率 Fig. 1 Adsorption capacity and adsorption rate of Pb2+ of peat of four wetland vegetation types under different peat input values |
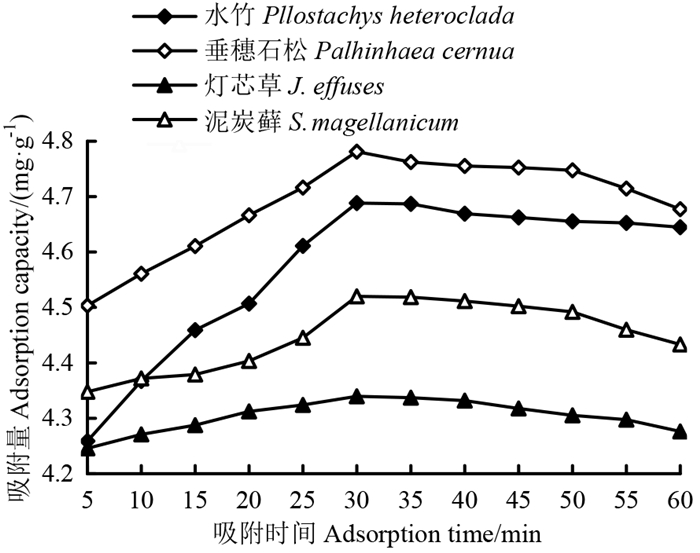
由图 2可知,4种湿地植被泥炭Pb2+的吸附量均随着吸附时间的延长呈增多趋势,在吸附时间为30 min时,4种湿地植被泥炭Pb2+吸附量均达到最大值,Pb2+吸附量为垂穗石松(4.78 mg·g-1)>水竹(4.68 mg·g-1)>泥炭藓(4.52 mg·g-1)>灯芯草(4.34 mg·g-1),其中水竹植被泥炭Pb2+吸附量随着吸附时间的延长变化较大,而灯芯草植被泥炭的变化最小;当吸附时间超过30 min时,4种植被泥炭Pb2+的吸附量趋于稳定。其中垂穗石松植被泥炭Pb2+的吸附效果最好,同时为了保证4种湿地植被泥炭Pb2+吸附量的稳定性,可将最佳吸附时间定为30~50 min。
|
图 2 不同吸附时间下4种湿地植被泥炭Pb2+吸附量 Fig. 2 Adsorption capacity of Pb2+ of peat of four wetland vegetation types under different adsorption times |
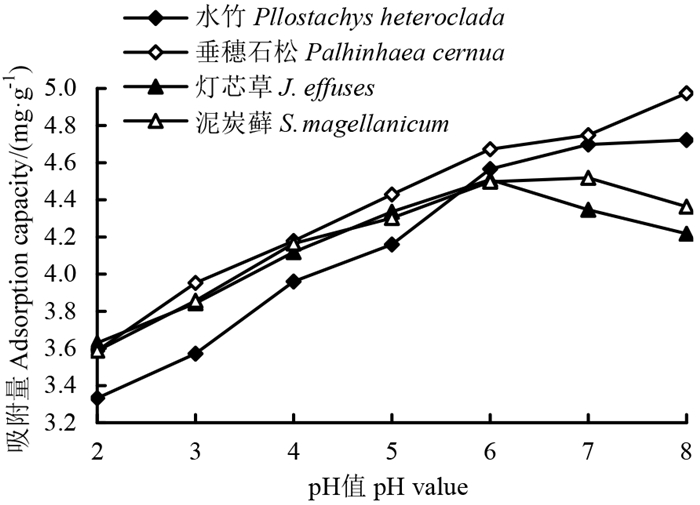
在不同pH值和泥炭吸附初始浓度为20 g·L-1下,4种湿地植被泥炭Pb2+的吸附量范围:垂穗石松植被为3.59~4.97 mg·g-1;水竹植被为3.33~4.72 mg·g-1;灯芯草植被为3.63~4.51 mg·g-1;泥炭藓植被为3.59~4.52 mg·g-1。pH值为2~8时,垂穗石松植被泥炭对Pb2+的吸附量一直高于其他3种植被泥炭(图 3)。从图 3还可以看出,垂穗石松植被泥炭的吸附量随pH值的升高不断增多,在pH值为8时,对Pb2+的吸附量达到最大值,为4.97 mg·g-1。水竹植被类型泥炭吸附量随pH值的升高先增加后趋于稳定,在pH值为7~8时,吸附量保持稳定。灯芯草植被泥炭在pH值为6时,吸附量达到最大值,随后吸附量减少。泥炭藓植被泥炭在pH值为7时,吸附量达到最大值,随后逐渐减少。在pH值为6~8范围内有利于泥炭对Pb2+的吸附,其中垂穗石松植被泥炭吸附效果较好。
|
图 3 不同pH值下4种湿地植被泥炭Pb2+吸附量 Fig. 3 Adsorption capacity of Pb2+ of peat of four wetland vegetation types under different pH values |
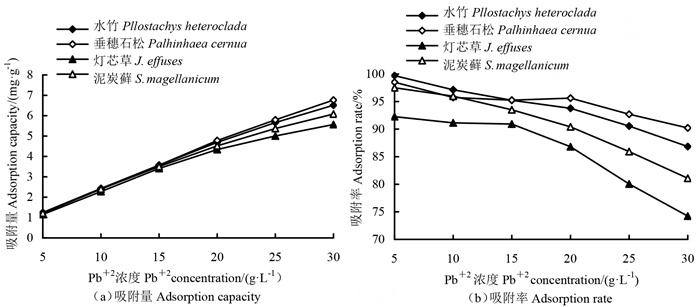
从图 4中可以看出,随着Pb2+浓度的升高,4种湿地植被泥炭对Pb2+的吸附量都逐渐增加,而吸附率变化趋势不一致。水竹和泥炭藓植被泥炭随Pb2+浓度的升高,吸附率呈不断下降的趋势;垂穗石松和灯芯草植被泥炭随Pb2+浓度的升高,吸附率呈先降低后升高再降低的趋势。
|
图 4 不同Pb2+浓度下4种湿地植被泥炭吸附率和吸附量 Fig. 4 Adsorption rate and adsorption capacity of peat of four wetland vegetation types under different Pb2+ concentrations |
使用Langmuir和Freundlich两种等温吸附模型对试验数据进行拟合,结果如图 5和表 2所示。由图 5可知,4种湿地植被泥炭对Pb2+的吸附特征均为非线性,其吸附量为垂穗石松>水竹>泥炭藓>灯芯草。由表 2可知,4种湿地植被泥炭对Pb2+的吸附特征与两种模型都有较好的相关性,在Langmuir模型中,R2值为0.915~0.986,在Freundlich模型中,R2值为0.910~0.985,说明在泥炭吸附Pb2+的过程中单分子层吸附和非均匀吸附同时存在,但更符合Langmuir模型,其中单分子层吸附占主导地位。Langmuir模型非线性拟合得到参数中,垂穗石松植被泥炭的Emax值和1/n值最大,分别为8.936和0.454,说明垂穗石松植被泥炭对Pb2+的吸附效果最佳。

|
图 5 4种湿地植被泥炭Pb2+等温吸附曲线 Fig. 5 Adsorption isotherm of Pb2+ of peat of four wetland vegetation types |
| 泥炭类型 Peat type |
Langmuir模型Langmuir model | Freundlich模型Freundlich model | |||||
| Emax | γ | R2 | K | 1/n | R2 | ||
| 水竹Pllostachys heteroclada | 7.422 | 0.015 | 0.915 | 0.869 | 0.339 | 0.910 | |
| 垂穗石松Palhinhaea cernua | 8.936 | 0.011 | 0.955 | 0.531 | 0.454 | 0.948 | |
| 泥炭藓S. magellanicum | 6.665 | 0.013 | 0.982 | 0.631 | 0.361 | 0.979 | |
| 灯芯草J. effuses | 6.688 | 0.010 | 0.986 | 0.418 | 0.398 | 0.985 | |
泥炭投入量和吸附时间对4种湿地植被泥炭吸附特征有重要影响,当泥炭投入量从1 g·L-1增加6 g·L-1时,垂穗石松植被泥炭吸附率和吸附量均大于其它3种,当泥炭投入量大于4 g·L-1,4种湿地植被泥炭吸附率上升缓慢,主要是由于泥炭吸附达到了饱和状态[16]。4种湿地植被泥炭在0~30 min对Pb2+进行较快吸附,当吸附时间为30 min时,其吸附量均达到最大值,当吸附时间为30~50 min时达到吸附平衡,可能是由于初始阶段的吸附主要发生在泥炭外表面上,之后Pb2+逐渐扩散进入泥炭孔隙中,进一步与内部表面上的活性位点发生反应,这一吸附阶段进行得比较缓慢,随着吸附时间的叠加,泥炭对Pb2+的吸附最终达到平衡状态[17]。本研究中影响4种湿地植被泥炭Pb2+吸附特征的主要原因可能与泥炭结构性质有关,垂穗石松的比表面积相对于其他3种湿地植被泥炭较高,所以垂穗石松的吸附性能要高于水竹、泥炭藓和灯芯草湿地植被泥炭。
pH值和Pb2+浓度是影响泥炭吸附的重要变量,对Pb2+的竞争吸附点位、活性官能团、离子交换、Pb2+形态以及水解过程等方面都有影响[18]。在pH值>6时,灯心草和泥炭藓植被吸附量开始减少,产生这样的原因可能是pH值过高,使溶液中的Pb2+水解,又因为这两种泥炭的腐殖酸含量较高,其腐殖酸结构发生较大变化(表 1)。当初始pH值为6~8时,4种湿地植被泥炭均能保持对Pb2+有较高的吸附能力,其中垂穗石松植被吸附能力较好。因此,在实际应用中可以考虑调节环境中的pH值,以提高治理重金属污染的效果。4种湿地植被泥炭的吸附量随Pb2+浓度的升高而增加,而吸附率变化趋势不一致,其中垂穗石松植被泥炭较易于与Pb2+结合。当溶液中Pb2+离子增多,与泥炭之间的离子交换反应趋于平衡时,吸附速率逐渐降低,但同时又增加了泥炭表面上的吸附点位,离子之间的碰触加强,导致泥炭对Pb2+的吸附量增加。
4种湿地植被泥炭对Pb2+的等温吸附过程用Langmuir模型拟合效果更好,说明4种湿地植被泥炭的吸附特征更趋于单分子层的吸附。由等温吸附曲线可知,垂穗石松植被类型对Pb2+的吸附量高于其他3种植被泥炭,说明垂穗石松植被泥炭的表面吸附点位是较多的,能更加有效地吸附Pb2+。然而重金属Pb2+在环境中很难被微生物降解。目前,常用的处理重金属污染的方法有乳化液膜法[19]、吸附法[20-21]、离子交换法[22]、微生物生物膜法[23]等。其中,吸附法因具有材料来源广、简便高效等优势在处理重金属污染中被广泛应用[24]。泥炭作为天然的有机质,具有改善土壤和水体生态系统的作用,利用泥炭制备功能肥料、土壤调理剂、发展基质栽培等产业,可有效解决土壤严重污染问题,满足社会公众对绿色健康农副产品的需求。通过在土壤中增加适量的泥炭[10]、在泥炭表面涂抹铁[21]、提高泥炭土中的巯基含量[25]等方法,可优化泥炭对重金属的吸附效果。因此,绿色、廉价以及高效的改性方法是泥炭广泛应用于治理重金属污染的关键。
植被泥炭的发育是大量植物残体等有机质堆积的结果,灯芯草植被泥炭中含有灯芯草残体,其主要成分是木质纤维,具有多孔结构,泥炭pH值呈中性[26]。泥炭藓植被泥炭中优势植被为泥炭藓,其残体难以分解,泥炭的腐殖化度和矿物质含量均较低,泥炭pH呈酸性[2]。水竹植被泥炭中含有大量草本植物凋落物,其残体较易分解,泥炭积累速度较慢,pH值呈弱酸性[2]。垂穗石松植被泥炭中植物群落多样性较大,且群落具有较大的稳定性,在4种湿地植被泥炭中分解度最高,其持水性最低,泥炭pH值为弱酸性[13]。有研究表明植物吸收和生物降解作用是泥炭沼泽湿地净化污染物的重要途径[27-28]。4种湿地植被泥炭中植物残体以及微生物群落等均有较大差异,考虑植物吸收和微生物固定等作用导致的泥炭面积、空间结构、形态、能量交换等值的变化,将有助于评估植被类型泥炭净化污染和可持续发展的能力。
| [1] |
马康, 史璇, 尤晓光, 等. 河流岸带湿地沉积物重金属分布对植被物种多样性和底栖动物群落特征的影响[J]. 生态学报, 2021, 41(5): 2001-2010. |
| [2] |
陈槐, 吴宁, 王艳芬, 等. 泥炭沼泽湿地研究的若干基本问题与研究简史[J]. 中国科学: 地球科学, 2021, 51(1): 15-26. |
| [3] |
饶娇萍, 贾沁贤, 王登红, 等. 中国泥炭矿成矿规律与开发利用[J]. 地质学报, 2020, 94(1): 192-203. |
| [4] |
KANG X M, HAO Y B, CUI X Y, et al. Variability and changes in climate, phenology, and gross primary production of an alpine wetland ecosystem[J]. Remote Sensing, 2016, 8(5): 391. DOI:10.3390/rs8050391 |
| [5] |
于跃辉. 泥炭藓沼泽湿地评价及保护: 以大兴安岭东部林区为例[J]. 安徽林业科技, 2020, 46(2): 39-42. DOI:10.3969/j.issn.2095-0152.2020.02.011 |
| [6] |
BAO K, XIA W, LU X, et al. Recent atmospheric lead deposition recorded in an ombrotrophic peat bog of Great Hinggan Mountains, Northeast China, from 210Pb and 137Cs dating[J]. Journal of Environmental Radioactivity, 2010, 101(9): 773-779. DOI:10.1016/j.jenvrad.2010.05.004 |
| [7] |
李增新, 薛淑云. 廉价吸附剂处理重金属离子废水的研究进展[J]. 环境污染治理技术与设备, 2006, 7(1): 6-11. |
| [8] |
WILD U, KAMP T, LENZ A, et al. Cultivation of Typha spp.in constructed wetlands for peatland restoration[J]. Ecological Engineering, 2001, 17(1): 49-54. DOI:10.1016/S0925-8574(00)00133-6 |
| [9] |
MARQUES J P, RODRIGUES V G S, RAIMONDI I M, et al. Increase in Pb and Cd adsorption by the application of peat in a tropical soil[J]. Water, Air, & Soil Pollution, 2020, 231(3): 136. |
| [10] |
NAWAB J, GHANI J, KHAN S, et al. Minimizing the risk to human health due to the ingestion of arsenic and toxic metals in vegetables by the application of biochar, farmyard manure and peat moss[J]. Journal of Environmental Management, 2018, 214: 172-183. |
| [11] |
LUBBAD S H, MOUSA E A. Softening of tap water via calcium removal using sphagnum peat moss sorbent by batch and flow-through approaches[J]. International Journal of Environmental Studies, 2020, 77(2): 222-235. DOI:10.1080/00207233.2020.1719805 |
| [12] |
顾健民, 丁德润. 泥炭和褐煤对Zn2+, Cu2+, Pb2+等重金属离子的吸附特征[J]. 环境化学, 1996, 15(4): 343-346. |
| [13] |
简立燕, 肖石红, 张中瑞, 等. 天宝岩国家级自然保护区4种泥炭沼泽湿地持水特性[J]. 四川农业大学学报, 2016, 34(4): 414-419, 425. |
| [14] |
陈花丹, 何东进, 游巍斌, 等. 天宝岩不同类型泥炭沼泽物种多样性与地上生物量关系[J]. 北华大学学报(自然科学版), 2014, 15(4): 535-539. |
| [15] |
GASKIN J W, STEINER C, HARRIS K, et al. Effect of low-temperature pyrolysis conditions on biochar for agricultural use[J]. Transactions of the ASABE, 2008, 51(6): 2061-2069. DOI:10.13031/2013.25409 |
| [16] |
席改红, 石国荣, 李强, 等. 木本泥炭对Cr(Ⅵ)的吸附性能[J]. 环境化学, 2019, 38(1): 202-208. |
| [17] |
唐雪娇, 章鹏鹏, 徐曹磊, 等. 生活污泥炭改性及其吸附性能研究[J]. 南开大学学报(自然科学版), 2020, 53(2): 50-55. |
| [18] |
毛凯, 陈颢明, 陈天民, 等. 不同粒径污泥生物质炭对水体中Zn污染的吸附效应研究[J]. 环境科学学报, 2020, 40(2): 536-545. |
| [19] |
CHAMBERS P A, PREPAS E E. Nutrient dynamics in riverbeds: the impact of sewage effluent and aquatic macrophytes[J]. Water Research, 1994, 28(2): 453-464. DOI:10.1016/0043-1354(94)90283-6 |
| [20] |
KASIULIENE A, CARABANTE I, BHATTACHARYA P, et al. Removal of metal(oid)s from contaminated water using iron-coated peat sorbent[J]. Chemosphere, 2018, 198: 290-296. DOI:10.1016/j.chemosphere.2018.01.139 |
| [21] |
WANG X S, TANG Y P, TAO S R. Kinetics, equilibrium and thermodynamic study on removal of Cr (Ⅵ) from aqueous solutions using low-cost adsorbent Alligator weed[J]. Chemical Engineering Journal, 2009, 148(2/3): 217-225. |
| [22] |
肖轲, 徐夫元, 降林华, 等. 离子交换法处理含Cr(Ⅵ)废水研究进展[J]. 水处理技术, 2015, 41(6): 6-11, 17. |
| [23] |
江娜, 宁增平, 郭圆, 等. 环境pH对微生物生物膜吸附重金属的影响研究进展[J]. 地球与环境, 2021, 49(2): 216-226. |
| [24] |
NAIYA T K, BHATTACHARYA A K, MANDAL S, et al. The sorption of lead (Ⅱ) ions on rice husk ash[J]. Journal of Hazardous Materials, 2009, 163(2/3): 1254-1264. |
| [25] |
姚璁, 何天容, 冉澍, 等. 巯基改性泥炭对水体中Hg2+的吸附解吸研究[J]. 工业水处理, 2020, 40(10): 67-71. |
| [26] |
梁兴唐, 李凤枝, 钟书明, 等. 聚乙烯亚胺原位改性多孔灯芯草高效吸附废水中的Cr(Ⅵ)[J]. 化工学报, 2021, 72(6): 3380-3389. |
| [27] |
VON DER WIESCHE M, WETZEL A. Temporal and spatial dynamics of nitrite accumulation in the River Lahn[J]. Water Research, 1998, 32(5): 1653-1661. DOI:10.1016/S0043-1354(97)00376-X |
| [28] |
MOKHTARI B, POURABDOLLAH K. Inclusion extraction of alkali metals by emulsion liquid membranes bearing nano-baskets[J]. Journal of Inclusion Phenomena and Macrocyclic Chemistry, 2013, 76(3/4): 403-413. DOI:10.1007/s10847-012-0212-y |

 2021, Vol. 41
2021, Vol. 41


