文章信息
- 陈胤好, 刘玉民, 闫洋洋, 代崇雯, 李峻安
- CHEN Yinhao, LIU Yumin, YAN Yangyang, DAI Chongwen, LI Jun'an
- 北美红枫‘十月光辉’扦插技术及生化分析
- Cutting methodology and biochemical analysis of Acer rubrum 'October Glory Maple'
- 森林与环境学报,2021, 41(4): 417-424.
- Journal of Forest and Environment,2021, 41(4): 417-424.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2021.04.012
-
文章历史
- 收稿日期: 2021-04-01
- 修回日期: 2021-06-01
2. 三峡库区生态环境教育部重点实验室, 重庆 400715
2. Key Laboratory of Eco-envirnments in Three Gorges Region, Ministry of Education, Chongqing 400715, China
北美红枫(Acer rubrum ‘Red Maple’)属槭树科(Aceraceae Juss.)槭属(Acer Linn.)落叶乔木,其外形高大挺拔、冠幅饱满、秋色艳丽醒目,季相变化分明,在城市绿化和景观规划中具有较高的应用价值[1]。自20世纪末引入我国后,学者们陆续开展了大量相关研究,‘红点’(Acer rubrum ‘Red Point’)、‘酒红’(Acer rubrum ‘Brand wine Maple’)、“秋火焰”(Acer rubrum ‘Autumn Blaze’)等北美红枫改良品种的扦插繁殖技术已经取得了一定进展[2-3]。研究发现,扦插基质和激素种类及浓度等均对北美红枫插穗生根有一定的影响[3],大部分北美红枫品种的最适扦插基质以珍珠岩为主,并辅助其他材料,最适生长调节剂为500~2 000 mg·L-1萘乙酸(naphthalene acetic acid,NAA)和100 mg·L-1生根粉(rooting powder,ABT)[2, 4]。研究还证实,生长调节剂处理会影响北美红枫插穗内营养物质(可溶性蛋白和可溶性糖)的含量,也会改变过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)、多酚氧化酶(polyphenol oxidase,PPO)及吲哚乙酸氧化酶(indoleacetic acid oxidase,IAAO)等氧化酶的活性,从而影响插穗的生根率及生根质量,但在北美红枫不同品种间相关研究结论存在一定差异[2-5]。
‘十月光辉’(Acer rubrum ‘October Glory Maple’)是北美红枫的杂交改良品种,具有彩叶期长、叶片变色稳定的特点,也是适宜城市“三化”(绿化、美化、彩化)的特色优良树种之一。‘十月光辉’实生苗叶色变异大[6],而无性繁殖技术是在林木改良过程中保持遗传增益和在繁殖过程中避免优良基因型分化的最佳选择[7]。扦插因其具有繁殖快、成本低和易于实施等优势,是使用最广的一种植物无性快繁技术[8]。‘十月光辉’为难生根树种,扦插生根率很不稳定,目前有关‘十月光辉’的扦插繁育技术还不完善,插穗生根机理尚不明确,不能满足苗木规模生产的需求,严重制约了其产业化发展。本试验以1年生‘十月光辉’枝条为试验材料,开展基质类型、生长调节物质、扦插时间等因素对插穗的生根影响研究,确定‘十月光辉’扦插快繁技术,通过分析不同生根水平插穗在生根过程中相关生理因子的变化差异,明确控制‘十月光辉’扦插生根的关键生理因子,揭示‘十月光辉’扦插生根机制,为‘十月光辉’扦插快繁体系建立提供技术指导和理论支持。
1 材料与方法 1.1 试验材料与取样方法试验材料来源于西南大学南校区试验田内的北美红枫5年生栽培品种‘十月光辉’,插穗采自当年生枝条,修剪成长度为10~12 cm,去掉叶片,上切口位于芽上方1~2 cm处,切口平切;下切口在芽下方4~5 cm处,切口以45°角度斜切(图 1)。

|
图 1 试验材料 Fig. 1 Experimental materials |
扦插基质处理试验:用‘十月光辉’当年生枝条于5月份进行扦插试验,设置5种不同扦插基质(表 1),每个处理50株插穗,所有插穗用NAA(50 mg·L-1)浸泡基部30 min,每个处理3次重复。扦插30 d后观察插穗生根情况,并统计生根率、愈伤率、根长和根粗。
| 基质Substrate | 基质配方Substrate formulation |
| T1 | 河沙∶腐殖质土=1∶1 River sand∶Humus soil=1∶1 |
| T2 | 石英砂∶腐殖质土=1∶3 Quartzite∶Humus soil=1∶3 |
| T3 | 蚯蚓土∶石英砂=3∶1 Earthworm soil∶Quartzite=3∶1 |
| T4 | 腐殖质土∶蛭石∶石英砂=3∶1∶1 Humus soil∶Vermiculite∶Quartzite=3∶1∶1 |
| T5 | 紫色土∶石英砂=3∶1 Purple soil∶Quartzite=3∶1 |
生长调节剂种类试验:用‘十月光辉’当年生枝条于10月份进行扦插试验,将插穗分别用浓度为50 mg·L-1的噻苯隆(thidiazuron,TDZ)、6-苄基氨基嘌呤(6-benzylaminopurine,6-BA)、赤霉素(gibberellic acid,GA3)、吲哚丁酸(indolebutyric acid,IBA)和NAA 5种生长调节剂浸泡处理30 min,基质为腐殖质土∶蛭石∶石英砂=3∶1∶1(质量比)。每个处理30株,重复3次。扦插30 d后观察插穗生根情况,并统计生根率、愈伤率、根长和根粗。
生长调节剂浓度试验:通过生长调节剂种类试验选出的最优的生长调节剂为NAA,将NAA设置为1、5、10、15、30、50、100 mg·L-1浓度梯度,处理时间30 min,基质为腐殖质土∶蛭石∶石英砂=3∶1∶1。每个处理10株,重复3次。用‘十月光辉’当年生枝条于12月份进行扦插试验,扦插30 d后统计插穗的生根率。
扦插季节试验:插穗分别于1、4、7、10月中旬进行扦插,基质为腐殖质土∶蛭石∶石英砂=3∶1∶1,所有插穗在15 mg·L-1 NAA溶液中浸泡30 min。每个处理50根,重复3次。扦插30 d后统计插穗的生根率。根长和根粗均用游标卡尺测定;愈伤率的统计方法为:愈伤率/%=产生愈伤枝条数/扦插枝条总数×100;生根率的统计方法为:生根率/%=生根枝条数/扦插枝条总数×100。
1.3 生理指标测定用‘十月光辉’当年生枝条于3月份进行扦插试验,浓度为15 mg·L-1 NAA浸泡处理插穗30 min,以50 mg·L-1 TDZ处理的插穗为对照CK(生长调节剂筛选试验结果显示,50 mg·L-1 TDZ处理插穗的生根率为0,而愈伤率为90%,适于做对照)。基质为腐殖质土∶蛭石∶石英砂=3∶1∶1,每个处理150根,重复3次。分别在扦插前(1 d)、扦插后每隔5 d取样,共5次。每次取样随机取插穗10根,用刀片剥取插穗基部2 cm范围内的表皮约0.2 g放入自封袋中,液氮速冻后置-80 ℃超低温冰箱保存,用于生理指标的测定,重复3次取样。
可溶性糖含量的测定采用蒽酮比色法[6];可溶性蛋白含量的测定采用考马斯亮蓝G-250染色法[6];POD活性测定采用愈创木酚比色法[9];CAT活性测定采用紫外吸收法[9];PPO活性采用邻苯二酌比色法测定[7];IAAO活性采用二氯酚比色法测定[7];丙二醛(malonyldialdehyde,MDA)含量采用TBA法测定[9]。
1.4 数据分析与处理选用Excel 2007软件进行数据统计、Origin 2017软件进行绘制图表,采用IBM SPSS Statistics 25统计软件比较差异是否具有统计学意义,进行数据的相关分析和单因素方差分析。
2 结果与分析 2.1 ‘十月光辉’扦插繁殖技术 2.1.1 扦插基质对插穗生根能力的影响扦插基质对‘十月光辉’插穗的愈伤率、生根率、根长均有较大影响,但对根粗的影响较小(表 2)。T2和T5基质中‘十月光辉’的愈伤率较高,均显著高于T1、T3、T4(P < 0.05)。T4和T5基质中‘十月光辉’插穗的生根率均显著高于T1、T2、T3(P < 0.05),而T4和T5基质间无显著差异(P>0.05),T4基质中‘十月光辉’的生根率最高,为56.00%。T3基质中‘十月光辉’的根长最长,为10.99 cm,而T4基质中的根长最短,仅为0.94 cm,显著低于其它扦插基质(P < 0.05)。扦插基质对‘十月光辉’根粗的影响较小,不同扦插基质间根粗的差异均不显著(P>0.05)。结果表明,扦插基质中高比例的腐殖质土、蛭石和石英砂(T4)可提供疏松、排水的生根条件,更有利于‘十月光辉’插穗的生根,但并不利于扦插苗根长的生长。因此,采用T4基质进行‘十月光辉’扦插时,插穗生根后应及时调整基质的组成比例,更有利于根系生长。
| 基质Substrate | 愈伤率Callus rate/% | 生根率Rooting rate/% | 根长Root length/cm | 根粗Root width/cm |
| T1 | 58.33±0.47c | 42.33±0.47c | 7.86±0.43b | 0.21±0.03a |
| T2 | 72.67±0.47a | 40.33±1.25c | 9.94±0.42ab | 0.21±0.04a |
| T3 | 56.00±0.82c | 42.33±0.47c | 10.99±0.30a | 0.24±0.01a |
| T4 | 66.33±0.47b | 56.00±0.82a | 0.94±0.22c | 0.19±0.04a |
| T5 | 70.00±0.82a | 52.33±2.05ab | 6.03±0.21b | 0.24±0.03a |
| 注:同列数据后不同小写字母表示差异具有统计学意义(P < 0.05)。Note: different lowercase letters after the same column indicate that the difference is statistically significant (P < 0.05). | ||||
生长调节剂种类对‘十月光辉’插穗的生根率、愈伤率、根长和根粗均有较大的影响(表 3),TDZ处理下的插穗愈伤率最高,达到了89.67%,而GA3并未诱导愈伤组织的形成,愈伤率为0;TDZ(50 mg·L-1)处理不能诱导插穗生根,生根率为0,而NAA处理下生根率最高,达到了52.33%;供试的5种生长调节物质对‘十月光辉’根长的影响差异显著(P < 0.05),NAA处理的插穗根长最长,为7.65 cm;6-BA诱导的根系最粗,为0.19 cm。愈伤率和生根率对同一生长调节剂的响应不同,TDZ处理的插穗愈伤率最高,但不能诱导不定根的形成,GA3处理不能诱导插穗愈伤形成和生根。通过对各个指标综合分析,NAA更有利于‘十月光辉’插穗生根及其根系生长。
| 生长调节剂Growth regulator | 愈伤率Callus rate/% | 生根率Rooting rate/% | 根长Root length/cm | 根粗Root width/cm |
| 噻苯隆TDZ | 89.67±1.25a | 0.00±0.00d | 0.00±0.00d | 0.00±0.00c |
| 萘乙酸NAA | 73.67±1.25ab | 52.33±1.25a | 7.65±0.25a | 0.16±0.04ab |
| 吲哚丁酸IBA | 33.33±2.49bc | 14.33±0.47c | 2.70±0.25b | 0.12±0.03bc |
| 6-苄基氨基嘌呤6-BA | 54.67±1.70b | 22.67±0.47b | 1.10±0.28c | 0.19±0.05a |
| 赤霉素GA3 | 0.00±0.00d | 0.00±0.00d | 0.00±0.00d | 0.00±0.00c |
| 注:同列数据后不同小写字母表示差异具有统计学意义(P < 0.05)。Note: different lowercase letters after the same column indicate that the difference is statistically significant(P < 0.05). | ||||
随NAA处理浓度的增加,‘十月光辉’插穗的生根率呈现先增后减的趋势(图 2)。在NAA浓度为15 mg·L-1时,与其它浓度处理间有显著差异(P < 0.05),此时‘十月光辉’插穗生根率达到最大,为66%。当NAA处理浓度从10 mg·L-1到15 mg·L-1时,生根率表现出显著地升高(P < 0.05);当NAA处理浓度大于30 mg·L-1后,生根率出现了显著降低(P < 0.05)。结果表明最适合‘十月光辉’扦插生根的NAA浓度为15 mg·L-1。

|
注:不同小写字母代表在不同浓度间差异具有统计学意义(P < 0.05)。Note: different lowercase letters show statistically significant differences between different concentrations(P < 0.05). 图 2 NAA浓度对‘十月光辉’扦插生根率的影响 Fig. 2 Effect of different NAA concentrations on the rooting rate of A. rubrum 'October Glory Maple' |
扦插时间对插穗成活率有很大的影响[10],且外界环境因素也影响着植物插穗生根能力[11]。本研究中(图 3),1和4月插穗的生根率显著高于7和10月(P < 0.05)。其中,插穗最大生根率在1月份,为68%,而插穗最小生根率在7月份,为40%,1与7月的生根率有28%之差。结果表明春季扦插最适合‘十月光辉’生根。
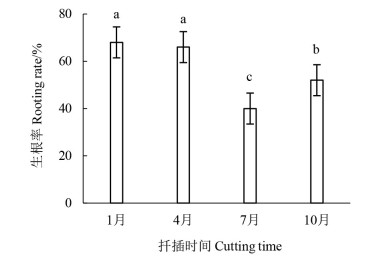
|
注:不同小写字母代表在不同扦插时间之间的差异具有统计学意义(P < 0.05)。Note: different lowercase letters show statistically significant differences between different times(P < 0.05). 图 3 扦插时间对‘十月光辉’生根率的影响 Fig. 3 Effect of different cutting times on the rooting rate of A. rubrum 'October Glory Maple' |
在扦插生根过程中,‘十月光辉’插穗基部皮可溶性糖含量随扦插生长而逐渐下降[图 4(a)],可溶性蛋白含量显著下降(P < 0.05)[图 4(b)],由于在扦插过程中插穗内部营养物质的消耗[12]。NAA处理下插穗内可溶性糖含量降幅小于对照,且显著(P < 0.05);在愈伤组织形成初期(6 d)和大量生根时期(16 d),NAA处理下插穗内可溶性糖和可溶性蛋白的含量显著高于对照(P < 0.05)(图 4)。表明插穗内可溶性糖和可溶性蛋白的积累可能是决定‘十月光辉’扦插能否生根的主要因子,营养物质的维持会更有利于‘十月光辉’插穗生根。
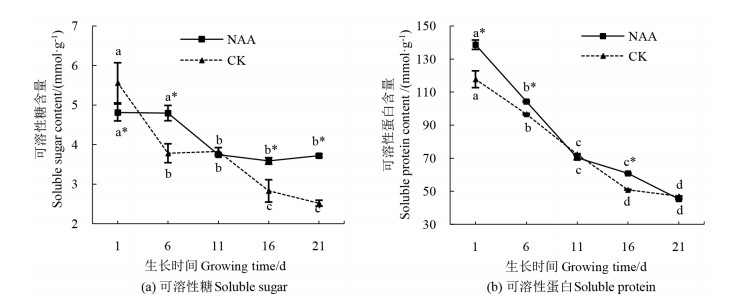
|
注:不同小写字母表示在时间变化上差异具有统计学意义(P < 0.05),*表示处理与对照间差异具有统计学意义(P < 0.05)。Note: different lowercase letters indicate statistically significant differences in time change(P < 0.05), * indicates a statistically significant difference between the treatment and control(P < 0.05). 图 4 生根过程中‘十月光辉’插穗内可溶性糖和可溶性蛋白含量的变化趋势 Fig. 4 Trends for change in soluble sugar and protein contents in A. rubrum 'October Glory Maple' cuttings |
POD活性的上升导致IAA的氧化分解,进而抑制了植物生长,而这种抑制效应具有累积作用[13-14]。在整个生根过程中,NAA处理下插穗内POD活性显著低于对照(P < 0.05)[图 5(a)],对照插穗中过高的POD活性可能是其没有生根的原因之一,这说明高活性的POD并不利于诱导和形成‘十月光辉’插穗的不定根。
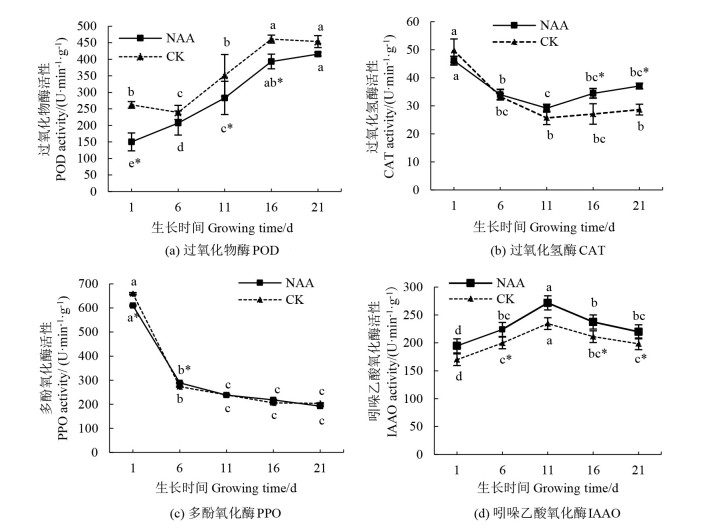
|
注:不同小写字母表示在时间变化上差异具有统计学意义(P < 0.05),*表示处理与对照间差异具有统计学意义(P < 0.05)。Note: different lowercase letters indicate statistically significant differences in time change (P < 0.05), * indicates a statistically significant difference between the treatment and control (P < 0.05). 图 5 生根程中‘十月光辉’插穗内氧化酶活性变化趋势 Fig. 5 Trends for change in oxidase activity in A. rubrum 'October Glory Maple' cuttings |
插穗CAT酶活性随插穗生长呈现先降低后升高的趋势[图 5(b)],且变化显著(P < 0.05)。插穗CAT的活性呈先下降的原因可能是在初期根形成时,插穗体内的代谢较慢以及H2O2产生水平较低;在大量生根后(16~21 d),NAA处理下插穗CAT的活性显著高于对照(P < 0.05),这是可能是由于生根后插穗内代谢活动增强,生成大量H2O2,而CAT可通过应激响应清除过量的H2O2。因此诱导CAT活性增强可以提高‘十月光辉’插穗的抗逆性,进而促进其生根。
植物在扦插生根的过程中,PPO催化多酚氧化为醌,醌聚合并与细胞内氨基酸反应产生黑色素沉淀,插穗发生褐变主要是PPO作用的结果[14-15]。PPO酶活性在愈伤组织诱导和形成期(1~6 d)显著降低(P < 0.05)[图 5(c)],可能是扦插初期插穗愈伤部位因为积累了过多的多酚类物质,而导致PPO的大量消耗。在愈伤组织形成期(6 d)和大量生根期(16 d),经NAA处理的插穗内PPO的活性显著高于对照(P < 0.05),表明经NAA处理后插穗内多酚类物质的积累显著降低,避免了插穗的褐化,进而有利于不定根的形成。
IAAO通过直接影响插穗体内IAA含量,间接对插穗不定根的诱导过程产生影响[16]。IAAO活性在不定根表达期(11~21 d)呈下降趋势[图 5(d)],在大量生根后降幅不显著(P>0.05),表明IAA在不定根表达期急剧升高并维持在较高水平,NAA处理下的插穗IAAO活性在大量生根期显著低于对照(P < 0.05),表明低活性的IAAO有利于插穗不定根形成。
2.2.3 插穗基部皮丙二醛含量的动态变化植物在逆境下受到伤害时,会通过膜脂的过氧化作用产生MDA,其含量高则表示该植物遭受伤害的程度严重[17]。‘十月光辉’扦插过程中插穗内MDA含量呈下降趋势(图 6),NAA处理的插穗MDA含量显著低于对照(P < 0.05),表明经NAA处理的‘十月光辉’插穗通过降低其膜脂过氧化程度,增强插穗的抗逆性,从而促进其生根。
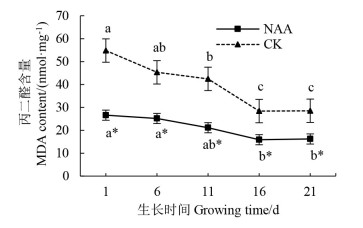
|
注:不同小写字母表示在时间变化上差异具有统计学意义(P < 0.05),*表示处理与对照间差异具有统计学意义(P < 0.05)。Note: different lowercase letters indicate statistically significant differences in time change(P < 0.05), * indicates a statistically significant difference between the treatment and control (P < 0.05). 图 6 生根过程中‘十月光辉’丙二醛的变化趋势 Fig. 6 Trend for change in MDA in A. rubrum 'October Glory Maple' cuttings |
植物扦插生根是一个复杂的过程,插穗的切口处理、留叶量等状态,其长度、粗度等规格,以及扦插基质、生长调节剂及其浓度、扦插季节的选择都会影响插穗内部的水分、营养物质的含量和氧化酶的活性[2, 7]。不同品种或种源要采取不同扦插管理方式以适应其遗传性状[15],研究认为‘酒红’、‘夏日红’等北美红枫品种以珍珠岩为最佳扦插基质,多数树种在春秋季适宜的扦插[2, 18],也有部分树种在有保暖措施的条件下,可在冬季进行扦插[19]。本研究中‘十月光辉’以高比例的腐殖质土、蛭石和石英砂作基质插穗生根率最高,可能是因为其扦插过程需要通气透水的土壤条件和相对低浓度的激素调节以利于生根。‘十月光辉’在春季扦插插穗的生根效果最好,可能是因为重庆的春季光照强度适中且雨水较多,对插穗切口愈伤组织的形成和根系的分化尤为适宜。
生长调节物质是提高植物扦插生根的重要因素,也是影响插穗生根能力的关键因子。NAA、ABT和IBA等生长调节物质能显著提高多数北美红枫品种的插穗生根率,但不同品种生根所需的最佳生长调节物质种类并不相同[2-4, 6],本研究中经NAA处理的‘十月光辉’插穗生根率最高,IBA和6-BA处理的插穗生根效果较差,而GA3和TDZ处理的插穗则并未生根。有研究认为,NAA可通过促进插穗基部的淀粉水解成还原性糖等能源物质为插穗提供能量来源,从而促进插穗生根,这可能是本研究中经NAA处理的‘十月光辉’插穗生根率最高的主要原因。植物愈伤组织诱导和根系发生所需生长调节物质的种类并不相同[16, 20],研究表明TDZ诱导有利于植物愈伤组织形成,但对植物生根的促进作用不明显[20-21],这与本研究中经TDZ处理的‘十月光辉’插穗愈伤率最高(90%),而生根率为最低(0)的结果一致。
本试验中‘十月光辉’扦插生根过程中插穗基部皮内可溶性糖含量随扦插生长而逐渐下降,与北美红枫的其他改良种扦插试验结果一致[3-4],可能是由于插穗在生根的过程中代谢加快,呼吸速率和氧化作用不断加强,这些生理活动消耗插穗体内大量糖分和蛋白质[11-12]。‘十月光辉’扦插过程中NAA处理的插穗生根率及大量生根期的插穗内营养物质含量均显著高于对照,说明NAA处理可以减少‘十月光辉’插穗内营养物质的消耗,据此可推测,插穗内可溶性糖和可溶性蛋白等营养物质的积累可能是决定‘十月光辉’扦插能否生根的主要因子,在插穗生根过程中,其营养物质的维持更有利于‘十月光辉’插穗生根。
扦插生根在短时间内新陈代谢较为剧烈,除了营养物质的供应,体内相关氧化酶也参与了这些过程,且氧化酶发挥着重要作用[22]。本研究的插穗在整个生根过程中其POD活性呈上升趋势,POD活性的升高可能是由于剪切作用刺激伤口处分泌酚类物质,还可能与生长素代谢和细胞壁的木质化有关[23];本研究中NAA处理的插穗基部皮的POD活性显著低于对照,说明高活性的POD不利于插穗生根。CAT与植物氧化衰老等生理过程有关[7, 11],麻疯树插穗愈伤组织和根的形成时期CAT活性增强[24],厚叶扇子花插穗生根过程中其CAT活性呈先下降后上升趋势[25],与本研究结果一致。插穗基部皮内CAT活性在未生根之前下降,这是由于插穗基部存在切口,基部组织被氧化程度高,在插穗生根后插穗代谢活力增强,此时CAT活性上升,与插穗活力呈密切正相关。在‘十月光辉’扦插过程的愈伤组织形成期和大量生根期,插穗基部皮内PPO活性显著高于对照,可能是较高活性的PPO有效催化了插穗内酚类物质,进而促进了IAA-酚酸复合物的合成,从而有利于不定根的形成[26],但高活性的PPO对愈伤组织形成无促进作用,其具体机制需要进一步研究。有研究认为难生根树种IAAO活性基本呈上升趋势[16, 23],而本试验中‘十月光辉’插穗基部皮内IAAO活性呈先增后减的趋势,且NAA处理的插穗在根系形成期IAAO活性显著低于对照,与以前的研究结果有一定差异,可能是因为在根形成阶段较低活性的IAAO减少对IAA的氧化消耗,插穗内维持较高水平的IAA有利于不定根的形成。
4 结论美国红枫‘十月光辉’扦插的关键技术是以腐殖质土∶蛭石∶石英砂=3∶1∶1为基质,用15 mg·L-1 NAA浸泡插穗30 min,在春季进行扦插。插穗生根后及时调整基质的组成或补充营养物质,更有利于其根系生长。
插穗基部皮内营养物质的积累与维持可能是决定‘十月光辉’扦插能否生根的主要因子,插穗基部皮内的IAAO、POD、CAT和PPO活性可通过调控插穗内生长素水平、活性氧含量及插穗褐化程度间接影响生根能力。
| [1] |
LI L, LIU Y M, WANG M, et al. Physiological response mechanism of three kinds of Acer rubrum L.under continuous high temperature and drought stress[J]. Acta Ecologica Sinica, 2014, 34(22): 6471-6480. |
| [2] |
陆秀君, 洪晓松, 刘景强, 等. 扦插基质及生根促进剂对美国红枫扦插繁殖的影响[J]. 西北林学院学报, 2015, 30(5): 138-142. DOI:10.3969/j.issn.1001-7461.2015.05.22 |
| [3] |
DAI C W, YAN Y Y, LIU Y M, et al. The regeneration of Acer rubrum L.'October Glory' through embryonic callus[J]. BMC Plant Biology, 2020, 20(1): 309. DOI:10.1186/s12870-020-02496-z |
| [4] |
吴琰琰, 刘玉民, 闫洋洋. 北美红枫秋季呈色的生理机制研究[J]. 西南大学学报(自然科学版), 2019, 41(5): 21-29. |
| [5] |
LI L, MANNING W J, WANG X K. Effects of elevated CO2 concentrations on leaf senescence and late-season net photosynthesis of red maple(Acer rubrum)[J]. Water, Air, & Soil Pollution: an International Journal of Environmental Pollution, 2020, 231(9): 351-372. DOI:10.1007/s11270-020-04828-z |
| [6] |
刘玉民, 刘亚敏, 马明, 等. 马尾松扦插生根过程相关生理生化分析[J]. 林业科学, 2010, 46(9): 28-33. |
| [7] |
SHEN L, ZHANG J H, NI JG, et al. Study on rapid propagation of mutant Photinia fraseri in vitro[J]. Acta Agriculture Zhejiangensis, 2014, 26(5): 1207-1211. |
| [8] |
CHEN B H, LI J M, ZHANG J, et al. Optimizing the propagation of Cinnamomum micranthum by cuttings[J]. Life Science Journal, 2014, 11(12): 928-931. |
| [9] |
袁哈利, 郝晓云, 郑学伟, 等. 陆地棉GDSL脂肪酶增强拟南芥对黄萎病菌的抗性[J]. 石河子大学学报(自然科学版), 2015, 33(5): 529-534. |
| [10] |
魏茂胜. 不同处理对茶绒杜鹃扦插生根与生长的影响[J]. 森林与环境学报, 2019, 39(1): 27-31. |
| [11] |
张帆, 王鸿. 桃硬枝扦插生根机理研究进展[J]. 植物生理学报, 2019, 55(11): 1595-1606. |
| [12] |
ZHANG H, GRAVES W R, TOWNSEND A M. Water loss and survival of stem cuttings of two maple cultivars held in subirrigated medium at 24 to 33℃[J]. Hortscience A Publication of the American Society for Horticultural Science, 1997, 32(1): 129-131. |
| [13] |
MA Y, RONG S, SONG Q, et al. Study on cutting propagation and rooting mechanism of Magnolia officinalis subsp.biloba[J]. Chinese Agricultural Science Bulletin, 2012, 28(33): 112-117. |
| [14] |
GASPAR T, KEVEERS C, HAUSMAN J F, et al. Practical uses of peroxidase activity as a predictive marker of rooting performance of micropropagated shoots[J]. Agronomy for Sustainable Development, 1992, 12(10): 757-765. |
| [15] |
王瑞敏, 祝凌云, 陈颖, 等. 金叶银杏硬枝扦插繁殖生根过程及其生根机制研究[J]. 中南林业科技大学学报, 2020, 40(5): 28-37. |
| [16] |
路斌, 缴丽莉, 李京涛, 等. 生长调节剂对金叶白蜡扦插生根及酶活性的影响[J]. 林业与生态科学, 2018, 33(1): 93-97. |
| [17] |
周强英, 黄泽梅, 陈瑶. 铅镉复合胁迫下黄葛树和女贞的生长生理及吸收特性研究[J]. 西南林业大学学报(自然科学), 2019, 39(6): 33-40. |
| [18] |
邱子文, 林永盛, 向旭文, 等. 基质和生根剂处理对千层金扦插繁育的影响[J]. 森林与环境学报, 2020, 40(6): 648-653. |
| [19] |
仲兆清, 潘春香. 不同基质、外源激素与扦插时间对油茶扦插育苗的影响[J]. 南方农业学报, 2014, 45(4): 623-627. DOI:10.3969/j:issn.2095-1191.2014.4.623 |
| [20] |
吴夏雷, 韩超, 孙宇涵, 等. 杉木体细胞胚胎发生胚性愈伤组织诱导条件的优化[J]. 北京林业大学学报, 2020, 42(2): 79-86. |
| [21] |
张旭红, 王頔, 梁振旭, 等. 欧洲百合愈伤组织诱导及植株再生体系的建立[J]. 植物学报, 2018, 53(6): 840-847. |
| [22] |
郑涛, 樊军锋, 张海燕. 秦白杨3号扦插繁育技术研究[J]. 西北林学院学报, 2019, 34(5): 122-126. DOI:10.3969/j.issn.1001-7461.2019.05.19 |
| [23] |
宋金耀, 刘永军, 宋刚, 等. 几个常见树种扦插生根过程中POD、IAAO活性及酚含量的变化[J]. 江苏农业科学, 2007(6): 115-118. DOI:10.3969/j.issn.1002-1302.2007.06.037 |
| [24] |
郑科, 郎南军, 曹福亮, 等. 麻疯树扦插过程插条IAAO与CAT酶活性变化研究[J]. 南方农业学报, 2011, 42(11): 1332-1336. DOI:10.3969/j.issn.2095-1191.2011.11.007 |
| [25] |
刘玉民, 刘亚敏, 徐娜婷, 等. IBA处理对厚叶扇子花扦插苗生根关联酶活性的影响[J]. 草业科学, 2011(5): 777-782. DOI:10.3969/j.issn.1001-0629.2011.05.013 |
| [26] |
周幼成. 千年桐半木质化春梢扦插繁殖及生根机理研究[J]. 中南林业科技大学学报, 2020, 40(8): 25-36. |

 2021, Vol. 41
2021, Vol. 41


