文章信息
- 袁贵云, 孙学广, 郑炀, 郭其强, 丁贵杰
- YUAN Guiyun, SUN Xueguang, ZHENG Yang, GUO Qiqiang, DING Guijie
- 马尾松叶表微生物多样性
- Epiphytic microbial diversity of Pinus massoniana needles
- 森林与环境学报,2021, 41(3): 318-324.
- Journal of Forest and Environment,2021, 41(3): 318-324.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2021.03.012
-
文章历史
- 收稿日期: 2021-01-13
- 修回日期: 2021-03-12
2. 贵州大学林学院, 贵州 贵阳 550025
2. College of Forestry, Guizhou University, Guiyang, Guizhou 550025, China
叶际主要指植物叶形成的环境,能在叶际生存的微生物被称为叶际微生物[1]。叶际包含叶表和叶子的内部,叶际微生物也分为叶表微生物和叶内生微生物[2]。不同于叶的内部环境,叶表环境更为多变,叶表温度和湿度的波动较大、紫外线辐射强度高,可供微生物利用的营养非常有限且分布不均,叶表微生物的生存环境恶劣,还面临着植物防御机制的影响[3-4]。尽管如此,植物叶表仍存在大量的微生物,包括细菌、真菌、线虫和病毒等[5-6]。叶表微生物在促进植物生长、提高植物抗病性和参与生态系统碳氮循环方面发挥重要作用[7],但目前仅在少数几种植物上开展了叶表微生物的多样性研究,主要为农作物[8],林木类仅见于红松(Pinus koraiensis Sieb. et Zucc.)[9-10]、油松(P. tabuliformis Carrière)[11]。叶表微生物的收集是叶表微生物分离培养及多样性分析的首要步骤,目前,针对叶表微生物的收集尚无公认的标准方法,常用的收集方法主要有悬摇法(或震荡法)[12-13]和超声波法[14-15]两类。然而,有关这两类方法收集效果的比较研究鲜见报道。
马尾松(P. massoniana Lamb.)是我国亚热带地区特有的重要造林树种[16],具有较高的经济价值和生态价值,目前,对其叶表微生物的研究鲜见报道。研究马尾松叶表微生物多样性对发掘有利于林木生长发育的优良微生物资源、解析林木与微生物的互作关系有重要意义。鉴于此,本研究以马尾松针叶为试验材料,分别采用悬摇法和超声波法收集叶表微生物,比较这两种方法的收集效果,以期为叶表微生物收集方法的选择提供参考,并用扩增子高通量测序技术、MUSCLE和Qiime软件研究马尾松叶表微生物的多样性,研究结果可为揭示马尾松与叶表微生物的互作关系提供理论依据。
1 材料与方法 1.1 样地概况样地位于贵州省都匀市龙里林场响水工区(107°00′37″E,26°28′00″N),属亚热带季风气候区,年平均降水量1 100 mm,年平均气温14.8 ℃。采集点为马尾松人工纯林,调查树龄22 a(速生期)。林下土壤为黄壤,pH值4.4,有机质含量21.46 g·kg-1,总氮含量0.68 g·kg-1,有效氮含量62.20 mg·kg-1,总磷含量0.11 g·kg-1,有效磷含量0.86 mg·kg-1和有效钾含量62.70 mg·kg-1[17]。
1.2 针叶采集根据周政贤[16]的研究结果,速生期马尾松的针叶生物量集中在第5~8盘的2~3年生枝条,为使采集的样品更具代表性,从树冠中部(树冠底部向上2 m左右)收集针叶。具体采集过程为:在样地内随机选取10株马尾松(间距10 m以上),使用15 m长的高枝剪按不同方位采集针叶,每株采集约20 g。将采集的针叶混合后随机取10束用于扫描电子显微镜(scanning electron microscope, SEM)观测,剩余的针叶用于叶表微生物收集。
1.3 叶表微生物收集取5 g针叶置于装有150 mL无菌水的三角瓶(250 mL)中,水完全浸没针叶,用悬摇法(恒温摇床25 ℃,200 r·min-1悬摇60 min)或超声波法(25 ℃,40 kHz,处理15 min)洗脱叶表微生物,对洗脱液离心并收集沉淀物。悬摇法的洗脱条件参考GOMES et al[12]和THAPA et al[13]的方法,超声波法的洗脱条件参考FINKEL et al[14]和OTTESEN et al[15]的方法。每种洗脱方法各收集18瓶,每3瓶收集的沉淀物合并为1个样品,共6个样品,其中1个样品用于SEM观测,其余样品-40 ℃储存,用于微生物多样性分析。另保留部分经超声波和悬摇洗脱后的针叶用于SEM观测。
1.4 叶表微生物观测叶表微生物的原位观测:为减少脱水过程对叶表微生物的影响,用鲜样进行叶表微生物的原位观测。将针叶剪成1 cm长的片段后用导电胶带粘贴在样品台上,用离子溅射仪(型号为MSP-mini)镀金1 min。SEM(型号为TM 4 000 plus)观测条件为:低真空,5 kV,背散射电子成像。
待针叶表面水分自然蒸发完全后,采用同样的方法进行针叶叶表微生物观测。
叶表微生物收集物观测:因收集物含水量较高,需脱水处理后观测。脱水过程为:将收集物浸入质量分数为2.5%的戊二醛溶液,4 ℃过夜固定,10 000 r·min-1离心5 min后弃去上清液,随后用pH值7.2的PBS缓冲液漂洗3~4次,每次15 min(每次漂洗完成后均离心弃上清液);依次用体积分数为30%、50%、75%、95%的乙醇和无水乙醇逐级脱水,每次30 min(每次脱水完成后均离心弃上清液);分别用体积比为3∶1、2∶2、1∶3的乙醇与叔丁醇混合液处理收集物10 min,最后用叔丁醇处理10 min(每次处理结束后均离心弃去上清液)。待叔丁醇完全挥发后进行SEM观测,用毛笔蘸取收集物后均匀涂抹在导电胶带上,离子溅射仪镀金1 min。SEM观测条件为:高真空,15 kV,背散射电子成像。
1.5 叶表微生物多样性分析采用PowerSoil DNA isolation kit试剂盒提取叶表微生物收集物的DNA,分别使用带DNA片段(DNA barcode)的515F+907R和ITS5+ITS2引物对细菌16S V4-V5区和真菌ITS1区序列进行扩增纯化,并构建文库。基于novaseq 6 000平台对原来的数据进行了拼接、质控和嵌入式过滤等操作,获得适用于随时检测和处理的有效数据进行高通量测序分析。使用Uparse软件以97%的频率一致性把有效的数据序列集合聚类为最邻近的运算分类单位(operational taxonomic units,OTUs),筛选OTUs中出现频率最高的数据序列作为OTUs的一个代表。
物种注释: 对OTUs序列进行物种注释,基于MUSCLE软件对细菌和真菌进行快速多序列比对,获得所有OTUs代表序列的系统发生关系,并在各分类水平统计各样本的群落组成,最后以样本中数据量最少的为标准对各样本的数据进行均一化处理。
多样性分析:基于Qiime软件进行运算分类单位数(OTUs number)、Chao1、香农-威纳指数(Shannon index)等Alpha多样性指数和加权UniFrac距离(weighted Unifrac distance),并构建非加权配对算数平均法(unweighted pair-group method with arithmetic means, UPGMA)样本聚类树;使用R软件(Version 2.15.3)绘制叶表微生物的测定物种指数稀释曲线,进行Alpha多样性指数组间差异分析。
2 结果与分析 2.1 叶表微生物定殖情况的扫描电子显微镜观测马尾松叶表微生物定殖情况的扫描电子显微镜观测结果如图 1所示。马尾松针叶表面定殖有大量微生物,包括真菌(菌丝及孢子)和细菌。这些叶表微生物大多聚集分布,主要分布于气孔周围及叶表棱纹间隙,偶见菌丝穿过气孔进入针叶内部[图 1(a)]。从图 1(b)和(c)可以看出,悬摇法和超声波法均能从马尾松针叶表面收集到大量微生物,收集物中可见大量菌丝、细菌或孢子。相较于悬摇法,超声波法对叶表真菌的收集效果更佳,经超声波处理的针叶表面更为洁净,且几乎无菌丝或孢子残留。在细菌收集方面,两种方法均可有效洗脱叶表细菌。

|
注:白色箭头指示菌丝,黑色箭头指示细菌或孢子,燕尾箭头指示结构可能为分生孢子串,“S”代表气孔。标尺为20 μm。 Note: white arrowheads indicate hyphae; black arrowheads indicate bacteria or spores, dovetail arrows indicate the conidia cluster; "S" represents stomata. Scale bar is 20 μm. 图 1 叶表微生物的定殖情况 Fig. 1 Colonization of epiphytes on P. massoniana needles |
利用重叠关系将双末端测序得到的成对短序列(Reads)拼接、质控、去嵌合体,共得到619 891条有效序列。以97%的一致性将序列聚类成为OTUs,去除低频序列后595 664条序列共聚类成490个OTUs。通过与数据库Silva132比对,进行物种注释,并对不同分类层级统计发现:注释到界水平的比例为100.00%,门水平的比例为99.95%,纲水平的比例为95.17%,目水平的比例为95.07%,科水平的比例为93.29%,属水平的比例为81.35%,种水平的比例为66.85%。其中,在门水平上,优势类群主要为变形杆菌门(Proteobacteria)(50.26%)、蓝细菌门(Cyanobacteria)(41.22%);在科水平上的优势物种为拜叶林克氏菌科(Beijerinckiaceae)(40.04%)、未分类的蓝细菌科(unidentified_Cyanophyceae)(36.53%);优势属为未分类的蓝细菌属(unidentified_Cyanobacteria)(36.53%)、未分类的拜叶林克氏菌属(unidentified_Beijerinckia)(28.60%)、鞘氨醇单胞菌属(Sphingomonas)(2.35%)。
2.2.2 真菌多样性通过对Reads拼接、质控、去嵌合体,共得到646 437条有效序列。以97%的一致性将序列聚类成为OTUs,去除低频序列后624 432条序列共聚类成1 273个OTUs。通过与数据库UNITE比对进行物种注释,并对不同分类层级统计发现:能够注释到界水平的比例为100.00%,门水平的比例为18.49%,纲水平的比例为15.70%,目水平的比例为15.32%,科水平的比例为9.86%,属水平的比例为8.59%,种水平的比例为6.35%。其中,在门水平上,优势类群主要为子囊菌门(Ascomycota)(16.40%)、担子菌门(Basidiomycota)(1.89%);在科水平上的优势物种为枝孢霉科(Cladosporiaceae)(2.46%)、球腔菌科(Mycosphaerellaceae)(1.24%);优势属为枝孢属(Cladosporium)(2.45%)、拟盘多毛孢属(Pestalotiopsis)(0.92%)、无头孢菌属(Capnobotryella)(0.91%)。
悬摇法和超声波法所收集的细菌类群数目变化随着序列数的增加逐渐呈现出平缓趋势,继续增加序列数仅有小部分新的观测物种会产生,说明序列数是充足的[图 2(a)];而所收集的真菌物种数目差异较为明显,其物种丰富度在样品间的波动也存在较大差异,随序列数的增加悬摇法比超声波法更早趋于平缓[图 2(b)]。
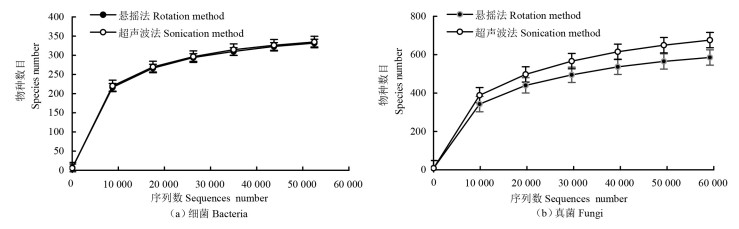
|
图 2 叶表微生物的测定物种指数稀释曲线 Fig. 2 Rarefaction curve based on observed species of microorganisms on the leaf surface of P. massoniana |
悬摇法和超声波法收集物的细菌OTUs数差别不大,分别为454个和441个,共有的OTUs数为405个;两种方法获取的收集物的真菌OTUs差异较大,分别为1 158个(超声波法)和967个(悬摇法),共有的OTUs数为852个。
2.3.1 收集方法对细菌多样性检测结果的影响两种方法测得的细菌群落α多样性指数均相近,表明两种收集方法所检测到的OTUs数、Chao1指数、物种丰度(香农-威纳指数)以及均匀度(辛普森指数)均无显著差异(表 1)。两种收集方法测得的测序深度指数均大于0.990,表明测序深度已基本覆盖到样品中所有的物种。
| 方法 Method |
运算分类单位数 OTUs number |
香农-威纳指数 Shannon index |
辛普森指数 Simpson index |
Chao1指数 Chao1 index |
测序深度指数 Sequencing depth index |
| 悬摇法Rotation method | 331.8±18.0a | 4.101±0.394a | 0.825±0.039a | 381.410±56.071a | 0.999±0.000a |
| 超声波法Sonication method | 334.6±11.0a | 3.539±0.414a | 0.736±0.073a | 357.783±11.036a | 0.999±0.000a |
| 注:同列数据后的相同字母代表数据间无显著差异(P>0.05)。Note: the same letter after the data in the same column means that there is no significant difference between the data(P>0.05). | |||||
聚类分析表明,超声波法处理的样品测得的细菌群落组分差异较小,表明该方法的重复性较好;相较而言,悬摇法处理的样品间组分差异较大(图 3)。整体而言,变形杆菌门、蓝细菌门、酸杆菌门(Acidobacteria)是马尾松叶表细菌的优势群落。
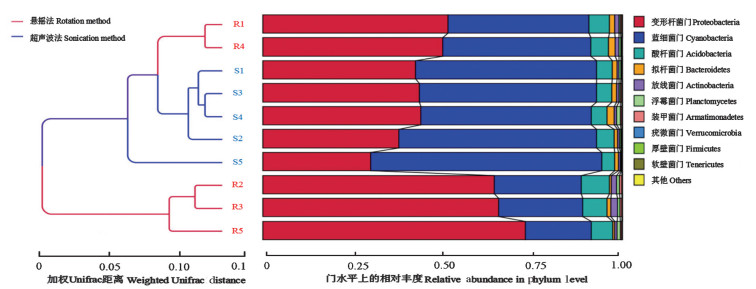
|
图 3 叶表细菌群落基于加权Unifrac距离的聚类树 Fig. 3 Clustering tree based on weighted Unifrac distance of the epiphytic bacterial communities |
超声波法收集的叶表真菌群落的OTUs数、香农-威纳指数均显著高于悬摇法(P < 0.05),辛普森指数、Chao1指数及测序深度指数则无显著差异(表 2),表明由超声波法收集的真菌群落物种多样性更高,而两种方法收集的真菌群落的物种均匀度无明显差异。两种方法的高通量测序深度也覆盖到了样品中所有的物种(测序深度指数大于0.990)。
| 方法 Method |
运算分类单位数 OTUs number |
香农-威纳指数 Shannon index |
辛普森指数 Simpson index |
Chao1指数 Chao1 index |
测序深度指数 Sequencing depth index |
| 悬摇法Rotation method | 585.4±37.4A | 5.489±0.191a | 0.951±0.008a | 656.155±41.416a | 0.998±0.000 0a |
| 超声波法Sonication method | 667.0±36.1B | 5.746±0.093b | 0.957±0.006a | 886.440±312.880a | 0.998±0.000 8a |
| 注:同列数据后的不同大写字母代表数据间差异达极显著水平(P<0.01);同列数据后的不同小写字母代表数据间差异达显著水平(0.01<P<0.05)。Note: different capital letters after the same column of data indicate extremely significant differences between the data(P < 0.01); different lowercase letters after the same column of data indicate significant differences between the data(0.01<P<0.05). | |||||
在门水平上,各样本内占据主导地位的主要是子囊菌门、担子菌门、被孢霉门(Mortierellomycota),各样本中有大量OTUs(超过75%)尚未注释到门水平;两种方法收集的真菌群落结构相似,其中,悬摇法收集的真菌群落共聚于一支,样品间群落相似性更高(图 4)。
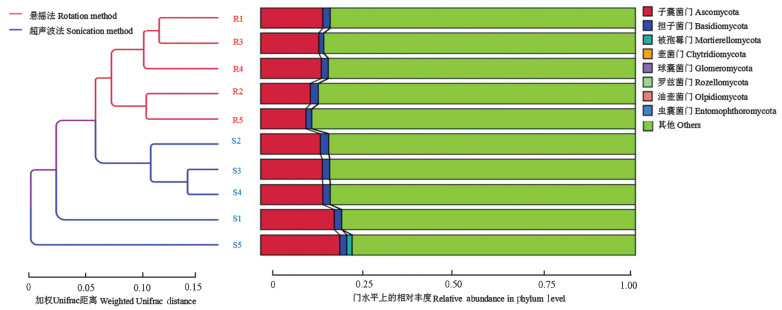
|
图 4 不同样品叶表真菌群落基于加权Unifrac距离的聚类树 Fig. 4 Clustering tree based on weighted Unifrac distance of epiphytic fungal communities |
SEM观测结果及微生物多样性分析结果表明,马尾松叶表有丰富的微生物。马尾松叶表微生物多聚集并沿叶脉沟槽分布或分布在气孔周围,这与其他植物叶表微生物在叶片上的分布情况类似[18-19],这些区域往往能为微生物提供更多的水分和营养物质[20]。一般而言,叶表微生物类群中细菌有着较高的生物量和物种多样性[11, 20],然而,本研究中SEM观测结果及微生物多样性测试结果均表明,马尾松叶表真菌多样性和生物量均高于叶表细菌,这可能与植物类型及针叶的特异性有关。另外,相较于农作物类的草本植物,细菌向高大乔木冠层(高度往往大于10 m)的扩散能力有限,而真菌则可释放大量的孢子并通过气流传播。
同其他植物类似[21-22],变形杆菌门细菌是马尾松叶表细菌群落中的优势类群;但蓝细菌门细菌也占有较大比例,这与以往研究差异较大,可能与宿主植物的特异性有关[20]。针叶相较于阔叶没有明显的正反面,叶表细菌更易受到辐射、干旱等影响,生存环境更为恶劣,而蓝细菌有相对较强的抗逆能力且可固氮固碳,更能适应这种严酷的环境[23]。鞘氨醇单胞菌属作为优势属,可帮助植物叶片抵挡紫外辐射[24]。优势属未分类的蓝细菌属可能在固氮、改善植物叶际营养环境方面有重要功能[25],而未分类的拜叶林克氏菌属细菌主要为乙烷营养型[26],其在马尾松叶表发挥的具体功能有待进一步研究。子囊菌门真菌是马尾松叶表真菌中最主要的类群,这与其他植物的研究结果一致[27-28]。枝孢属、拟盘多毛孢属和无头孢菌属是马尾松叶表真菌的优势属,这些类群的真菌在林木叶表较为常见[29-31],其中,枝孢属优势真菌类群在红松叶栖真菌的研究中也有发现[9-10],它们可能在维持植物叶际环境中发挥重要功能。本研究中有大量真菌OTUs未能注释特定分类单元,表明马尾松叶表真菌仍有大量类群是未知的。
本研究选用的悬摇法和超声波法均可有效收集马尾松叶际微生物。针对叶表细菌多样性研究,悬摇法和超声波法均有较好的物种检出度,但相较而言,超声波法收集物的细菌群落重复性更优;在叶表真菌多样性方面,超声波法的收集物有较高的物种检出度,这可能与超声波法对叶表微生物有更好的洗脱效果有关。但超声波法收集的叶表真菌群落在其样品间变异性较大,表明其洗脱效果可能不稳定。在进行马尾松叶表细菌多样性研究时,悬摇法和超声波法均适用;在进行马尾松叶表真菌多样性研究时,则需要根据测试目的进行选择(侧重物种多样性研究可选择超声波法,侧重群落结构和功能研究则悬摇法更适宜)。另外,用磷酸缓冲液替代无菌水收集叶表微生物的收集效果无明显差异[2, 12, 14]。值得注意的是,因不同植物叶表物理和化学性质有所差异,本研究的结果对于其他植物(特别是阔叶树)是否适用还需要进一步探索验证。为取得更好的收集效果,未来可将两种方法结合起来对叶表微生物的收集方法进一步优化。
| [1] |
LINDOW S E, BRANDL M T. Microbiology of the phyllosphere[J]. Applied and Environmental Microbiology, 2003, 69(4): 1857-1883. |
| [2] |
周育, 乔雄梧, 王静, 等. 植物叶际微生物提取方法研究[J]. 植物研究, 2006, 26(2): 233-237. DOI:10.3969/j.issn.1673-5102.2006.02.024 |
| [3] |
REISBERG E E, HILDEBRANDT U, RIEDERER M, et al. Distinct phyllosphere bacterial communities on Arabidopsis wax mutant leaves[J]. PLoS One, 2013, 8(11): e78613. DOI:10.1371/journal.pone.0078613 |
| [4] |
BRINGEL F, COUÉE I. Pivotal roles of phyllosphere microorganisms at the interface between plant functioning and atmospheric trace gas dynamics[J]. Frontiers in Microbiology, 2015, 6: 486. |
| [5] |
VACHER C, HAMPE A, PORTÉ A J, et al. The phyllosphere: microbial jungle at the plant-climate interface[J]. Annual Review of Ecology, Evolution, and Systematics, 2016, 47: 1-24. DOI:10.1146/annurev-ecolsys-121415-032238 |
| [6] |
KOSKELLA B. Phage-mediated selection on microbiota of a long-lived host[J]. Current Biology, 2013, 23(13): 1256-1260. DOI:10.1016/j.cub.2013.05.038 |
| [7] |
潘建刚, 呼庆, 齐鸿雁, 等. 叶际微生物研究进展[J]. 生态学报, 2011, 31(2): 583-592. |
| [8] |
刘利玲, 李会琳, 蒙振思, 等. 青杨雌雄株叶际微生物群落多样性和结构的差异[J]. 微生物学报, 2020, 60(3): 556-569. |
| [9] |
黄永青, 邵力平, 马俊莹. 树栖真菌群落多样性研究Ⅰ: 红松芽、叶及短枝栖真菌群落组成分析[J]. 菌物系统, 1997, 16(3): 182-188. |
| [10] |
宋瑞清, 黄永青. 红松叶栖真菌群落结构: Ⅱ[J]. 东北林业大学学报, 2001, 29(1): 103-107. DOI:10.3969/j.issn.1000-5382.2001.01.029 |
| [11] |
郑义. 黑皮油松叶围微生物及抑菌作用研究[J]. 吉林农业, 2011(10): 57. |
| [12] |
GOMES T, PEREIRA J A, BENHADI J, et al. Endophytic and epiphytic phyllosphere fungal communities are shaped by different environmental factors in a Mediterranean ecosystem[J]. Microbial Ecology, 2018, 76(3): 668-679. DOI:10.1007/s00248-018-1161-9 |
| [13] |
THAPA S, RANJAN K, RAMAKRISHNAN B, et al. Influence of fertilizers and rice cultivation methods on the abundance and diversity of phyllosphere microbiome[J]. Journal of Basic Microbiology, 2018, 58(2): 172-186. DOI:10.1002/jobm.201700402 |
| [14] |
FINKEL O M, BURCH A Y, LINDOW S E, et al. Geographical location determines the population structure in phyllosphere microbial communities of a salt-excreting desert tree[J]. Applied and Environmental Microbiology, 2011, 77(21): 7647-7655. DOI:10.1128/AEM.05565-11 |
| [15] |
OTTESEN A R, GORHAM S, REED E, et al. Using a control to better understand phyllosphere microbiota[J]. PLoS One, 2016, 11(9): e0163482. DOI:10.1371/journal.pone.0163482 |
| [16] |
周政贤. 中国马尾松[M]. 北京: 中国林业出版社, 2001.
|
| [17] |
李敏, 丁贵杰, 孙学广, 等. 贵州马尾松群落植物多样性与土壤酶活性[J]. 森林与环境学报, 2016, 36(4): 434-441. |
| [18] |
LEVEAU J H J, LINDOW S E. Appetite of an epiphyte: quantitative monitoring of bacterial sugar consumption in the phyllosphere[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(6): 3446-3453. DOI:10.1073/pnas.061629598 |
| [19] |
MÜLLER T, RUPPEL S. Progress in cultivation-independent phyllosphere microbiology[J]. FFEMS Microbiology Ecology, 2014, 87(1): 2-17. DOI:10.1111/1574-6941.12198 |
| [20] |
SCHLECHTER R O, MIEBACH M, REMUS-EMSERMANN M N P. Driving factors of epiphytic bacterial communities: a review[J]. Journal of Advanced Research, 2019, 19: 57-65. DOI:10.1016/j.jare.2019.03.003 |
| [21] |
KEMBEL S W, O'CONNOR T K, ARNOLD H K, et al. Relationships between phyllosphere bacterial communities and plant functional traits in a neotropical forest[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(38): 13715-13720. DOI:10.1073/pnas.1216057111 |
| [22] |
邓世林, 申东晨, 潘理, 等. 高通量测序法分析感杨树灰斑病前后叶围微生物多样性[J]. 东北林业大学学报, 2020, 48(5): 104-106. DOI:10.3969/j.issn.1000-5382.2020.05.020 |
| [23] |
RIGONATO J, ALVARENGA D O, ANDREOTE F D, et al. Cyanobacterial diversity in the phyllosphere of a mangrove forest[J]. FEMS Microbiology Ecology, 2012, 80(2): 312-322. DOI:10.1111/j.1574-6941.2012.01299.x |
| [24] |
STONE B W G, JACKSON C R. Biogeographic patterns between bacterial phyllosphere communities of the southern magnolia (Magnolia grandiflora) in a small forest[J]. Microbial Ecology, 2016, 71(4): 954-961. DOI:10.1007/s00248-016-0738-4 |
| [25] |
LIANG S X, LIU H, WU S H, et al. Genetic diversity of diazotrophs and total bacteria in the phyllosphere of Pyrus serotina, Prunus armeniaca, Prunus avium, and Vitis vinifera[J]. Canadian Journal of Microbiology, 2019, 65(9): 642-652. DOI:10.1139/cjm-2018-0588 |
| [26] |
LAU E, AHMAD A, STEUDLER P A, et al. Molecular characterization of methanotrophic communities in forest soils that consume atomospheric methane[J]. FEMS Microbiology Ecology, 2007, 60(3): 490-500. DOI:10.1111/j.1574-6941.2007.00308.x |
| [27] |
CHEN Q L, CAI L, WANG H C, et al. Fungal composition and diversity of the tobacco leaf phyllosphere during curing of leaves[J]. Frontiers in Microbiology, 2020, 11: 554051. DOI:10.3389/fmicb.2020.554051 |
| [28] |
KEMBEL S W, MUELLER R C. Plant traits and taxonomy drive host associations in tropical phyllosphere fungal communities[J]. Botany, 2014, 92(4): 303-311. DOI:10.1139/cjb-2013-0194 |
| [29] |
JUMPPONEN A, JONES K L. Seasonally dynamic fungal communities in the Quercus macrocarpa phyllosphere differ between urban and nonurban environments[J]. New Phytologist, 2010, 186(2): 496-513. DOI:10.1111/j.1469-8137.2010.03197.x |
| [30] |
YAO H, SUN X, HE C, et al. Phyllosphere epiphytic and endophytic fungal community and network structures differ in a tropical mangrove ecosystem[J]. Microbiome, 2019, 7: 57. DOI:10.1186/s40168-019-0671-0 |
| [31] |
BAO L J, CAI W Y, CAO J X, et al. Microbial community overlap between the phyllosphere and rhizosphere of three plants from Yongxing Island, South China Sea[J]. Microbiology Open, 2020, 9(7): e1048. |

 2021, Vol. 41
2021, Vol. 41


