文章信息
- 毛行简, 郑风英, 任可, 陈凌艳, 何天友, 郑郁善
- MAO Xingjian, ZHENG Fengying, REN Ke, CHEN Lingyan, HE Tianyou, ZHENG Yushan
- 花叶假连翘3种叶色表型叶片的光合特性
- Photosynthetic characteristics of three leaf color phenotypes of Duranta repens 'Variegata'
- 森林与环境学报,2021, 41(3): 225-233.
- Journal of Forest and Environment,2021, 41(3): 225-233.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2021.03.001
-
文章历史
- 收稿日期: 2020-11-04
- 修回日期: 2021-01-18
2. 福建农林大学林学院, 福建 福州 350002
2. College of Forestry, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
花叶假连翘(Duranta repens ‘Variegata’)是马鞭草科(Verbenaceae)假连翘属(Duranta Linn.)多年生灌木,与模式种假连翘(Duranta repens Linn.)的主要形态区别在于叶片边缘具乳白色斑纹,叶色美丽,其花和叶观赏特性俱佳,常被用作花坛、绿篱和盆栽观赏植物,园林应用前景广阔。花叶假连翘为典型的叶色嵌合体植物,其叶片包含正常绿色细胞和突变产生的白色细胞两种细胞类型,通过分析叶片表型特征,可以判断其属于周缘嵌合体,叶缘和叶心分别表现出顶端分生组织细胞原层LⅡ和LⅢ的特征,叶色呈现白边绿心形态。通常情况下周缘嵌合体表型性状稳定,但在实地调查中发现,花叶假连翘部分枝条上叶片全部为绿叶或白叶,表现出单一性状,推测其绿色和白色两种细胞类型发生了转移和分离,原因可能是不同外界环境下两种细胞类型的生长竞争力发生了变化[1-3]。
植物叶片表型是植物在长期的外界环境选择压力下,通过响应和适应复杂的外界环境而形成的表观特征,在进化过程中其形态和功能表现出较强的变异性[4-5]。植物的生长发育与叶片的光合作用有着密切联系[6]。光合作用是植物新陈代谢的基础,一般情况下,光合特性的差异是导致植物生理生态特性产生差异的重要原因之一[7]。目前对植物光合作用的研究主要集中在植物种间光合特性的比较[8-9]和光合特性与光照[10-11]、温度[12]、水分[13]、矿质营养[14]等环境因子之间的关系上,鲜见有关叶片自身特性与光合作用关系的报道[15-16]。鉴于此,本研究以花叶假连翘全绿叶、花叶和全白叶3种不同叶色表型叶片为试验材料,通过探讨叶色表型与光合特性的关系,明确不同叶色表型叶片光合能力的差异,为花叶假连翘和其它具有相似叶色嵌合性状的园林植物的栽培应用和叶色选育提供理论依据。
1 材料与方法 1.1 试验材料试验材料来自福建农林大学中华名特优植物园(119°23′E,26°10′N),所在地属亚热带季风性气候,温暖湿润,年平均日照时间1 800 h, 年平均降水量1 359 mm,年平均气温20 ℃,年平均相对湿度77%。于2020年10月15日至25日进行试验,以人工栽培的健康花叶假连翘植株全绿叶、花叶和全白叶3种叶色表型叶片(图 1)作为试验材料。

|
注:A.全绿叶;B.花叶;C.全白叶。 Note: A.Green leaf; B.Striped leaf; C.White leaf. 图 1 花叶假连翘3种叶色表型 Fig. 1 Three leaf color phenotypes of D. repens 'Variegata' |
根据彭运生等[17]的方法测定光合色素含量。采集花叶假连翘全绿叶、花叶和全白叶若干,分别去中脉剪碎后混匀,各称取3份,每份0.1 g,浸入10 mL混合液(V丙酮∶V无水乙醇=2∶1)中,在室温避光环境下浸提48 h至叶片纯白,得到叶绿素提取液。然后以混合液作为对照(CK),利用紫外分光光度计测定663、645、470 nm波长处叶绿素提取液的吸光值,再根据Arnon公式计算叶绿素a、叶绿素b、叶绿素a+b和类胡萝卜素含量。每种叶色表型叶片测定3次。
1.2.2 叶片冷冻切片制作采集花叶假连翘3种叶色表型新鲜叶片,分别避开叶脉,在叶片中部至边缘位置切取4 mm×2 mm的方块。在冷冻切片机速冻台上,使用OCT包埋剂对切取的叶片组织进行包埋,设置速冻台温度为-18 ℃,冷凝10 min后将组织块固定于冻头上进行修块。组织块修好后用拇指按压其上,使其适当回温以使切片尽量完整不破碎,在10 s内快速完成切片,设置切片厚度为20 μm。切片后以室温下存放的载玻片贴近触碰切片,使切片附着在载玻片上,及时加盖玻片,在数码荧光显微镜下观察切面细胞层中叶绿体的分布情况。
1.2.3 光响应曲线与参数测定在无风少云的晴天上午(9:00—11:30),利用LI-6400便携式光合作用测定系统,分别测定花叶假连翘3种叶色表型叶片的光响应曲线,每种表型叶片各3片。测定前先利用LI-6400 LED红蓝光源设定光合有效辐射(photosynthetically active radiation,PAR)为1 000 μmol·m-2·s-1,对待测叶片诱导30 min。设定光合有效辐射强度依次为2 000、1 800、1 600、1 400、1 200、1 000、800、600、400、200、100、80、60、40、20和0 μmol·m-2·s-1,设定CO2浓度为(400±0.5) μmol·mol-1,气体流速为(500±0.5) mmol·s-1。在每个光合有效辐射下等待3~5 min,以获得稳定的读数,每个读数重复5次。
光合响应曲线的拟合采用直角双曲线修正模型[18]:
| $ {P_{\rm{n}}}I = \alpha \frac{{1 - \beta I}}{{1 + \gamma I}}I - {R_{\rm{d}}} $ | (1) |
式中:Pn为净光合速率(net photosynthesis rate, μmol·m-2·s-1);I为光合有效辐射(μmol·m-2·s-1);α为初始斜率;β为修正系数;γ为一个与光强无关的系数;Rd为暗呼吸速率(dark respiration rate, μmol·m-2·s-1)。
1.2.4 CO2响应曲线与参数测定利用LI-6400 LED红蓝光源将光合有效辐射设定在光饱和点处,参比室CO2浓度稳定在(400±0.5) μmol·mol-1时, 将待测叶片进行诱导30 min。设定CO2浓度依次为2 000、1 800、1 600、1 400、1 200、1 000、800、600、400、200、150、100、50、20 μmol·mol-1, 设定气体流速为(500±0.5)mmol·s-1。在每个CO2浓度下等待3~5 min,以获得稳定的读数,每个读数重复5次。
CO2响应曲线的拟合采用直角双曲线修正模型[18]:
| $ {P_{\rm{n}}}{\rm{ = }}a\frac{{1 - b{C_{\rm{i}}}}}{{1 + c{C_{\rm{i}}}}}{C_{\rm{i}}} - {R_{\rm{p}}} $ | (2) |
式中:a为初始羧化效率;b和c为系数,Ci为胞间CO2浓度(intercellular CO2 concentration,μmol·mol-1);Rp为光呼吸速率(photorespiration rate,μmol·m-2·s-1)。
1.3 数据处理利用Excel 2007和SPSS 20.0软件进行数据处理、单因素方差分析、Duncan差异性多重比较和Pearson相关性分析,利用光合计算4.1.1软件进行光响应曲线与CO2响应曲线的拟合和特征参数的计算,利用Excel 2007软件绘制光响应曲线和CO2响应曲线。
2 结果与分析 2.1 光合色素含量花叶假连翘3种叶色表型叶片光合色素含量如表 1所示。全绿叶、花叶和全白叶的光合色素含量差异显著(P<0.05);叶绿素a、叶绿素b、叶绿素a+b和类胡萝卜素含量在3种叶色表型的叶片中表现为全绿叶>花叶>全白叶,表现出随着叶片白色面积比例的增加而减少的趋势。花叶和全白叶的叶绿素a+b含量分别为全绿叶的34.40%和0.59%,类胡萝卜素含量分别为全绿叶的58.26%和2.49%,表明花叶假连翘不同叶色表型叶片产生色彩差异,是因为叶片中光合色素含量存在差异。
| 叶色表型 Leaf color phenotypes |
光合色素含量/(mg·g-1) | |||
| 叶绿素a Chlorophyll a |
叶绿素b Chlorophyll b |
叶绿素a+b Chlorophyll a+b |
类胡萝卜素 Carotenoids |
|
| 全绿叶Green leaf | 2.542±0.014a | 0.868±0.011a | 3.410±0.246a | 0.321±0.003a |
| 花叶Striped leaf | 0.880±0.006b | 0.293±0.009b | 1.173±0.003b | 0.187±0.014b |
| 全白叶White leaf | 0.011±0.002c | 0.009±0.001c | 0.020±0.002c | 0.008±0.020c |
| 注:表中数值为平均值±标准误; 同列数据后不同字母表示差异显著(P<0.05)。Note: the values in the table are average values±standard errors, and different letters in the same row demonstrate significant differences at the 0.05 level. | ||||
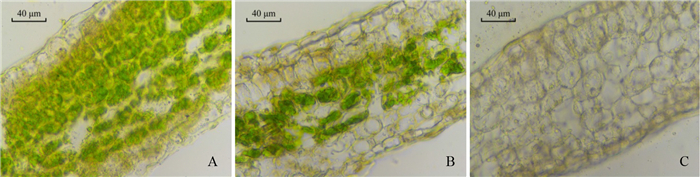
花叶假连翘3种叶色表型叶片的冷冻切片如图 2所示。全绿叶、花叶的细胞层数量相同,均含有9个细胞层,全白叶含有8个细胞层。全绿叶除上、下表皮未见明显叶绿体存在外,各细胞层均含有叶绿体,故颜色为深绿。花叶绿心上、下表皮细胞, 栅栏组织和部分海绵组织细胞层无明显叶绿体分布,故颜色为浅绿。全白叶各细胞层均仅可观察到极少量的叶绿体的存在,故其颜色失绿近白色。切片观察结果表明,花叶假连翘不同叶色表型叶片叶绿素含量存在差异,是因为细胞层中叶绿体分布存在差异。
|
注:A.全绿叶(×400);B.花叶绿心(×400);C.全白叶(×400)。 Note: A.Green leaf(×400); B.Green heart of striped leaf(×400); C.White leaf(×400). 图 2 3种叶色表型叶片横切面 Fig. 2 Three color phenotypes of the D. repens 'Variegata' leaf cross-section |
光响应曲线可反映植物的净光合速率随光合有效辐射变化而变化的规律,花叶假连翘3种叶色表型叶片光响应曲线如图 3所示。全绿叶和花叶的净光合速率对光强的响应曲线趋势较一致,当光合有效辐射为0~200 μmol·m-2·s-1时,全绿叶和花叶的净光合速率由负值增长为正值,呈现线性增长趋势,全绿叶的净光合速率增长幅度大于花叶;当光合有效辐射为200~1 000 μmol·m-2·s-1时,净光合速率增长幅度持续放缓,直至达到光饱和点(light saturation point,LSP)处,全绿叶的净光合速率增长幅度大于花叶;当光合有效辐射为1 000~2 000 μmol·m-2·s-1时,净光合速率开始下降,降低幅度持续增加,全绿叶净光合速率降低幅度大于花叶。总体而言,与全绿叶相比,花叶的净光合速率始终较低,随光合有效辐射变化而变化的幅度始终较缓。全白叶的净光合速率始终为负值,无法进行光响应曲线的拟合。

|
图 3 3种叶色表型叶片光响应曲线 Fig. 3 3 Light response curves of three leaf color phenotypes of D. repens 'Variegata' |
花叶假连翘光响应曲线拟合结果表明,全绿叶和花叶的光响应曲线决定系数分别为0.996和0.993,拟合效果较好(表 2)。全绿叶的最大净光合速率(maximum net photosynthetic rate,Pn, max)、Rd和初始量子效率分别为10.047、0.466和0.681 μmol·m-2·s-1,显著高于花叶且差异显著(P<0.05),但其光补偿点(light compensation point,LCP)和光饱和点显著低于花叶且差异显著(P<0.05),分别为花叶的78.11%和90.64%。
| 叶色表型 Leaf colorphenotypes |
决定系数R | 最大净光合速率Pn, max/(μmol·m-2·s-1) | 暗呼吸速率Rd/(μmol·m-2·s-1) | 光补偿点LCP/(μmol·m-2·s-1) | 光饱和点LSP/(μmo·m-2·s-1) | 初始量子效率Initial quantumefficiency/(μmol·m-2·s-1) |
| 全绿叶Green leaf | 0.996 | 10.047±0.230a | 0.466±0.043a | 7.097±0.807b | 894.458±4.341b | 0.681±0.003a |
| 花叶Striped leaf | 0.993 | 4.455±0.019b | 0.374±0.012b | 9.086±0.065a | 986.847±21.995a | 0.438±0.001b |
| 全白叶White leaf | ||||||
| 注:表中数值为平均值±标准误;同列数据后不同字母表示差异显著(P<0.05)。Note: the values in the table are average values±standard errors, and different letters in the same row demonstrate significant differences at the 0.05 level. | ||||||
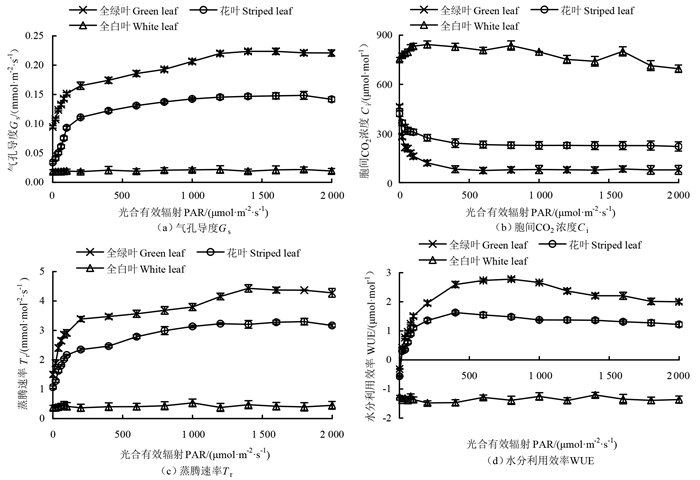
随着光合有效辐射的增加,花叶假连翘全绿叶和花叶的气孔导度(stomatal conductance,Gs)、蒸腾速率(transpiration rate,Tr)和水分利用效率(water use efficiency,WUE)总体呈现上升趋势(图 4)。当光合有效辐射为0~100 μmol·m-2·s-1时,气孔导度、蒸腾速率和水分利用效率基本呈现线性增长趋势;当光合有效辐射继续增大时,增长逐渐放缓直至趋于平稳。胞间CO2浓度的变化趋势与之相反,当光合有效辐射为0~100 μmol·m-2·s-1时,胞间CO2浓度基本呈现线性降低趋势;当光合有效辐射继续增大时,胞间CO2浓度下降逐渐放缓直至趋于平稳。全白叶的气孔导度、胞间CO2浓度、蒸腾速率和水分利用效率变化趋势均较为平缓,其中气孔导度、蒸腾速率和水分利用效率始终处于较低水平,而胞间CO2浓度始终处于较高水平。3种叶色表型叶片中,气孔导度、蒸腾速率和水分利用效率均表现为全绿叶>花叶>全白叶,而胞间CO2浓度的大小关系与之相反。
|
图 4 3种叶色表型叶片气体交换参数对不同光合有效辐射的响应曲线 Fig. 4 Response curve of Gs, Ci, Tr, and WUE with regard to different levels of photosynthetically active radiation for three leaf color phenotypes of D. repens 'Variegata' |
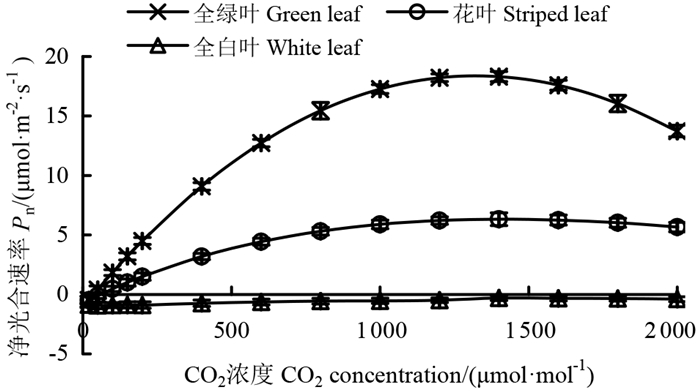
CO2响应曲线反映了植物的净光合速率随CO2浓度变化的规律。花叶假连翘3种叶色表型叶片的CO2响应曲线拟合结果如图 5所示。全绿叶和花叶净光合速率对CO2的响应曲线趋势较一致,当CO2浓度为0~1 400 μmol·mol-1时,全绿叶和花叶的净光合速率由负值转为正值,增长幅度持续放缓,直至达到CO2饱和点(CO2 saturation point,CSP)处,全绿叶的净光合速率增长幅度大于花叶;当CO2浓度为1 400~2 000 μmol·mol-1时,净光合速率持续下降,降低幅度持续增加,全绿叶的净光合速率降低幅度大于花叶。总体而言,与全绿叶相比,花叶的净光合速率始终较低,随CO2浓度变化而变化的幅度始终较缓。全白叶的净光合速率始终为负值,无法进行CO2响应曲线的拟合。
|
图 5 3种叶色表型叶片CO2响应曲线 Fig. 5 CO2 response curves of three leaf color phenotypes of D. repens 'Variegata' |
花叶假连翘3种叶色表型叶片的CO2响应曲线的特征参数如表 3所示。全绿叶和花叶的CO2响应曲线决定系数分别0.997和0.999,拟合效果较好。全绿叶具有较高的光合能力(photosynthetic capacity,Amax)、光呼吸速率和初始羧化效率(initial carboxylation efficiency,CE),分别为18.248、1.122和0.031 μmol·m-2·s-1,显著高于花叶且差异显著(P<0.05),但其CO2补偿点(CO2 compensation point,CCP)和CO2饱和点均低于花叶且差异显著(P<0.05),分别为花叶的61.66%和92.82%。
| 叶色表型 Leaf color phenotypes |
决定系数R | 光合能力Amax/(μmol·m-2·s-1) | 光呼吸速率Rp/(μmol·m-2·s-1) | CO2补偿点CCP/(μmol·mol-1) | CO2饱和点CSP/(μmol·mol-1) | 初始羧化效率CE/(μmol·m-2·s-1) |
| 全绿叶Green leaf | 0.997 | 18.248±0.127a | 1.122±0.079a | 36.793±1.795b | 1 315.779±6.723b | 0.031±0.001a |
| 花叶Striped leaf | 0.999 | 6.324±0.019b | 0.733±0.005b | 59.668±0.395a | 1 417.523±7.884a | 0.013±0.000b |
| 全白叶White leaf | ||||||
| 注:表中数值为平均值±标准误;同列数据后不同字母表示差异显著(P<0.05)。Note: the values in the table are average values±standard errors, and different letters in the same row demonstrate significant differences at the 0.05 level. | ||||||
花叶假连翘3种叶色表型叶片的叶绿素含量和光合特征参数相关性分析结果如表 4所示。3种叶色表型叶片的叶绿素a+b含量,与光响应净光合速率、气孔导度、蒸腾速率、水分利用效率和CO2响应净光合速率相关系数分别为0.987、0.940、0.935、0.920和0.999,呈正相关关系(P<0.01);与胞间CO2浓度相关系数为-0.872,呈负相关关系(P<0.01)。相关性关系表明,花叶假连翘不同叶色表型叶片的叶绿素a+b含量对光合特性影响显著。
| 指标Index | 叶绿素a+b含量Chlorophyll a+b content | 光响应净光合速率Light response Pn | 气孔导度Gs | 胞间CO2浓度Ci | 蒸腾速率Tr | 水分利用效率WUE | CO2响应净光合速率CO2 response Pn |
| 叶绿素a+b含量Chlorophyll a+b content | 1.000 | ||||||
| 光响应净光合速率Light response Pn | 0.987** | 1.000 | |||||
| 气孔导度Gs | 0.940** | 0.982** | 1.000 | ||||
| 胞间CO2浓度Ci | -0.872** | -0.938** | -0.986** | 1.000 | |||
| 蒸腾速率Tr | 0.935** | 0.979** | 0.999** | -0.988** | 1.000 | ||
| 水分利用效率WUE | 0.920** | 0.969** | 0.995** | -0.988** | 0.997** | 1.000 | |
| CO2响应净光合速率CO2 response Pn | 0.999** | 0.993** | 0.952** | -0.889** | 0.947** | 0.933** | 1.000 |
| 注:**表示在0.01水平(双侧)上显著相关。Note: ** indicates asignificant correlation at the 0.01 level (both-sides). | |||||||
光合作用与植物的光合生产力直接相关,对植物的生长发育和生态适应性有重要影响,是评价植物生长状况的重要指标[19]。叶绿素能够捕捉光能,固定CO2,是植物进行光合作用和光能转换的重要物质,直接影响着植物的光合效率,在植物光合作用中起关键作用[20-22]。本研究中,花叶假连翘3种叶色表型叶片的叶绿素含量表现为全绿叶>花叶>全白叶,含量变化趋势与叶片中绿色部分面积比例呈现相同的规律,这与闾邱杰等[15]对竹柏[Podocarpus nagi (Thunb.) Zoll. et Mor ex Zoll.]、赖金莉等[16]对银丝竹[Bambusa multiplex (Lour.) Raeusch. ex Schult. ‘Silverstrip’ R. A. Young]的研究结果类似。通过对3种叶色表型叶片进行切片观察,进一步明确了花叶假连翘不同叶色表型叶片细胞层间叶绿体分布不均,是叶绿素含量存在差异的原因,最终导致了叶色的差异。花叶假连翘3种叶色表型叶片的叶绿素含量和光合特征参数的相关性分析结果表明,叶绿素含量对其光合特性影响显著。
光响应曲线是衡量植物光合作用的重要指标,光合特征参数可有效表征植物光合能力、光能利用率和光抑制水平[23]。叶片的最大净光合速率反映了植物叶片的最大光合能力,初始量子效率体现了植物叶片在弱光环境下的光合能力,其数值越大,表明植物叶片在弱光下吸收转化光能的能力越强[24]。CO2饱和点和CO2补偿点分别反映植物对强光和弱光的适应能力[25],CO2饱和点值较高,对强光环境的适应性较强,CO2补偿点值较低,对弱光的适应性较强[26]。花叶假连翘花叶的CO2饱和点较高,全绿叶的CO2补偿点较高,因此花叶具有较强的利用强光的能力,而全绿叶可较好地适应弱光环境。全绿叶具有较高的最大净光合速率和初始量子效率,但其暗呼吸速率较低,表明其光合能力和光化学转换效率较强,受光抑制影响程度较小,呼吸消耗速率较低,因此与花叶相比,在相同的光环境下,全绿叶光合作用的光反应较强,可生成较多的腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)和还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH),为暗反应提供充足的反应条件,可积累更多的光合产物并且生长更加旺盛。全白叶的净光合速率始终为负值,表明在一定光强范围内,其呼吸作用始终强于光合作用,由于其叶绿素含量极低,缺少作为光合作用发生场所的叶绿体,无法生成足够多的光合产物,因此其生长发育主要通过植株光合产物的自我调控来供给生长所需养分。许多研究表明,叶绿素含量的减少会导致叶片的衰老和光合速率不可逆的降低[27-28],花叶假连翘3种叶色表型叶片的净光合速率大小表现为全绿叶>花叶>全白叶,与叶绿素含量呈正相关关系。有学者研究指出,植物叶片叶绿素含量过高部分造成了光抑制现象的产生[29],王坤等[30]对12种金花茶(Camellia nitidissima Chi)品种的光合生理特性的比较研究结果表明,叶绿素含量较高的品种具有较低的CO2饱和点和CO2补偿点,利用弱光的能力较强,周振翔等[31]的研究表明, 叶绿素含量较高的野生型水稻(Oryza sativa Linn.)比叶绿素含量较低的突变型水稻更易发生光抑制,这和本研究花叶假连翘全绿叶具有较低的光饱和点,更易发生光抑制现象相一致。
植物气孔通过调节保卫细胞的开闭,调控着CO2吸收和水分散失的平衡关系,在光合、呼吸和蒸腾作用等气体代谢过程中起到重要作用[32]。本研究中, 花叶假连翘3种叶色表型叶片的胞间CO2浓度与净光合速率呈负相关关系。当光合有效辐射处于较低水平时,全绿叶和花叶的气孔导度增长幅度较大,表明在弱光环境下,随着光合有效辐射的增加,作为光合作用反应底物的CO2被迅速消耗,从而导致了胞间CO2浓度迅速降低。此时植物通过提高叶片气孔的开张度来补充反应底物,使得气孔导度逐渐增大,引起蒸腾作用的增强,蒸腾速率提高,与此同时随着净光合速率的提高和光合产物积累,植物消耗水分生产有机物的效率即水分利用效率也得以提高。相较于花叶,全绿叶叶绿素含量丰富,光合作用强度较大,反应底物CO2消耗量也比花叶多,使得胞间CO2浓度较低,继而引起了其他参数与花叶产生了差异,全白叶缺少光合作用场所,对反应底物CO2的消耗量极少,故其胞间CO2浓度始终维持较高水平,其它参数值均较低。
CO2响应曲线初始羧化效率反映了植物对CO2的利用能力,其值越高,对低浓度CO2的利用能力越强。花叶假连翘全绿叶初始羧化效率和净光合速率显著高于花叶,表明全绿叶具有更强的CO2利用能力,在低浓度CO2环境中生长发育不易受抑制。相关研究表明,CO2响应曲线初始羧化效率与核酮糖-l, 5-二磷酸羧化酶/加氧酶(ribulose bisphosphate carboxylase oxygenase,Rubisco)含量和活性密切相关,Rubisco初始活力下降是光合衰退的最直接的内在因素[33-34]。Rubisco是C3植物进行光合碳同化的关键酶,它参与光合作用和光呼吸过程,调节两者之间的关系,对净光合速率起着决定性作用[35-36],其在叶绿体的合成发生在类囊体膜上[37]。翁晓燕等[38]的研究表明,白化水稻突变体白化期间Rubisco含量显著降低,与叶绿体类囊体膜结构被破坏,导致其合成受阻有关。ATP合成酶是能量代谢关键酶,其参与光合作用中的光合磷酸化及氧化磷酸化过程,将光能转化为化学能,在跨膜质子动力势的推动下合成ATP[39]。叶绿体中的ATP合成酶位于类囊体膜上,ATP合成酶的缺失会导致植物叶片光合电子传递受到影响和ATP合成受阻,而ATP作为光合作用暗反应过程C3还原的能量来源,其含量的减少,使得暗反应阶段碳的还原效率降低,碳同化作用减弱[40]。李勤等[37]对白化茶树品种“白叶1号”的研究表明,其白化过程中,ATP合成酶表达量与白化程度呈负相关关系。花叶假连翘全绿叶、花叶和全白叶3种表型叶片叶绿素含量逐渐减少,叶肉细胞层中缺失叶绿体的细胞逐渐增多,可以推测花叶假连翘绿色叶片组织和白色叶片组织的叶绿体结构存在差异,绿色叶片组织叶绿体发育正常,类囊体膜完整,而白色叶片组织叶绿体合成受阻,类囊体膜发育不充分,花叶由叶绿体发育正常的叶肉细胞和叶绿体合成受阻的叶肉细胞共同构成,不同叶色表型叶片叶绿体和类囊体膜发育程度和结构的差异,造成了Rubisco和ATP的合成效率产生差异。全绿叶、花叶和全白叶3种表型叶片的Rubisco和ATP合成效率随白化程度的加深而降低,C3循环受到不同程度的抑制,使净光合速率差异显著。刘敏敏等[41]对南方10种常绿植物的研究表明,叶绿素含量与固碳释氧量之间相关性显著,叶绿素含量较高的植物,固碳释氧量也较高,本研究中花叶假连翘叶绿素含量较高的全绿叶净光合速率最大,利用CO2的能力最强,与其研究结果类似,即全绿叶具有较高的光合碳同化能力,花叶和全白叶光合碳同化能力较弱。
综上所述,花叶假连翘3种叶色表型叶片光合特性存在显著差异,与叶绿体层间分布不均导致叶绿素含量产生差异有直接关系。本研究结果表明,花叶假连翘花叶利用强光的能力较强,在强光环境下其性状可保持稳定,因此,在人工繁育和园林配置实践中,可将花叶假连翘栽种在光照较强的环境中,以此保持花叶性状和诱导形成更多的花叶表型。本研究从叶片叶绿体分布和叶绿素含量角度比较分析了花叶假连翘3种叶色表型叶片光合生理层面的差异,今后的研究可进一步探究花叶假连翘不同叶色表型叶片叶绿体结构发育的差异,以及外界环境条件对嵌合体性状的影响机制。
| [1] |
李天菲, 蔡得田. 植物嵌合体机理及研究进展[J]. 湖北大学学报(自然科学版), 2002, 24(1): 81-86. DOI:10.3969/j.issn.1000-2375.2002.01.020 |
| [2] |
李明银, 何云晓. 植物遗传嵌合体及其在观赏植物育种中的应用[J]. 植物学通报, 2005, 22(6): 641-647. DOI:10.3969/j.issn.1674-3466.2005.06.001 |
| [3] |
刘和平, 林剑波, 何业华. 园艺植物嵌合体研究进展[J]. 现代农业科技, 2010(22): 112-114. DOI:10.3969/j.issn.1007-5739.2010.22.068 |
| [4] |
KLICH M G. Leaf variations in Elaeagnus angustifolia, related to environmental heterogeneity[J]. Environmental and Experimental Botany, 2000, 44(3): 171-183. DOI:10.1016/S0098-8472(00)00056-3 |
| [5] |
DIAZ S, CABIDO M, CASANOVES F. Plant functional traits and environmental filters at a regional scale[J]. Journal of Vegetation Science, 1998, 9(1): 113-122. DOI:10.2307/3237229 |
| [6] |
程建峰, 陈根云, 沈允钢. 植物叶片特征与光合性能的关系[J]. 中国生态农业学报, 2012, 20(4): 466-473. |
| [7] |
许红娟, 陈之林, 石乐娟, 等. 4种彩叶矾根的光合特性及在贵州的适应性[J]. 贵州农业科学, 2018, 46(11): 101-106. DOI:10.3969/j.issn.1001-3601.2018.11.026 |
| [8] |
李云霞, 张艺祎, 郭艳珊, 等. 4种独蒜兰属植物光合特性比较研究[J]. 云南农业大学学报(自然科学), 2018, 33(5): 891-897. |
| [9] |
李冬梅, 刘小飞, 朱根发. 4种山奈属植物光合特性的比较研究[J]. 热带农业科学, 2018, 38(4): 46-51. |
| [10] |
蒋华伟, 罗红雨, 李静会, 等. 不同光照对2种观赏连翘光合及叶绿素荧光参数的影响[J]. 江苏农业科学, 2015, 43(11): 246-249. |
| [11] |
PARK J, DINH T B. Contrasting effects of monochromatic LED lighting on growth, pigments and photosynthesis in the commercially important cyanobacterium Arthrospira maxima[J]. Bioresource Technology, 2019, 291: 121846. DOI:10.1016/j.biortech.2019.121846 |
| [12] |
智永祺, 郑玉红, 张鹏翀, 等. 阶跃温度对石蒜光合作用和新陈代谢的影响[J]. 江苏农业科学, 2019, 47(22): 148-152. |
| [13] |
王海梅, 贾成朕, 李慧融, 等. 水分胁迫对典型草原植物群体光合作用的影响[J]. 干旱地区农业研究, 2020, 38(1): 237-242. |
| [14] |
戴伟, 胡振阳, 王刚, 等. NaCl胁迫对5种植物生理光合特性影响的比较研究[J]. 江西农业学报, 2019, 31(8): 6-13. |
| [15] |
闾邱杰, 曹景怡. 竹柏2种颜色叶片的光合特性研究[J]. 热带亚热带植物学报, 2020, 28(2): 177-184. |
| [16] |
赖金莉, 李欣欣, 陈凌艳, 等. 银丝竹3种颜色叶片光合特性研究[J]. 生态环境学报, 2018, 27(2): 255-261. |
| [17] |
彭运生, 刘恩. 关于提取叶绿素方法的比较研究[J]. 北京农业大学学报, 1992, 18(3): 247-250. |
| [18] |
叶子飘, 高峻. 光响应和CO2响应新模型在丹参中的应用[J]. 西北农林科技大学学报(自然科学版), 2009, 37(1): 129-134. |
| [19] |
JUMRANI K, BHATIA V S, PANDEY G P. Impact of elevated temperatures on specific leaf weight, stomatal density, photosynthesis and chlorophyll fluorescence in soybean[J]. Photosynthesis Research, 2017, 131(3): 333-350. DOI:10.1007/s11120-016-0326-y |
| [20] |
杨笑笑, 左琪琪, 杨磊, 等. 蝴蝶兰叶片叶绿素含量对栽培基质含水量和施肥量的响应[J]. 安徽农业科学, 2015, 43(27): 48-50. DOI:10.3969/j.issn.0517-6611.2015.27.019 |
| [21] |
薛磊, 凡莉莉, 赖金莉, 等. 不同施肥模式对沿海沙地鼓节竹发笋期生长和生理特性的影响[J]. 江苏农业科学, 2019, 47(1): 97-100. |
| [22] |
SINGH S K, REDDY V R, FLEISHER D H, et al. Relationship between photosynthetic pigments and chlorophyll fluorescence in soybean under varying phosphorus nutrition at ambient and elevated CO2[J]. Photosynthetica, 2017, 55(3): 421-433. DOI:10.1007/s11099-016-0657-0 |
| [23] |
王海珍, 韩路, 徐雅丽, 等. 胡杨异形叶光合作用对光强与CO2浓度的响应[J]. 植物生态学报, 2014, 38(10): 1099-1109. |
| [24] |
RICHARDSON A D, BERLYN G P. Spectral reflectance and photosynthetic properties of Betula papyrifera (Betulaceae) leaves along an elevational gradient on Mt.Mansfield, Vermont, USA[J]. American Journal of Botany, 2002, 89(1): 88-94. DOI:10.3732/ajb.89.1.88 |
| [25] |
李迎春, 杨清平, 陈双林, 等. 龟甲竹光合生理特性及其与主要影响因子关系[J]. 林业科技开发, 2011, 25(2): 35-39. |
| [26] |
曾小华. 遮荫对野生峨眉凤仙花的影响[D]. 雅安: 四川农业大学, 2016.
|
| [27] |
杨富军, 赵长星, 闫萌萌, 等. 栽培方式对夏直播花生叶片光合特性及产量的影响[J]. 应用生态学报, 2013, 24(3): 747-752. |
| [28] |
陈凌艳, 谢德金, 荣俊冬, 等. 光合色素含量差异对花叶唐竹不同叶色表型光合特性的影响[J]. 林业科学, 2019, 55(12): 21-31. |
| [29] |
ORT D R, MERCHANT S S, ALRIC J, et al. Redesigning photosynthesis to sustainably meet global food and bioenergy demand[J]. Proceedings of the National Academy of Sciences of the United States of Americaa, 2015, 112(28): 8529-8536. DOI:10.1073/pnas.1424031112 |
| [30] |
王坤, 韦晓娟, 李宝财, 等. 12种金花茶组植物光合生理特性比较[J]. 经济林研究, 2019, 37(1): 80-86. |
| [31] |
周振翔, 李志康, 陈颖, 等. 叶绿素含量降低对水稻叶片光抑制与光合电子传递的影响[J]. 中国农业科学, 2016, 49(19): 3709-3720. |
| [32] |
罗丹丹, 王传宽, 金鹰. 植物应对干旱胁迫的气孔调节[J]. 应用生态学报, 2019, 30(12): 4333-4343. |
| [33] |
邓雄, 李小明, 张希明, 等. 四种荒漠植物的光合响应: 英文[J]. 生态学报, 2003, 23(3): 598-605. |
| [34] |
郑炳松, 蒋德安, 翁晓燕, 等. 钾营养对水稻剑叶光合作用关键酶活性的影响[J]. 浙江大学学报(农业与生命科学版), 2001, 27(5): 489-494. |
| [35] |
SPREITZER R J, SALVUCCI M E. Rubisco: structure, regulatory interactions, and possibilities for a better enzyme[J]. Annual Review of Plant Biology, 2002, 53: 449-475. |
| [36] |
董晓丽, 周集体, 杜翠红, 等. Rubisco的分子生物学研究[J]. 高技术通讯, 2001, 11(12): 95-97. |
| [37] |
李勤, 程晓梅, 李永迪, 等. 白叶1号白化过程中叶绿体蛋白质组差异分析[J]. 茶叶科学, 2019, 39(3): 325-334. |
| [38] |
翁晓燕, 蒋德安, 陆庆. 水稻转绿型白化突变系W25转绿过程中Rubisco、Rubisco活化酶活性与光合速率的变化[J]. 植物生理学报, 2000, 26(3): 213-218. |
| [39] |
IGAMBERDIEV A U, KLECZKOWSKI L A. Optimization of ATP synthase function in mitochondria and chloroplasts via the adenylate kinase equilibrium[J]. Frontiers in Plant Science, 2015, 6: 10. |
| [40] |
毛娟, 迟伟, 马今方, 等. 拟南芥PAB1蛋白参与叶绿体ATP合酶复合物调控机制的研究[J]. 生物物理学报, 2009, 25(S1): 242. |
| [41] |
刘敏敏, 黄满红, 杨振乾. 对南方公路常绿植物固碳释氧和降温增湿的研究[J]. 上海师范大学学报(自然科学版), 2014, 43(2): 204-209. |

 2021, Vol. 41
2021, Vol. 41


