文章信息
- 黄旭萍, 黄一航, 黄敏, 王建超, 陈孝丑, 陈发兴
- HUANG Xuping, HUANG Yihang, HUANG Min, WANG Jianchao, CHEN Xiaochou, CHEN Faxing
- 山乌桕叶片DNA提取及ISSR-PCR反应体系优化
- Optimization of DNA extraction method and ISSR-PCR reaction system for Sapium discolor leaves
- 森林与环境学报,2021, 41(2): 164-171.
- Journal of Forest and Environment,2021, 41(2): 164-171.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2021.02.007
-
文章历史
- 收稿日期: 2021-01-07
- 修回日期: 2021-02-10
2. 福建省农业科学院果树研究所, 福建 福州 350013;
3. 福州植物园, 福建 福州 350012
2. Fruit Research Institute, Fujian Academy of Agricultural Sciences, Fuzhou, Fujian 350013, China;
3. Fuzhou Botanical Garden, Fuzhou, Fujian 350012, China
山乌桕[Sapium discolor (Champ. ex Benth.) Muell. Arg.]为大戟科(Euphorbiaceae)乌桕属(Sapium)的落叶乔木或灌木,树高6~12 m;主要靠种子繁殖和裸根繁殖,幼苗生长繁殖迅速,常生于山坡或山谷林地中,喜深厚、湿润的土壤,主要分布于浙江、江西、福建、台湾、广东、广西、云南及贵州等地[1-]。山乌桕花期较长,一般为4—6月,花朵蜜腺发达,泌蜜量大,是优良的蜜源植物[3-];山乌桕的根皮、树皮、叶等均可入药,木材可加工成火柴杆,是重要的经济树种[5];其树干通直、树皮光滑、树形优美、叶色浓郁艳丽,具有较高的观赏价值,是优良的观赏植物和生态林树种[6]。
简单重复序列区间(inter-simple sequence repeat, ISSR)是在简单重复序列(simple sequence repeat, SSR)基础上发展起来的新型分子标记技术[7-],可与聚合酶链式扩增反应(polymerase chain reaction, PCR)结合,用于扩增的引物由人工合成,在SSR的5′或3′末端加上2~4个随机选择的核苷酸、长16~18个碱基序列[9],所以ISSR分子标记具有专一性较强、操作简单、快速高效、引物特异性强和多态性好等优点,在物种遗传多样性和种质亲缘关系方面的应用越来越广泛[10]。
山乌桕秋季叶片呈红色或黄色,叶色浓郁艳丽,作为乡土树种在园林应用中具有适应性强,易于栽培成活,能形成地方特色景观等特点,但其在园林应用中的开发利用程度不够,与其相关的研究主要集中在茎叶化学成分分析[11-]、育苗造林[14-]、食品工艺[17-]等方面,对其物种多样性方面的研究较少。鉴于此,本研究通过比较试剂盒法、改良十六烷基三甲基溴化铵(cetyl trimethyl ammonium bromide, CTAB)法和十二烷基硫酸钠(sodium dodecyl sulfate, SDS)法对山乌桕叶片DNA的提取效果,确定适合山乌桕叶片DNA的提取方法,进而利用单因素试验结合正交试验等方法优化山乌桕叶片ISSR-PCR体系,建立最佳ISSR-PCR反应体系,为彩叶树种山乌桕遗传多样性研究提供技术参考,进一步为培育山乌桕优良种质资源奠定基础。
1 材料与方法 1.1 材料与仪器试验所用山乌桕叶片采自福建省福州市晋安区福州植物园,采集山乌桕嫩叶,用冰盒运回实验室,液氮冻样,-80 ℃冰箱保存备用。
试验所用试剂有D2485 HP Plant DNA Kit试剂盒、缓冲液A、缓冲液B[19]、SDS缓冲液、SDS提取液[20],1×TAE电泳液、6×Loading Buffer、2×Taq Master Mix、Goldview核酸染料,所有试剂均购于天根生化科技(北京)有限公司。试验所用仪器有上海精宏实验设备有限公司DKB-501S恒温水浴锅、NanoDropTM Lite分光光度计、上海培清科技有限公司SensiAnsys凝胶成像系统、WIX-EP 300电泳仪、BIO-RADT 100TM PCR仪。
1.2 试验方法 1.2.1 山乌桕叶片DNA提取改良CTAB法根据参考文献[19]的方法并稍作修改:(1)称取适量冻存样品,加入少量聚乙烯吡咯烷酮(polyvinyl polypyrrolidone, PVPP),研磨成细粉末,装至2.0 mL的离心管中;(2)加入1.0 mL预冷的缓冲液A,混匀后冰浴15 min,此过程中颠倒混匀2~3次;(3)在转速为10 800 r·min-1的离心机中离心10 min,弃上清液;(4)重复步骤(2)和(3),直至上清液不黏稠;(5)加入600 μL缓冲液B和50 μL β-巯基乙醇,混匀后65 ℃水浴30 min,每10 min颠倒混匀一次,颠倒混匀时动作需轻缓;(6)10 800 r·min-1离心10 min,取上清液并置于干净的2.0 mL离心管中;(7)加入与上清液等体积的酚-氯仿-异戊醇溶液,其中,V酚∶V氯仿∶V异戊醇=25∶24∶1,颠倒混匀2~5 min;(8)10 800 r·min-1离心10 min,取上清液置于干净的1.5 mL离心管中;(9)重复步骤(7)和(8),直到离心后两个液面之间没有沉淀;(10)加入0.5 mL预冷异丙醇,轻轻混匀,-20 ℃放置30 min;(11)10 800 r·min-1离心10 min,弃上清液;(12)加入0.5 mL体积分数为75%的乙醇,轻轻弹起沉淀,10 800 r·min-1离心2 min,弃上清液;(13)重复步骤(12);(14)风干乙醇,加入50~100 μL双蒸水溶解DNA;(15)加入2 μL 10 mg·mL-1 RNase,37 ℃放置30~60 min;(16)测定DNA的浓度和纯度,DNA贮存于4 ℃冰箱备用。
SDS法的步骤基本与CTAB法相同,其中, 步骤(2)加入1.0 mL预冷的SDS缓冲液,步骤(5)加入650 μL SDS提取液和体积分数为2%的β-巯基乙醇,步骤(7)加入与上清液等体积的氯仿-异戊醇溶液(V氯仿∶V异戊醇=24∶1)和200 μL 5 mol·L-1 KAc,步骤(10)加入0.5 mL预冷的无水乙醇。
试剂盒法参考试剂盒提取说明操作。
1.2.2 引物合成试验所用引物为加拿大哥伦比亚大学(University of British Columbia, UBC)公布的100条ISSR通用引物,由北京六合华大基因公司合成。
1.2.3 DNA质量检测利用紫外分光光度计检测DNA浓度,记录样品浓度和吸光度(absorbance, A)值。A260/A280小于1.70,表明样品中有蛋白质和酚类污染;A260/A280大于1.90,说明样品含RNA等杂质;当A260/A280在1.70~1.90之间时,说明提取的DNA纯度较好,可用于后续试验。
琼脂糖凝胶电泳检测DNA质量,制备质量浓度为1%的琼脂糖凝胶,5 μL DNA样品和1 μL上样缓冲液混匀点样,110 V电泳30 min,在凝胶成像系统中观察结果。
1.2.4 ISSR-PCR单因素试验PCR反应体系总体积为20 μL,引物使用UBC 835,设计山乌桕ISSR-PCR反应体系单因素试验(表 1),分析DNA模板用量、引物浓度和2×Taq Master Mix添加量对ISSR-PCR扩增效果的影响。
| 水平 Level |
因素Factor | ||
| DNA模板用量 DNA template amount/μL |
2×Taq Master Mix添加量 2×Taq Master Mix amount/μL |
引物浓度 Primer concentration /(μmol·L-1) |
|
| 1 | 0.5 | 6.0 | 0.2 |
| 2 | 1.0 | 7.0 | 0.4 |
| 3 | 1.5 | 8.0 | 0.6 |
| 4 | 2.0 | 9.0 | 0.8 |
| 5 | 2.5 | 10.0 | 1.0 |
利用L25(53)正交设计,以山乌桕叶片DNA混样为DNA模板,对ISSR-PCR反应体系的DNA模板用量、引物浓度和2×Taq Master Mix添加量进行优化,DNA模板浓度稀释至20 ng·μL-1,引物浓度10 μmol·L-1,加入ddH2O至反应体系体积为20 μL。参考尚小红等[21]的直观分析法对正交电泳结果进行评分,计算K值(Km)和R值,确定ISSR-PCR的最佳组合。ISSR-PCR反应程序参考同属植物乌桕[Sapium sebiferum (L.) Roxb.][22]的PCR反应程序,选定UBC 835为固定引物。
1.2.6 ISSR-PCR扩增程序优化利用优化的ISSR-PCR反应体系对反应程序的变性时间、退火时间、退火温度、延伸时间和循环次数等进行优化;退火温度设置为引物解链温度(melting temperature, Tm)±5 ℃,由PCR仪自动生成8个温度梯度:58.0、57.2、56.0、54.2、51.9、49.9、48.7和48.0 ℃,进行两个重复。PCR产物经质量浓度为1%的凝胶电泳检测,利用凝胶成像系统拍照并保存。
2 结果与分析 2.1 山乌桕叶片DNA提取质量分析利用不同方法提取的山乌桕叶片DNA的质量检测结果如表 2所示。试剂盒法与改良CTAB法提取的DNA A260/A280均在1.70~1.90之间,表明这两种方法提取的DNA质量较好,没有RNA污染;SDS法提取的DNA A260/A280在1.40~1.75之间,DNA絮状沉淀为淡黄色至黄褐色,表明DNA纯度较低,有蛋白质和酚类污染;改良CTAB法和试剂盒法提取的DNA浓度均较高,SDS法浓度最低。
| 方法 Method |
处理 Treatment |
A260/A280 | DNA浓度 Concentration of DNA /(μg·μL-1) |
| 改良CTAB法 Modified CTAB method |
1 | 1.83 | 473.0 |
| 2 | 1.74 | 411.9 | |
| 3 | 1.76 | 754.9 | |
| 试剂盒法 Kit method |
1 | 1.75 | 578.1 |
| 2 | 1.88 | 452.1 | |
| 3 | 1.89 | 261.2 | |
| SDS法 SDS method |
1 | 1.74 | 255.9 |
| 2 | 1.43 | 188.1 | |
| 3 | 1.67 | 166.8 |
DNA电泳结果如图 1所示,改良CTAB法和试剂盒法提取的DNA均没有拖带现象,电泳条带明亮,主带清晰,加样孔干净,说明这两种方法提取的DNA没有RNA、蛋白质、多糖和酚类等杂质的污染,DNA浓度较高、质量较好;SDS法提取的DNA电泳条带部分主带不明显,加样孔有亮带,表明含有蛋白质或多糖。这说明试剂盒法提取的DNA没有受污染,操作简便快速,DNA纯度和浓度较高,是较好的提取方法;改良CTAB法成本较低,在考虑试验成本的情况下,操作简单,也可提取比较理想的DNA。
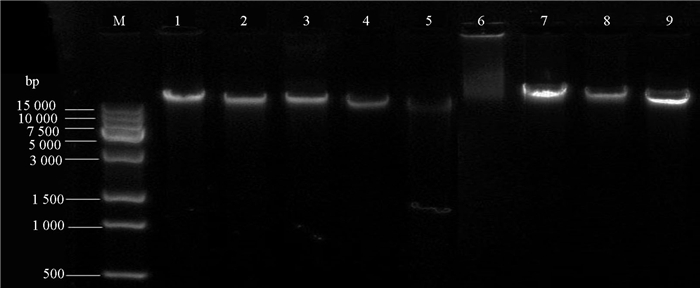
|
注:M为15 000 bp Marker;1~3为试剂盒法;4~6为SDS法;7~9为改良CTAB法。 Note: M is the 15 000 bp Marker; 1-3 are from the Kit method; 4-6 are from the SDS method; and 7-9 are from the modified CTAB method. 图 1 不同方法提取的DNA电泳图谱 Fig. 1 Electrophoresis patterns of DNA extracted by different methods |
DNA模板用量对ISSR-PCR体系影响最大,一定范围内,随着反应体系中DNA模板用量的增加,ISSR扩增产物的浓度升高,超过一定用量后,非特异性产物出现的几率增加[23]。单因素试验电泳图谱如图 2所示,DNA用量为0.5~1.5 μL时,PCR扩增条带亮度逐渐增强;当DNA用量增大到2.5 μL时,PCR条带亮度减弱,条带出现部分缺失和模糊,所以DNA模板最佳用量为1.5 μL。
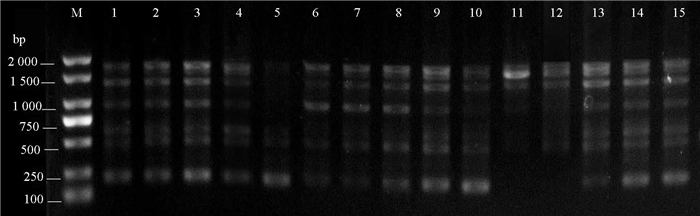
|
注:1~5表示DNA模板用量分别为0.5、1.0、1.5、2.0和2.5 μL;6~10表示引物浓度分别为0.2、0.4、0.6、0.8和1.0 μmol·L-1;11~15表示2×Taq Master Mix添加量梯度分别为6.0、7.0、8.0、9.0和10.0 μL。 Note: 1-5 had different amounts of DNA template(0.5, 1.0, 1.5, 2.0, and 2.5 μL, respectively); 6-10 had different primer concentration gradients(0.2, 0.4, 0.6, 0.8, and 1.0 μmol·L-1, respectively); and 11-15 had different 2×Taq Master Mix addition gradients(6.0, 7.0, 8.0, 9.0, and 10.0 μL, respectively). 图 2 单因素试验电泳图谱 Fig. 2 Single factor test electrophoresis pattern |
ISSR-PCR扩增效果也受引物浓度影响,引物浓度过低反应扩增条带少,过高导致条带弥散模糊[24]。从图 2可以看出,PCR扩增条带亮度随着引物浓度的增加而增强;当引物浓度低于0.8 μmol·L-1时,PCR条带不完整,部分缺失;当引物浓度为0.8、1.0 μmol·L-1时,条带完整、清晰。随着引物浓度增大,出现条带拖带,清晰度降低的现象,所以山乌桕ISSR-PCR体系最佳引物浓度为0.8 μmol·L-1。
2×Taq Master Mix添加量对ISSR-PCR扩增效果影响最小。2×Taq Master Mix添加量为6.0~9.0 μL时,PCR扩增条带亮度逐渐升高;2×Taq Master Mix添加量为8.0 μL和9.0 μL时,条带完整,条带亮度强;2×Taq Master Mix添加量高于9.0 μL时,条带亮度减弱,PCR扩增条带存在缺失的情况,因此,2×Taq Master Mix最适宜的添加量为8.0 μL。
2.2.2 正交试验结果正交试验电泳结果如图 3所示,组合13、14、15、18、19、22和23的扩增条带较完整,其余各组合扩增条带都存在条带缺失和条带不清晰的情况;其中,组合14、19和23条带部分模糊,15、18、22条带亮度弱,组合13条带清晰,扩增效果较理想。
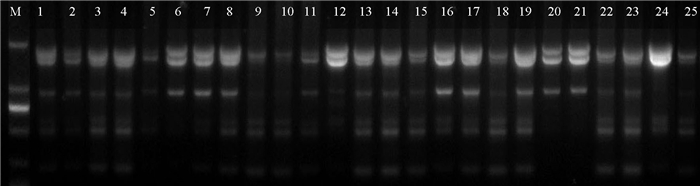
|
图 3 ISSR-PCR扩增电泳图谱 Fig. 3 ISSR-PCR amplification electrophoresis pattern |
利用直观分析法对各组合条带的提取效果进行打分并计算均值(K)和极差(R),结果如表 3所示。R为该因素对ISSR-PCR扩增效果的影响程度,其值越大,影响越大。在表 3中,DNA模板用量的R值最大,所以DNA模板用量对山乌桕ISSR-PCR的扩增效果影响最大,其次为引物浓度,2×Taq Master Mix添加量影响最小。Km表示因素m水平下的均值,Km越大,扩增效果越好。从表 3的Km得出,DNA模板量第3水平,2×Taq Master Mix第3水平,引物浓度第4、5水平扩增效果好。综合ISSR-PCR扩增结果(图 3)及直观分析法结果(表 3)来看,处理13(体系含DNA模板1.5 μL、2×Taq Master Mix 8.0 μL、引物浓度0.8 μmol·L-1)为最佳反应组合。
| 处理 Treatment |
DNA模板用量 DNA template amount/μL |
2×Taq Master Mix添加量 2×Taq Master Mix amount/μL |
引物浓度 Primer concentration/(μmol·L-1) |
得分 Score |
| 1 | 0.5 | 8.0 | 0.6 | 4 |
| 2 | 0.5 | 7.0 | 0.4 | 3 |
| 3 | 0.5 | 9.0 | 0.8 | 7 |
| 4 | 0.5 | 10.0 | 1.0 | 7 |
| 5 | 0.5 | 6.0 | 0.2 | 3 |
| 6 | 1.0 | 8.0 | 0.2 | 6 |
| 7 | 1.0 | 9.0 | 0.4 | 7 |
| 8 | 1.0 | 10.0 | 0.6 | 8 |
| 9 | 2.0 | 7.0 | 1.0 | 8 |
| 10 | 1.0 | 6.0 | 0.8 | 6 |
| 11 | 1.5 | 6.0 | 0.4 | 6 |
| 12 | 1.5 | 10.0 | 0.2 | 6 |
| 13 | 1.5 | 8.0 | 0.8 | 13 |
| 14 | 1.5 | 9.0 | 1.0 | 12 |
| 15 | 1.5 | 7.0 | 0.6 | 10 |
| 16 | 2.0 | 8.0 | 0.4 | 8 |
| 17 | 2.0 | 9.0 | 0.6 | 9 |
| 18 | 2.0 | 6.0 | 1.0 | 9 |
| 19 | 2.0 | 10.0 | 0.8 | 9 |
| 20 | 2.0 | 7.0 | 0.2 | 5 |
| 21 | 2.5 | 9.0 | 0.2 | 6 |
| 22 | 2.5 | 7.0 | 0.8 | 12 |
| 23 | 2.5 | 8.0 | 1.0 | 11 |
| 24 | 2.5 | 10.0 | 0.4 | 6 |
| 25 | 2.5 | 6.0 | 0.6 | 4 |
| K1 | 4.8 | 5.6 | 5.2 | |
| K2 | 7.0 | 7.6 | 6.0 | |
| K3 | 9.4 | 8.4 | 7.0 | |
| K4 | 8.0 | 8.2 | 9.4 | |
| K5 | 7.8 | 7.2 | 9.4 | |
| R | 4.6 | 2.8 | 4.2 |
利用优化的反应体系对ISSR-PCR反应程序的退火时间、退火温度和循环次数等进行优化,结果如图 4所示。退火时间为45 s时,扩增条带多态性好且清晰;退火时间为30和60 s时,条带模糊不清晰,30 s时条带部分缺失。依此对扩增程序循环次数进行优化,结果见图 5,循环次数为30、35时,条带缺失和条带模糊,条带亮度弱,循环次数为40时,条带清晰,多态性好,因此,最佳循环次数为40。

|
注:1~3表示退火时间为30 s;4~6表示退火时间为45 s;7~9表示退火时间为60 s。 Note: 1-3 had an annealing time of 30 s; 4-6 had an annealing time of 45 s; and 7-9 had an annealing time of 60 s. 图 4 不同退火时间扩增结果 Fig. 4 Amplification results with different annealing times |
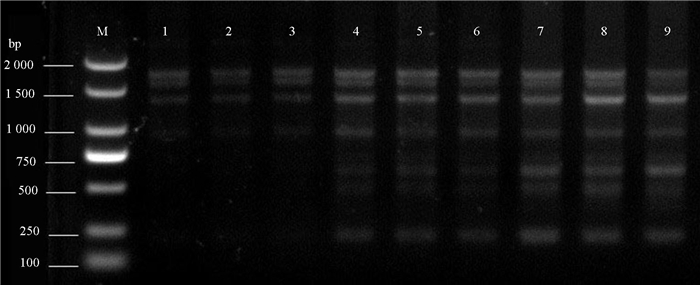
|
注:1~3表示循环30次;4~6表示循环35次;7~9表示循环40次。 Note: 1-3 had 30 cycles of PCR; 4-6 had 35 cycles of PCR; and 7-9 had 40 cycles of PCR. 图 5 不同循环次数扩增结果 Fig. 5 Amplification results with different numbers of PCR cycles |
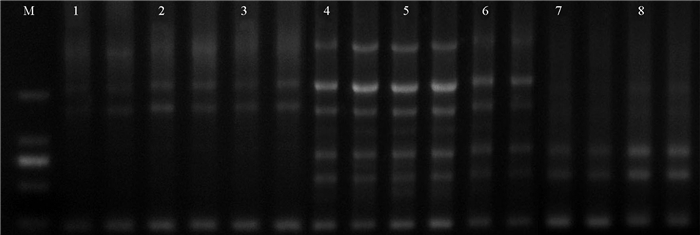
利用优化的ISSR-PCR体系对退火温度进行优化,电泳结果如图 6所示。当退火温度高于54.2 ℃和低于49.9 ℃时,扩增条带模糊、条带缺失;退火温度为51.9 ℃时,条带清晰、完整;因此,ISSR-PCR体系的最佳退火温度为51.9 ℃。用引物UBC 880对山乌桕ISSR-PCR优化体系和程序进行验证,结果见图 7,引物UBC880在该体系下条带重复性和多态性良好。
|
注:1~8分别表示退火温度为58.0、57.2、56.0、54.2、51.9、49.9、48.7和48.0 ℃。 Note: 1-8 had annealing temperatures of 58.0, 57.2, 56.0, 54.2, 51.9, 49.9, 48.7, and 48.0 ℃. 图 6 ISSR-PCR程序退火温度优化 Fig. 6 Optimization of annealing temperature for the ISSR-PCR program |

|
图 7 引物UBC 880电泳结果 Fig. 7 Electrophoresis results of primer UBC 880 |
DNA纯度是影响后期PCR能否扩增出目的片段的重要因素。通常情况下,若DNA模板含有杂质,则可能会在PCR中产生抑制作用[25-]。山乌桕叶片中含大量酚类、萜类及一些次生代谢物质,从中提取DNA时多酚易被氧化而使DNA呈棕褐色[27],所以在这类植物中提取DNA比在禾本植物和蔬果类植物中提取困难,提取的DNA产量低、质量差、易降解[28]。本研究利用3种方法提取山乌桕叶片DNA,其中,改良CTAB法和试剂盒法提取效果较好,提取的DNA絮状沉淀呈纯白色,纯度好,浓度高,符合后续试验要求,能扩增出较多条带,且条带清晰;SDS法提取的DNA沉淀呈黄褐色,纯度和浓度较低,有多糖、多酚等杂质污染,PCR扩增条带少,条带模糊,无法达到试验要求;综合考虑,在样品量不大,经费充足的情况下,试剂盒法和改良CTAB法都是良好的山乌桕叶片DNA提取方法。
ISSR-PCR反应体系扩增结果受到多种因素的影响,主要有DNA模板用量、引物浓度、2×Taq Master Mix添加量和退火温度等,不同因素的影响程度不同。结合单因素试验和正交试验分析了DNA模板用量、引物浓度和2×Taq Master Mix添加量等对山乌桕ISSR-PCR扩增效果的影响,正交试验的极差分析结果表明,DNA模板用量对山乌桕ISSR-PCR扩增效果影响最大,2×Taq Master Mix添加量的影响最小。正交试验设计分布均匀,可以直接筛选出ISSR-PCR体系的最佳条件,但试验结果受主观影响较大;单因素试验可以直观看出每个因素对扩增结果的影响,但无法观察各个因素共同作用结果[29],所以综合单因素试验和正交试验结果,同时考虑成本,以较少的2×Taq Master Mix添加量达到较好的效果,最终确定2×Taq Master Mix添加量为8.0 μL,山乌桕叶片ISSR-PCR的最优反应体系为:总体积20 μL,其中含20 ng DNA模板1.5 μL、2×Taq Master Mix 8.0 μL、引物浓度0.8 μmol·L-1。山乌桕叶片ISSR-PCR的反应程序为:94 ℃预变性5 min、94 ℃变性30 s、51.9 ℃退火45 s、72 ℃延伸90 s、40个循环,72 ℃延伸10 min、4 ℃保存。在该体系下扩增的条带清晰、稳定,可用于山乌桕种质培育和遗传多样性研究。
| [1] |
夏炳文, 汪家礼. 山乌桕[J]. 园林, 2015(1): 64-66. |
| [2] |
王昌铭. 不容忽视的树种: 山乌桕[J]. 广东林业科技, 2012, 28(2): 93-95. DOI:10.3969/j.issn.1006-4427.2012.02.019 |
| [3] |
史莹, 张丽珍, 曾志将, 等. 山乌桕蜂蜜酒酿造酵母的筛选、鉴定及应用[J]. 中国食品学报, 2013, 13(10): 197-204. |
| [4] |
杨柳, 夏晓翠, 徐细建, 等. 中蜂分巢复酿生产成熟蜜技术的研究[J]. 中国蜂业, 2019, 70(2): 44-46. |
| [5] |
中国科学院《中国植物志》编辑委员会. 中国植物志: 第44卷第3分册[M]. 北京: 科学出版社, 1997.
|
| [6] |
秦新生. 适合园林应用的三种乌桕属乡土观赏植物[J]. 广东园林, 2011, 33(2): 71-73. DOI:10.3969/j.issn.1671-2641.2011.02.018 |
| [7] |
ZIETKIEWICZ E, RAFALSKI A, LABUDA D. Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification[J]. Genomics, 1994, 20(2): 176-183. DOI:10.1006/geno.1994.1151 |
| [8] |
赖瑞联, 徐洋, 赖恭梯, 等. 山枇杷基因组DNA的提取及自然群体内ISSR遗传多样性分析[J]. 森林与环境学报, 2015, 35(1): 53-59. |
| [9] |
周成城, 杨德明, 李士坤, 等. 18份樱属材料亲缘关系的ISSR分析[J]. 森林与环境学报, 2020, 40(1): 46-53. |
| [10] |
SHAHABZADEH Z, MOHAMMADI R, DARVISHZADEH R, et al. Genetic structure and diversity analysis of tall fescue populations by EST-SSR and ISSR markers[J]. Molecular Biology Reports, 2020, 47(1): 655-669. DOI:10.1007/s11033-019-05173-z |
| [11] |
贾靓, 施瑶, 刘晓燕, 等. 山乌桕化学成分研究: Ⅱ[J]. 中成药, 2007(7): 1043-1045. DOI:10.3969/j.issn.1001-1528.2007.07.032 |
| [12] |
张永丽, 潘其明, 张贵杰, 等. 山乌桕茎叶的化学成分研究[J]. 中国中药杂志, 2019, 44(17): 3738-3744. |
| [13] |
秦新生, 林丽静, 何科稣. 3种乌桕属植物根化学成分的GC-MS分析[J]. 福建农林大学学报(自然科学版), 2014, 43(3): 273-276. |
| [14] |
王晓琴. 山乌桕种子繁育关键技术的研究[J]. 林业勘察设计, 2018, 38(3): 24-27. |
| [15] |
罗坚强. 山乌桕的育苗与造林技术研究[J]. 北京农业, 2015(3): 68. |
| [16] |
林锦森. 山乌桕的特征特性及育苗造林技术[J]. 现代农业科技, 2011(8): 193-195. DOI:10.3969/j.issn.1007-5739.2011.08.124 |
| [17] |
段亚豪, 曹玉玺, 吴祖芳, 等. 果酒酵母菌混合培养的生长规律及对山乌桕蜂蜜酒发酵风味分析[J]. 中国野生植物资源, 2019, 38(5): 36-42. |
| [18] |
史莹. 蜂蜜酿酒酵母分离鉴定及山乌桕蜂蜜酒的研制[D]. 南昌: 江西农业大学, 2012.
|
| [19] |
李金璐, 王硕, 于婧, 等. 一种改良的植物DNA提取方法[J]. 植物学报, 2013, 48(1): 72-78. |
| [20] |
郭宝生, 张辉, 耿军义, 等. 改良SDS法快速提取小样品量棉花总DNA及其纯化[J]. 棉花学报, 2005, 17(5): 320. DOI:10.3969/j.issn.1002-7807.2005.05.015 |
| [21] |
尚小红, 严华兵, 曹升, 等. 葛根SRAP-PCR反应体系的优化及引物筛选[J]. 分子植物育种, 2019, 17(16): 5368-5374. |
| [22] |
李熳. 乌桕优株遗传多样性研究[D]. 长沙: 中南林业科技大学, 2013.
|
| [23] |
郭傲, 高欢欢, 陈默, 等. 无花果ISSR-PCR反应体系的建立与优化[J]. 分子植物育种, 2020, 18(22): 7458-7466. |
| [24] |
王彦华, 侯喜林, 徐明宇. 正交设计优化不结球白菜ISSR反应体系研究[J]. 西北植物学报, 2004, 24(5): 899-902. |
| [25] |
邹枚伶, 夏志强, 王文泉. 白木香基因组DNA提取与ISSR反应体系的优化[J]. 中国农学通报, 2009, 25(2): 250-254. |
| [26] |
黄青青, 乙引, 魏洪美, 等. 高质量竹黄菌全基因组DNA的提取方法比较[J]. 贵州农业科学, 2015, 43(12): 19-22. |
| [27] |
张帅, 王晓光, 涂炳坤, 等. 乌桕不同组织DNA提取方法及其效果[J]. 亚热带植物科学, 2009, 38(4): 82-83. |
| [28] |
李宏, 王新力. 植物组织RNA提取的难点及对策[J]. 生物技术通报, 1999(1): 36-39. |
| [29] |
任风鸣, 胡开治, 刘燕琴, 等. 传统中药金钱草ISSR-PCR反应体系的正交优化研究[J]. 中国中药杂志, 2014, 39(12): 2233-2238. |

 2021, Vol. 41
2021, Vol. 41


