文章信息
- 宋豪威, 洪慧滨, 陈思路, 林成芳, 杨玉盛
- SONG Haowei, HONG Huibin, CHEN Silu, LIN Chengfang, YANG Yusheng
- 磷添加对米槠和杉木及其混合细根分解的影响
- Effects of phosphorus addition on fine root decomposition of Castanopsis carlesii, Cunninghamia lanceolata and mixed
- 森林与环境学报,2021, 41(1): 1-9.
- Journal of Forest and Environment,2021, 41(1): 1-9.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2021.01.001
-
文章历史
- 收稿日期: 2020-10-31
- 修回日期: 2020-12-02
2. 湿润亚热带山地生态国家重点实验室培育基地, 福建 福州 350007
2. State Key Laboratory of Subtropical Mountain Ecology, Fuzhou, Fujian 350007, China) Abstract
凋落物分解作为陆地生态系统碳(C)素和养分循环的重要过程[1],其分解产物具有调节土壤有机物组成的作用,释放的矿质养分是植物生长必需元素的重要来源,影响陆地生态系统净生产力[2]。自然生态系统中,地表凋落物一般以混合物的形式存在,这种混合状况不仅形成了分解环境,还会影响以凋落物为食的特定微生物群落,最终影响凋落物分解速率以及养分循环速率。不同凋落物混合通过改变凋落物分解的理化环境,导致养分转移,造成混合凋落物的实测分解速率与期望速率显著不同[3]。目前关于混合凋落物在分解干重损失与养分释放等方面产生的效应尚无一致结论,主要分为3类:物种丰富度对凋落物分解影响有正效应[4-5]、负效应[6]以及加和效应[7]。大多数分解研究在野外原位进行,能真实反映分解速率,但由于分解环境和凋落物底物性质的混淆效应,导致难以厘清分解的机制[8]。
热带和亚热带地区土壤高度风化,磷(P)易于和铁(Fe)、铝(Al)氧化物络合,从而降低P的生物有效性[9]。已有相关研究证实热带、亚热带生态系统的净初级生产力被P有效性所限制,且有研究表明P元素与凋落物分解速率显著相关[10],这表明P可限制凋落物的分解。此前洪慧滨等[11]在三明市格氏栲自然保护区开展过外源P添加对米槠[Castanopsis carlesii (Hemsl.) Hayata]与杉木[Cunninghamia lanceolata (Lamb.) Hook]细根分解的影响研究,但野外环境具有复杂性,土壤中Fe、Al氧化物对P有效性的强吸附性会干扰细根的分解,容易忽视分解变化是由底物质量与周围环境养分共同作用的结果。而凋落物养分含量和土壤养分有效性常形成生态系统的正反馈环,难以区分它们对凋落物分解的各自作用[12],需要控制试验来证实是凋落物自身养分或是环境的养分对分解的影响,但仍然没有控制试验表明是凋落物质量还是所在环境中的P含量限制了亚热带林木细根的分解。微生物是凋落物的最终分解者,酶活性是微生物的功能表达,已有很多研究通过观测酶活性的变化来解释凋落物的分解动态[13-14]。如P添加可促使微生物在生物吸收和土壤吸附有效P的竞争中占据主导地位[15],并能促进分解过程中酶活性的提高,加快细根之中木质素和纤维素的降解[16],进而对细根的分解产生促进作用。但由于根系混合-微生物交互影响作用具有潜在复杂性,微生物会对根系混合分解和P添加产生何种功能响应目前尚不清楚,因而研究P添加下细根分解有助于深入了解生态系统物质和养分循环机理。
米槠为东部亚热带地区典型的阔叶树种,近几十年来,大多数原生阔叶林被砍伐,代之以更高生产力的人工林树种,如杉木,以满足人们对木材和其他森林产品的需求。已有研究发现,杉木属于内生菌根树种,米槠属于外生菌根树种,二者细根形态和理化性质等方面都具有显著的差异[10, 17]。本研究收集这两种树种细根及混合细根(米槠、杉木两树种的细根按质量比1:1比例混合),同时设置P添加处理,将这3种细根置于室内培养皿中,控制温度和湿度进行无土培养分解能更有效地研究P有效性对细根分解的机理,探讨米槠、杉木根系混合分解是否会出现非加性效应,外源P添加是否促进米槠和杉木细根及其混合分解速率,研究结果可为区域C和养分循环模型提供基础数据。
1 材料与方法 1.1 样品收集2013年3月, 在三明格氏栲自然保护区(117°28′E,26°11′N)的天然林与临近的杉木人工林内,选取不施任何肥料的米槠与杉木幼苗为细根来源。采用土块法分别收集细根(d≤2 mm)样品[10, 18],于树干基部一定距离用工具挖掘1个边长20 cm的正方体土块,挖取发育相对完整的根系,编号后用湿纱布包裹以保持活性,并迅速带回室内,剔除杂根与死根,在尺寸为0.150 mm的筛网中用去离子水清洗干净,置于阴凉处风干,并将同种细根样品混合均匀,混合细根为米槠和杉木的细根按质量比1:1比例混合而成。
1.2 室内试验设计与处理室内试验设计参考GVSEWELL et al[19]室内细根分解试验,选取直径6 cm组培瓶,分别称取0.5 g的米槠细根、混合细根、杉木细根,分别与18 g石英砂进行均匀混合。用去离子水(3 L)与米槠林分采回的新鲜土样(1 kg)进行混合,搅拌过滤后,将溶液接种到组培瓶中,保证组培瓶中接种的菌落一致。设置P添加与对照(CK)两种处理,每种处理9次重复,P(KH2PO4)添加用量为1.5 mg,为了平衡P添加,处理时加入钾离子,CK中施1.5 mg KCl,且溶液经KOH与HCl调制中性,使CK与P添加处理在这一条件上保持一致。细根样品培养采用的培养箱温度设置为22 ℃,湿度设置为50%,1周后喷洒去离子水,此后隔1周喷1次水,用来保持空气湿度并提供细根分解所需的水分,在培养7、14、21、28、42、56、84和112 d后取样,进行细根酶活性(3次重复)、干质量残留率和相关养分指标(6次重复)的测定与分析。
1.3 养分、化学组分与酶活性的测定采用碳氮元素分析仪测定细根中的C、N含量,用连续流动分析仪测定细根中的P含量,用近似系统分析法测定纤维素和木质素含量。细根酶活性的测定采用以下方法[11]:酸性磷酸酶(acid phosphatase, AP)、β-葡萄糖苷酶(β-1, 4-glucosidase, βG)、纤维素水解酶(cellobiohydrolase, CBH)、β-N-乙酰氨基葡萄糖苷酶(β-1, 4-N-acetylglucosaminidase, NAG)活性采用伞形酮(umbelliferone,MUB)作为底物测定。过氧化物酶(peroxidase, PerOx)、酚氧化酶(phenol oxidase, PhOx)采用L-二羟苯丙氨酸(L-Dihydroxyphenylalanine,DOPA)作为底物测定。将加入样品及底物的酶板放入20 ℃培养箱无光培养4、18 h,最后用Synergy H4多功能酶标仪分别测定水解酶与氧化酶活性。
1.4 数据处理与统计分析统计分析采用SPSS 19.0软件,通过单因素方差分析(one-way analysis of variance, ANOVA)和最小显著性差异法(least significant difference, LSD)方法分析不同处理之间的显著性差异,通过Pearson相关性分析法判断不同处理之间的相关性,显著性水平设为P < 0.05。作图采用EXCEL 2016软件。
细根干质量残留率、混合细根残留率计算公式如下:
| $ {\rm{细根干质量残留率/\% = }}{\mathit{Y}_\mathit{t}}\mathit{/}{\mathit{Y}_{\rm{0}}} \times 100 $ | (1) |
式中:Y0为细根的初始质量(g);Yt为t时细根残留的干质量(g)。
Olson指数衰减模型计算细根分解速率:
| $ \frac{{{\mathit{Y}_\mathit{t}}}}{{{\mathit{Y}_{\rm{0}}}}} = {\exp ^{ - kt}} $ | (2) |
式中:k为分解常数。
细根50%分解计算式为:
| $ {t_{0.5}} = \frac{{\ln 0.5}}{{ - k}} $ | (3) |
细根95%分解计算式为:
| $ {t_{0.05}} = \frac{{\ln {{0.05}^{\left[ {11} \right]}}}}{{ - k}} $ | (4) |
混合细根干质量残留率的预测值公式为:
| $ V = \frac{{aX + bY}}{{X + Y}} $ | (5) |
式中:V为两树种细根混合后的干质量残留率预测值(%);a、b为两种树种细根单独分解时的干质量残留率实测值(%);X、Y为两树种细根质量在混合细根质量中所占比重(%)[20]。
2 结果与分析 2.1 磷添加对米槠和杉木及其混合细根分解的影响由表 1可知,杉木、混合细根的N、P养分含量以及纤维素显著低于米槠细根(P < 0.01),而木质素、C/N、C/P、N/P、木质素/P、木质素/N显著高于米槠细根(P < 0.01)。
| 细根 Fine root |
C含量 C content /(g•kg-1) |
N含量 N content /(g•kg-1) |
P含量 P content /(g•kg-1) |
C/N | C/P | N/P | 纤维素含量 Cellulose content/% |
木质素含量 Lignin content/% |
木质素/N Lignin/N |
木质素/P Lignin/P |
| 米槠细根Castanopsis carlesii fine root |
443.90±4.31a | 6.72±0.05a | 1.15±0.19a | 60.41±0.48c | 391.67±1.65c | 5.93±0.93c | 22.45±1.54a | 26.44±0.25c | 3.94±0.06c | 23.34±3.99c |
| 混合细根Mixed fine root |
439.37±2.55a | 5.63±0.40b | 0.74±0.02b | 78.19±6.79b | 596.15±2.34b | 7.67±0.97b | 20.05±2.27b | 28.99±2.61b | 4.81±0.60b | 36.57±2.68b |
| 杉木细根Cunninghamia lanceolata fine root |
421.26±1.09b | 4.22±0.11c | 0.33±0.02c | 101.05±2.65a | 1 264.39±1.85a | 12.66±0.24a | 14.90±0.54c | 37.09±0.89a | 8.79±0.10a | 111.29±1.94a |
| 注:同列数字后不同小写字母表示差异显著(P < 0.05)。Note: different lowercase letters after the same column of numbers indicate significant differences(P < 0.05). | ||||||||||
如表 2所示,3种细根在分解初期(0~21 d内)干质量损失较快,21 d后分解变慢,且112 d分解结束,CK下, 3种细根干质量残留率呈现米槠 < 混合< 杉木;21~112 d,P添加处理显著降低了杉木细根的干质量残留率,但米槠与混合细根干质量残留率在P添加处理下变化较小。重复测量方差分析表明,3种细根干质量残留率与分解时间之间存在显著性差异,且细根干质量残留率呈现指数衰减过程(表 3),与CK相比,P添加处理对米槠、混合细根的分解速率影响较小,对初始P含量、P有效性均较低的杉木细根具有更强的促进作用。
| 分解时间 Decom position time/d |
米槠细根干质量残留率 Dry mass retention rate of Castanopsis carlesii/% |
混合细根干质量残留率 Dry mass retention rate of mixed fine root/% |
杉木细根干质量残留率 Dry mass retention rate of Cunninghamia lanceolata/% |
|||||
| CK | P添加P addition | CK | P添加P addition | CK | P添加P addition | |||
| 0 | 100.00 | 100.00 | 100.00 | 100.00 | 100.00 | 100.00 | ||
| 7 | 85.65a | 86.26a | 88.73a | 84.98b | 87.05a | 86.51a | ||
| 14 | 82.90b | 84.56a | 82.81b | 84.01a | 83.08b | 84.35a | ||
| 21 | 80.88b | 81.81a | 82.68a | 81.57b | 82.13a | 80.14b | ||
| 28 | 80.72a | 81.42a | 82.02a | 81.13a | 81.68a | 79.77b | ||
| 42 | 78.84a | 78.02a | 77.82a | 77.25a | 78.10a | 77.24b | ||
| 56 | 75.92b | 77.08a | 77.60a | 76.51a | 77.66a | 76.85b | ||
| 84 | 75.54a | 74.93a | 75.37a | 74.56a | 76.41a | 73.94b | ||
| 112 | 72.17a | 71.50b | 73.51a | 72.79a | 74.84a | 72.75b | ||
| 注:同行数据后不同小写字母表示处理间差异显著(P<0.05)。Note: different lowercase letters within the same line indicate significant differences among treatments(P < 0.05). | ||||||||
| 细根 Fine root |
处理 Treatment |
Olson负指数 方程Olson negative exponential equation |
R2 | 分解常数k Decay constant k |
年预期干质 量损失率 Annual predicted mass rate/% |
年实际干质 量损失率 Annual observed mass rate/% |
半分解 时间 Half decomposition time/a |
95%分解 时间 95% decomposition time/a |
| 米槠细根Castanopsis | CK | Y=0.96e-0.35x | 0.88 | 0.35 | 23.67 | 18.18 | 1.99 | 8.12 |
| carlesii fine root | P添加P addition | Y=0.97e-0.36x | 0.89 | 0.36 | 20.97 | 19.58 | 1.89 | 7.75 |
| 混合细根Mixed | CK | Y=0.97e-0.33x | 0.89 | 0.33 | 17.98 | 17.98 | 1.86 | 8.09 |
| fine root | P添加P addition | Y=0.94e-0.32x | 0.83 | 0.32 | 19.87 | 18.87 | 1.93 | 7.54 |
| 杉木细根Cunninghamia | CK | Y=0.94e-0.29x | 0.83 | 0.29 | 20.64 | 18.32 | 2.19 | 8.71 |
| lanceolata fine root | P添加P addition | Y=0.95e-0.32x | 0.84 | 0.32 | 19.03 | 18.23 | 2.04 | 8.13 |
由表 4可知,CK下0~7 d混合细根干质量残留率实测值显著大于预测值,表明前期混合细根抑制分解,后期分解干质量残留率实测值与预测值无显著差异;与CK相比,P添加使混合细根在分解7、21 d干质量残留率显著降低,促进了分解,但21 d后干质量残留率无显著差异。
| 分解时间 Decomposition days/d |
CK干质量残留率CK dry mass retention rate/% | P添加干质量残留率P addition dry mass retention rate/% | |||
| 预测值 Predicted value |
实测值 Observed value |
预测值 Predicted value |
实测值 Observed value |
||
| 7 | 86.40±0.42 | 88.73±2.43a* | 86.39±0.61 | 84.98±0.61b* | |
| 21 | 81.50±0.82 | 82.68±1.12a | 81.00±0.67 | 81.57±1.11b | |
| 56 | 76.80±0.38 | 77.60±0.65a | 76.96±0.28 | 77.51±0.71a | |
| 84 | 76.00±0.65 | 75.37±1.85a | 74.44±0.70 | 74.56±1.03a | |
| 112 | 73.52±0.28 | 73.51±0.78a | 72.15±0.24 | 72.79±1.23a | |
| 注:同行数据后不同小写字母表示处理间差异显著(P < 0.05);*表示t检验后预测值与实测值之间差异显著(P < 0.05)。Note: different lowercase letters within the same line indicate significant differences among treatments(P < 0.05), and the * indicates that there is a significant difference between the predicted value and the measured value according to the t-test(P < 0.05). | |||||
如图 1所示,在室内分解期(112 d内),与CK相比,P添加处理对3种细根中氮(N)分解释放的影响较小,仅米槠细根中N的释放显著变慢。如图 2所示,P添加处理使3种细根分解过程中P大量富集,且分解末期初始P含量最低的杉木细根P残留率较CK增加了474.69%。
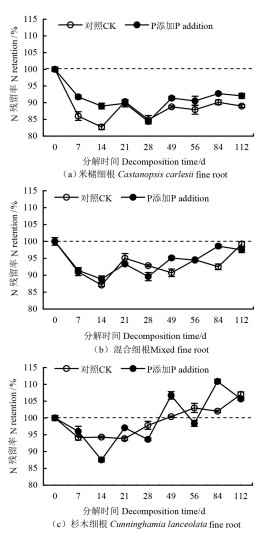
|
图 1 细根分解过程中N释放动态 Fig. 1 N retention over time in incubation of decomposing fine roots |
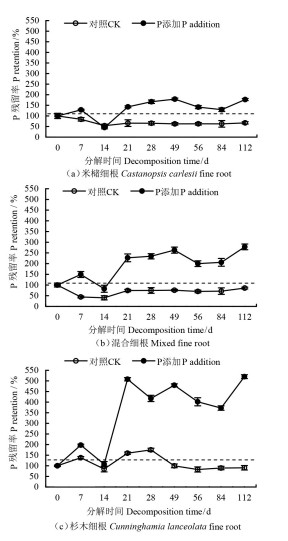
|
图 2 细根分解过程中P释放动态 Fig. 2 P retention over time in incubation of decomposing fine roots |
如图 3所示,112 d分解期后,与CK相比,P添加处理显著降低了米槠、杉木细根的AP活性,但增加了混合细根以及杉木细根的CBH、NAG以及两种氧化酶(PhOx和PerOx)活性。且整体来看,P添加对初始P含量较低的杉木细根酶活性影响较大。
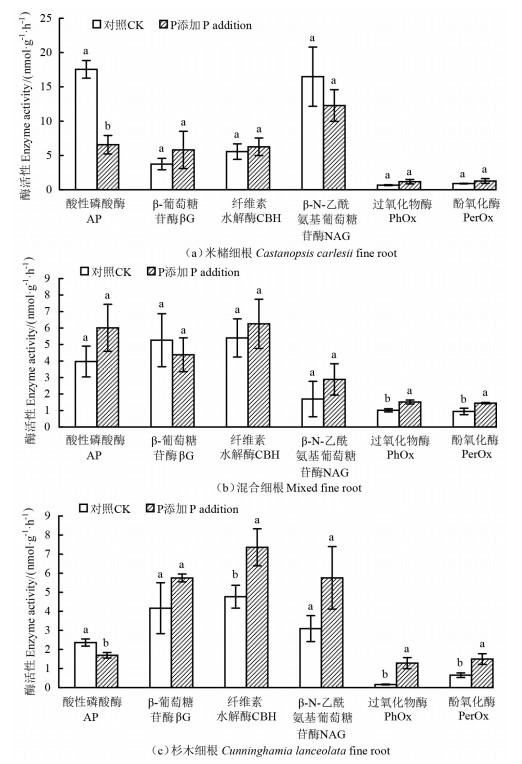
|
注:不同小写字母表示同一种酶活性在不同处理间差异显著(P < 0.05)。 Note:different lowercase letters indicate significant differences between the control and P addition treatments at the same enzyme activity levels(P < 0.05). 图 3 细根分解过程中酶活性的动态 Fig. 3 Dynamics of fine root degrading enzyme activity |
CK的细根干质量损失速率与初始化学性质和酶活性的相关分析表明:细根干质量损失速率与初始N浓度、PerOx呈显著正相关,与C/N、木质素、木质素/N呈显著负相关(表 5)。
| N | P | C/N | N/P | 纤维素 Cellulose/% |
木质素 Lignin/% |
木质素/N Lignin/N/% |
木质素/P Lignin/P/% |
酸性磷酸酶 AP |
过氧化物酶 PerOx |
| 0.768* | 0.344 | -0.711* | 0.032 | 0.529 | -0.724* | -0.773* | -0.517 | 0.439 | 0.691* |
| 注:*表示P < 0.05。Note: the * indicates P < 0.05. | |||||||||
在局域气候条件下,凋落物底物质量,如C组分,在控制分解速率方面尤为重要。细根中常用N、P、木质素含量、C/N、木质素/N、木质素/C等来作为衡量分解速率的指标[21]。有研究表明:凋落物质量能解释分解常数k变化的21.7%[22]。文中通过研究米槠、杉木细根以及混合细根(两树种细根同比例混合)的分解状况,发现其分解常数k呈现:米槠>混合>杉木,且不同的根干质量残留率差异显著,说明根系类别对分解具有显著影响(P < 0.05)。这与路颖等[23]的研究结果相似。凋落物混合的分解速率经常高于各自单独分解速率[3]。本研究中混合细根的分解结果表明:前期(0~7 d),干质量残留率实测值显著大于预测值,说明混合细根抑制了分解,但后期分解速率趋同;混合细根分解速率仅显著高于杉木细根单独分解。前期混合细根分解受到抑制,可能是由于不同细根间尚未建立起养分传输的“菌丝桥”,不同养分利用未能相互补充,而后期分解速率趋同,是由于不同养分的互补起作用[16]。与米槠和混合细根相比,造成杉木细根较低分解速率的原因主要是其低质量的底物性质。
本研究结果发现,细根分解速率与初始N浓度呈显著性正相关(P < 0.05),一般来讲,初始N、P有效性在凋落物分解前期作用较大,后期分解主要与木质素等难降解的化学组分有关[22]。且有研究表明,凋落物分解速率通常与其初始凋落物养分浓度呈正相关,而与C/N或C/P呈负相关[22],这与本研究的相关分析结果一致。作为影响凋落物分解的重要因素,以往关于木质素对分解影响的研究有很多[22-24],相较其他初始化学组分,木质素一直是影响凋落物分解更重要的因素。本研究结果中,细根分解速率与木质素显著负相关,作为难分解的酸不溶性C组分,分解后期木质素逐渐积累,所占比例变大,限制了细根的分解,这也可解释本研究中3种细根前后期不同的分解特征。有研究表明,木质素/N能解释k值变异的16.4%[25],本研究中细根分解速率也与木质素/N显著负相关。但本研究不同树种的细根分解速率没有表现出与初始P含量显著正相关,而是与初始N含量呈显著正相关,这说明在室内无土培养试验中,相比P,N含量更显著影响凋落物分解。这似乎与先前在中亚热带天然林细根分解的研究中发现分解速率与初始P含量有很强的相关性相矛盾[10]。实际上,先前的原位分解试验中,土壤有效P含量很低, 约为1 mg·kg-1,而N有效性高,因此分解底物的P含量对分解速率的影响显得尤为重要。而本研究隔离了土壤环境对分解的影响,导致分解速率与细根初始N含量有显著相关关系。
微生物在凋落物分解以及养分释放中起着关键作用,胞外酶活性可以反映凋落物的分解速率[13],研究与凋落物分解有关的胞外酶可以为生态系统养分循环提供信息,其中关键酶活性可以用来反映微生物养分获取状况[22]。本研究发现细根分解速率与AP呈正相关,与PerOx呈显著正相关,这与洪慧滨等[11]的研究结果相似。凋落物分解的初期主要分解可溶性糖类,此时与之相关的纤维素酶(βG和CBH)发挥主要作用并逐渐上升,随着纤维素等多糖物质分解后其活性逐渐下降。作为木质素降解酶,随着后期难降解的酸不溶性物质等的不断积累,PerOx活性的变化成为后期凋落物分解快慢的主要因素。而由于分解底物的不断减少,微生物生物量、养分也会降低[15],此时环境不适宜微生物定居,进而对凋落物后期分解产生抑制作用。此外,有研究表明,PhOx以及PerOx活性会随着凋落物中次生化合物和木质素浓度含量增加而上升[26]。
本研究中P添加处理在112 d分解期内使混合细根干质量残留率下降,仅7、21 d分解期时与CK相比呈现显著差异。P添加显著提高了杉木细根单独分解速率,这与洪慧滨等[11]在福建三明格氏栲自然保护区森林进行的P添加试验的研究结果类似,且研究结果都表明P添加仅对细根P含量较低的杉木细根具有显著促进作用,但本研究不同点是,与野外环境相比,室内培养没有土壤吸附作用的干扰,分解更可能受限于N、P养分的平衡。且已有研究表明在同一环境中分解不同细根,低P浓度的细根对P的吸收强度比具有较高P浓度的细根大[21],说明P对具有较低P含量凋落物分解中的限制作用。P添加对初始P含量相对较高、木质素比例低的米槠细根分解影响较小,可能是P元素并不是促进初始N、P含量较高的米槠细根分解的主要因素,但却显著提高了初始P含量较低、木质素比例高的杉木细根中后期的分解,这说明P添加对初始P含量较低的杉木细根促进较大,且对杉木细根的促进作用主要在中后期(21~112 d)。因此混合细根在P添加处理下分解速率加快的原因可能是外源P添加促进了混合细根中杉木细根的分解,进而对整体分解产生促进。
除根系质量外,环境养分水平还被证明对根系分解非常重要。已有研究证实,通常随着N、P两种养分含量的增加,凋落物分解速度加快[21]。相反,一些研究报告称,根的分解速率没有因养分富集而改变[27]。通常认为,如果凋落物提供分解者的养分有限,外部营养添加会促进凋落物的分解[21]。本研究中仅初始P含量较低的杉木细根在P添加后分解速率显著加快,而混合细根以及单独分解的米槠细根在P添加后分解速率变化不显著,一般来讲,分解过程中P富集表明微生物分解者缺P,需要从周围环境中吸收富集P以满足正常生长需求。但微生物也有可能缺少其他元素,例如N,单一的养分含量不足以指示分解速率的快慢。且本研究发现N/P较平衡的米槠与混合细根在P添加下无显著变化,P添加对N/P高的杉木细根的分解却有显著促进作用,说明细根底物的化学计量比(N/P)比细根中P含量对细根的影响更为重要[28]。已有研究表明,凋落物分解速率因木质素、纤维素降解受到抑制而减慢[22]。本研究中,细根分解速率与木质素显著负相关,而纤维素是由木质素聚合体所包裹[24],木质素降解受限也会影响纤维素的降解速率。
胞外酶由微生物产生,催化有机质的分解[21],已有研究证实了微生物胞外酶与凋落物分解之间的联系[12, 22]。本研究中仅初始N、P含量较低,木质素含量较高的杉木细根在P添加后分解加速,可能是由于P的加入促进了纤维素降解酶(βG和CBH)活性的升高,此种酶在分解前中期对中度易分解纤维素的分解起重要作用。这与近期一项对中亚热带森林凋落物分解与酶活性之间关系的研究结果类似[29]。而P添加处理下混合细根分解与CK相比没有呈现显著差异,可能与βG的活性受到抑制有关。近期的Meta分析显示,P添加显著刺激了PerOx活性,表明P添加可能加速难降解土壤有机碳的分解[30],这与本研究的结果相似。且有研究表明木质素降解酶(PhOx、PerOx)活性的上升说明随着分解进行木质素浓度与次生化合物比例的增加,进而减缓了后期凋落物的分解速率[26]。根据生态经济学“最优配置”原理[31],外源P添加后,促进P的有效性提高,微生物获得P将花费更少的能量,转而提高获得C、N的胞外酶活性[26]。这与本研究C获取酶(βG和CBH)及N获取酶(NAG)在P添加后活性提高的结果一致。本研究发现细根分解常数与PerOx活性存在显著的正相关性,表明作为木质素降解酶的PerOx能较好地反映分解速率,这与洪慧滨等[11]的研究结果一致。
本研究室内无土分解试验发现,混合细根未显著提高分解速率;同样P添加也未显著提高混合细根和米槠细根的分解速率,但却显著提高了初始P浓度较低、木质素含量高的杉木细根分解速率。研究结果表明,木质素含量始终是林木细根分解的重要限制因素,同时养分有效性(无论N、P)也显著影响分解,且分解过程中的酶(如PerOx)活性变化能较好反映分解速率。
| [1] |
卢胜旭, 许恩兰, 吴东梅, 等. 米槠人工林土壤微生物群落组成对凋落物输入的响应[J]. 森林与环境学报, 2020, 40(1): 16-23. |
| [2] |
SCHLESINGER W H, BERNHARDT E S. Biogeochemistry:an analysis of global change[M]. 3rd ed.. New York: Elsevier/Academic Press, 2013.
|
| [3] |
李宜浓, 周晓梅, 张乃莉, 等. 陆地生态系统混合凋落物分解研究进展[J]. 生态学报, 2016, 36(16): 4977-4987. |
| [4] |
葛露露, 何宗明, 孟庆权, 等. 滨海沙地纹荚相思和木麻黄凋落物混合分解的变化过程[J]. 东北林业大学学报, 2019, 47(1): 35-40, 46. |
| [5] |
王小平, 杨雪, 杨楠, 等. 凋落物多样性及组成对凋落物分解和土壤微生物群落的影响[J]. 生态学报, 2019, 39(17): 6264-6272. |
| [6] |
佘汉基, 蔡金桓, 薛立, 等. 模拟外源性氮磷对尾叶桉和马占相思混合凋落叶分解的影响[J]. 西北林学院学报, 2017, 32(6): 45-52. DOI:10.3969/j.issn.1001-7461.2017.06.07 |
| [7] |
杨红玲, 李玉霖, 宁志英, 等. 添加混合凋落物对沙丘草地土壤有机碳矿化的影响[J]. 生态学报, 2019, 39(7): 2510-2519. |
| [8] |
薛飞, 龙翠玲, 廖全兰, 等. 喀斯特森林凋落物对土壤养分及土壤酶的影响[J]. 森林与环境学报, 2020, 40(5): 449-458. |
| [9] |
CAMENZIND T, HÄTTENSCHWILER S, TRESEDER K K, et al. Nutrient limitation of soil microbial processes in tropical forests[J]. Ecological Monographs, 2018, 88(1): 4-21. DOI:10.1002/ecm.1279 |
| [10] |
LIN C F, YANG Y S, GUO J F, et al. Fine root decomposition of evergreen broadleaved and coniferous tree species in mid-subtropical China:dynamics of dry mass, nutrient and organic fractions[J]. Plant and Soil, 2011, 338(1/2): 311-327. |
| [11] |
洪慧滨, 林成芳, 彭建勤, 等. 磷添加对中亚热带米槠和杉木细根分解及其酶活性的影响[J]. 生态学报, 2017, 37(1): 136-146. |
| [12] |
KASPARI M, GARCIA M N, HARMS K E, et al. Multiple nutrients limit litterfall and decomposition in a tropical forest[J]. Ecology Letters, 2008, 11(1): 35-43. |
| [13] |
WARING B G. Exploring relationships between enzyme activities and leaf litter decomposition in a wet tropical forest[J]. Soil Biology and Biochemistry, 2013, 64: 89-95. DOI:10.1016/j.soilbio.2013.04.010 |
| [14] |
DONG L L, SUN T, BERG B, et al. Effects of different forms of N deposition on leaf litter decomposition and extracellular enzyme activities in a temperate grassland[J]. Soil Biology and Biochemistry, 2019, 134: 78-80. DOI:10.1016/j.soilbio.2019.03.016 |
| [15] |
RICHARDSON A E, SIMPSON R J. Soil microorganisms mediating phosphorus availability update on microbial phosphorus[J]. Plant Physiology, 2011, 156(3): 989-996. DOI:10.1104/pp.111.175448 |
| [16] |
王光军, 田大伦, 闫文德, 等. 去除和添加凋落物对枫香(Liquidambar formosana)和樟树(Cinnamomum camphora)林土壤呼吸的影响[J]. 生态学报, 2009, 29(2): 643-652. DOI:10.3321/j.issn:1000-0933.2009.02.012 |
| [17] |
林成芳, 杨玉盛, 郭剑芬, 等. 杉木和米槠细根混合分解及其养分释放[J]. 生态学报, 2010, 30(3): 626-634. |
| [18] |
GUO D L, MITCHELL R J, HENDRICKS J J. Fine root branch orders respond differentially to carbon source-sink manipulations in a longleaf pine forest[J]. Oecologia, 2004, 140(3): 450-457. DOI:10.1007/s00442-004-1596-1 |
| [19] |
GVSEWELL S, GESSNER M O. N:P ratios influence litter decomposition and colonization by fungi and bacteria in microcosms[J]. Functional Ecology, 2009, 23(1): 211-219. DOI:10.1111/j.1365-2435.2008.01478.x |
| [20] |
王欣, 郭延朋, 赵辉, 等. 华北落叶松与白桦叶凋落物混合分解及其养分动态[J]. 林业与生态科学, 2018, 33(1): 29-36. |
| [21] |
LIN C F, LIN W S, CHEN S L, et al. Phosphorus addition accelerates fine root decomposition by stimulating extracellular enzyme activity in a subtropical natural evergreen broad-leaved forest[J]. European Journal of Forest Research, 2019, 138(6): 917-928. DOI:10.1007/s10342-019-01211-4 |
| [22] |
陈思路, 蔡劲松, 林成芳, 等. 亚热带不同树种凋落叶分解对氮添加的响应[J]. 植物生态学报, 2020, 44(3): 214-227. |
| [23] |
路颖, 李坤, 梁强, 等. 泰山4种优势造林树种叶片凋落物分解对凋落物内细菌群落结构的影响[J]. 生态学报, 2019, 39(9): 3175-3186. |
| [24] |
周世兴, 肖永翔, 向元彬, 等. 模拟氮沉降对华西雨屏区天然常绿阔叶林凋落叶分解过程中基质质量的影响[J]. 生态学报, 2016, 36(22): 7428-7435. |
| [25] |
唐仕姗, 杨万勤, 殷睿, 等. 中国森林生态系统凋落叶分解速率的分布特征及其控制因子[J]. 植物生态学报, 2014, 38(6): 529-539. |
| [26] |
SINSABAUGH R L. Phenol oxidase, peroxidase and organic matter dynamics of soil[J]. Soil Biology and Biochemistry, 2010, 42(3): 391-404. DOI:10.1016/j.soilbio.2009.10.014 |
| [27] |
SNYDER J M, REJMÁNKOVÁ E. Macrophyte root and rhizome decay:the impact of nutrient enrichment and the use of live versus dead tissue in decomposition studies[J]. Biogeochemistry, 2015, 124(1/2/3): 45-59. |
| [28] |
MCGRODDY M E, SILVER W L, DE OLIVEIRA JR R C. The effect of phosphorus availability on decomposition dynamics in a seasonal lowland Amazonian forest[J]. Ecosystems, 2004, 7(2): 172-179. |
| [29] |
宋影, 辜夕容, 严海元, 等. 中亚热带马尾松林凋落物分解过程中的微生物与酶活性动态[J]. 环境科学, 2014, 35(3): 1151-1158. |
| [30] |
XIAO W, CHEN X, JING X, et al. A meta-analysis of soil extracellular enzyme activities in response to global change[J]. Soil Biology and Biochemistry, 2018, 123: 21-32. |
| [31] |
王冰冰, 曲来叶, 马克明, 等. 岷江上游干旱河谷优势灌丛群落土壤生态酶化学计量特征[J]. 生态学报, 2015, 35(18): 6078-6088. |

 2021, Vol. 41
2021, Vol. 41


