文章信息
- 黄幸然, 谢承劼, 潘若琪, 徐亚, 郑丽丽, 易志刚
- HUANG Xingran, XIE Chengjie, PAN Ruoqi, XU Ya, ZHENG Lili, YI Zhigang
- 氮添加对马尾松和木荷幼苗根系土壤挥发性有机化合物的影响
- Effects of nitrogen addition on soil volatile organic compounds of Pinus massoniana and Schima superba seeding root zone soils
- 森林与环境学报,2020, 40(3): 243-250.
- Journal of Forest and Environment,2020, 40(3): 243-250.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2020.03.003
-
文章历史
- 收稿日期: 2020-03-09
- 修回日期: 2020-04-21
2. 福建农林大学土壤环境健康与调控 福建省重点实验室, 福建 福州 350002;
3. 福建省环境监测中心站, 福建 福州 350002
2. Fujian Provincial Key Laboratory of Soil Environmental Health and Regulation, Fujian Agriculture and Foresty University, Fuzhou, Fujian 350002, China;
3. Fujian Province Environmental Monitoring Center, Fuzhou, Fujian 350002, China
土壤挥发性有机化合物(volatile organic compounds,VOCs)是一类具有亲脂性、高蒸气压、低沸点和低分子量的微生物初级和次级代谢产物[1-2],以烷烃、烯烃、醇类和醛酮类化合物为主[3-4]。土壤VOCs不仅在土壤生物和非生物过程发挥重要生态功效[5-6],而且由于其具有较强的活性, 会影响大气环境和全球气候变化。例如,VOCs在光照和氮氧化物等条件下经过一系列复杂过程生成臭氧[7],同时伴随着氢氧自由基的减少,增加甲烷的半衰期[8]。此外,VOCs还与二次有机气溶胶和云凝结核的形成密切相关[9-10]。但目前大多数研究集中在植物和整个生态系统VOCs的释放[11],而关于土壤VOCs的研究相对较少并且结果存在争议[4, 12]。
土壤微生物是土壤VOCs主要来源之一[7, 13-14]。SCHADE et al[15]研究发现德国北部某农田地表会释放甲醇和丙酮,且人工松林地表甲醇、丙酮和乙醛的释放与该林冠层排放通量相当[16],这是由于微生物分解土壤有机质释放大量VOCs[12]。研究结果表明,土壤细菌主要以产生烯烃、醇类、酮类和萜烯类化合物为主,土壤真菌更多的是释放醇类、苯类、醛类、酮类和砷类化合物[4]。此外,植物根系能够合成和分泌氨基酸、有机酸、糖类、酚类和醛类等有机物[5, 17]。土壤不仅可以作为VOCs的“源”,也能够作为VOCs的“汇”。土壤颗粒物能够吸附地表和凋落叶产生的VOCs[12],植物根系组织也会吸收、累积或降解土壤中的VOCs[4, 13]。例如,OWEN et al[6]发现土壤微生物既可以合成单萜烯,也可以利用单萜烯作为碳源。土壤VOCs的“源”与“汇”是一个紧密相连且复杂的动态过程,受多种因素的影响。氮沉降作为全球气候变化的重要环境因子,势必会通过影响土壤微生物和植物根系来改变土壤VOCs通量。
中国已成为继欧洲和北美地区之外的全球第三大氮沉降集中区,并且预计将会持续增加[18]。一方面,氮沉降增加会改变植物代谢过程和引起植物营养失衡,影响植物光合作用和根系活动[19-20]。另一方面,氮沉降也会加快土壤酸化[21-22],直接或间接改变土壤微生物的群落结构[23],最终影响土壤VOCs吸收与释放[5, 13],同时土壤VOCs释放的种类也会随着地上植被不同而有所差异[24]。然而,关于氮沉降对土壤VOCs影响的研究尚不明确。此外,目前大多数模拟氮沉降的方式都采用直接向土壤施氮[21],而忽略植物本身具有截留氮的能力[19],导致模拟氮沉降得到的结果与实际氮沉降对土壤VOCs的影响存在一定的偏差。因此,在氮沉降增加背景下,研究不同施氮方式和氮水平对亚热带优势树种马尾松(Pinus massoniana Lamb.)和木荷(Schima superba Gardn. et Champ.)土壤VOCs释放的影响,能够为正确评价土壤VOCs对大气氮沉降增加的响应提供基础数据,同时为建立土壤VOCs模型提供数据支持。
1 材料与方法 1.1 研究方法2012年3月,选取1年生的马尾松和木荷两种南亚热带树种为研究对象。实验前将幼苗移栽至花盆(高30 cm、直径40 cm),添加等量预处理土壤(华南植物园游览区季风林表层土壤),土壤理化性质见刘双娥等[25],并置于温室中培养。待2个月缓苗后,进行添加氮处理。根据广州降雨格局(年降水量为1 600~1 900 mm)和大气氮沉降量(5.6 g·m-2·a-1)[26],设置自然氮沉降(control,5.6 g·m-2·a-1)、中氮(medium-N,15.6 g·m-2·a-1)和高氮(high-N,20.6 g·m-2·a-1)3个氮处理,每周施加硝酸铵溶液来模拟氮沉降。同时,设置两种施氮方式:将配好的氮溶液用花洒均匀喷洒在土壤表层(土壤施氮,soil application of N,SAN)或者幼苗顶端(叶面施氮,foliage application of N,FAN)。每个处理6个重复,共72盆植物。具体实验设计详见刘双娥等[25]和HUANG et al[21]。
1.2 样品采集氮处理一年半后,于2013年10月采集土壤VOC样品,具体操作如下:采样前移除盆栽凋落物,在幼苗周围(10 cm)用土钻取0~15 cm的土壤样品,两盆相同处理植物土壤混合成一个土样。取其中100 g左右土壤避光密封在Tedlar气袋中,充入4 L经过吸附柱(硅胶-活性炭-碘化钾)去除大部分VOCs的零空气,分别采集密封后0和30 min的Tedlar袋中的气体(约300 mL)于Teflon采样袋中,并于第一次(0 min)采样后补充等体积的零空气。同时测量采样时的温度,采集结束后采样袋避光保存并尽快分析,土壤带回实验室,用于测量土壤理化性质。
1.3 样品分析使用质子转移反应飞行时间质谱仪(proton transfer reaction-time of flight-mass spectrometry, PTR-TOF-MS)分析土壤VOCs组成及含量。主要参数如下:漂移管工作电压600 V;漂移管内压力220 Pa;进样流量150~200 mL·min-1。测量前后都进行气体校正,绝大部分VOCs的校准曲线R2>0.99。此外,挑选部分样品进行预浓缩-GCMS测定,对PTR-TOF-MS的数据进行进一步校正,保证结果可靠性。本实验中用于计算VOCs浓度的主要化合物反应速率常数k值详见表 1。土壤理化性质分析参照国标方法。
| 化合物Compound | 分子式Formula | k |
| 丙炔Acetylene | C3H4 | 1.71 |
| 丙烯Propylene | C3H6 | 1.58 |
| 1-丁烯1-Butene | C4H8 | 1.73 |
| 异戊二烯Isoprene | C5H8 | 1.94 |
| 苯Benzene | C6H6 | 1.97 |
| 甲苯Toluene | C7H8 | 2.12 |
| 苯乙烯Styrene | C8H8 | 2.33 |
| 乙苯Ethylbenzene | C8H10 | 2.25 |
| 二甲苯Xylene | C8H10 | 2.28 |
| 单萜烯Monoterpene | C10H16 | 2.44 |
| 甲醛Formaldehyde | CH2O | 2.92 |
| 甲酸Formic acid | CH2O2 | 2.02 |
| 甲醇Methanol | CH4O | 2.33 |
| 乙烯酮Ethenone | C2H2O | 2.21 |
| 乙醛Acetaldehyde | C2H4O | 3.36 |
| 乙酸Acetic acid | C2H4O2 | 2.27 |
| 乙醇Ethanol | C2H6O | 2.26 |
| 丙酮Acetone | C3H6O | 3.00 |
| 苯酚Phenol | C6H6O | 2.52 |
| 乙腈Acetonitrile | C2H3N | 4.74 |
| 二甲基硫醚Dimethyl sulfide | C2H6S | 2.53 |
单位干重土壤VOCs的通量E(pmol·g-1·h-1):
| $ E = \frac{{1{\kern 1pt} {\kern 1pt} 000\Delta CV}}{{0.5{V_n}W}} $ | (1) |
式中: △C表示0和30 min时VOC的浓度差(nL·L-1);V表示Tedlar体积(L);Vn表示测量温度下的气体摩尔体积(L·mol-1);W表示测量时的土壤干重(g)。
总VOCs(total VOCs)的通量为各类型土壤VOCs[非甲烷碳氢化合物(NMHCs)、含氧VOCs (OVOCs)、含氮VOCs(NVOCs)、含硫VOCs(SVOCs)、芳香类VOCs(AVOCs)和卤代VOCs(HVOCs)]通量的加和。
使用SPSS 20.0进行多因素方差(ANOVA)、Duncan多重检验法检验和独立样本t检验法,检验马尾松和木荷幼苗根系土壤VOC通量在不同氮水平或施氮方式间的差异显著性(P < 0.05),对VOCs通量及其理化性质进行Spearman相关性分析, 使用SigmaPlot 12.5作图。
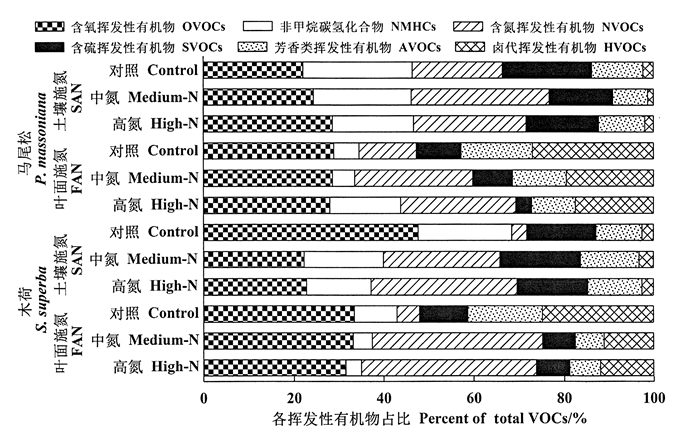
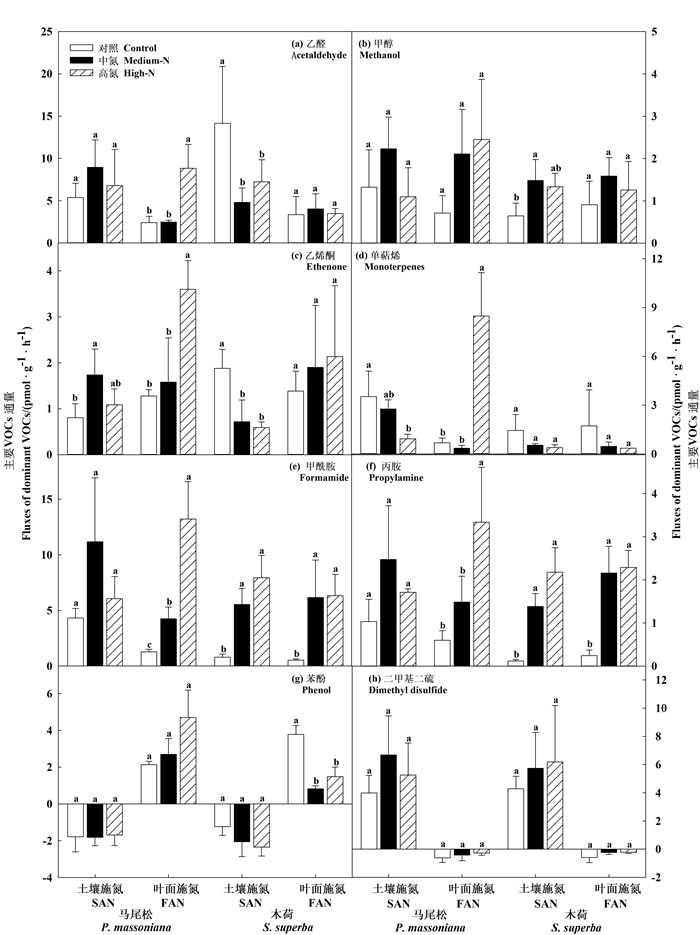
2 结果与分析在各氮水平和施氮方式处理下,使用PTR-TOF-MS共检测到100种VOCs,其中28种OVOCs,23种NMHCs,11种NVOCs,9种SVOCs,10种AVOCs和19种HVOCs。马尾松和木荷幼苗根系土壤总VOCs的释放量为19.50~70.94 pmol·g-1·h-1(图 1)。OVOCs和NVOCs是马尾松和木荷幼苗根系土壤释放的主要化合物类型,分别占总VOCs的22.04%~47.71%和3.31%~38.68%(图 2)。其中,OVOCs以乙醛、甲醇和乙烯酮为主,NVOCs以甲酰胺和丙胺为主。此外,单萜烯、二甲基二硫和苯酚分别为马尾松和木荷幼苗根系土壤NMHCs、SVOCs和AVOCs的主要化合物(图 3)。

|
注:不同小写字母表示同一处理氮水平间差异显著(P < 0.05)。 Note: different letters for a given variable indicate a significant difference (P < 0.05) across different N levels. 图 1 氮处理对马尾松和木荷幼苗根系土壤总VOCs的影响 Fig. 1 Effects of N treatments on total VOC fluxes of P. massoniana and S. superba seeding root zone soils |
|
图 2 不同氮处理下马尾松和木荷幼苗根系土壤不同种类VOCs的百分比 Fig. 2 Contribution of different VOC species emitted from P. massoniana and S. superba seeding root zone soils under different N treatments |
|
注:不同小写字母表示同一处理下不同氮水平间差异显著(P < 0.05)。 Note: different letters for a given variable indicate a significant difference (P < 0.05) across different N levels. 图 3 不同氮处理对马尾松和木荷幼苗根系土壤主要VOCs的影响 Fig. 3 Effects of N levels and N application methods on dominant VOC fluxes of P. massoniana and S. superba seedling root zone soils |
总体而言,除叶面施氮高氮处理会显著促进马尾松幼苗根系土壤总VOCs的释放外,氮添加在两种施氮方式下对马尾松和木荷幼苗根系土壤总VOCs(OVOCs、NMHCs、SVOCs、AVOCs和HVOCs)的释放无显著影响,但却促进马尾松和木荷幼苗根系土壤NVOCs的释放(P < 0.05,表 2,图 1和图 2)。马尾松和木荷幼苗根系土壤AVOCs、木荷幼苗根系土壤NMHCs在土壤施氮和叶面施氮处理下具有显著差异。氮水平和施氮方式交互影响马尾松幼苗根系土壤NVOCs的释放。此外,马尾松和木荷树种之间在各处理下,根系土壤VOCs差异不显著(图 2,表 2)。
| 树种Tree species | 处理Treatment | Total VOCs | OVOCs | NMHCs | NVOCs | SVOCs | AVOCs | HVOCs |
| 马尾松P. massoniana | 氮水平N levels | 0.174 | 0.315 | 0.588 | 0.009** | 0.942 | 0.586 | 0.962 |
| 施氮方式N application methods | 0.846 | 0.799 | 0.210 | 0.783 | 0.133 | 0.014* | 0.957 | |
| 氮水平*施氮方式 N levels * N application methods |
0.057 | 0.246 | 0.160 | 0.006** | 0.942 | 0.455 | 0.973 | |
| 木荷S. superba | 氮水平N levels | 0.694 | 0.722 | 0.972 | 0.002** | 0.887 | 0.556 | 0.648 |
| 施氮方式N application methods | 0.511 | 0.568 | 0.015* | 0.923 | 0.068 | 0.025* | 0.402 | |
| 氮水平*施氮方式 N levels * N application methods |
0.697 | 0.389 | 0.864 | 0.795 | 0.874 | 0.803 | 0.558 | |
| 树种间Interspecific comparison | 土壤施氮Soil application of N | 0.603 | 0.852 | 0.505 | 0.271 | 0.885 | 0.736 | 0.499 |
| 叶面施氮Foliage application of N | 0.415 | 0.492 | 0.239 | 0.389 | 0.813 | 0.286 | 0.663 | |
| 注:**,*分别表示相关性在0.01和0.05水平显著性(P < 0.01,P < 0.05)。Note:**, * showed significant correlation at level of 0.01 and 0.05 (P < 0.01, P < 0.05). | ||||||||
不同化合物对氮水平、施氮方式和树种间的响应不一致(表 2,图 3)。在土壤施氮处理下,与对照氮水平相比,添加氮显著促进木荷幼苗根系土壤甲醇、甲酰胺和丙胺、马尾松幼苗根系土壤乙烯酮的释放,降低(P < 0.05)木荷幼苗根系土壤乙醛和乙烯酮、马尾松幼苗根系土壤单萜烯的排放,但对马尾松和木荷幼苗根系土壤苯酚和二甲基二硫的通量无显著影响。而在叶面施氮下,添加氮促进(P < 0.05)马尾松幼苗根系土壤乙醛、乙烯酮和单萜烯、马尾松和木荷幼苗根系土壤甲酰胺和丙胺的释放,同时显著降低木荷幼苗根系土壤苯酚释放,对马尾松和木荷幼苗根系土壤甲醇和二甲基二硫的通量无显著影响。
3 讨论 3.1 土壤VOCs种类及源汇本研究所采集的马尾松和木荷幼苗根系土壤样品,共检测出100种不同化合物,包括含氧VOCs(OVOCs)、非甲烷碳氢(NMHCs)、含氮VOCs(NVOCs)、含硫VOCs(SVOCs)、芳香类VOCs(AVOCs)和含卤VOCs(HVOC),其中以OVOCs和NVOCs为主,占总VOCs的38.45%~70.91%(图 1和2)。乙醛、甲醇、乙烯酮、单萜烯、甲酰胺、丙胺、苯酚和二甲基二硫是马尾松和木荷幼苗根系土壤最主要的VOCs(图 3)。研究表明,土壤挥发性有机化合物种类繁多,以烷烃、烯烃、醛、酮、醚和有机酸等为主[3-4]。与本研究结果类似,GREENBERG et al[27]、SCHADW et al[16]发现,甲醇、乙醛、丙酮和乙酸是黄松种植地土壤最主要的挥发物。MANCUSO et al[28]研究结果表明3种不同类型土壤都会释放甲醇、乙醇、异戊二烯、环戊烷、苯甲醚、檀烯、乙酸异戊酯和单萜烯。KRAMSHØJ et al[29]也发现永冻土解冻后释放大量的甲醇和乙醇。不同土壤释放的VOCs种类不一样,可能是由于土壤植被种类和理化性质的不同,造成植物根系和土壤微生物活动出现差异。因此,在估算区域土壤VOCs贡献时应该考虑植被与土壤类型差异带来的影响。本研究中,马尾松和木荷盆栽根系土壤作为大多数VOCs的“源”(图 1和3),这可能是由于土壤真菌和细菌分解土壤有机质、植物根系分泌和合成代谢产物等过程会产生大量VOCs[5, 8, 12]。其次,本研究中土壤不是原位土壤,而是混匀土,破坏了土壤原有的物理结构,这会导致土壤体积膨胀、孔隙和水力学性质等发生改变[30],从而促进了土壤VOCs的释放。但是,土壤也是部分VOCs(如苯酚和二甲基二硫等)的“汇”(图 3),这可能是由于微生物利用VOCs作为碳源,导致土壤吸收和降解VOCs[17]。GAN et al[31]发现芸苔属植物释放的溴甲烷20%~35%会被土壤所吸收。土壤中的丁烷氧化菌会降解污染丁烷[32],苯酚降解菌则会促进土壤对苯酚消耗[33]。此外,YOO et al[34]则发现Pseudomonas sp.会利用土壤中某些VOCs(如α-蒎烯),同时VOCs也会刺激土壤中微生物种群,促进其他VOCs的释放。因此,土壤的源与汇是一个极其复杂的过程,不同类型土壤和微生物都会使VOCs“源”与“汇”发生差异。
3.2 添加氮对土壤VOCs的影响目前,关于氮沉降对土壤VOCs的研究相对匮乏。本研究中,两种氮增加方式均显著地促进马尾松和木荷幼苗根系土壤NVOCs的释放(表 2、图 2)。这可能是由于土壤VOCs的释放与土壤基质密切相关,土壤营养组分的微小变化(添加KNO3或者(NH4)2SO4)都可能影响VOCs的种类和数量[35]。添加氮会提高土壤铵态氮和硝态氮的含量[21],直接或者间接地改变土壤微生物群落结构[23],进而影响土壤挥发物的通量[2, 13]。SEEWALD et al[36]使用PTR-MS检测基质诱导堆肥后土壤VOCs的释放情况也发现,氮肥能够通过改变土壤微生物群落结构来促进土壤VOC的释放。另外,有研究表明,欧洲山杨异戊二烯释放速率与土壤有效氮含量呈正相关,当土壤养分充足时,异戊二烯释放速率大;反之,营养匮乏时异戊二烯释放量明显下降,这与异戊二烯合成酶的活性有关[37]。马尾松和木荷幼苗根系土壤NVOCs的通量与土壤铵态氮和硝态氮呈显著的正相关(P < 0.05,表 3),正好能解释部分施氮促进土壤NVOCs释放的结果。
| 树种Tree species | 指标Indexs | Total VOCs | OVOCs | NMHCs | NVOCs | SVOCs | AVOCs | HVOCs |
| 马尾松 P. massoniana |
pH值pH value | -0.296 | -0.249 | -0.233 | -0.460 | -0.150 | 0.037 | 0.092 |
| 有效磷Available phosphorus | 0.225 | 0.266 | 0.298 | 0.267 | 0.453 | -0.011 | -0.395 | |
| 有机质Organic matter | 0.160 | 0.224 | 0.103 | 0.208 | -0.291 | 0.126 | 0.028 | |
| 铵态氮Ammonium nitrogen | 0.469* | 0.500* | 0.292 | 0.528* | 0.136 | 0.119 | -0.068 | |
| 硝态氮Nitrate nitrogen | 0.477* | 0.519* | 0.346 | 0.601** | 0.220 | 0.389 | -0.384 | |
| 木荷 S. superba |
pH值pH value | -0.199 | -0.087 | -0.442 | -0.220 | -0.357 | 0.501* | 0.063 |
| 有效磷Available phosphorus | 0.505* | 0.412 | 0.450 | 0.329 | 0.391 | -0.299 | 0.069 | |
| 有机质Organic matter | 0.080 | -0.011 | -0.504* | 0.488 | -0.435 | 0.476* | 0.265 | |
| 铵态氮Ammonium nitrogen | 0.400 | 0.110 | -0.129 | 0.593** | -0.036 | 0.053 | 0.507* | |
| 硝态氮Nitrate nitrogen | 0.257 | -0.093 | 0.133 | 0.676** | 0.183 | -0.227 | 0.140 | |
| 注:**,*分别表示相关性在0.01和0.05水平显著性(P < 0.01,P < 0.05)。Note:**,* showed significant correlation at 0.01 and 0.05 (P < 0.01, P < 0.05),respectively. | ||||||||
不同施氮方式比较发现,只有在叶面施氮处理下,高氮显著地促进马尾松土壤总VOCs的释放,土壤施氮对马尾松和木荷总VOCs(OVOCs、NMHCs、SVOCs、AVOCs和HVOCs)的影响不大(图 1和图 2、表 2)。本研究中,添加氮降低土壤微生物(细菌、真菌和放线菌)生物量,改变微生物群落结构[21],从而影响土壤VOCs的释放(图 1、图 2和图 3)。叶面施氮处理下,植物叶片和枝条具有截留部分氮溶液的作用[19],都会使到达土壤中氮的形态和数量发生一定的变化[21],最终导致植物对叶面添加氮的吸收效率比土壤施氮处理高。此外,土壤酸碱度和微生物等更易受土壤施氮处理影响。因此,可利用性氮素增加可能会促进参与VOCs合成的微生物活性及增加植物细根生物量,从而导致叶面施氮对土壤VOCs释放的增加作用更明显。
不同化合物对添加氮的响应不一致(表 2,图 3)。总体而言,施氮促进木荷幼苗根系土壤甲酰胺和丙胺、马尾松幼苗根系土壤乙烯酮的释放,对马尾松和木荷幼苗根系土壤二甲基二硫的通量无影响。原因可能是由于施氮会影响不同类群土壤微生物,从而使土壤VOCs的产生与吸收发生变化[5, 13];其次,不同树种的微生物类群、根系分泌物的不同可能也是导致土壤VOCs响应差异的一个重要因素[24]。SMOLANDER et al[38]研究发现,单萜烯的浓度在针叶树种土壤中高于阔叶树种的土壤。LIN et al[17]则发现针叶树种根系VOCs(如单萜烯)含量较大,会加大对地表VOCs的贡献。由于土壤的复杂性,土壤VOCs对添加氮的具体影响机理还有待进一步研究。
4 结论通过不同的氮添加水平和方式对两种盆栽植物根系土壤挥发性气体通量的研究结果表明,马尾松和木荷盆栽根系土壤是大部分土壤VOCs的“源”,主要以释放含氧VOCs和含氮VOCs为主。两种施氮方式对木荷幼苗根系土壤总VOCs影响不显著,但马尾松叶面氮添加处理下根系土壤总VOCs释放量显著增加。因此,在研究土壤VOCs对氮添加的响应时,应综合考虑林冠模拟氮沉降的方式,研究不同树种的短期效应和长期效应,以更准确估算氮沉降对土壤VOCs的影响。
氮添加除显著促进马尾松和木荷幼苗根系土壤NVOCs的释放外,对其他类型VOCs影响不大,这与土壤铵态氮和硝态氮增加密切相关。氮添加对土壤不同VOCs释放的影响因氮水平、氮添加方式和树种而异。然而本研究只局限于关注盆栽幼苗根系土壤的VOCs动态,对于实际氮沉降影响下的土壤VOCs通量有待进一步研究。
| [1] |
SCHMIDT R, CORDOVEZ V, DE BOER W, et al. Volatile affairs in microbial interactions[J]. The ISME Journal, 2015, 9(11): 2 329-2 335. DOI:10.1038/ismej.2015.42 |
| [2] |
SCHULZ-BOHM K, MARTÍN-SÁNCHEZ L, GARBEVA P. Microbial volatiles:small molecules with an important role in Inftra- and Inter- kingdom interactions[J]. Frontiers in Microbiology, 2017(8): 2 484. |
| [3] |
AALTONEN H, AALTO J, KOLARI P, et al. Continuous VOC flux measurements on boreal forest floor[J]. Plant and Soil, 2013, 369(1/2): 241-256. |
| [4] |
PEÑUELAS J, ASENSIO D, THOLL D, et al. Biogenic volatile emissions from the soil[J]. Plant, Cell & Environment, 2014, 37(8): 1 866-1 891. |
| [5] |
MASSALHA H, KORENBLUM E, THOLL D, et al. Small molecules below-ground:the role of specialized metabolites in the rhizosphere[J]. The Plant Journal, 2017, 90(4): 788-807. DOI:10.1111/tpj.13543 |
| [6] |
OWEN S M, CLARK S, POMPE M, et al. Biogenic volatile organic compounds as potential carbon sources for microbial communities in soil from the rhizosphere of Populus tremula[J]. FEMS Microbiology Letters, 2007, 268(1): 34-39. DOI:10.1111/j.1574-6968.2006.00602.x |
| [7] |
PEÑUELAS J, STAUDT M. BVOCs and global change[J]. Trends in Plant Science, 2010, 15(3): 133-144. DOI:10.1016/j.tplants.2009.12.005 |
| [8] |
POTOSNAK M J. Including the interactive effect of elevated CO2 concentration and leaf temperature in global models of isoprene emission[J]. Plant, Cell & Environment, 2014, 37(8): 1 723-1 726. |
| [9] |
HAQUE M M, KAWAMURA K, KIM Y. Seasonal variations of biogenic secondary organic aerosol tracers in ambient aerosols from Alaska[J]. Atmospheric Environment, 2016(130): 95-104. |
| [10] |
SCOTT C E, RAP A, SPRACKLEN D V, et al. The direct and indirect radiative effects of biogenic secondary organic aerosol[J]. Atmospheric Chemistry and Physics, 2014, 14(1): 447-470. DOI:10.5194/acp-14-447-2014 |
| [11] |
SVENDSEN S H, PRIEMÉ A, VORISKOVA J, et al. Emissions of biogenic volatile organic compounds from arctic shrub litter are coupled with changes in the bacterial community composition[J]. Soil Biology and Biochemistry, 2018(120): 80-90. |
| [12] |
LEFF J W, FIERER N. Volatile organic compound (VOC)emissions from soil and litter samples[J]. Soil Biology and Biochemistry, 2008, 40(7): 1 629-1 636. DOI:10.1016/j.soilbio.2008.01.018 |
| [13] |
INSAM H, SEEWALD M S A. Volatile organic compounds (VOCs)in soils[J]. Biology and Fertility of Soils, 2010, 46(3): 199-213. DOI:10.1007/s00374-010-0442-3 |
| [14] |
XU C K, MO M H, ZHANG L M, et al. Soil volatile fungistasis and volatile fungistatic compounds[J]. Soil Biology and Biochemistry, 2004, 36(12): 1 997-2 004. DOI:10.1016/j.soilbio.2004.07.020 |
| [15] |
SCHADE G W, CUSTER T G. OVOC emissions from agricultural soil in northern Germany during the 2003 European heat wave[J]. Atmospheric Environment, 2004, 38(36): 6 105-6 114. DOI:10.1016/j.atmosenv.2004.08.017 |
| [16] |
SCHADE G W, GOLDSTEIN A H. Plant physiological influences on the fluxes of oxygenated volatile organic compounds from ponderosa pine trees[J]. Journal of Geophysical Research:Atmospheres, 2002, 107(D10): 4 082. |
| [17] |
LIN C, OWEN S M, PEÑUELAS J. Volatile organic compounds in the roots and rhizosphere of Pinus spp[J]. Soil Biology and Biochemistry, 2007, 39(4): 951-960. DOI:10.1016/j.soilbio.2006.11.007 |
| [18] |
LIU X J, ZHANG Y, HAN W X, et al. Enhanced nitrogen deposition over China[J]. Nature, 2013, 494(7 438): 459-462. |
| [19] |
WORTMAN E, TOMASZEWSKI T, WALDNER P, et al. Atmospheric nitrogen deposition and canopy retention influences on photosynthetic performance at two high nitrogen deposition Swiss forests[J]. Tellus Series B:Chemical and Physical Meteorology, 2012, 64(1): 17 216. DOI:10.3402/tellusb.v64i0.17216 |
| [20] |
李德军, 莫江明, 方运霆, 等. 氮沉降对森林植物的影响[J]. 生态学报, 2003, 23(9): 1 891-1 900. |
| [21] |
HUANG X R, LIU Y F, LI Y Y, et al. Foliage application of nitrogen has less influence on soil microbial biomass and community composition than soil application of nitrogen[J]. Journal of Soils and Sediments, 2019, 19(1): 221-231. DOI:10.1007/s11368-018-2027-y |
| [22] |
王晖, 莫江明, 鲁显楷, 等. 南亚热带森林土壤微生物量碳对氮沉降的响应[J]. 生态学报, 2008, 28(2): 470-478. DOI:10.3321/j.issn:1000-0933.2008.02.003 |
| [23] |
XIONG Q L, PAN K W, ZHANG L, et al. Warming and nitrogen deposition are interactive in shaping surface soil microbial communities near the alpine timberline zone on the eastern Qinghai-Tibet Plateau, southwestern China[J]. Applied Soil Ecology, 2016(101): 72-83. |
| [24] |
KESSELMEIER J, STAUDT M. Biogenic volatile organic compounds (VOC):an overview on emission, physiology and ecology[J]. Journal of Atmospheric Chemistry, 1999, 33(1): 23-88. DOI:10.1023/A:1006127516791 |
| [25] |
刘双娥, 李义勇, 方熊, 等. 不同氮添加量和添加方式对南亚热带4个主要树种幼苗生长的影响[J]. 植物生态学报, 2015, 39(10): 950-961. DOI:10.17521/cjpe.2015.0092 |
| [26] |
LIU J X, ZHANG D Q, ZHOU G Y, et al. CO2 enrichment increases nutrient leaching from model forest ecosystems in subtropical China[J]. Biogeosciences, 2008, 5(6): 1 783-1 795. DOI:10.5194/bg-5-1783-2008 |
| [27] |
GREENBERG J P, ASENSIO D, TURNIPSEED A, et al. Contribution of leaf and needle litter to whole ecosystem BVOC fluxes[J]. Atmospheric Environment, 2012(59): 302-311. |
| [28] |
MANCUSO S, TAITI C, BAZIHIZINA N, et al. Soil volatile analysis by proton transfer reaction-time of flight mass spectrometry (PTR-TOF-MS)[J]. Applied Soil Ecology, 2015(86): 182-191. |
| [29] |
KRAMSHØJ M, ALBERS C N, HOLST T, et al. Biogenic volatile release from permafrost thaw is determined by the soil microbial sink[J]. Nature Communications, 2018, 9(1): 3 412. DOI:10.1038/s41467-018-05824-y |
| [30] |
王卫华, 王全九, 樊军. 原状土与扰动土导气率、导水率与含水率的关系[J]. 农业工程学报, 2008, 24(8): 25-29. DOI:10.3321/j.issn:1002-6819.2008.08.006 |
| [31] |
GAN J, YATES S R, OHR H D, et al. Production of methyl bromide by terrestrial higher plants[J]. Geophysical Research Letters, 1998, 25(19): 3 595-3 598. DOI:10.1029/98GL52697 |
| [32] |
张莹.丁烷的协同氧化及丁烷氧化菌分子探针的初步研究[D].北京: 中国农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10019-1014221407.htm
|
| [33] |
王云端, 董小军, 王茜, 等. 自然土壤中苯酚降解菌的分离和系统发育分析[J]. 环境科学, 2007, 28(3): 623-626. DOI:10.3321/j.issn:0250-3301.2007.03.032 |
| [34] |
YOO S K, DAY D F. Bacterial metabolism of α- and β-pinene and related monoterpenes by Pseudomonas sp.strain PIN[J]. Process Biochemistry, 2002, 37(7): 739-745. DOI:10.1016/S0032-9592(01)00262-X |
| [35] |
WHEATLEY R E. The consequences of volatile organic compound mediated bacterial and fungal interactions[J]. Antonie van Leeuwenhoek, 2002, 81(1/2/3/4): 357-364. |
| [36] |
SEEWALD M S A, SINGER W, KNAPP B A, et al. Substrate-induced volatile organic compound emissions from compost-amended soils[J]. Biology and Fertility of Soils, 2010, 46(4): 371-382. DOI:10.1007/s00374-010-0445-0 |
| [37] |
SHARKEY T D, WIBERLEY A E, DONOHUE A R. Isoprene emission from plants:why and how[J]. Annals of Botany, 2008, 101(1): 5-18. |
| [38] |
SMOLANDER A, KETOLA R A, KOTIAHO T, et al. Volatile monoterpenes in soil atmosphere under birch and conifers:effects on soil N transformations[J]. Soil Biology and Biochemistry, 2006, 38(12): 3 436-3 442. DOI:10.1016/j.soilbio.2006.05.019 |

 2020, Vol. 40
2020, Vol. 40


