文章信息
- 陆芝, 林先云, 张晓阳, 江仲鹏, 宋漳, 冯丽贞
- LU Zhi, LIN Xianyun, ZHANG Xiaoyang, JIANG Zhongpeng, SONG Zhang, FENG Lizhen
- 刨花楠溃疡病菌生物学特性及其防治药剂筛选
- Biological characteristics of pathogen of Machilus pauhoi canker and the selection of fungicides
- 森林与环境学报,2019, 39(4): 438-443.
- Journal of Forest and Environment,2019, 39(4): 438-443.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2019.04.017
-
文章历史
- 收稿日期: 2019-03-01
- 修回日期: 2019-04-18
2. 顺昌县林业局, 福建 顺昌 353200
2. Shunchang County Forestry Bureau, Shunchang, Fujian 353200, China
刨花楠(Machilus pauhoi Kanehira)属樟科润楠属植物,该属植物全世界约100种,而我国有82种4变种,是我国传统珍贵树种,也是全国重要的木材战略储备树种,主要分布于西南和南部地区[1-3]。润楠属植物具有广泛的利用价值,该属许多植物的木材浸水后可生产粘合剂;其种子是制造润滑油、蜡烛和肥皂的优良原料;一些种类的树皮可作饮水净化剂、褐色染料、薰香调合剂等使用;枝、叶和果也是芳香油和香料提取的良好材料, 可供化妆品的研发和生产[4-8]。鉴于其巨大的经济价值和广泛的用途,近年来各种楠木类树种在全国各地发展迅猛,在福建省也广为种植。
近年来,在福建顺昌由于刨花楠大面积集中连片种植,林分抗逆性差,造成溃疡病大量发生,受害林分感病株率达100%。该病害主要侵染刨花楠枝丫,尤其是枝丫分叉处最易感病,病斑颜色呈暗褐色至黑色,韧皮部坏死,病斑形状不规则形,随着病斑的扩展,病斑包围枝干致枝干上部枝叶慢慢脱水干枯,最后导致整株树木死亡[9],造成巨大经济损失,严重制约楠木产业的可持续发展。目前,国内外报道的楠木类病害主要为小孢拟盘多毛孢(Pestalotiopsis microspora)引起的闽楠(Phoebe bournei Yang)、石楠(Photinia serrulata Lindl)、红叶石楠(Photinia fraseri Dress)等叶部病害[10-12],而楠木枝干类病害未见报道,有关刨花楠溃疡病菌的生物学特性研究也未见报道。本研究通过对刨花楠溃疡病病原菌展开生物学特性测定以及化学浓药筛选,旨在掌握该病原菌的生物学特性,并筛选出有效的防治药剂,为刨花楠溃疡病的防治提供科学依据。
1 材料与方法 1.1 供试菌株供试菌株为刨花楠溃疡病致病菌株SC-8(Lasiodiplodia margaritacea)[9],分离纯化自福建顺昌曲村自然发病的刨花楠溃疡病植株。
1.2 供试培养基供试培养基主要有:马铃薯葡萄糖琼脂培养基(PDA)、麦芽糖琼脂培养基、淀粉琼脂培养基、燕麦片琼脂培养基、马铃薯蔗糖琼脂培养基(PSA)、水琼脂培养基(WA)、查氏培养基(Czapek)、植物(刨花楠枝干)煎汁琼脂培养基、Bilay’s培养基。各培养基制备参照方中达[13]的方法。
1.3 菌株SC-8生物学特性研究 1.3.1 不同培养基对菌落生长的影响选用1.2中的9种培养基,用直径0.6 cm的打孔器打取菌饼,分别接种于不同培养基平板中央,置28 ℃下培养36 h,用十字交叉法测量菌落直径,每处理重复3次。
1.3.2 不同碳氮源对菌丝生长的影响采用真菌生理培养基为基本培养基,分别以葡萄糖、可溶性淀粉、麦芽糖、蔗糖、乳糖和果糖作为碳源; 分别以硝酸铵、氯化铵、硝酸钠、酵母膏、磷酸二氢铵、蛋白胨、硝酸钙、牛肉浸膏为氮源。用直径0.6 cm的打孔器打取菌饼,分别接种于不同氮源处理的培养基平板中央,每处理重复3次,28 ℃培养36 h,用十字交叉法测量菌落直径。
1.3.3 温度对菌丝生长的影响设置5、10、15、20、25、28、30、35、40 ℃共9个不同温度梯度,用直径0.6 cm的打孔器打取菌饼,接种于PDA平板中央,分别置于上述不同温度培养箱中培养24 h,用十字交叉法测量菌落直径,每处理重复3次。
1.3.4 pH值对菌丝生长的影响用1 mol·L-1HCl和1 mol·L-1NaOH溶液调节PDA培养基pH值至4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0和13.0共10个pH值,用直径0.6 cm的打孔器打取菌饼,分别接种于不同pH值的培养基平板中央,28 ℃培养24 h,用十字交叉法测量菌落直径,每处理重复3次。
1.3.5 光照对菌丝生长的影响用光照培养箱分别设置全光照、12 h光暗交替和全黑暗3种光照处理,用直径0.6 cm的打孔器打取菌饼,分别接种于PDA培养基平板中央,28 ℃培养24 h,用十字交叉法测量菌落直径,每处理重复3次。
1.3.6 菌丝致死温度测定取直径0.6 cm菌饼,放入加入无菌水的2 mL的离心管中,置于水浴锅中水浴10 min,再接种到PDA平板中,28 ℃培养24 h,观察菌丝生长情况,以“+”和“-”分别表示菌丝是否生长。致死温度设置35~60 ℃间6个温度梯度,分别为35、40、45、50、55、60 ℃,试验设置3个重复。
1.4 药剂室内筛选 1.4.1 供试药剂10%苯醚·甲环唑水分散粒剂[先正达(苏州)作物保护有限公司]、45%吡醚·甲硫灵悬浮剂[江西禾益化工股份有限公司]、75%百菌清可湿性粉剂[先正达(苏州)作物保护有限公司]、400 g·L-1氟硅唑乳油[广东茂名绿银农化有限公司]、500 g·L-1异菌脲(扑海因)悬浮剂[苏州富美实植物保护剂有限公司]、430 g·L-1戊唑醇悬浮剂[拜耳股份公司]、62.5 g·L-1精甲·咯菌腈悬浮种衣剂[先正达南通作物保护有限公司]、80%代森锰锌可湿性粉剂[陶氏益农农业科技(中国)有限公司]、50%腐霉利可湿性粉剂[住友化学(上海)有限公司]、250 g·L-1嘧菌酯悬浮剂[先正达南通作物保护有限公司]、25%苯甲·咪鲜胺悬浮剂[山东潍坊双星农药有限公司]、90%多菌灵水分散粒剂[上海禾本药业股份有限公司]。
1.4.2 药剂室内毒力方法采用菌丝生长速率法[11-12],将供试药剂设置成5个浓度,制成含药平板,病菌培养3 d后在菌落缘取直径0.6 cm菌块,移至含药平板上,置于28 ℃恒温箱中培养30 h后,测量菌落大小,计算抑菌率[抑菌率/%=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100%],利用SPSS 19.0统计软件求出毒力回归方程、相关系数和EC50。每处理设3个重复,以不含药平板为对照。
1.5 数据处理软件数据取多次重复结果的平均值,通过SPSS 19.0对不同条件下菌株SC-8的菌落生长影响进行单因素方差分析,并用Duncan多重比较检验其相关性。本研究所有数据统计分析在Microsoft Excel 2017和SPSS19.0中完成,使用Origin 9.0进行图形绘制。
2 结果与分析 2.1 不同培养基对菌丝生长的影响SC-8菌株在各供试的培养基上均能够生长(表 1),在不同培养基上菌丝生长速率差异显著(P < 0.05)。在PAD培养基上生长最好,菌丝白色且浓密,菌落边缘规则;其次是PSA培养基,其余几种培养均不利于SC-8菌株生长;在Bilay’s和植物煎汁培养基上菌丝体稀疏且菌落边缘不规则;在麦芽糖和WA培养基上长势最差,培养基表面只有一层轻薄的菌丝层,菌落颜色和培养基颜色一样,呈透明色,肉眼几乎难以观察到菌丝体。
| 培养基 Culture medium |
菌落直径 Colony diameter/cm |
| 麦芽糖琼脂培养基Maltose agar medium | 5.93±0.21c |
| 淀粉琼脂培养基Starch agar medium | 5.08±0.04d |
| 燕麦琼脂培养基Oatmeal agar medium | 5.01±0.16d |
| PDA培养基Potato dextrose agar medium | 8.57±0.23a |
| PSA培养基Potato sucrose agar medium | 7.70±0.15b |
| Bilay’s培养基Bilay’s agar medium | 5.72±0.12c |
| WA培养基Water agar medium | 4.49±0.25e |
| 查彼培养基Czapek agar medium | 5.84±0.39c |
| 植物煎汁培养基Plant decoction agar medium | 5.73±0.33c |
| 注:标注不同字母的数值表示差异显著, P < 0.05。Note: values marked with different letters shows significant differences, P < 0.05. | |
不同碳、氮源对病原菌菌丝生长的影响差异显著(P < 0.05),结果见表 2、表 3。以果糖为碳源时,病原菌生长最快,培养36 h后,菌落直径达8.36 cm,其次是葡萄糖和蔗糖,在可溶性淀粉为碳源的培养基上生长最差,菌落直径为6.58 cm。以硝酸铵为氮源时,病原菌生长最快,培养36 h后,菌落直径达到8.64 cm,其次为硝酸钠、硝酸钙和氯化铵,菌落直径分别为7.64、7.38、7.37 cm,以磷酸二氢铵为氮源时菌落生长最慢,培养36 h菌落直径为6.30 cm。
| 碳源Carbon | 菌落直径Colony diameter/cm |
| 葡萄糖Dextrose | 7.99±0.24b |
| 麦芽糖Malt dust | 7.28±0.21d |
| 可溶性淀粉Amylogen | 6.58±0.51e |
| 乳糖Lactobiose | 7.59±0.31cd |
| 果糖Fructose | 8.36±0.24a |
| 蔗糖Saccharose | 7.73±0.16bc |
| 注:标注不同字母的数值表示差异显著, P < 0.05。Note: values marked with different letters shows significant differences, P < 0.05. | |
| 氮源Nitrogen | 菌落直径Colony diameter/cm |
| 硝酸钠Sodium nitrate | 7.64±0.11b |
| 氯化铵Ammonium chloride | 7.37±0.21b |
| 硝酸铵Ammonium nitrate | 8.64±0.07a |
| 酵母膏Yeast extract | 6.71±0.14c |
| 硝酸钙Calcium nitrate | 7.38±0.10b |
| 蛋白胨Peptone | 6.54±0.44cd |
| 牛肉浸膏Beef extract | 6.44±0.43cd |
| 磷酸二氢铵Ammonium dihydrogen phosphate | 6.30±0.14d |
| 注:标注不同字母的数值表示差异显著, P < 0.05。Note: values marked with different letters shows significant differences, P < 0.05. | |
由图 1可见,不同温度条件对病菌菌丝生长影响显著(P < 0.05)。病原菌在5 ℃条件下不能生长,在温度10~40 ℃条件下均可生长,最适生长温度为30 ℃,培养24 h菌落直径为6.94 cm,菌落在10、15、40 ℃条件下生长缓慢,说明15 ℃以下、40 ℃以上温度均不利于病原菌生长。
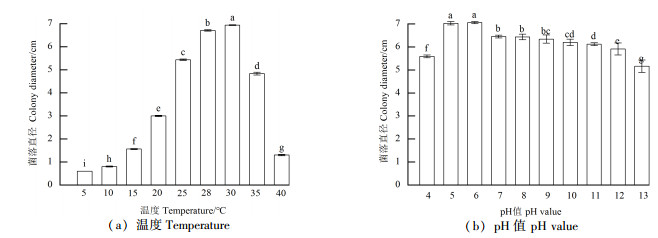
|
注:不同字母表示数值间差异显著,P < 0.05。 Note: values marked with different letters indicates significant differences, P < 0.05. 图 1 温度、pH值对刨花楠溃疡病菌菌落生长的影响 Fig. 1 Effect of temperature, pH value on mycelial growth of L. margaritacea |
病原菌在不同pH值培养基上的菌落直径测定结果如图 2所示。病菌在pH值为4~13范围内均可生长,最适生长的pH值范围是5~6,培养24 h后菌落直径分别为7.03和7.06 cm,在pH值为8~13时,随着pH值的增大,病原菌直径呈下降趋势,说明该病原菌不适宜在碱性环境条件下生长。
2.5 光照对菌丝生长的影响光照条件对病原菌生长的影响结果如表 4所示,24 h全光照条件下菌落生长相对较快,菌落直径为6.69 cm。24 h全黑暗和12 h光暗交替条件下病原菌菌落直径无显著差异(P < 0.05),菌落直径分别为6.56、6.52 cm。
| 处理Treatment | 菌落直径Colony diameter/cm |
| 全光照Full illumination | 6.69±0.05a |
| 全黑暗Total darkness | 6.56±0.07b |
| 光暗交替Alternate light and dark | 6.52±0.11b |
| 注:不同字母标注表示数值间差异显著,P < 0.05。Note: valuesmarked with different letters indicates significant differences,P < 0.05. | |
将直径0.6 cm的病菌菌饼在40~65 ℃水浴中处理10 min后将其接种到PDA平板上,结果显示(表 5),50 ℃以上菌丝均不能生长,因此菌株SC-8的菌丝致死温度为50 ℃、10 min。
| 温度 Temperature/℃ |
测定结果 Result |
| 40 | + |
| 45 | + |
| 50 | - |
| 55 | - |
| 60 | - |
| 65 | - |
12种杀菌剂对菌株SC-8的EC50值范围在0.01~1 239.88 mg·L-1(表 6),除吡醚·甲硫灵和代森锰锌的相关系数分别为0.82和0.76以外,其余的10种药剂相关系数均在0.9以上。毒力较好的前3种药剂是氟硅唑、咯菌腈和多菌灵,EC50值分别为0.01、0.14、0.25 mg·L-1,异菌脲和百菌清对菌株SC-8的毒力相差不大,毒力相对比较低,毒力最低的是代森猛锌,EC50值为1 239.88 mg·L-1,其相关系数也最低。
| 杀菌剂 Fungicide |
毒力回归方程 Toxic regressionequation |
相关系数 R2 |
EC50/ (mg·L-1) |
| 氟硅唑Flusilazole | Y=0.759+0.376X | 0.97 | 0.01 |
| 咯菌腈Fludioxonil | Y=1.720+1.994X | 0.93 | 0.14 |
| 多菌灵Carbendazim | Y=3.278+3.522X | 0.99 | 0.25 |
| 戊唑醇Tebuconazole | Y=0.152+0.666X | 0.93 | 0.59 |
| 腐霉利Procymidone | Y=-1.985+2.834X | 0.98 | 2.51 |
| 嘧菌酯Azoxystrobin | Y=-0.363+0.323X | 0.91 | 13.31 |
| 异菌脲Iprodione | Y=-5.987+2.919X | 0.99 | 112.47 |
| 百菌清Chlorothalonil | Y=-2.643+1.203X | 0.93 | 118.04 |
| 代森锰锌Mancozeb | Y=-2.172+0.681X | 0.76 | 1 239.88 |
| 苯甲·咪鲜胺Benzoyl prochloraz | Y=-0.309+0.618X | 0.95 | 0.79 |
| 吡醚·甲硫灵Pyrazole methionine | Y=-0.337+1.043X | 0.82 | 0.95 |
| 苯醚·甲环唑Difenoconazole | Y=-0.588+0.568X | 0.95 | 1.09 |
葡萄座腔菌是一种重要的病原体,它能侵染多种木本植物,可导致果实腐烂病、叶斑病、茎和枝溃烂病、枯萎病等,在某些情况下甚至导致树木死亡[14-15]。在亚洲、欧洲、美洲、大洋洲和非洲都有报道它对杨树、苹果、梨、桃子、桉树和橄榄树具有传染性[16-17]。根据培养特征和系统发育资料描述,毛色二孢属(Lasiodiplodia)隶属真菌界子囊菌门座囊菌纲葡萄座腔菌目葡萄座腔菌科,有110种[18-20]。毛色二孢属(Lasiodiplodia)能够引起多种植物病害,如由可可毛色二孢(L. theobromae)引起的桉树枝枯病[21]、南洋楹溃疡病[22],由假可可毛色二孢(L. pseudotheobromae)引起的葡萄枯萎病[23],但由L. margaritacea引起的刨花楠溃疡病在国内外未见报道。
本文研究了不同培养条件对刨花楠溃疡病菌(L. margaritacea)SC-8菌株生长的影响,研究结果表明,菌株SC-8在供试的10种培养基上均能生长,但在PDA、PSA两种培养基上生长最好,菌丝生长旺盛。不同碳氮源对病菌生长影响试验表明,最适病原菌生长的碳源和氮源分别是果糖和硝酸钾。该菌在温度为10~40 ℃的条件下均能生长,30 ℃时菌落生长最快,30 h左右就能长满0.9 cm的培养皿,这与PAVLIC et al[24]的研究结果一致,说明该病原菌嗜高温,福建顺昌属于中亚热带海洋性季风气候,夏季时间长,天气炎热潮湿,给病原菌提供了一个适宜的生存发展环境。毛色二孢属生长的最佳pH值通常在5~8,供试菌株SC-8生长的适宜pH值为5~6;菌丝的致死温度为50 ℃;菌落生长对光照的要求不严格。
12种药剂试验表明,杀菌剂氟硅唑、咯菌腈、多菌灵、戊唑醇、苯甲·咪鲜胺等对刨花楠溃疡病病菌的毒力相对较高,氟硅唑、戊唑醇属于三唑类杀菌剂,具有保护和治疗作用的内吸性,可被植物的根、茎、叶所吸收,在植物体内能快速向上传导。咪鲜胺是咪唑类广谱杀菌剂,其系抑制麦角甾醇生物合成,不具内吸性,但具有一定的传导性,对多种植物子囊菌和半知菌病害有显著防效[25-26]。咯菌腈属于苯基吡咯类、非内吸性的广谱杀菌剂,作用机理是通过抑制葡萄糖磷酰化有关的转移,并抑制真菌菌丝体的生长,最终导致病菌死亡,由于独特的作用机理,使其具有较低的风险性和毒性。咯菌腈作为一种新的降低风险的化合物,已被登记用于采后处理包括柑橘在内的几种水果商品,对可可毛色二孢(L. theobromae)引起的柑橘类水果采后腐烂有较好的防治效果。对毛色二孢属引起的水果茎端腐病和绿色霉菌的防治,咯菌腈也是一种有效的方法。研究表明,该药剂与现有的杀菌剂无交互抗性,可与其它药剂复配使用[27-28]。多菌灵为苯并咪唑类杀菌剂,其作用机制是与病原菌的β-微管蛋白结合,阻止β-微管蛋白与α-微管蛋白组装成微管或使已组装的微管解聚,导致纺锤体不能形成,进而阻止真菌细胞的有丝分裂,起到杀菌作用[29-30]。试验还发现,异菌脲、百菌清、代森锰锌等药剂对病菌抑制作用差,由此可见,杀菌剂的作用机理不同,对病原菌的毒力也不同,同类的杀菌剂对刨花楠溃疡病病菌的毒力也不同。根据室内毒力测定结果,氟硅唑、咯菌腈、多菌灵、戊唑醇等药剂可用于田间防治,但在田间防治时,对于不同药剂的复配使用及各药剂适期、剂量等还需进一步研究。
| [1] |
李树刚, 韦发南. 楠木名称考订[J]. 广西植物, 1988, 8(4): 297-300. |
| [2] |
中国科学院中国植物志编辑委员会. 中国植物志:第31卷[M]. 北京: 科学出版社, 1982: 7-43.
|
| [3] |
钟义, 夏念和. 国产润楠属植物的叶表皮特征及其系统学意义[J]. 热带亚热带植物学报, 2010, 18(2): 109-121. DOI:10.3969/j.issn.1005-3395.2010.02.001 |
| [4] |
中国树木志编辑委员会. 中国树木志:第1卷[M]. 北京: 中国林业出版社, 1983: 225-226.
|
| [5] |
陈瑞英, 郭晶贞, 祝田心. 小果润楠和闽楠木材的构造特征[J]. 森林与环境学报, 2015, 35(4): 358-363. |
| [6] |
黄承石, 潘珈瑶, 王东, 等. 5种润楠属植物叶表皮结构和滞尘能力研究[J]. 河南科技大学学报(自然科学版), 2019, 40(2): 76-79. |
| [7] |
阳树松. 刨花润楠的优良特性及栽培技术[J]. 绿色科技, 2018(7): 90-91. |
| [8] |
郭晓敏, 牛德奎, 孙科辉. 优良阔叶树种:刨花楠木材构造性质及用途的研究[J]. 江西农业大学学报, 1999(3): 391-394. |
| [9] |
ZHANG Q H, LU Z, DING Y, et al. Canker on Machilus pauhoi caused by Lasiodiplodia margaritacea in the Fujian Province of China[J]. Plant Disease, 2019. DOI:10.1094/PDIS-10-18-1759-PDN |
| [10] |
陈全助, 金亚杰, 郭朦朦, 等. 闽楠叶斑病病原鉴定及其生物学特性测定[J]. 植物病理学报, 2018, 48(3): 313-323. |
| [11] |
于静亚, 董立坤, 王志华, 等. 石楠叶斑病病原鉴定及对药物敏感性测定[J]. 植物病理学报, 2017, 47(4): 440-447. |
| [12] |
管斌, 徐超, 张红岩, 等. 红叶石楠叶斑病病原菌分离鉴定及致病性测定研究[J]. 西部林业科学, 2013, 42(2): 56-61. DOI:10.3969/j.issn.1672-8246.2013.02.010 |
| [13] |
方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998: 46-50.
|
| [14] |
SLIPPERS B, SMIT W A, CROUS P W, et al. Taxonomy, phylogeny and identification of Botryosphaeriaceae associated with pome and stone fruit trees in South Africa and other regions of the world[J]. Plant Pathology, 2007, 56(1): 128-139. |
| [15] |
LIU H X, LI X D, ZHU X P, et al. First report of pomegranate stem scab caused by Botryosphaeria dothidea in China[J]. Plant Pathology, 2009, 58(2): 400. |
| [16] |
PHILLIPS A J L, RUMBOS I C, ALVES A, et al. Morphology and phylogeny of Botryosphaeria dothidea causing fruit rot of olives[J]. Mycopathologia, 2005, 159(3): 433-439. DOI:10.1007/s11046-005-0256-2 |
| [17] |
PITT W M, HUANG R, STEEL C C, et al. Identification, distribution and current taxonomy of Botryosphaeriaceae species associated with grapevine decline in New South Wales and South Australia[J]. Australian Journal of Grape and Wine Research, 2010, 16(1): 258-271. DOI:10.1111/ajgw.2010.16.issue-1 |
| [18] |
RODAS C A, SLIPPERS B, GRYZENHOUT M, et al. Botryosphaeriaceae associated with Eucalyptus canker diseases in Colombia[J]. Forest Pathology, 2009, 9(2): 110-123. |
| [19] |
TANG W, DING Z, ZHOU Z Q, et al. Phylogenetic and pathogenic analyses show that the causal agent of apple ring rot in China is Botryosphaeria dothidea[J]. Plant Disease, 2012, 96(4): 486-496. DOI:10.1094/PDIS-08-11-0635 |
| [20] |
SLIPPERS B, BOISSIN E, PHILLIPS A J L, et al. Phylogenetic lineages in the Botryosphaeriales:a systematic and evolutionary framework[J]. Studies in Mycology, 2013, 76: 31-49. DOI:10.3114/sim0020 |
| [21] |
廖旺姣, 朱英芝, 邹东霞, 等. 桉树枝枯病菌生物学特性[J]. 广西林业科学, 2016, 45(4): 369-372. DOI:10.3969/j.issn.1006-1126.2016.04.005 |
| [22] |
王伟, 王新荣, 曾炳山, 等. 南洋楹溃疡病病原菌生物学特性研究[J]. 中国森林病虫, 2017, 36(6): 14-17, 32. DOI:10.3969/j.issn.1671-0886.2017.06.004 |
| [23] |
明德南. 引起墨西哥葡萄藤溃疡病的可可毛色二孢和色二孢属真菌的鉴定和致病性[J]. 世界热带农业信息, 2009(2): 27-28. |
| [24] |
PAVLIC D, WINGFIELD M J, BARBER P, et al. Seven new species of the Botryosphaeriaceae from baobab and other native trees in western Australia[J]. Mycologia, 2008, 100(6): 851-866. DOI:10.3852/08-020 |
| [25] |
陈文, 黄海, 谭清群, 等. 13种杀菌剂对杧果炭疽病菌的室内毒力测定及田间防效[J]. 中国南方果树, 2018, 47(3): 70-72, 76. |
| [26] |
邹东霞, 黄乃秀, 廖旺姣, 等. 八种杀菌剂对八角炭疽病菌的室内毒力[J]. 中国森林病虫, 2018, 37(2): 36-38. DOI:10.3969/j.issn.1671-0886.2018.02.009 |
| [27] |
PITT W M, SOSNOWSKI M R, TAYLOR A, et al. Management of Botryosphaeria canker of grapevines[J]. Australian Viticulture, 2010, 14(2): 52-56. |
| [28] |
ZHANG J X. The potential of a new fungicide fludioxonil for stem-end rot and green mold control on Florida citrus fruit[J]. Postharvest Biology and Technology, 2007, 46(3): 262-270. DOI:10.1016/j.postharvbio.2007.05.016 |
| [29] |
ISHⅡ H, HOLLOMON D W. Fungicide resistance in plant pathogens:principles and a guide to practical management[M]. Tokyo: Springer, 2015: 233-255.
|
| [30] |
纪兆林, 刘娟, 童蕴慧, 等. 不同杀菌剂对桃流胶病的毒力测定[J]. 中国南方果树, 2012, 41(4): 39-41, 46. |

 2019, Vol. 39
2019, Vol. 39


