文章信息
- 马晓华, 张旭乐, 钱仁卷, 郑坚, 陈义增, 张庆良
- MA Xiaohua, ZHANG Xule, QIAN Renjuan, ZHENG Jian, CHEN Yizeng, ZHANG Qingliang
- 镉与铜胁迫下无柄小叶榕的生理响应
- Physiological response of Ficus concinna var. subsessilis under heavy metal cadmium-copper stress
- 森林与环境学报,2019, 39(2): 194-200.
- Journal of Forest and Environment,2019, 39(2): 194-200.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2019.02.012
-
文章历史
- 收稿日期: 2018-05-09
- 修回日期: 2018-08-06
随着全球经济的发展,城市的环境污染问题日益凸显。环境污染主要来自于工业生产,工业生产中大量的污水和废弃物等被排放到附近水域和郊区土地,城市土壤的重金属污染日益严重。土壤重金属污染对人们的生活用水、农作物及园林景观植物的生长产生了很大的影响[1]。镉(Cd)因其在土壤中的高度移动性和对植物的高度毒害性,被视为重金属中最具有危害性的污染元素之一[2-3]。Cd影响植物细胞分裂、光合作用、细胞结构及酶活性。铜(Cu)也是土壤重金属污染的重要元素之一,研究表明,Cu影响植物的生长发育和代谢,导致植物代谢紊乱,生长发育缓慢,甚至死亡[4]。因此,重金属污染已严重威胁到城市的生态环境、食品卫生安全及人类的身心健康。土壤重金属污染修复问题已迫在眉睫,目前,为避免二次污染及土壤板结等问题,以植物为主的环境修复技术因其低成本,且利于城市景观绿化等优点得到广泛应用。
无柄小叶榕(Ficus concinna var. subsessilis Corner)是小叶榕[Ficus concinna (Miq.) Miq]的一个变种,是热带、亚热带地区特有的景观和生态树种[5]。因其独特的园林景观和耐低温、耐盐碱的特征成为浙江、福建、广东、广西等省(自治区)生态环境建设和沿海泥质海岸防护林营造的重要树种之一[6]。目前,我国Cd污染土壤的面积已达2×105 km2,占总耕地面积的1/6,涉及11个省市的25个地区[7]。2005—2013年,环境保护部会同国土资源部开展的首次全国土壤污染状况调查也显示,在无机污染物中,Cu的点位超标率达2. 1%,华南地区Cu含量高于华北地区,特别是矿脉地区[8]。由于无柄小叶榕耐盐碱的特性,其在盐碱地的绿化方面应用较为广泛,学者们研究浙南盐碱地适生树种时发现,无柄小叶榕在pH值为8. 01,含盐量0. 37%的重度盐碱条件下,成活率达100%[9], 无柄小叶榕对Cd、Cu具有一定的吸附能力[10],因此无柄小叶榕对重金属土壤的修复力引起科研工作者的广泛关注。如果能够在重金属污染土壤上种植该景观植物,既可缓解我国工业发展所面临的生态环境污染压力,又可为治理和合理利用重金属污染土壤开辟一条新的途径,还可以改善生态环境。因此,通过盆栽试验,对不同浓度Cd和Cu处理下无柄小叶榕生理特性进行研究,旨在探索重金属胁迫下无柄小叶榕的生理生态响应及耐性机理,探索土壤重金属污染治理的科学途径,也为污染区的进一步治理提供科学指导。
1 材料与方法 1.1 试验材料试验材料为生长状况良好且长势一致的2年生无柄小叶榕,苗高(120±0.5) cm,地径(9.5±0.1) mm,2016年5—9月,在浙江省亚热带作物研究所温室内采用土培盆栽的方法进行试验,用规格相同的硬质营养钵(盆口直径23. 5 cm,高25 cm,盆底4个透水孔),盆底放置白色塑料托盘,保证每盆含土(3.50±0.2) kg,土壤pH值6. 8、成分为黄泥土(含2.92 g · kg-1有机质)。试验开始处理之前做好日常的苗木养护,保证土壤水分充足,昼夜温度自然过渡。
1.2 试验设计2016年5月中旬,以清水为对照,在无柄小叶榕盆栽土壤中施加不同浓度Cd2+与Cu2+溶液,同时在土壤中添加表面活性剂鼠李糖脂。挑选生长健壮且外形较一致的无柄小叶榕,根据参考文献[11]设置不同浓度重金属胁迫处理。Cd2+、Cu2+分别以CdCl2 · 2. 5H2O和CuSO4 · 5H2O (分析纯)分别配成一定浓度的母液,以干土质量计算纯Cd2+、Cu2+含量,以盐溶液加入各盆,然后对照(CK)处理加不含Cd2+、Cu2+的等量去离子水。试验中完全随机摆放各盆,共设置16个处理(每个处理3次重复,每个重复5株幼苗),土壤重金属含量如表 1所示。
| 处理编号 Treatment number |
重金属含量Contents of heavy metals/(mg·kg-1) | |
| Cu | Cd | |
| CK | 0 | 0 |
| A1 | 0 | 5 |
| A2 | 0 | 15 |
| A3 | 0 | 25 |
| A4 | 0 | 35 |
| A5 | 0 | 50 |
| B1 | 50 | 0 |
| B2 | 100 | 0 |
| B3 | 200 | 0 |
| B4 | 300 | 0 |
| B5 | 400 | 0 |
| C1 | 50 | 5 |
| C2 | 100 | 15 |
| C3 | 200 | 25 |
| C4 | 300 | 35 |
| C5 | 400 | 50 |
采用分光光度计(UV-2550型,日本)测定叶绿素a、叶绿素b和类胡萝卜素的含量[12];采用便携式光合测定仪(Li-6400 XT型,美国)测定净光合速率(net photosynthetic rate,Pn)、气孔导度(stomatal conductance,Gs)、胞间CO2浓度(intercellular CO2 concentration,Ci) [13]和蒸腾系数(transpiration coefficient, Tr) 4个光合参数;氮蓝四唑(nitroblue tetrazolium,NBT)法测定超氧化物歧化酶(superoxide dismutase,SOD)活性;紫外吸收法测定过氧化氢酶(catalase,CAT)活性;愈创木酚法测定过氧化物酶(peroxidase,POD)活性[14]。采用参考文献[15]的方法测定相对电导率(relative electrical conductivity,REC);硫代巴比妥酸(thiobarbital,TBA)法测定丙二醛(malonaldehyde,MDA)含量[16];紫外吸收法分别测定超氧阴离子(O2.-)产生速率和过氧化氢(H2O2)含量[17]。
1.4 数据处理采用SPSS 11. 5软件进行方差分析,用Duncan新复极差法进行方差分析检验差异显著性(n=5)。
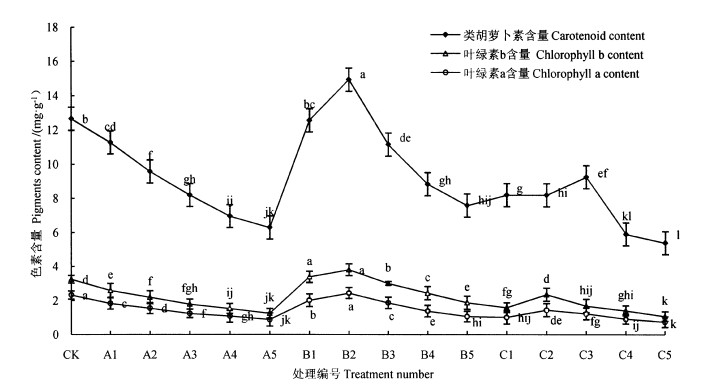
2 结果与分析 2.1 镉与铜胁迫对叶绿素和类胡萝卜素含量的影响不同重金属含量对无柄小叶榕叶片叶绿素a、叶绿素b和类胡萝卜素含量的影响如图 1所示。土壤中Cd、Cu的浓度显著影响了无柄小叶榕叶片叶绿素与类胡萝卜素含量,与对照组相比,随着Cd2+浓度升高,叶绿素a、叶绿素b与类胡萝卜素含量逐渐降低,土壤中Cd2+浓度最高的A5组中叶绿素a、叶绿素b、类胡萝卜素含量分别是对照组的35. 2%、40. 2%和53. 5%。随着土壤中Cu2+浓度升高,叶绿素a、叶绿素b与类胡萝卜素含量先增加后减少,在土壤中Cu2+浓度最高的B5组中叶绿素a、叶绿素b与类胡萝卜素的含量分别是对照组的29. 9%、88. 1%和60. 6%。而随着土壤中Cd2+-Cu2+含量的增加,叶绿素a、叶绿素b与类胡萝卜素的含量出现了显著降低的现象。
|
注:不同小写字母表示根据Duncan检验,在0. 05水平上的差异显著性,相同字母表示差异不显著。 Note: the different lowercase letters indicate the significant difference at the 0. 05 level according to the Duncan test. The same letter indicates that the difference is not significant. 图 1 无柄小叶榕叶绿素和类胡萝卜素含量的变化 Fig. 1 Variation in chlorophyll and carotenoid content of F. concinna var. subsessilis |
不同重金属含量对无柄小叶榕Pn、Gs、Tr和Ci的影响如表 2所示。土壤中Cd、Cu的浓度显著地影响了无柄小叶榕的光合作用。相比对照组,随着Cd2+浓度升高,无柄小叶榕Pn、Gs和Tr逐渐降低,土壤中Cd2+浓度最高的A5组中Pn、Gs和Tr分别是对照组的50. 3%、45. 9%和48. 9%。Ci随着Cd2+浓度升高先降低后升高。随着Cu2+浓度升高,无柄小叶榕Gs和Tr逐渐降低,Pn先升高后降低,Cu2+浓度最低的B1组中Pn是对照组的107%,Cu2+浓度最高的B5组净光合速率为对照组的60. 1%。而随着土壤中Cd2+-Cu2+含量的增加,Pn、Gs、Tr显著降低,其中Cd2+-Cu2+含量最高的C5组,Pn为对照组的49. 4%。
| 处理编号 Treatment number |
光合参数Photosynthetic parameter | |||
| 净光合速率Pn /(μmol·m-2·s-1) |
气孔导度Gs /(mmol·m-2·s-1) |
蒸腾系数Tr /(mmol·m-2·s-1) |
胞间二氧化碳浓度 Ci/(μmol·mol-1) |
|
| CK | 10.33±0.78a | 0.37±0.05a | 5.71±0.26a | 293.29±1.56a |
| A1 | 9.49±0.58c | 0.32±0.08bc | 4.67±0.13c | 281.52±1.73b |
| A2 | 8.15±0.72d | 0.30±0.02c | 3.77±0.45f | 274.33±2.70c |
| A3 | 7.63±0.43e | 0.27±0.01de | 3.22±0.76g | 262.62±1.56ef |
| A4 | 6.59±0.89d | 0.25±0.06e | 2.98±0.84hi | 255.27±1.73g |
| A5 | 5.20±0.91i | 0.17±0.08gh | 2.79±0.52ij | 288.81±2.40b |
| B1 | 11.05±0.79a | 0.33±0.07ab | 4.03±0.72d | 271.63±1.56cd |
| B2 | 9.64±0.94bc | 0.28±0.08cd | 5.12±0.68bc | 265.32±1.73e |
| B3 | 9.05±0.72cd | 0.24±0.06e | 3.93±0.92ef | 244.51±2.70gh |
| B4 | 7.44±0.68ef | 0.22±0.05ef | 3.16±0.75gh | 231.19±1.56i |
| B5 | 6.21±0.79gh | 0.15±0.03h | 2.65±0.89k | 221.31±1.73j |
| C1 | 8.10±0.49e | 0.30±0.01d | 5.16±0.04e | 281.31±2.40c |
| C2 | 7.32±0.56fg | 0.28±0.02cd | 4.18±0.25cd | 265.13±2.70e |
| C3 | 6.76±0.68g | 0.22±0.01ef | 3.32±0.06g | 252.18±1.56d |
| C4 | 5.42±0.49hi | 0.14±0.04hi | 3.01±0.06hi | 232.26±1.73ij |
| C5 | 5.10±0.49j | 0.11±0.03i | 2.41±0.04k | 221.02±2.40j |
| 注:不同小写字母表示根据Duncan检验,在0. 05水平上的差异显著性,相同字母表示差异不显著。Note: the different lowercase letters indicate the significant difference at the 0. 05 level according to the Duncan test. The same letter indicates that the difference is not significant. | ||||
不同重金属含量对无柄小叶榕丙二醛(MDA)含量及相对电导率(REC)的影响如图 2所示。土壤中Cd、Cu的浓度显著地影响了无柄小叶榕的MDA含量与REC。相比对照组,随着Cd2+浓度升高,无柄小叶榕MDA含量与REC逐渐升高,Cd2+浓度最高的A5组中MDA含量和REC是对照组的1. 93和2. 96倍。Cu2+浓度升高也引起了无柄小叶榕MDA含量和REC的逐渐升高,但MDA含量升高趋势较为缓慢,Cu2+浓度最高的B5组中MDA含量和REC是对照组的1. 93和2. 96倍。而随着Cd2+-Cu2+含量增加,MDA含量和REC显著升高,Cd2+-Cu2+含量最高的TC5组,MDA含量和REC显著高于其他处理组,分别是对照组的5. 27和3. 96倍。

|
注:不同小写字母表示根据Duncan检验,在0. 05水平上的差异显著性,相同字母表示差异不显著。 Note: the different lowercase letters indicate the significant difference at the 0. 05 level according to the Duncan test. The same letter indicates that the difference is not significant. 图 2 镉与铜对无柄小叶榕丙二醛含量及相对电导率的影响 Fig. 2 Effects of Cd and Cu on the MDA content and REC in F. concinna var. subsessilis corner |
不同重金属含量对无柄小叶榕O2.-产生速率与H2O2含量的影响如图 3所示。土壤中Cd、Cu浓度显著地影响了无柄小叶榕O2.-产生速率和H2O2含量。相比对照组,随着Cd2+浓度升高,无柄小叶榕O2.-产生速率和H2O2含量逐渐升高,Cd2+浓度最高的A5组中O2.-产生速率和H2O2含量分别是对照组的2. 89和2. 18倍。Cu2+浓度升高也引起了无柄小叶榕O2.-产生速率和H2O2含量的升高,趋势与Cd2+引起的变化相似。而Cd2+-Cu2+含量的同时增加,导致O2.-产生速率和H2O2含量显著升高,其中Cd2+-Cu2+含量最高的C5组,O2.-产生速率和H2O2含量分别是对照组的5. 07和3. 62倍。

|
注:不同小写字母表示根据Duncan检验,在0. 05水平上的差异显著性,相同字母表示差异不显著。 Note: the different lowercase letters indicate the significant difference at the 0. 05 level according to the Duncan test. The same letter indicates that the difference is not significant. 图 3 镉与铜对无柄小叶榕O2.-产生速率和H2O2的影响 Fig. 3 Effects of Cd and Cu on O2.- production rate and H2O2 content in F. concinna var. subsessilis corner |
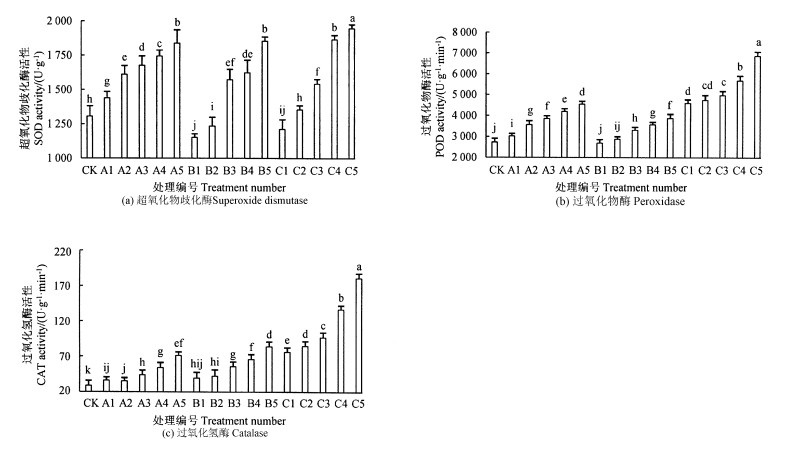
无柄小叶榕叶片中保护酶活性随着Cd、Cu浓度变化结果如图 4所示。随着Cd2+与Cu2+浓度升高,无柄小叶榕叶片中SOD、POD和CAT活性逐渐升高,且在Cd2+-Cu2+浓度最高的C5组达到最高值,分别是对照组的1. 49、2. 52和6. 31倍。Cd2+浓度升高引起了无柄小叶榕叶片POD和CAT活性的缓慢升高,而与CK相比,Cu2+的浓度升高则使SOD与POD活性先降低后升高。Cd2+-Cu2+含量的增加,引起无柄小叶榕POD和CAT活性显著高于其他处理组。
|
注:不同小写字母表示根据Duncan检验,在0. 05水平上的差异显著性,相同字母表示差异不显著。 Note: the different lowercase letters indicate the significant difference at the 0. 05 level according to the Duncan test. The same letter indicates that the difference is not significant. 图 4 镉与铜对无柄小叶榕保护酶活性的影响 Fig. 4 Effects of Cd and Cu on the protective enzyme activity in F. concinna var. subsessilis corner |
目前,我国的土壤环境质量标准的制定主要是基于其对人类健康的影响,而关于土壤中Cd和Cu对植物的危害还未有明确的生态环境质量阈值[18]。无论是Cu还是Cd,当其浓度在植物体内的累积超过一定界限时,就会对植物产生毒害作用[19]。重金属产生的毒害可以抑制植物体内某些细胞器参与生理生化进程,导致其代谢紊乱,生长发育缓慢,严重时导致植株死亡[20]。然而,植物在重金属毒害条件下也可引发一系列应激保护反应,绝大部分植物都具备稳定的细胞渗透调节机制来调节细胞内的重金属离子浓度,从而最大限度减轻甚至避免重金属可能导致的生理生化损伤。随着Cu2+浓度逐渐升高,无柄小叶榕叶片内的叶绿素含量呈先增加后下降的趋势;而随着Cd2+浓度的升高,叶绿素含量逐渐降低。这表明Cu作为植物生长必需元素之一,低浓度Cu2+可以促进无柄小叶榕叶绿素合成,Cu2+浓度为100 mg · kg-1时叶绿素含量达到最高值,而Cu2+浓度继续升高,过多Cu2+代替叶绿素中的Mg2+,阻碍了叶绿素的合成。Cd2+可通过抑制叶肉细胞内原叶绿素酸酯还原酶和氨基-7-酮戊酸的合成来阻碍叶绿素的合成,因此当遭受Cd2+胁迫后,无柄小叶榕叶片内叶绿素a与叶绿素b含量下降[21]。研究表明,类胡萝卜素是保护植物器官的重要植物色素之一,其中β-类胡萝卜素是一种并不具有抗氧化功能的细胞色素,但它在保护植物的光合作用方面具有十分重要的意义[22]。因此在低浓度的Cu、Cd胁迫下,无柄小叶榕会通过增加类胡萝卜素的含量来保护自身。在低浓度Cu2+与Cd2+-Cu2+条件下,无柄小叶榕的类胡萝卜素含量增加。光合作用对重金属离子的响应较为敏感,低浓度Cu2+条件下,无柄小叶榕Pn增加;Cd2+胁迫、高浓度Cu2+及Cd2+-Cu2+共同胁迫时Pn、Gs和Tr显著受到抑制。导致这种现象的重要原因之一是叶绿素合成受阻,还可能是由于Cu2+与Cd2+的毒害对无柄小叶榕叶绿体结构产生了破坏,导致基粒垛迭减少,分布不均匀,从而影响类囊体膜的组成,破坏两个光合系统的协调功能,导致光系统Ⅰ (PSⅠ)受损,最终抑制光合作用[23]。彭鸣等[24]以玉米(Zea mays L.)为研究材料也证明了这一点。
重金属胁迫还可使植物离子吸收、运输、渗透调节等发生功能障碍。研究发现,Cu2+与Cd2+胁迫条件下均促使无柄小叶榕叶片中MDA含量、REC、O2.-产生速率与H2O2含量增加。这与文晓慧等[25-26]的研究一致,油菜(Brassica campestris L.)、水稻(Oryza sativa L.)在不同重金属胁迫下,MDA含量增加,随着重金属浓度升高,MDA含量逐渐上升,表明Cd、Cu胁迫使无柄小叶榕细胞膜结构遭到破坏,造成质膜的选择透性降低,功能丧失,细胞内外的物质交换和信息传递受阻。同时Cd、Cu胁迫也促使O2.-产生速率与H2O2含量增加,这些活性氧攻击细胞膜上的不饱和脂肪酸,进一步破坏细胞膜结构。研究发现,高浓度的Cd2+与Cu2+促进了无柄小叶榕SOD、CAT、POD活性增强,这表明无柄小叶榕体内的抗氧化系统通过增强SOD、POD和CAT的活性清除重金属诱导产生的自由基,保护细胞免受伤害[27-28]。
综上,Cd、Cu胁迫显著影响无柄小叶榕的生理生化进程,低浓度Cu2+促进无柄小叶榕的光合作用及生理响应,而高浓度Cu2+可导致叶绿素合成、光合作用降低;而Cd2+以及Cd2+-Cu2+的相互作用均显著地抑制无柄小叶榕叶绿素合成及光合作用,同时产生大量的MDA及O2.-、H2O2,抑制无柄小叶榕的生长发育。
| [1] | 夏利亚, 来俊卿. 土壤重金属污染及防治对策[J]. 能源环境保护, 2011, 25(4): 54–55, 58. DOI:10.3969/j.issn.1006-8759.2011.04.015 |
| [2] | 王松良, 郑金贵. 芸苔属蔬菜的Cd富集特性及其修复土壤Cd污染的潜力[J]. 福建农林大学学报(自然科学版), 2004, 33(1): 94–99. |
| [3] | HALL J L. Cellular mechanisms for heavy metal detoxification and tolerance[J]. Journal of Experimental Botany, 2002, 53(366): 1–11. |
| [4] | 张国军, 邱栋梁, 刘星辉. Cu对植物毒害研究进展[J]. 福建农林大学学报(自然科学版), 2004, 33(3): 289–294. |
| [5] | 林霞, 郑坚, 刘洪见, 等. 不同基质对无柄小叶榕容器苗生长和叶片生理特性的影响[J]. 林业科学, 2010, 46(8): 62–70. |
| [6] | 郑坚, 陈秋夏, 李效文, 等. 无柄小叶榕容器苗形态和生理质量评价指标筛选[J]. 中国农学通报, 2010, 26(15): 141–148. |
| [7] | 李玉浸. 集约化农业的环境问题与对策[M]. 北京: 中国农业科技出版社, 2001: 14-17. |
| [8] | 王萌, 李杉杉, 李晓越, 等. 我国土壤中铜的污染现状与修复研究进展[J]. 地学前缘, 2018, 25(5): 305–313. |
| [9] | 刘志坚, 陈坚. 浙南海岸带盐碱地适生树种筛选试验[J]. 现代农业科技, 2016(9): 157–158. DOI:10.3969/j.issn.1007-5739.2016.09.096 |
| [10] | 李少君, 邓欢欢, 马斌斌, 等. 无柄小叶榕对盐碱地Cd、Cu的吸收特性及修复潜力[J]. 环境科学学报, 2017, 37(12): 4724–4733. |
| [11] | 李志博, 骆永明, 宋静, 等. 土壤环境质量指导值与标准研究Ⅱ.污染土壤的健康风险评估[J]. 土壤学报, 2006, 43(1): 142–151. DOI:10.3321/j.issn:0564-3929.2006.01.020 |
| [12] | 王福民, 黄敬峰, 王秀珍. 水稻叶片叶绿素、类胡萝卜素含量估算的归一化色素指数研究[J]. 光谱学与光谱分析, 2009, 29(4): 1064–1068. DOI:10.3964/j.issn.1000-0593(2009)04-1064-05 |
| [13] | 胡继超, 姜东, 曹卫星, 等. 短期干旱对水稻叶水势、光合作用及干物质分配的影响[J]. 应用生态学报, 2004, 15(1): 63–67. DOI:10.3321/j.issn:1001-9332.2004.01.014 |
| [14] | 李霞, 阎秀峰, 于涛. 水分胁迫对黄檗幼苗保护酶活性及脂质过氧化作用的影响[J]. 应用生态学报, 2005, 16(12): 2353–2356. DOI:10.3321/j.issn:1001-9332.2005.12.025 |
| [15] | 郑炳松, 王正加. 现代植物生理生化研究技术[M]. 北京: 气象出版社, 2006: 154-167. |
| [16] | 张科.重庆市六种园林草本地被植物的耐旱性评价[D].重庆: 西南大学, 2010. |
| [17] | 周本宏, 王慧媛, 郭志磊, 等. 石榴皮鞣质对羟自由基和超氧阴离子自由基的清除作用[J]. 中国医院药学杂志, 2008, 28(17): 1442–1445. DOI:10.3321/j.issn:1001-5213.2008.17.004 |
| [18] | 周国华, 秦绪文, 董岩翔. 土壤环境质量标准的制定原则与方法[J]. 地质通报, 2005, 24(8): 721–727. DOI:10.3969/j.issn.1671-2552.2005.08.008 |
| [19] | 夏来坤, 郭天财, 朱云集, 等. 土壤重金属铜、镉胁迫对冬小麦碳氮运转的影响[J]. 水土保持学报, 2006, 20(1): 117–120. DOI:10.3321/j.issn:1009-2242.2006.01.029 |
| [20] | 宋阿琳, 娄运生, 梁永超. 不同水稻品种对铜镉的吸收与耐性研究[J]. 中国农学通报, 2006, 22(9): 408–411. DOI:10.3969/j.issn.1000-6850.2006.09.100 |
| [21] | 陆干, 李磊明, 陶祥运, 等. Pb、Cu胁迫对玉米(Zea mays L.)生长、细胞色素合成以及重金属吸收特性的影响[J]. 安徽农业大学学报, 2017, 44(5): 905–911. |
| [22] | 高家合, 王树会. 镉胁迫对烤烟生长及生理特性的影响[J]. 农业环境科学学报, 2006, 25(5): 1167–1170. DOI:10.3321/j.issn:1672-2043.2006.05.015 |
| [23] | 杨丹慧. 重金属离子对高等植物光合膜结构与功能的影响[J]. 植物学报, 1991, 8(3): 26–29. |
| [24] | 彭鸣, 王焕校, 吴玉树. 镉、铅诱导的玉米(Zea mays L.)幼苗细胞超微结构的变化[J]. 中国环境科学, 1991, 11(6): 426–431. |
| [25] | 文晓慧. 重金属胁迫对植物的毒害作用[J]. 农业灾害研究, 2012, 2(11): 20–21, 27. |
| [26] | 文晓慧, 陈基宁, 蔡昆争.Cd和Zn复合污染对水稻幼苗的毒害作用[C]//第六届中国植物逆境生理学与分子生物学学术研讨会论文摘要汇编.深圳: 中国植物生理与分子生物学学会, 2010: 131. |
| [27] | 孙境蔚, 钱莲文, 许秀真, 等. 铝胁迫对常绿杨生长状况及保护酶活性的影响[J]. 森林与环境学报, 2015, 35(2): 136–140. |
| [28] | SCHVTZENDVBEL A, POLLE A. Plant responses to abiotic stresses:heavy metal-induced oxidative stress and protection by mycorrhization[J]. Journal of Experimental Botany, 2002, 53(372): 1351–1365. |

 2019, Vol. 39
2019, Vol. 39


