文章信息
- 梁艺凡, 万晓华, 桑昌鹏, 王民煌, 林宇, 黄志群
- LIANG Yifan, WAN Xiaohua, SANG Changpeng, WANG Minhuang, LIN Yu, HUANG Zhiqun
- 滨海防护林土壤氮组分对凋落物和根系去除的响应
- Response of soil nitrogen pool to litter and root exclusion in costal protection forest
- 森林与环境学报,2019, 39(2): 127-134.
- Journal of Forest and Environment,2019, 39(2): 127-134.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2019.02.003
-
文章历史
- 收稿日期: 2018-05-07
- 修回日期: 2018-06-05
2. 福建师范大学地理科学学院, 福建 福州 350007;
3. 福建省长乐大鹤国有防护林场, 福建 长乐 350212
2. College of Geographical Science, Fujian Normal University, Fuzhou, Fujian 350007, China;
3. Changle Dahe State-owned Protection Forest Farm of Fujian Province, Changle, Fujian 350212, China
森林土壤氮素转化与循环是全球氮循环的重要组成部分,在森林生态系统功能中发挥着极其重要的作用。在森林生态系统中,土壤有机质能储存50%~90%的氮[1]。氮素在森林生态系统中的输入和输出过程受到生物和非生物因素的共同影响,树种是影响土壤氮素循环的关键生物因子之一[2]。由于凋落物和细根的数量与质量的差异,以及根系分泌和根际沉降等过程的不同,不同树种人工林下土壤氮库和氮循环过程存在很大差异[3-4]。许多研究发现,凋落物是土壤微生物的重要碳源,而凋落物质量(如C/N、酚类化合物、可溶性碳或氮含量等)会影响土壤氮矿化和硝化等[5-8]。凋落物碳氮比高会导致其分解缓慢,在土壤中形成高碳氮比的酸性腐殖质层,产生抑制硝化的物质,导致土壤净氮矿化和硝化速率低[3]。叶片的酚类化合物,如木质素、单宁等次生代谢物会抑制微生物生长,降低有机质分解与净氮矿化、硝化速率[9-10]。然而,有部分研究却发现土壤氮转化与凋落物化学组成之间无显著相关性[11],他们强调主要是根系分泌物和根系周转在调控土壤氮转化过程。有研究发现,细根分泌物的增加促进了土壤氮矿化;和地上部分凋落物一样,细根分泌过程中产生的次生代谢物质也会抑制土壤硝化作用[12-13],从而对土壤氮循环产生影响。
凋落物和根系输入是人工林生态系统中土壤养分的主要来源,而植物残体的添加与去除实验是研究凋落物与根系碳源输入数量和速率的改变如何影响土壤有机质积累和养分循环过程的重要实验方法[14-15]。我国亚热带[16]和温带[17]森林研究中发现,去除根系和凋落物后,土壤全氮和有机层土壤氮储量均有显著降低。全氮含量的下降可能是由于凋落物和根系等外源基质降低后,土壤中易变性氮组分等输出增加,以淋溶或气体等形式损失,而具体哪些易变性氮组分对凋落物和根系去除响应更敏感有待进一步研究。土壤酶活性对植物残体的添加与去除响应非常敏感[18],土壤酶活性下降与凋落物和根系输入的有机质含量减少具有一定相关性。国外KOTROCZO et al [19]和VERES et al [20]的研究发现,去除凋落物和根系数年后,土壤碳、氮含量的显著降低与土壤中β-葡萄糖苷酶和多酚氧化酶等酶活性的显著下降有关。因此,去除凋落物和根系后,土壤酶活性增高或降低会导致土壤碳库及养分转化过程的加快或减慢。土壤酶是土壤中养分循环和能量流动不可替代的参与者[21],它们对外源碳输入变化响应敏感,可能会进一步引起土壤中碳、氮耦合过程的变化。同时,这些变化及其敏感性可能在很大程度上受到树种差异的影响,特别是在系统结构简单、土壤贫瘠和保水保肥能力差的滨海沙地人工林系统,树种对土壤氮循环过程的影响可能尤为显著。
有关森林土壤氮循环的研究有杨树[22]、杉木[23]、落叶松[24]、桉树[25]等,讨论了施肥、生物炭、连栽等对土壤氮素转化的影响,而关于改变碳输入对滨海沙地土壤氮组分和酶活性影响的研究还比较少。本文以巨尾桉(Eucalyptus grandis × urophylla,EGU)、湿地松(Pinus elliottii Engelm.,PE)、木麻黄(Casuarina equisetifolia J.R. Forst. & G. Forst.,CE)、纹荚相思(Acacia aulacocarpa Benth.,AA)人工林为研究对象,设置去除凋落物和去除根系处理,分析改变凋落物和根系输入后土壤氮组分和酶活性的变化,探索凋落物和根系输入诱导的土壤酶活性变化对土壤氮循环的影响,以期提高土壤氮保留能力,促进森林可持续经营。
1 材料与方法 1.1 试验地概况及设计试验地位于福建省长乐市大鹤国有防护林场(25°96′N,119°68′E),地处福建东部沿海,气候属亚热带海洋性季风气候,年均温度19.2 ℃,年均降水量1 383 mm。地势平坦,平均海拔为10 m,土壤为滨海相风积沙土,砂层较厚,达6~10 m,土壤肥力较低。尾巨桉、木麻黄和纹荚相思人工林均是在湿地松采伐迹地上营造的,2016年调查时,林龄均为13 a。人工林林下植被稀少,常见有牛口刺(Cirsium shansiense Petrak)、白茅(Imperata cylindrica Beauv.)、马樱丹(Lantana camara L.)等。各样地基本概况见表 1。
| 树种 Tree species |
林木Tree | 凋落物Litter | ||||||||
| 树高 Tree height/ % |
胸径 DBH/% |
生物量 Biomass/ (t·hm-2·a-1) |
碳含量 C content /(g·kg-1) |
氮含量 N content /(g·kg-1) |
碳氮比 C:N |
纤维素 Cellulose /% |
木质素 Lignin /% |
|||
| 尾巨桉EGU | 19.1±0.2b | 14.5±0.1a | 9.9±1.4b | 496.3±3.2ab | 14.6±0.8b | 34.4±2.0b | 11.5±0.2d | 18.0±0.4d | ||
| 湿地松PE | 12.5±0.3a | 16.1±0.9a | 14.3±2.1a | 509.2±0.6a | 6.7±0.4c | 76.3±4.6a | 21.8±0.0b | 36.6±0.0a | ||
| 木麻黄CE | 12.7±0.5a | 11.8±0.6b | 16.8±3.8a | 487.2±1.8b | 16.0±0.5b | 30.6±0.9bc | 27.5±1.8a | 22.7±0.8c | ||
| 纹荚相思AA | 10.9±0.5c | 11.0±0.2b | 8.5±2.1b | 511.7±1.9a | 21.6±1.3a | 24.0±1.4c | 17.6±0.9c | 28.6±2.5b | ||
| 树种 Tree species |
细根Fine Root | 土壤Soil | ||||||||
| 生物量 Biomass /(t·hm-2 ·a-1) |
碳含量 C content /(g·kg-1) |
氮含量 N content /(g·kg-1) |
碳氮比 Root C:N |
pH值 pH value |
总有机碳 Total organic C/(g·kg-1) |
全氮Total N content /(g·kg-1) |
碳氮比 Root C:N |
|||
| 尾巨桉EGU | 0.3±0.01b | 406.5±11.8a | 4.7±0.4c | 87.2±4.8b | 5.4±0.14ac | 4.3±0.2a | 0.5±0.03b | 8.6±0.9a | ||
| 湿地松PE | 0.5±0.20b | 387.2±9.9a | 3.2±0.3c | 122.3±11.7a | 5.4±0.04a | 4.3±0.6a | 0.5±0.02b | 8.1±0.9a | ||
| 木麻黄CE | 1.6±0.26a | 412.7±20.0a | 11.0±0.6b | 37.5±1.0c | 5.1±0.05bc | 4.6±0.4a | 0.7±0.04a | 8.7±2.1a | ||
| 纹荚相思AA | 0.3±0.05b | 412.6±31.0a | 19.2±1.3a | 21.4±0.2d | 5.0±0.06b | 4.4±0.3a | 0.7±0.05a | 6.4±0.4a | ||
2014年9月,在4种人工林分别设置4个20 m×20 m的样方,样方内随机设置3个2 m×2 m小区,作为3个处理: (1)去除凋落物,将小区内原地表凋落物全部移除,并在小区上方1 m处放置孔径为2 mm的尼龙网隔离凋落物;(2)去除根系,沿着小区四周挖1 m深度壕沟,并在壕沟内埋入3层孔径为0.1 mm的尼龙网阻断周围根系向小区内生长;(3)对照,即不作任何处理。
1.2 土壤样品采集与测定2016年6月,即处理21个月后取土壤样品。用内径为3.5 cm的土钻在每个小区内沿对角线等距离钻取4个点,采集0~10 cm土壤层样品。将同一小区土壤样品混合后,用冰盒带回实验室。在室内,去除砂石、可见根系后过2 mm筛,储存于4 ℃冰箱中,用于提取矿质氮组分、可溶性有机氮、微生物生物量氮和土壤酶活性测定。
土壤矿质氮组分用密度为2 mol · L-1的氯化钾溶液浸提。向相当于10 g干土重的鲜土样品中加入40 ml氯化钾溶液,振荡30 min后,过0.45 μm滤膜得到待测液。浸提液中的铵态氮(NH4+-N)和硝态氮(NO3--N)含量用连续流动分析仪(Skalar San++,荷兰)测定。土壤微生物生物量氮(microbial biomass nitrogen,MBN)用氯仿熏蒸浸提法浸提,浸提液中有机碳含量用总有机碳分析仪(SHIMADZU TOC-VCPH/CPN analyzer, 日本岛津)测定。
参考SAIYA-CORK et al [26]的方法,用96孔微孔板法测定土壤样品中β-葡萄糖苷酶(β-glucosidase, βG),乙酰氨基葡萄糖苷酶(N-acetyl-β-d-glucosaminidase, NAG),多酚氧化酶(polyphenol oxidase, PPO)和过氧化物酶(peroxidase, PER)活性。其中,β-葡萄糖苷酶将纤维素降解为葡萄糖[27],是重要的碳获取酶[28]。乙酰氨基葡萄糖苷酶降解几丁质(含氮的高分子有机化合物),被认为是主要的氮素获取酶之一[29-30]。多酚氧化酶和过氧化物酶分别降解酚类物质和木质素,在凋落物分解过程中起重要作用[31]。β-葡萄糖苷酶和乙酰氨基葡萄糖苷酶活性测定所用基质分别为4-甲基伞形酮-β-D-葡萄糖苷和4-甲基伞形酮-2-乙酰氨基-2-脱氧-β-D-吡喃葡萄糖苷。多酚氧化酶和过氧化物酶测定所用基质为25 mmol · L-1的左旋多巴胺(L-DOPA),过氧化物酶在多酚氧化酶基础上加10 μL 3%的H2O2。用Synerge H4多功能酶标仪(BioTek, 美国)测定荧光值。土壤酶活性用每小时每克干土的基质转化量(μmol · g-1 · h-1)表示。
1.3 数据处理基于Excel 2010进行数据处理,利用SPSS 19.0进行统计分析。采用单因素方差分析检验差异显著性,P= 0.05;用双因素方差分析指示树种和处理及其交互作用对土壤氮组分影响的差异。通过Pearson相关系数分析确定土壤不同氮组分与酶活性的相关性。
2 结果与分析 2.1 土壤氮组分变化在尾巨桉人工林中,去除凋落物显著降低了表层土壤中NH4+-N、NO3--N、矿质氮和MBN的含量(P < 0.05) (图 1);而去除根系对土壤氮组分无显著影响(P>0.05)。在湿地松人工林中,去除根系后显著增加土壤矿质氮和NO3--N含量(P < 0.01)。在木麻黄人工林中,去除凋落物和根系均显著降低土壤NH4+-N含量(P < 0.01),纹荚相思人工林中去除凋落物和根系对土壤矿质氮各组分均无显著影响;实验处理对湿地松、木麻黄和纹荚相思人工林土壤MBN含量影响不显著。树种对土壤MBN、NO3--N和矿质氮均有显著影响,处理对土壤NH4+-N、NO3--N和矿质氮总量影响显著,而对MBN影响不显著。
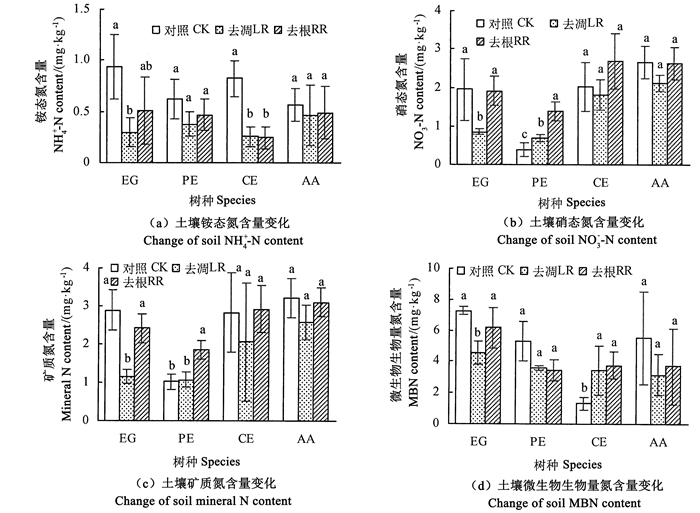
|
注:不同小写字母表示同一树种差异显著(P < 0.05)。 Note: different lowercase letters denote significant difference in the same tree species (P < 0.05). 图 1 4个树种人工林去除凋落物和根系后土壤氮组分含量变化 Fig. 1 Concentrations of soil N pool in litter and root exclusion treatments in the 4 forest plantations |
尾巨桉人工林中,去除凋落物显著降低了β-葡萄糖苷酶、乙酰氨基葡萄糖苷酶和过氧化物酶活性(P < 0.05)(图 2)。湿地松人工林中,去除凋落物和根系后均显著增加了多酚氧化酶活性(P < 0.01),而对其他酶活性影响不显著。木麻黄人工林中,去除凋落物和根系均显著降低了β-葡萄糖苷酶和乙酰氨基葡萄糖苷酶活性(P < 0.05)。在纹荚相思人工林中,去除凋落物和根系后4种土壤酶活性均无显著变化。
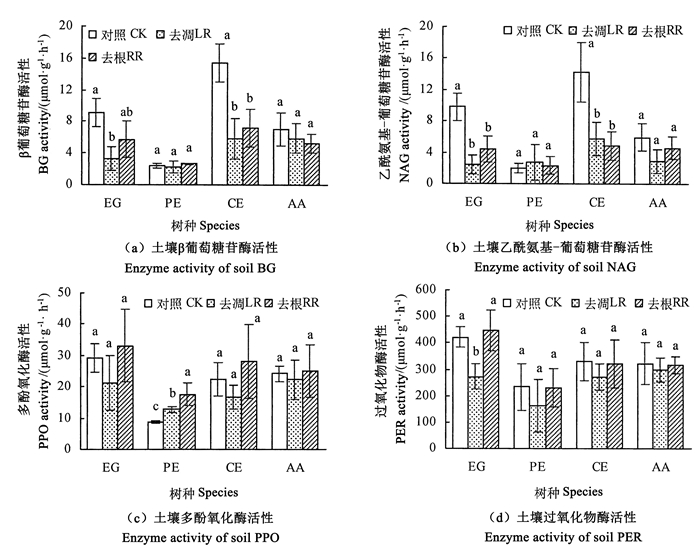
|
注:不同小写字母表示同一树种差异显著(P < 0.05)。 Note: different lowercase letters denote significant difference in the same tree species (P < 0.05). 图 2 4个树种人工林去除凋落物和根系后土壤酶活性 Fig. 2 Soil enzyme activity change in litter and root exclusion treatments in the 4 forest plantations |
相关分析显示,土壤NO3--N和矿质氮含量均与β-葡萄糖苷酶、乙酰氨基葡萄糖苷酶、多酚氧化酶和过氧化物酶活性之间均具有显著或极显著正相关关系(表 2)。土壤MBN含量与多酚氧化酶和过氧化物酶活性之间具有显著或极显著正相关关系。
| 组分 Fractions |
β-葡萄糖苷酶βG | 乙酰氨基葡萄糖苷酶NAG | 多酚氧化酶PPO | 过氧化物酶PER | |||||||
| 相关系数R | 显著度P | 相关系数R | 显著度P | 相关系数R | 显著度P | 相关系数R | 显著度P | ||||
| 微生物生物量氮MBN | -0.02 | 0.87 | 0.07 | 0.66 | 0.32* | 0.03 | 0.48** | 0.001 | |||
| 铵态氮NH4+-N | 0.22 | 0.13 | 0.31* | 0.03 | -0.08 | 0.58 | 0.15 | 0.310 | |||
| 硝态氮NO3--N | 0.47** | 0.001 | 0.38** | 0.01 | 0.49** | < 0.001 | 0.43** | 0.002 | |||
| 矿质氮Mineral N | 0.51** | < 0.001 | 0.48** | 0.001 | 0.38** | 0.01 | 0.44** | 0.002 | |||
| 注:*代表 0.05水平上显著相关,* *代表 0.01水平上显著相关。* represents significant correlation at P < 0.05,* * represents significant correlation at P < 0.01. | |||||||||||
本研究结果表明,土壤不同氮组分对凋落物、根系去除的响应程度和方向因树种而异。尾巨桉人工林土壤不同氮组分对凋落物去除响应比较敏感,均有显著下降。湿地松人工林去除根系后土壤矿质氮反而有显著增加,而纹荚相思人工林土壤不同氮组分与对照相比无显著变化。碳氮获取酶和氧化酶酶活性对处理的响应在一定程度上能够解释土壤不同氮组分的变化。
在尾巨桉人工林中,凋落物特性(如木质素含量、Lignin/N等)可能是调控土壤氮循环过程的重要因子。研究结果显示,去除凋落物后土壤氮组分均有显著下降,而去除根系对土壤氮组分无影响,表明尾巨桉人工林地上凋落物碳输入对表层土壤氮的贡献要显著高于地下根系输入。这一研究结果与WANG et al [16]、BRANT et al [32]和FEKETE et al [33]研究结果不一致,以上研究均强调地下根系输入对土壤有机质形成的影响要显著大于地上凋落物输入。而其它研究发现,去除凋落物显著降低微生物生物量碳含量,而去除根系对微生物量碳无影响[34]。一般来说,木质素含量较低的凋落物更易被微生物所降解[35],去除凋落物后,地表直接受光照或雨淋,引起地表土壤温度、湿度等剧烈波动,恶化了微生物的生存环境[36-37],加之高质量的凋落物去除后减少了微生物的有机质供应从而限制微生物生长和功能,使土壤变得贫瘠[38]。本研究中尾巨桉人工林凋落物氮含量较高,木质素和纤维素含量较低,分解较快;而且本研究区位于滨海沙地,年降雨量大,新鲜凋落物层的淋滤物质能够为微生物提供大量的易变性有机质,刺激微生物活性[39]。土壤酶活性的变化可以指示土壤微生物活性[40]。去除凋落物后,微生物碳获取酶(β-葡萄糖苷酶)、氮获取酶(乙酰氨基葡萄糖苷酶)和促进腐殖物质释放碳,氮等养分的过氧化物酶活性均有显著降低,表明当微生物可利用的有机质减少后,微生物活性下降,这与WEINTRAUB et al [41]在热带雨林中的研究结果一致,随之微生物对氮的矿化和转化能力也降低,导致土壤中的矿质氮和有机氮含量显著下降。因此,尾巨桉人工林中,地上凋落物碳输入是微生物的主要碳源,一旦切断凋落物输入,使土壤微环境恶化,微生物可利用的碳减少,活性降低,影响土壤氮转化和矿化过程;另一方面去除凋落物也切断了氮输入,微生物分解后能释放的有效氮减少。
在湿地松人工林中,去除根系反而增加了土壤中硝态氮、矿质氮含量。在其他一些阔叶和针叶人工林中,也有研究发现,切断植物根系后会显著增加土壤中矿质氮含量和硝化速率[42-43]。原因可能是(1)去除根系后,植物有效氮摄取量减少,导致土壤中氮含量上升;(2)根系分泌物、根系周转及共生菌根真菌能够为微生物提供大量有机碳,刺激微生物活性从而固定大量氮[44],而去除根系后,这些易变性有机碳输入减少,微生物生物量降低,释放一部分被固定的氮,土壤氮含量增加。本研究中,湿地松人工林对照小区的土壤矿质氮含量均显著低于其他3个树种的对照小区,表明湿地松人工林原本土壤中可供植物和微生物吸收利用的有效氮含量很低,较低的土壤氮有效性会加剧植物与微生物之间对氮的竞争。此外,湿地松凋落物中木质素含量非常高,凋落物和根系的C/N比值也最高,相对于尾巨桉高质量的凋落物来说,湿地松人工林中来自于凋落物和根系输入的易变性有机碳较少,所以,湿地松人工林土壤微生物群落对地上、地下易变性有机碳输入响应不灵敏,去根后多酚氧化酶活性显著增加,可能与多酚氧化酶促进土壤有机质中难分解组分(比如木质素、酚类物质等)释放养分元素有关。刘星等[45]对太岳山油松林的研究发现,切根去凋处理后过氧化物酶活性略微上升,可能是与挖壕沟产生的大量死根,为土壤微生物活动提供大量有效底物有关。因此,在湿地松人工林中,去除根系后,一方面来自于植物的氮摄取量减少和水分有效性提高,另一方面微生物通过分泌多酚氧化酶等降解难分解的有机质(如木质素、单宁等)来维持自身生长和代谢,加快土壤氮矿化和转化过程。
两个固氮树种木麻黄和纹荚相思人工林土壤氮组分对凋落物和根系去除的响应也不一致。木麻黄人工林去除凋落物和根系后铵态氮含量下降可能与氮获取酶(乙酰氨基葡萄糖苷酶)活性降低有关。对于纹荚相思人工林,前期处理1年后的测定结果显示;去除凋落物和根系显著降低了MBN含量以及β-葡萄糖苷酶、乙酰氨基葡萄糖苷酶活性[46-47]。而本研究发现,去除凋落物和根系两年后土壤氮组分和酶活性均无显著变化,表明纹荚相思人工林土壤微生物群落对有机质输入改变具有较好的适应力。也有研究表明,微生物群落对长期有机质去除具有适应性,随着地上地下碳输入的减少,微生物群落可能会从氮相对丰富的群落结构转变为能适应氮输入减少的群落结构[48]。纹荚相思人工林去除凋落物和根系后氮含量均没有显著低于对照,我们认为(1)去除根系后,来自于凋落物层的淋溶物质为微生物提供大量有机质;(2)去除凋落物后,来自于根系输入的碳(如根系分泌物,根系周转等),保证了微生物可以用于生长和代谢的能量;在基质和能量均未受限的条件下,土壤氮的转化速率也未受到处理的显著影响。
综上所述,不同树种的凋落物和根系特性影响土壤氮矿化和转化过程,土壤微生物群落通过其数量和活性变化发挥了重要作用,而且其影响程度和方向受到实验处理和树种的双重影响,以树种为主。从滨海沙地土壤氮矿化和氮保留能力及其有效性综合评价来看,阔叶树种尾巨桉最优;但本研究仅讨论处理后单次取样的氮组分变化,具有一定局限性。因此,继续深入开展人工林生态系统氮循环的动态研究利于更好地评价人工林的稳定性及其生态功能,对森林氮素养分管理也具有重要的现实意义。
| [1] | KAYE J P, BINKLEY D, RHOADES C. Stable soil nitrogen accumulation and flexible organic matter stoichiometry during primary floodplain succession[J]. Biogeochemistry, 2003, 63(1): 1–22. |
| [2] | KNOPS J M H, BRADLEY K L, WEDIN D A. Mechanisms of plant species impacts on ecosystem nitrogen cycling[J]. Ecology Letters, 2002, 5(3): 454–466. |
| [3] | ANDRIANARISOA K S, ZELLER B, POLY F, et al. Control of nitrification by tree species in a common-garden experiment[J]. Ecosystems, 2010, 13(8): 1171–1187. |
| [4] | LOVETT G M, WEATHERS K C, ARTHUR M A, et al. Nitrogen cycling in a northern hardwood forest:do species matter?[J]. Biogeochemistry, 2004, 67(3): 289–308. DOI:10.1023/B:BIOG.0000015786.65466.f5 |
| [5] | KAMEI J, PANDEY H N, BARIK S K. Tree species distribution and its impact on soil properties, and nitrogen and phosphorus mineralization in a humid subtropical forest ecosystem of northeastern India[J]. Canadian Journal of Forest Research, 2007, 39(1): 36–47. |
| [6] | MEIER C L, BOWMAN W D. Links between plant litter chemistry, species diversity, and below-ground ecosystem function[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(50): 19780–19785. |
| [7] | SCOTT N A, BINKLEY D. Foliage litter quality and annual net N mineralization:comparison across North American forest sites[J]. Oecologia, 1997, 111(2): 151–159. DOI:10.1007/s004420050219 |
| [8] | TEMPLER P, FINDLAY S, LOVETT G. Soil microbial biomass and nitrogen transformations among five tree species of the Catskill Mountains, New York, USA[J]. Soil Biology and Biochemistry, 2003, 35(4): 607–613. DOI:10.1016/S0038-0717(03)00006-3 |
| [9] | KANERVA S, KITUNEN V, KⅡKKILÄ O, et al. Response of soil C and N transformations to tannin fractions originating from Scots pine and Norway spruce needles[J]. Soil Biology and Biochemistry, 2006, 38(6): 1364–1374. |
| [10] | SMOLANDER A, KANERVA S, ADAMCZYK B, et al. Nitrogen transformations in boreal forest soils:does composition of plant secondary compounds give any explanations?[J]. Plant and Soil, 2012, 350(1/2): 1–26. |
| [11] | HUANG Z Q, WAN X H, HE Z M, et al. Soil microbial biomass, community composition and soil nitrogen cycling in relation to tree species in subtropical China[J]. Soil Biology and Biochemistry, 2013, 62: 68–75. |
| [12] | YIN H J, LI Y F, XIAO J, et al. Enhanced root exudation stimulates soil nitrogen transformations in a subalpine coniferous forest under experimental warming[J]. Global Change Biology, 2013, 19(7): 2158–2167. DOI:10.1111/gcb.12161 |
| [13] | SUBBARAO G V, ITO O, SAHRAWAT K L, et al. Scope and strategies for regulation of nitrification in agricultural systems:challenges and opportunities[J]. Critical Reviews in Plant Sciences, 2006, 25(4): 303–335. |
| [14] | NADELHOFFER K J, BOONE R D, BOWDEN R D, et al. The DIRT experiment: litter and root influences on forest soil organic matter stocks and function[M]//FOSTER D R, ABER J D. Forest Landscape Dynamics in New England: Ecosystem Structure and Function as a Consequence of 5000 Years of Change. Oxford: Oxford University Press, 2004. |
| [15] | LAJTHA K, CROW S E, YANO Y, et al. Detrital controls on soil solution N and dissolved organic matter in soils:a field experiment[J]. Biogeochemistry, 2005, 76(2): 261–281. DOI:10.1007/s10533-005-5071-9 |
| [16] | WANG Q K, HE T X, WANG S L, et al. Carbon input manipulation affects soil respiration and microbial community composition in a subtropical coniferous forest[J]. Agricultural and Forest Meteorology, 2013, 178. |
| [17] | PARK J H, MATZNER E. Controls on the release of dissolved organic carbon and nitrogen from a deciduous forest floor investigated by manipulations of aboveground litter inputs and water flux[J]. Biogeochemistry, 2003, 66(3): 265–286. |
| [18] | FEKETE I, VARGA C, KOTROCZÓ Z, et al. The relation between various detritus inputs and soil enzyme activities in a Central European deciduous forest[J]. Geoderma, 2011, 167. |
| [19] | KOTROCZÓ Z, VERES Z, FEKETE I, et al. Soil enzyme activity in response to long-term organic matter manipulation[J]. Soil Biology and Biochemistry, 2014, 70: 237–243. |
| [20] | VERES Z, KOTROCZÓ Z, FEKETE I, et al. Soil extracellular enzyme activities are sensitive indicators of detrital inputs and carbon availability[J]. Applied Soil Ecology, 2015, 92: 18–23. |
| [21] | DICK R P, BREAKWELL D P, TURCO R F. Soil enzyme activities and biodiversity measurements as integrative microbiological indicators[M]//DORAN J W, JONES A J. Methods for Assessing Soil Quality. Madison: SSSA Special Publication, 1996. |
| [22] | 戴腾飞, 席本野, 闫小莉, 等. 施肥方式和施氮量对欧美108杨人工林土壤氮素垂向运移的影响[J]. 应用生态学报, 2015, 26(6): 1641–1648. |
| [23] | 魏志超, 孟李群, 李惠通, 等. 生物炭对杉木人工林土壤氮素的影响[J]. 森林与环境学报, 2017, 37(1): 60–66. |
| [24] | 张景普, 于立忠, 刘利芳, 等. 不同作业方式对落叶松人工林土壤养分及酶活性的影响[J]. 生态学杂志, 2016, 35(6): 1403–1410. |
| [25] | 吕小燕, 何斌, 吴永富, 等. 连栽桉树人工林土壤有机碳氮储量及其分布特征[J]. 热带作物学报, 2017, 38(10): 1874–1880. DOI:10.3969/j.issn.1000-2561.2017.10.017 |
| [26] | SAIYA-CORK K R, SINSABAUGH R L, ZAK D R. The effects of long term nitrogen deposition on extracellular enzyme activity in an Acer saccharum forest soil[J]. Soil Biology and Biochemistry, 2002, 34(9): 1309–1315. DOI:10.1016/S0038-0717(02)00074-3 |
| [27] | TURNER B L, HOPKINS D W, HAYGARTH P M, et al. β-Glucosidase activity in pasture soils[J]. Applied Soil Ecology, 2002, 20(2): 157–162. DOI:10.1016/S0929-1393(02)00020-3 |
| [28] | KRAKOMPERGER Z, TÓTH J A, VARGA C, et al. The effect of litter input on soil enzyme activity in an oak forest[J]. Cereal Research Communications, 2008, 36(5): 323–326. |
| [29] | SINSABAUGH R L, ANTIBUS R K, LINKINS A E, et al. Wood decomposition:nitrogen and phosphorus dynamics in relation to extracellular enzyme activity[J]. Ecology, 1993, 74(5): 1586–1593. |
| [30] | ZHOU X Q, CHEN C R, WANG Y F, et al. Warming and increased precipitation have differential effects on soil extracellular enzyme activities in a temperate grassland[J]. Science of the Total Environment, 2013, 444: 552–558. DOI:10.1016/j.scitotenv.2012.12.023 |
| [31] | SINSABAUGH R L. Phenol oxidase, peroxidase and organic matter dynamics of soil[J]. Soil Biology and Biochemistry, 2010, 42(3): 391–404. DOI:10.1016/j.soilbio.2009.10.014 |
| [32] | BRANT J B, MYROLD D D, SULZMAN E W. Root controls on soil microbial community structure in forest soils[J]. Oecologia, 2006, 148(4): 650–659. DOI:10.1007/s00442-006-0402-7 |
| [33] | FEKETE I, KOTROCZÓ Z, VARGA C, et al. Alterations in forest detritus inputs influence soil carbon concentration and soil respiration in a Central-European deciduous forest[J]. Soil Biology and Biochemistry, 2014, 74: 106–114. DOI:10.1016/j.soilbio.2014.03.006 |
| [34] | FENG W T, ZOU X M, SCHAEFER D. Above- and belowground carbon inputs affect seasonal variations of soil microbial biomass in a subtropical monsoon forest of southwest China[J]. Soil Biology and Biochemistry, 2009, 41(5): 978–983. DOI:10.1016/j.soilbio.2008.10.002 |
| [35] | CARREIRO M M, SINSABAUGH R L, REPERT D A, et al. Microbial enzyme shifts explain litter decay responses to simulated nitrogen deposition[J]. Ecology, 2000, 81(9): 2359–2365. |
| [36] | MATSUSHIMA M, CHANG S X. Effects of understory removal, N fertilization, and litter layer removal on soil N cycling in a 13-year-old white spruce plantation infested with Canada bluejoint grass[J]. Plant and Soil, 2007, 292(1/2): 243–258. |
| [37] | 陆耀东, 薛立, 曹鹤, 等. 去除地面枯落物对加勒比松(Pinus caribaea)林土壤特性的影响[J]. 生态学报, 2008, 28(7): 3205–3211. |
| [38] | LI X. Nutrient cycling in a Chinese-fir (Cunninghamia lanceolata) stand on a poor site in Yishan, Guangxi[J]. Forest Ecology and Management, 1996, 89(1/2/3): 115–123. |
| [39] | GARCÍA-OLIVA F, SVESHTAROVA B, OLIVA M. Seasonal effects on soil organic carbon dynamics in a tropical deciduous forest ecosystem in western Mexico[J]. Journal of Tropical Ecology, 2003, 19(2): 179–188. DOI:10.1017/S0266467403003201 |
| [40] | AMARAL H F, SENA J O A, SCHWAN-ESTRADA K R F, et al. Soil chemical and microbial properties in vineyards under organic and conventional management in southern Brazil[J]. Revista Brasileira de Ciência do Solo, 2011, 35(5): 1517–1526. |
| [41] | WEINTRAUB S R, WIEDER W R, CLEVELAND C C, et al. Organic matter inputs shift soil enzyme activity and allocation patterns in a wet tropical forest[J]. Biogeochemistry, 2013, 114(1/2/3): 313–326. |
| [42] | ROSS D J, SCOTT N A, TATE K R, et al. Root effects on soil carbon and nitrogen cycling in a Pinus radiata D. Don plantation on a coastal sand[J]. Australian Journal of Soil Research, 2001, 19(5): 1027–1039. |
| [43] | LAVOIE M, BRADLEY R L. Short-term increases in relative nitrification rates due to trenching in forest floor and mineral soil horizons of different forest types[J]. Plant and Soil, 2003, 252(2): 367–384. |
| [44] | KUZYAKOV Y, FRIEDEL J K, STAHR K. Review of mechanisms and quantification of priming effects[J]. Soil Biology and Biochemistry, 2000, 32(11/12): 1485–1498. |
| [45] | 刘星, 王娜, 赵博, 等. 改变碳输入对太岳山油松林土壤酶活性的影响[J]. 应用与环境生物学报, 2014, 20(4): 655–661. |
| [46] | 桑昌鹏, 万晓华, 余再鹏, 等. 凋落物和根系去除对滨海沙地土壤微生物群落组成和功能的影响[J]. 应用生态学报, 2017, 28(4): 1184–1196. |
| [47] | 林宝平, 林思祖, 何宗明, 等. 不同碳输入方式对沿海防护林土壤氮库的影响[J]. 森林与环境学报, 2016, 36(4): 385–391. |
| [48] | 陈玉平, 吴佳斌, 张曼, 等. 枯落物处理对森林土壤碳氮转化过程影响研究综述[J]. 亚热带资源与环境学报, 2012, 7(2): 84–94. DOI:10.3969/j.issn.1673-7105.2012.02.014 |

 2019, Vol. 39
2019, Vol. 39


