文章信息
- 吴慧, 汤祖武, 卢生昌, 胡会超, 黄六莲, 陈礼辉
- WU Hui, TANG Zuwu, LU Shengchang, HU Huichao, HUANG Liulian, CHEN Lihui
- 高羧基含量TEMPO氧化纤维素的制备与表征
- Preparation and characterization of TEMPO-oxidized cellulose with high carboxyl content
- 森林与环境学报,2019, 39(1): 88-94.
- Journal of Forest and Environment,2019, 39(1): 88-94.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2019.01.015
-
文章历史
- 收稿日期: 2018-03-30
- 修回日期: 2018-07-02
纤维素是自然界中最为丰富的天然高分子,是一种绿色环保的可再生资源。纤维素因来源丰富、价格低廉、可再生、且具有生物可降解性及生物相容性等而被广泛地应用在材料、化工、食品、医药、环境等领域[1]。进一步有效利用纤维素,对纤维素进行功能化改性[2-9],开发具有高附加值和高性能的纤维素基产品成为国内外研发的重点。
氧化纤维素作为一种纤维素衍生物,具有无毒无害、良好的生物相容性和生物可降解性等优点,已被广泛用在医疗、化工和材料等领域[10-11]。通常有两种方法来制备氧化纤维素[12]:非选择性氧化和选择性氧化。非选择性氧化可同时氧化伯羟基和仲羟基,生成醛、酮、酸等多种基团。在氧化反应过程中,伴有多种副反应,分子链剧烈降解,不能有效控制氧化度和降解度;选择性氧化只单独氧化纤维素分子链上的伯羟基或仲羟基,可有效地减少副反应。
选择性氧化纤维素的主要方法有氧化氮类体系氧化法[13-14]、高碘酸盐体系氧化法[15]、TEMPO氧化法[16-17]等。YAEKEL et al[13]在气相NO2条件下研究了纤维素C6位上选择性氧化。氧化纤维素因含氮而呈现黄到棕色,产物高度降解,氧化反应速度慢。de NOOY et al[14]以NaNO3作为氧化剂,NaNO2作催化剂,在磷酸溶液中氧化纤维素。虽然C6位95%以上的伯羟基被氧化成羧基,但C2和C3位上也有10%~20%的仲羟基被氧化成酮基。JACKSON et al[15]用高碘酸钠溶液氧化棉纤维素来制备双醛纤维素,但此体系会破坏纤维素的主链结构。而TEMPO氧化法可选择性氧化纤维素C6位上的伯羟基制备单羧基纤维素,具有污染小、条件温和、成本低、操作简单等优点,引起人们广泛地关注[16-29]。ISOGAI et al[18-22]用TEMPO/NaClO2/NaClO体系氧化阔叶木纤维素制备了TEMPO氧化纤维素。当氧化纤维素羧基含量为0.78 mmol · g-1时,可在水中解离成宽度为5 nm,长度不低于2 μm的高结晶度的纳米纤维[18]。羧基含量在1.09~1.45 mmol · g-1的氧化纤维素可制成医用可吸收止血纱布,应用于手术治疗及整形外科手术中[23]。但是制备医用品对氧化纤维素的羧基含量具有一定的要求;若羧基含量过低,不足以制备具有止血等功能的医药试剂[30-31]。因此,高羧基含量的氧化纤维素有利于其在水溶液中的分散或溶解,有利于其作为中间体进行进一步改性制备高附加值的产品,有助于其在膜材料、胶黏材料、复合材料、医疗用品等方面的应用。
在目前的文献报道中,盐酸水解产生的TEMPO氧化的囊泡晶须的最大氧化度约为10%[32]。将云杉木粉中的木质素去除后,通过TEMPO氧化和超声波处理所制备的超薄纤维素微纤维的氧化度为50%[33]。本课题组[29]曾将纤维素用NaOH/尿素溶解,制备了氧化度为91%的TEMPO氧化纤维素。为了进一步提高TEMPO氧化纤维素的氧化度,本研究以纤维素为原料,采用DMAc/LiCl溶解体系破坏纤维素Ⅰ结构来获得低结晶度的纤维素粉末,利用TEMPO/NaBr/NaClO体系对纤维素粉末进行TEMPO氧化,获得氧化度高达97%的氧化纤维素。
1 材料与方法 1.1 试验原料竹溶解浆板(原纤维素)是由四川天竹竹资源开发有限公司提供。纸浆中的α-纤维素、半纤维素和灰分的含量分别为94.5%、5.2%和0.1%。凝胶渗透色谱法测定的重均分子量为141 000,数均分子量为56 000。分析纯的2, 2, 6, 6 -四甲基哌啶氧化物(TEMPO)、次氯酸钠(NaClO)、溴化钠(NaBr)、氢氧化钠(NaOH)、N, N-二甲基乙酰胺(DMAc)、氯化锂(LiCl)、碳酸氢钠(NaHCO3)、盐酸(HCl)、乙醇(C2H5OH)和氯化钠(NaCl)购自中国天津国药集团化学试剂有限公司。
1.2 TEMPO氧化纤维素的制备高氧化度TEMPO氧化纤维素采用两步法制备:第一步, 将纤维素Ⅰ中的氢键用DMAc/LiCl溶解体系破坏,获得较低结晶度的纤维素粉末,第二步, 通过TEMPO/NaBr/NaClO氧化体系将羟甲基高度选择性氧化成羧基。在TEMPO氧化过程中,NaClO是主要的氧化剂。每消耗2 mol NaClO,1 mol羟甲基转化为1 mol羧酸盐基团[16]。理论上每克纤维素需要使用12.3 mmol NaClO才能将羟甲基氧化成羧基,而本实验中NaClO的用量为25.5 mmol,比理论剂量要高很多。因此,本研究使用足够剂量的NaClO来保证高氧化度TEMPO氧化纤维素的制备。
TEMPO氧化纤维素的制备条件如下:将80 g LiCl溶于1 L DMAc中,加入5 g竹纤维素并加热至100 ℃搅拌2 h,再常温搅拌12 h制得0.5%的纤维素溶液[34]。将此溶液在8 000 r · min-1的转速下常温离心15 min移除少量不溶物得到透明纤维素溶液。将20 L超纯水逐滴滴入到纤维素溶液中并剧烈搅拌,过滤,冷冻干燥3 d得DMAc/LiCl处理的纤维素。
将4.8 g处理后的纤维素放到500 mL超纯水中,搅拌使其完全分散。加入0.16 g TEMPO试剂和12.70 g NaBr,用0.1 mol · L-1 NaOH溶液控制体系的pH值为10左右(pH计检测)。待TEMPO试剂完全溶解后,加入114 mL质量分数为8%的NaClO溶液进行TEMPO氧化反应。反应过程中用0.1 mol · L-1 NaOH溶液维持体系的pH值在10±0.1,直到pH值不再变化。用5 mL无水乙醇终止反应。先将此混合液转移到透析袋于超纯水中透析3 d,冷冻干燥后得到DMAc/LiCl处理的氧化纤维素。
作为对比实验,采用TEMPO体系直接将纤维素进行氧化,以获得直接TEMPO氧化的纤维素。反应条件如下:将4.8 g竹纤维素加到500 mL水中,使其完全分散。加入0.16 g TEMPO、12.70 g NaBr和114 mL质量分数为8% NaClO溶液在pH=10±0.1反应6 h。将样品透析并冷冻干燥后获得直接TEMPO氧化纤维素[21, 29]。
1.3 表征与测试方法 1.3.1 羧基含量的测定准确称取0.054 0 g已完全酸化的样品,置于容积为20 mL的顶空测试瓶中。加入4.0 mL浓度为0.08 mol · L-1 NaHCO3溶液。摇晃测试瓶,使样品充分分散,进行顶空气相色谱测试,记录二氧化碳气相色谱峰的面积(A)。
校正系数的确定:在一组加有4.0 mL浓度为0.08 mol · L-1 NaHCO3溶液的密封顶空样品瓶中分别加入0、10、20、30、40、50 μL浓度为0.01 mol · L-1的盐酸溶液(重复3次),进行顶空气相色谱检测并分别得到它们色谱图信号的峰面积。再以顶空样品瓶中所加入盐酸的绝对量(mol)为横坐标,以所得到相应色谱图信号的峰面积为纵坐标,绘制标准曲线,所得标准曲线的斜率即为校正系数k。通过公式(1)计算羧基含量[35]:
| $ {C_{{\rm{COOH}}}} = \frac{{A - {A_0}}}{{km}} $ | (1) |
式中:CCOOH为待测样品中羧酸基团的含量(mmol · g-1);A为添加样品后检测到的二氧化碳信号峰面积;A0为未添加样品时检测到的二氧化碳信号峰面积;k为校正常数(mmol-1);m为样品的绝干质量(g)。
1.3.2 氧化度的测定氧化度(degree of oxidation, DO)为已被氧化的羟甲基基团的数量与总羟甲基基团数量的比值。电导滴定法的测定如下:50 mg纤维素样品完全分散在15 mL浓度为0.01 mol · L-1 HCl溶液中,搅拌10 min后,用0.005 mol · L-1 NaOH溶液进行滴定,同时通过电导测定仪记录体系中电导率的变化,当溶液pH=11,测定终止。采用公式(2)计算氧化度[32, 36]:
| $ {D_{\rm{O}}} = \frac{{162C\left( {{V_2} - {V_1}} \right)}}{{m - 36C\left( {{V_2} - {V_1}} \right)}} \times 100\% $ | (2) |
式中:C为NaOH溶液浓度(mol · L-1);V2为对应于样品溶液总酸体积所消耗NaOH溶液的量(mL);V1为对应于样品溶液HCl溶液体积所消耗NaOH溶液的量(mL);m为样品的绝干质量(mg)。
1.3.3 FTIR分析将TEMPO氧化纤维素样品酸化,采用KBr压片法在红外光谱仪(BRUKER TENSOR Ⅱ, Karlsruhe)上测定样品的红外吸收谱图。样品与KBr的质量比为1 : 100,扫描次数为64次,测量波长范围为4 000~400 cm-1。
1.3.4 13C NMR分析用核磁(Avance Ⅲ 500, Bruker)对不同样品进行分析,操作条件是4 mm魔角探头,转速5 kHz,脉冲宽度90,交叉极化时间0.05 s,采样间隔时间10 μs, 接触时间2 000 μs,弛豫时间1 s,采集数据点8192。
1.3.5 XRD分析用X射线衍射仪(Shimatzu diffractometer, XRD 6100, Kyushu)波长0.154 05 nm分析不同样品的结晶度,这仪器是在20 kV和5 mA条件下操作,扫描衍射角范围在5°~60°。用结晶度指数(ICr)来表示样品的结晶度。通过公式(3)计算结晶度[37]:
| $ {I_{{\rm{Cr}}}} = \frac{{{I_{200}} - {I_{am}}}}{{{I_{200}}}} \times 100\% $ | (3) |
式中:I200为200晶面衍射峰强度(纤维素Ⅰ的2θ=22.6°,纤维素Ⅱ的2θ=21.7°);Iam为不定性区晶面衍射峰强度(纤维素Ⅰ的2θ=19.0°,纤维素Ⅱ的2θ=16.0°)。
2 结果与讨论 2.1 羧基含量纤维素改性前后的羧基含量通过顶空气相色谱法计算,其羧基含量如表 1所示。原纤维素和DMAc/LiCl处理的纤维素的羧基含量约为0.01 mmol · g-1,表明其中存有微量的羧基。经过TEMPO氧化后,直接TEMPO氧化纤维素的羧基含量为1.27 mmol · g-1,表明TEMPO试剂只氧化原纤维素表面上的伯羟基,并没有进入纤维素Ⅰ晶体的内部,故用足量的NaClO也不能直接制备高羧基含量的TEMPO氧化纤维素。而DMAc/LiCl处理的TEMPO氧化纤维素的羧基含量高达2.02 mmol · g-1,远远大于直接TEMPO氧化纤维素的羧基含量。这说明DMAc/LiCl溶解体系破坏了纤维素Ⅰ结晶区,羟甲基可以充分暴露出来并被TEMPO试剂氧化,导致很高的羧基含量。
| 样品Sample | 羧基含量 Carboxyl content/(mmol·g-1) |
氧化度 Oxidation degree/% |
结晶度 Crystallinity/% |
| 原纤维素Pristine cellulose | 0.01 | 0.3 | 71.0 |
| DMAc/LiCl处理的纤维素DMAc/LiCl-treated cellulose | 0.01 | 0.3 | |
| 直接TEMPO氧化纤维素Direct TEMPO-oxidized cellulose | 1.27 | 53.0 | 69.5 |
| DMAc/LiCl处理后TEMPO氧化纤维素DMAc/LiCl-treated TEMPO-oxidized cellulose | 2.02 | 97.0 |
纤维素改性前后的氧化度通过电导滴定曲线来计算。电导率值和NaOH溶液消耗体积如图 1所示,氧化度如表 1所示。通过电导率滴定法测得原纤维素和DMAc/LiCl处理的纤维素的氧化度约为0.3%。直接TEMPO氧化纤维素的氧化度为53.0%。这说明在TEMPO氧化过程中,原纤维素上约为52.7%的羟甲基被氧化成羧基。DMAc/LiCl处理的TEMPO氧化纤维素的氧化度为97.0%。在本研究中,由于DMAc/LiCl溶解体系破坏了纤维素Ⅰ的晶体结构,TEMPO试剂可以充分与无定形纤维素中的羟甲基反应,使药剂的可及性提高,从而可得到高氧化度的TEMPO氧化纤维素。电导滴定法结果与顶空气相色谱法计算的结果一致。
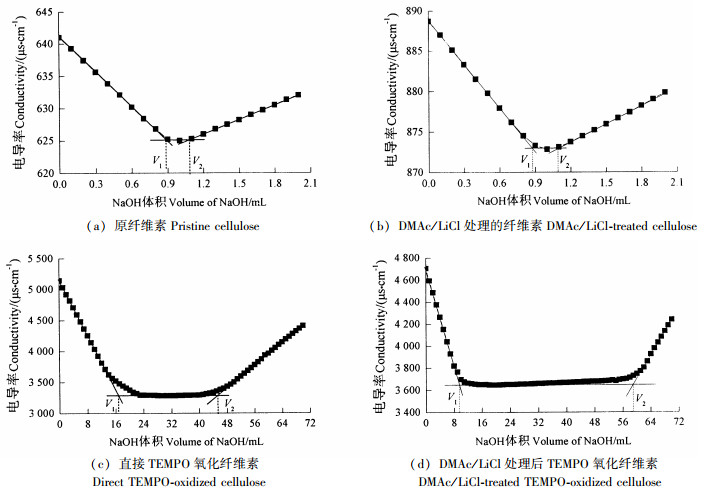
|
图 1 氧化度电导滴定曲线 Fig. 1 Conductivity titration curve of oxidation degree |
纤维素改性前后的FTIR图如图 2所示。在未氧化纤维素的光谱中[图 2(a)、(b)],1 064 cm-1为纤维素主链骨架C—O的伸缩振动,并且不受TEMPO氧化的影响[38-39]。在图 2 (c)、(d)的1 730 cm-1处出现了一个新峰,此峰为C=O伸缩振动。这表明D-葡萄糖单元的羟甲基成功转化为羧基。DMAc/LiCl处理的TEMPO氧化纤维素的C=O的峰强度很强,而直接TEMPO氧化纤维素的C=O峰强度弱,表明DMAc/LiCl处理的TEMPO氧化纤维素的羧基数量最多,氧化程度最高。
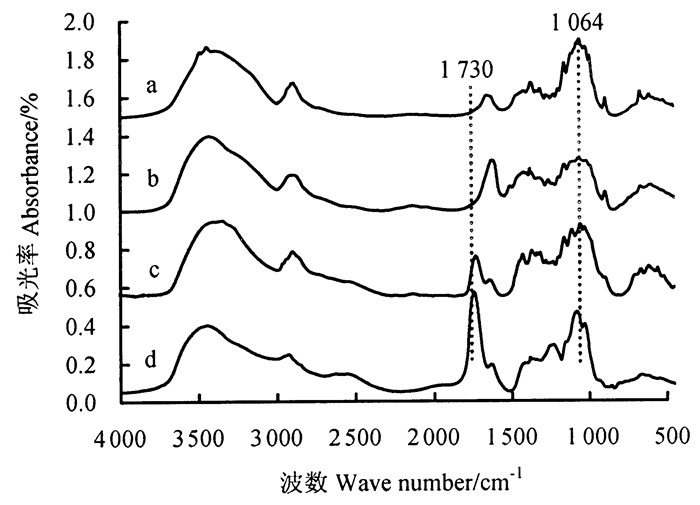
|
注:a代表原纤维素;b代表DMAc/LiCl处理的纤维素;c代表直接TEMPO氧化纤维素;d代表DMAc/LiCl处理TEMPO氧化纤维素。Note: a represents pristine cellulose; b represents DMAc/LiCl-treated cellulose; c represents direct TEMPO-oxidized cellulose and d represents DMAc/LiCl-treated TEMPO-oxidized cellulose. 图 2 红外光谱图 Fig. 2 FTIR spectrum |
图 3为纤维素及其TEMPO氧化纤维素的13C NMR谱图。在原纤维素(图 3a)和DMAc/LiCl处理的纤维素(图 3b)的碳谱图中,δ 104.8处为C1峰,δ 72.3处为C2峰,δ 74.8处为C3峰,δ 88.6处为C4峰,δ 82.5处为C5峰,δ 64.8处为C6峰[40-42]。图 3c是直接TEMPO氧化纤维素的碳谱,可以看出在δ 174.6处出现了一个新的谱峰。该峰为C6′的羧基峰,说明原纤维素中有羟甲基氧化为羧基。同时谱图上还可看见δ 64.8处有C6峰存在,说明直接TEMPO试剂并没有完全氧化C6上的羟甲基。图 3d是DMAc/LiCl处理TEMPO氧化纤维素的碳谱,可知位于δ 174.6处C6′峰强度很大,而δ 64.8处的C6峰很弱,说明原纤维素经过DMAc/LiCl溶解体系处理后,C6上羟甲基的氧化程度显著得到了提高。

|
图 3 13C NMR图 Fig. 3 13C NMR spectrum |
为了进一步验证两步法处理的效果,对纤维素氧化前后进行了XRD表征,如图 4所示。在原纤维素的XRD曲线(图 4a)中,2θ=14.8°、16.4°、22.6°和34.2°处的衍射峰分别为(110)、(110)、(200)和(040)晶面峰[43],显示出典型的纤维素Ⅰ型晶体结构[32]。图 4b为DMAc/LiCl处理的纤维素,其纤维素衍射峰的位置与原纤维素完全不同,只在21°处观测到一个纤维素Ⅱ型的(110) / (200)晶面衍射峰。但是没法对其结晶度进行估算。这表明再生后的纤维素的晶型结构发生了变化,体系中的氢键受到严重破坏,由Ⅰ型晶体结构转变为Ⅱ型晶体或者无定形结构。在以前研究中[29],经过NaOH/尿素处理的纤维素Ⅱ型的结晶度仍有63.2%。这是由于NaOH/尿素体系对纤维素的溶解不够完全,对晶体结构的破坏不够彻底,而DMAc/LiCl体系能更好地破坏纤维素的结晶区。在图 4c中,原纤维素被TEMPO/NaBr/NaClO氧化后,没有观察到峰位置的变化,表明纤维素Ⅰ晶体具有显著的抗氧化性。这是因为原纤维素中氢键排列规整,结晶度高,使TEMPO试剂的可及性降低,氧化反应难以破坏纤维素Ⅰ的晶体结构[32]。图 4d是DMAc/LiCl处理的TEMPO氧化纤维素粉末的衍射图,除了在29.5°处存在一个很宽的散射峰外,很难辨认出结晶衍射峰的存在,这表明经过DMAc/LiCl处理的TEMPO氧化纤维素已经处于无定形状态。而NaOH/尿素处理后TEMPO氧化纤维素的结晶度是26.6%[29]。由此说明DMAc/LiCl体系能更彻底地破坏原纤维素的结晶区,使得TEMPO试剂可以更加充分的进入纤维素内部氧化伯羟基,提高羧基含量。
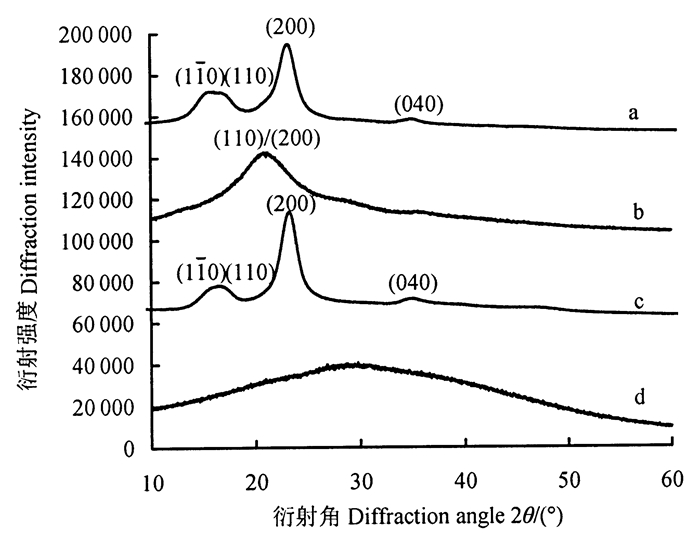
|
注:a代表原纤维素;b代表DMAc/LiCl处理的纤维素;c代表直接TEMPO氧化纤维素;d代表DMAc/LiCl处理TEMPO氧化纤维素。Note: a represents pristine cellulose; b represents DMAc/LiCl-treated cellulose; c represents direct TEMPO-oxidized cellulose and d represents DMAc/LiCl-treated TEMPO-oxidized cellulose. 图 4 XRD图 Fig. 4 X-ray diffraction curves |
采用DMAc/LiCl体系,通过两步法制备高羧基含量、高氧化度的水溶性TEMPO氧化纤维素。第一步采用DMAc/LiCl溶解体系破坏纤维素Ⅰ结构来获得低结晶度纤维素粉末,第二步利用TEMPO/NaBr/NaClO体系对纤维素粉末进行TEMPO氧化。DMAc/LiCl处理TEMPO氧化纤维素的羧基含量高达2.02 mmol · g-1,氧化度高达97%。高氧化度的TEMPO氧化纤维素可应用于医学、造纸、食品、电子产品等领域。
| [1] | WANG S, LU A, ZHANG L N. Recent advances in regenerated cellulose materials[J]. Progress in Polymer Science, 2016, 53: 169–206. DOI:10.1016/j.progpolymsci.2015.07.003 |
| [2] | LIN X X, MA W, WU H, et al. Superhydrophobic magnetic poly(DOPAm-co-PFOEA)/Fe3O4/cellulose microspheres for stable liquid marbles[J]. Chemical Communications, 2016, 52(9): 1895–1898. DOI:10.1039/C5CC08842A |
| [3] | ZHOU X M, LIN X X, WHITE K L, et al. Effect of the degree of substitution on the hydrophobicity of acetylated cellulose for production of liquid marbles[J]. Cellulose, 2016, 23(1): 811–821. DOI:10.1007/s10570-015-0856-z |
| [4] | WU H, WU L H, LU S C, et al. Robust superhydrophobic and superoleophilic filter paper via atom transfer radical polymerization for oil/water separation[J]. Carbohydrate Polymers, 2018, 181: 419–425. DOI:10.1016/j.carbpol.2017.08.078 |
| [5] | 徐思佳, 巫龙辉, 卢生昌, 等. 纤维素接枝2-(全氟辛基)乙基甲基丙烯酸酯共聚物的制备和表征[J]. 纤维素科学与技术, 2016, 24(3): 7–11. |
| [6] | LIN X X, MA W, WU H, et al. Fabrication of cellulose based superhydrophobic microspheres for the production of magnetically actuatable smart liquid marbles[J]. Journal of Bioresources and Bioproducts, 2017, 2(3): 110–115. |
| [7] | 李国炜, 林新兴, 汤祖武, 等. AAO模板法制备纤维素纳米纤维[J]. 纤维素科学与技术, 2017, 25(2): 9–14. |
| [8] | WU H, HIGAKI Y, TAKAHARA A. Molecular self-assembly of one-dimensional polymer nanostructures in nanopores of anodic alumina oxide templates[J]. Progress in Polymer Science, 2018, 77: 95–117. DOI:10.1016/j.progpolymsci.2017.10.004 |
| [9] | 黄六莲, 卢生昌, 黄慧华, 等. 柑橘渣的阳离子化改性及其对刚果红的吸附性能[J]. 森林与环境学报, 2018, 38(3): 265–271. |
| [10] | SAITO T, ISOGAI A. A novel method to improve wet strength of paper[J]. Tappi Journal, 2005, 4(3): 3–8. |
| [11] | FOGLAROVA M, PROKOP J, MILICHOVSKY M. Oxidized cellulose:an application in the form of sorption filter materials[J]. Journal of Applied Polymer Science, 2009, 112(2): 669–678. DOI:10.1002/app.v112:2 |
| [12] | 李琳, 赵帅, 胡红旗. 纤维素氧化体系的研究进展[J]. 纤维素科学与技术, 2009, 17(3): 59–64. DOI:10.3969/j.issn.1004-8405.2009.03.011 |
| [13] | YACKEL E C, KENYON W O. The oxidation of cellulose by nitrogen dioxide[J]. Journal of the American Chemical Society, 1942, 64(1): 121–127. DOI:10.1021/ja01253a032 |
| [14] | de NOOY A E J, PAGLIARO M, VAN BEKKUM H, et al. Autocatalytic oxidation of primary hydroxyl functions in glucans with nitrogen oxides[J]. Carbohydrate Research, 1997, 304(2): 117–123. DOI:10.1016/S0008-6215(97)10004-0 |
| [15] | JACKSON E L, HUDSON C S. Application of the cleavage type of oxidation by periodic acid to starch and cellulose[J]. Journal of the American Chemical Society, 1937, 59(10): 2049–2050. DOI:10.1021/ja01289a077 |
| [16] | de NOOY A E J, BESEMER A C, VANBEKKUM H. Highly selective TEMPO mediated oxidation of primary alcohol groups in polysaccharides[J]. Recueil Des Travaux Chimiques Des Pays-Bas, 1994, 113(3): 165–166. |
| [17] | CHANG P S, Robyt J F. Oxidation of primary alcohol groups of naturally occurring polysaccharides with 2, 2, 6, 6-tetramethyl-1-piperidine oxoammonium ion[J]. Journal of Carbohydrate Chemistry, 1996, 15(7): 819–830. DOI:10.1080/07328309608005694 |
| [18] | SAITO T, HIROTA M, Tamura N, et al. Individualization of nano-sized plant cellulose fibrils by direct surface carboxylation using TEMPO catalyst under neutral conditions[J]. Biomacromolecules, 2009, 10(7): 1992–1996. DOI:10.1021/bm900414t |
| [19] | SAITO T, ISOGAI A. TEMPO-mediated oxidation of native cellulose. The effect of oxidation conditions on chemical and crystal structures of the water-insoluble fractions[J]. Biomacromolecules, 2004, 5(5): 1983–1989. DOI:10.1021/bm0497769 |
| [20] | SAITO T, SHIBATA I, ISOGAI A, et al. Distribution of carboxylate groups introduced into cotton linters by the TEMPO-mediated oxidation[J]. Carbohydrate Polymers, 2005, 61(4): 414–419. DOI:10.1016/j.carbpol.2005.05.014 |
| [21] | SAITO T, KIMURA S, NISHIYAMA Y, et al. Cellulose nanofibers prepared by TEMPO-mediated oxidation of native cellulose[J]. Biomacromolecules, 2007, 8(8): 2485–2491. DOI:10.1021/bm0703970 |
| [22] | ISOGAI A, SAITO T, FUKUZUMI H. TEMPO-oxidized cellulose nanofibers[J]. Nanoscale, 2011, 3(1): 71–85. DOI:10.1039/C0NR00583E |
| [23] | SAFERSTEIN L, WOLF S, KAMP L, et al. Process for preparing a neutralized oxidized cellulose product and its method of use[P]. US 5134229: 1992-07-28. |
| [24] | 杨建校, 章丽萍, 左宋林, 等. TEMPO氧化法制备氧化纤维素纳米纤维[J]. 东北林业大学学报, 2011, 39(3): 96–98. DOI:10.3969/j.issn.1000-5382.2011.03.028 |
| [25] | 戴路, 戴红旗, 袁洋春, 等. TEMPO氧化体系氧化棉纤维的动力学研究[J]. 南京林业大学学报, 2011, 35(2): 93–98. DOI:10.3969/j.issn.1000-2006.2011.02.020 |
| [26] | DAI L, WANG B, LONG Z, et al. Properties of hydroxypropyl guar/TEMPO-oxidized cellulose nanofibrils composite films[J]. Cellulose, 2015, 22(5): 3117–3126. DOI:10.1007/s10570-015-0691-2 |
| [27] | 戴磊, 龙柱, 张丹. TEMPO氧化纤维素纳米纤维的制备及应用研究进展[J]. 材料工程, 2015, 43(8): 84–91. |
| [28] | 叶贵超, 卢芸, 殷亚方, 等. TEMPO氧化和高频超声下埃米级厚度纤维素纳米纤丝的制备[J]. 高分子学报, 2017, 4: 683–691. |
| [29] | TANG Z W, LI W Y, Lin X X, et al. TEMPO-oxidized cellulose with high degree of oxidation[J]. Polymers, 2017, 9(9): 421. |
| [30] | GALGUT P N. Oxidized cellulose mesh:Ⅰ. Biodegradable membrane in periodontal surgery[J]. Biomaterials, 1990, 11(8): 561–564. DOI:10.1016/0142-9612(90)90078-5 |
| [31] | 熊犍, 叶君, 吴奏谦, 等. 羧酸纤维素的制备及其抗凝血性能的研究[J]. 功能高分子学报, 1997, 4(10): 559–563. |
| [32] | HABIBI Y, CHANZY H, VIGNON M R. TEMPO-mediated surface oxidation of cellulose whiskers[J]. Cellulose, 2006, 13(6): 679–687. DOI:10.1007/s10570-006-9075-y |
| [33] | SU Y, BURGER C, MA H, et al. Exploring the nature of cellulose microfibrils[J]. Biomacromolecules, 2015, 16(4): 1201–1209. DOI:10.1021/bm501897z |
| [34] | ZHONG J F, CHAI X S, FU S Y. Homogeneous grafting poly (methyl methacrylate) on cellulose by atom transfer radical polymerization[J]. Carbohydrate Polymers, 2012, 87(2): 1869–1873. DOI:10.1016/j.carbpol.2011.07.037 |
| [35] | 侯庆喜, 柴欣生, 朱俊勇. 应用顶空气相色谱测定纸浆纤维的羧基含量[J]. 中国造纸, 2005, 24(9): 5–9. DOI:10.3969/j.issn.0254-508X.2005.09.002 |
| [36] | DA SILVA PEREZ D, MONTANARI S, VIGNON M R. TEMPO-mediated oxidation of cellulose Ⅲ[J]. Biomacromolecules, 2003, 4(5): 1417–1425. DOI:10.1021/bm034144s |
| [37] | SEGAL L C, CREELY J, MARTIN A E J, et al. An empirical method for estimating the degree of crystallinity of native cellulose using the X-Ray diffractometer[J]. Textile Research Journal, 1959, 29(10): 786–794. DOI:10.1177/004051755902901003 |
| [38] | FRISONI G, BAIARDO M, SCANDOLA M, et al. Natural cellulose fibers:heterogeneous acetylation kinetics and biodegradation behavior[J]. Biomacromolecules, 2001, 2(2): 476–482. DOI:10.1021/bm0056409 |
| [39] | ZINI E, SCANDOLA M, GATENHOLM P. Heterogeneous acylation of flax fibers. Reaction kinetics and surface properties[J]. Biomacromolecules, 2003, 4(3): 821–827. DOI:10.1021/bm034040h |
| [40] | BERTOCCHI C, KONNWICZ P, SIGNORE S, et al. Synthesis and characterisation of polyglucuronan[J]. Carbohydrate Polymers, 1995, 27(4): 295–297. DOI:10.1016/0144-8617(95)00065-8 |
| [41] | TAHIRI C, VIGNON M R. TEMPO-oxidation of cellulose:synthesis and characterisation of polyglucuronans[J]. Cellulose, 2000, 7(2): 177–188. DOI:10.1023/A:1009276009711 |
| [42] | FOLLAIN N, MONTANARI S, JEACOMINE I, et al. Coupling of amines with polyglucuronic acid:evidence for amide bond formation[J]. Carbohydrate Polymers, 2008, 74(3): 333–343. DOI:10.1016/j.carbpol.2008.02.016 |
| [43] | TAKAHASHI Y, MATSUNAGA H. Crystal structure of native cellulose[J]. Macromolecules, 1991, 24(13): 3968–3969. DOI:10.1021/ma00013a035 |

 2019, Vol. 39
2019, Vol. 39

