文章信息
- 桂许维, 张扬, 宋庆妮, 陈欢欢, 杨清培, 栾丰刚
- GUI Xuwei, ZHANG Yang, SONG Qingni, CHEN Huanhuan, YANG Qingpei, LUAN Fenggang
- 毛竹林钾矿物分解细菌的分离与鉴定
- Isolation and identification of the mineral potassium-solubilizing bacteria in Phyllostachys edulis forest
- 森林与环境学报,2018, 38(4): 499-505.
- Journal of Forest and Environment,2018, 38(4): 499-505.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2018.04.018
-
文章历史
- 收稿日期: 2017-12-20
- 修回日期: 2018-05-13
毛竹[Phyllostachys edulis (Carrière)J. Houzeau]是分布面积最大、经济价值最高的笋用和材用竹类资源[1], 其主要依靠鞭根和篼根吸收养分[2]。近年来, 随着毛竹的经济价值不断提高及其在"以竹伐木"保护森林资源中的作用日益受到重视, 毛竹人工集约经营的面积也不断扩大[3]。与其他林种不同的是, 集约化经营毛竹林常受到一些高强度人工活动影响, 如对笋、秆、箨、鞭和根的采伐利用、垦复、施肥等, 许多毛竹林的土壤肥力随经营时间的延长呈下降趋势[1, 4]。在此背景下, 集约化经营毛竹林如何实现可持续经营及长期生产力维持的问题日益受到关注[5]。
微生物肥料不仅可改善土壤微环境, 增加土壤有效养分, 提高土壤肥力, 还可以在一定程度上分泌生长素和抗性物质, 促进植物生长及降低病害发生, 这为合理开发微生物菌肥应用于毛竹林提供了契机。钾矿物分解细菌是一类可以分解硅酸盐矿物并释放其中硅钾元素的细菌, 又称硅酸盐细菌(silicate bacteria)或解钾菌[6-7], 部分菌株还可以产生IAA、铁载体等植物促生物质[8]。国内外学者对钾矿物分解细菌的溶磷、解钾效果[9]及田间应用[10]等开展了大量的研究, 结果表明, 接种钾矿物分解细菌具有提高农作物产量、增强作物抗病能力、改善土壤结构等功能, 在微生物菌肥方面具有广阔的应用前景[11]。
目前, 钾矿物分解细菌资源调查及其多样性的研究工作多针对不同土壤类型[12-13]或不同植物根际土壤[14-15]开展, 关于毛竹林土壤钾矿物分解细菌的研究则未见报道。本研究以钾长石为唯一钾源的选择性培养基, 利用梯度稀释法和平板划线法从毛竹两种根系(鞭根与篼根)根际及非根际土壤中分离筛选出具有溶硅或释钾功能的钾矿物分解细菌, 测定菌株的溶硅、释钾及产IAA活性, 并依据16S rDNA序列特征对兼具溶硅与释钾功能的菌株进行鉴定和系统发育多样性分析, 初步获得了钾矿物分解细菌在毛竹林中的自然分布情况及多功能菌株的多样性信息, 为毛竹林钾矿物分解细菌的研究和应用提供了理论基础。
1 研究区概况与方法 1.1 研究地区概况试验地位于江西农业大学大港实验林场, 北纬28°37′12″, 东经114°55′48″, 该区属于赣西北九岭山中段宜丰县境内, 气候温和, 属中亚热带季风气候区, 降水主要集中在4—6月。土壤类型为山地红壤、山地黄红壤, 由于长期人为干扰与经营, 现存植被类型主要为毛竹林、杉木林等, 其中毛竹林中竹子密度为2 960株· hm-2, 另外伴生少量阔叶树如枫香(Liquidambar formosana Hance)、野鸦椿、薄叶山矾(Symplocos anomala Brand)等(表 1)。
| 物种 Species |
密度 Density/(株·hm-2) |
平均胸径 Mean DBH/cm |
平均高度 Mean height/m |
重要值 Importance value/% |
| 毛竹 Phyllostachys edulis | 3 950 | 12.66 | 10.79 | 81.03 |
| 枫香 Liquidambar formosana | 75 | 8.40 | 6.38 | 6.35 |
| 野鸦椿 Euscaphis japonica | 50 | 6.25 | 4.05 | 2.38 |
| 薄叶山矾 Symplocos anomalav | 25 | 13.00 | 11.90 | 2.13 |
| 其他 Other species | 100 | 8.11 |
本研究样品分3个处理, 分别为鞭根根际土壤(rhizosphere soil of bamboo rhizome root, BRR)、篼根根际土壤(rhizosphere soil of base root, BR)及非根际土壤(non-rhizosphere, NR), 每个处理设3个重复。采集时间为2016年8月, 在毛竹纯林中每隔约30 m选取Ⅱ度竹1棵, 共选择15棵, 分别采集篼根根际、鞭根根际及非根际土壤, 将相邻5株毛竹相同处理的土壤分别混匀。具体操作为沿毛竹基部挖开上层覆土, 追踪到其根系伸展方向, 用修枝剪分开将鞭根与篼根上的细根剪下, 轻轻抖动, 落下的为非根际土, 仍黏在根上的为根际土壤, 用毛刷收集到自封袋4 ℃保存。鞭根根际、篼根根际及非根际土壤pH值分别为4.23±0.10、4.11±0.08和3.88±0.06。
1.3 钾矿物分解细菌分离与纯化分离采用亚历山大罗夫培养基[16], 其中的土壤矿物采用蒸馏水冲洗并阴干的钾长石粉(SiO2:70.12%;Al2O3:15.84%;K2O:9.55%;Na2O:2.65%, 其它微量)代替。采用稀释平板法将每个样品制备3个浓度的土壤悬浮液(10-3、10-4、10-5), 每个浓度3个重复, 经平板涂布后置于28 ℃恒温培养, 3 d后统计典型菌落, 并挑取生长势良好的典型菌落划线纯化培养, 之后转接至营养琼脂(NA)斜面培养基[17], 置于4 ℃保存, 菌株分别按照鞭根根际土壤(BRRi)、篼根根际土壤(BRi)及非根际土壤(NRi)进行编号。
1.4 钾矿物分解细菌的功能分析 1.4.1 钾矿物分解细菌溶硅、释钾测定以钾长石作为唯一硅源和钾源, 参照WELCH & ULLMAN的方法以发酵液中SiO2含量的增加作为硅酸盐矿物溶解的标志[18]。选取50 mL三角瓶, 每瓶中添加20 mL缺钾培养基及120~200目钾长石粉0.2 g, 挑取一环活化好的斜面菌苔接入到液体培养基中, 置于28 ℃摇床培养7 d, 转速为160 r·min-1, 以不接菌摇瓶作为对照, 每株菌重复3次, 发酵液以10 000 r·min-1转速离心15 min, 取上清冷藏保存供硅、钾含量测定。
上述保存发酵液中的水溶性硅与钾含量分别采用硅钼蓝比色法与火焰光度法测定, 具体参照《土壤农化分析》[19], 水溶性硅或钾增加量及相对增加量分别按公式(1)和(2)计算:
| $ \alpha {\rm{ = }}{\rho _{\rm{1}}}-{\rho _0} $ | (1) |
| $ \beta {\rm{ = }}\frac{{\left( {{\rho _{\rm{1}}}-{\rho _0}} \right)}}{{{\rho _0}}} \times 100\% $ | (2) |
式中:α为水溶性硅或钾相对增加量(mg·L-1); β为水溶性钾相对增加量(%); ρ1为接种钾矿物分解细菌发酵液中水溶性硅或钾的含量(mg·L-1); ρ0为未接菌的对照发酵液中水溶性硅或钾的含量(mg·L-1)。依据水溶性硅或钾相对增加量大小判断菌株溶硅、释钾能力强弱。
1.4.2 钾矿物分解细菌产IAA测定对检测具有溶硅或释钾功能的菌株, 参照BANO et al[20]方法测定发酵液中吲哚乙酸(IAA)含量。液体发酵采用含0.5 mg·mL-1色氨酸的有氮液体培养基, 置于28 ℃摇床恒温培养3 d, 转速为160 r·min-1, 发酵液以6 000 r·min-1转速离心10 min取上清, 采用Salkowski法检测。
1.5 溶硅释钾菌株分子鉴定对兼具溶硅与释钾功能的菌株提取基因组DNA后, 采用16S rDNA通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-GGTTACCTTGTTACGACTT-3′进行扩增, PCR产物经电泳检测合格后送上海生物工程有限公司测序。将获得的约1 400 bp基因片段提交至GenBank数据库并获得登录号(表 2), 通过Blast程序与GenBank数据库中已发布的基因序列进行同源性比对分析, 获取的同源性高的序列下载, 并与溶硅释钾菌株序列在BioEdit中的ClustalW软件包[21]进行同源性比较与排列, 采用MEGA 6.0软件以邻接法(Neighbor-Joining)[22]构建系统进化树。
| 菌株编号 Strain number |
菌株保存号 Preservation number |
基因登录号 GenBank accession number |
| BR25 | JXDG201608-1 | MG452776 |
| NR23 | JXDG201608-2 | MG452761 |
| NR24 | JXDG201608-3 | MG452798 |
| NR25 | JXDG201608-4 | MG452777 |
| BRR31 | JXDG201608-5 | MG452784 |
| BRR23 | JXDG201608-6 | MG452790 |
| BRR24 | JXDG201608-7 | MG452773 |
| BRR22 | JXDG201608-8 | MG452771 |
| BR3 | JXDG201608-9 | MG452785 |
| BR18 | JXDG201608-10 | MG452779 |
| BRR16 | JXDG201608-11 | MG452800 |
| BR19 | JXDG201608-12 | MG452774 |
| NR18 | JXDG201608-13 | MG452770 |
| NR33 | JXDG201608-14 | MG452786 |
数据统计与分析处理采用Excel 2010与OriginPro 8.5统计分析软件, 运用One-Way AVONA分析各处理之间的差异显著性。
2 结果与分析 2.1 毛竹林硅酸盐细菌生态分布通过统计发现, 每克干土壤中的钾矿物分解细菌菌落形成数量在(3.7~12.9)×104之间(图 1), 其中以毛竹鞭根根际土壤中最多, 其菌落形成数显著高于蔸根根际土壤(P < 0.05), 钾矿物分解细菌在毛竹根系根际土壤中的分布表现出明显的根系效应。

|
图 1 毛竹林钾矿物分解细菌数量分布 Fig. 1 Distribution of the potassium-solubilizing bacteria in P.edulis forest |
对102株生长迅速的菌株进行溶硅、释钾及产IAA能力鉴定, 得到51株功能菌株, 其中19株菌分离自毛竹林鞭根土壤, 16株菌分离自毛竹林蔸根土壤, 16株菌分离自毛竹林非根际土壤(图 2)。51株功能菌中具有溶硅能力的菌株34株, 具解钾功能的菌株31株, 具产IAA能力菌株5株; 具溶硅与释钾功能的菌株14株; 具溶硅与产IAA功能的4株; 具释钾与产IAA功能的3株; 兼具3种能力的仅有2株(BR18和BR19)。
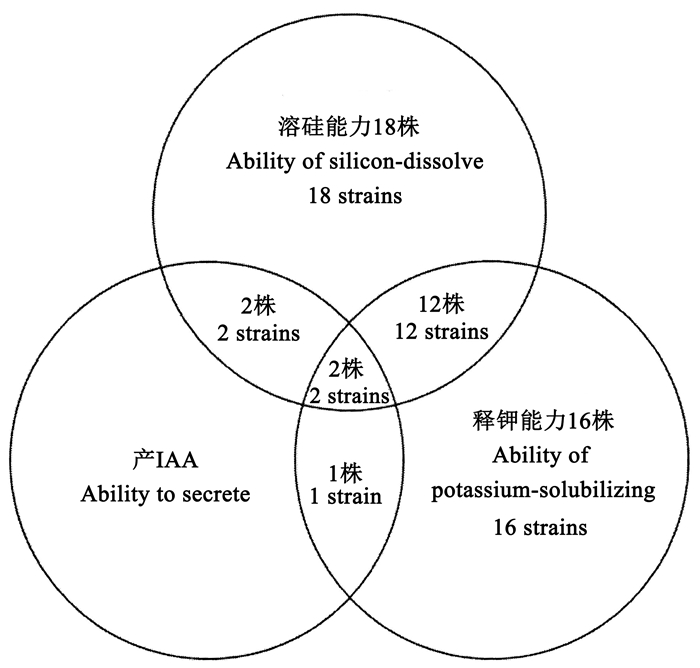
|
图 2 钾矿物分解细菌功能菌株分布Venn图 Fig. 2 Venn chart of functional strains of potassium-solubilizing bacteria |
对菌株溶硅、释钾及产IAA的能力分析可知:34株钾矿物分解细菌发酵液中水溶性硅相对增加量存在较大差异(表 2), 其中NR33、BR25和BR29溶硅能力显著高于其它菌株(P < 0.05), 3株菌较对照分别增加了65.70%、62.49%和48.89%;31株钾矿物分解细菌解钾效率也存在一定差异, 其中菌株NR33的释钾能力显著高于其它菌株(P < 0.05), 较对照增加了29.30%;51株功能菌株中仅有5株具有产IAA的能力, 其中菌株BR5产IAA能力最强(6.642±0.408 mg·L-1)。综合溶硅与释钾能力分析结果, 菌株NR33的活性最高。
| 功能 Function |
等级 Level |
菌株数 Strain number |
菌株 Strain |
| 溶硅能力 Ability of silicon-dissolving |
弱 Weak(0.000~0.100mg·L-1) | 21 | NR25、BRR24、BR19、NR24、NR27、NR18、BRR23、BR10、NR30、NR14、NR28、BR5、NR11、BRR31、BRR22、BR1、BRR16、BR23、BR3、BRR26、BRR18 |
| 中 Medium(0.100~0.400mg·L-1) | 10 | BR2、BRR5、BRR21、BR4、BRR12、BRR14、NR23、NR10、BR18、NR3 | |
| 高 High(0.400~1.000mg·L-1) | 3 | BR25、BR29、NR33 | |
| 释钾能力 Ability of potassium-solubilizing |
弱 Weak(0.000~0.700mg·L-1) | 18 | BRR23、BR32、NR17、BRR9、BRR24、BRR34、BR19、BRR22、BR31、BRR3、BR33、BR3、NR23、BRR31、BRR6、NR25、BR27、NR24 |
| 中 Medium(0.700~1.400mg·L-1) | 11 | BRR16、BRR30、BRR29、BR7、BR18、NR32、BR25、NR21、NR18、BRR35、NR20 | |
| 高 High(1.400~2.100mg·L-1) | 2 | BRR33、NR33 | |
| 产IAA能力 Ability to secrete IAA |
弱 Weak(0.000~2.000mg·L-1) | 1 | BRR33 |
| 中 Medium(2.000~4.000mg·L-1) | 3 | BR18、NR14、BR19 | |
| 高 High(4.000~7.100mg·L-1) | 1 | BR5 |
钾矿物分解细菌液体摇培发酵7 d后, 不同菌株发酵液的pH值较对照(pH值7.2)出现不同程度下降(图 3)。其中水溶性硅增加量与发酵液pH下降值之间呈极显著负相关(P=0.002 41 < 0.01), 而水溶性钾增加量与发酵液pH下降值之间呈负相关(P=0.315 04>0.05)。由上可知, 钾矿物分解细菌的溶硅与释钾作用可能与其产生酸性物质有一定关系, 即菌株产生少量的酸性物质有利于硅、钾元素的溶出, 而产生过多的酸性物质反而会抑制菌株溶硅与释钾能力。而菌株发酵液水溶性硅与钾增加量与pH下降值回归分析的决定系数均较低, 则意味着产酸可能并不是菌株溶硅与释钾的主要因素。
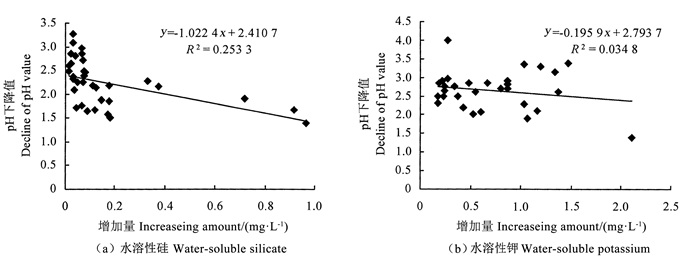
|
图 3 细菌发酵液中水溶性硅、钾与pH下降值间的相关性 Fig. 3 Correlation between the content of water-soluble silicate, potassium and decline value of pH |
通过对14株兼具溶硅与释钾功能的钾矿物分解细菌进行16S rDNA系统发育分析, 结果发现:9株钾矿物分解细菌(63.3%)在系统发育上与伯克霍尔德菌属(Burkholderia)亲缘关系最近, 其余5株钾矿物分解细菌分别属于假单胞菌属(Pseudomonas)、泛菌属(Pantoea)、肠杆菌属(Enterobacter)、四折叠球菌属(Quadrisphaera)和节细菌属(Arthrobacter)5个属(图 4)。两株兼具溶硅释钾及产IAA的菌株BR18和BR19分属于假单胞菌属和肠杆菌属, 溶硅兼具解钾能力最强的菌株NR33属于伯克霍尔德菌属。综上可见, 本研究区域内溶硅兼具释钾的钾矿物分解细菌表现出较高的生物多样性, 其中伯克霍尔德菌属为优势类群。
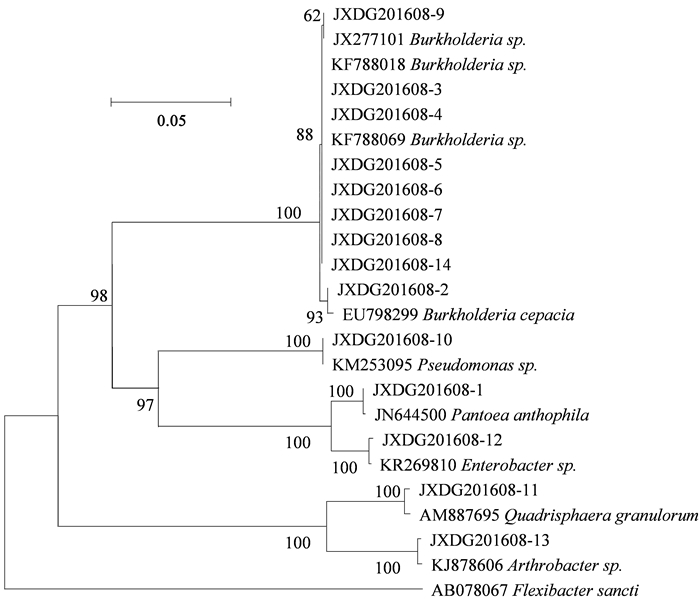
|
图 4 基于16S rDNA序列的14株溶硅释钾菌株系统发育树 Fig. 4 Phylogenetic position of 14 strains of Si/K-solubilizing bacteria based on 16S rDNA |
植物根系在执行其生理活动的同时, 对根际微生物群落与数量也会产生一定影响。如CHAUDHARY et al[23]研究发现, 不仅柳枝稷(Panicum virgatum L.)与麻风树(Jatropha curcas L.)的栽培土壤中微生物群落存在差异, 而且两种植物的根际与非根际土壤微生物群落结构同样存在差异。孟勇等[24]分析了毛竹鞭根根区与非根际土壤微生物数量, 发现鞭根根区根际土壤微生物数量显著高于非根际土壤, 细菌、真菌和放线菌数量分别提高231.7%、116.7%和8.3%。赵建诚[2]在研究了毛竹氮素利用等根系效应时发现, 氮素吸收速率和利用率总体表现为鞭根施肥处理高于篼根施肥, 表现出明显的根系效应。本研究分析比较了毛竹不同根系根际土壤和非根际土壤中钾矿物分解细菌数量分布后发现, 鞭根根际土壤显著高于篼根根际土壤, 钾矿物分解细菌在不同根系根际土壤中的分布表现出明显的偏好性, 这可能是由于毛竹鞭根与篼根的生理过程存在一定差异而造成的。
硅与钾素营养作为植物生长必需的大量元素, 对植物维持正常的生理活动发挥着重要作用[25]。已有的研究表明, 不同生境中钾矿物分解细菌对土壤硅、钾等植物营养元素转化能力的影响较大。如盛下放等[26]筛选的菌株NBT液体摇培120 h的释钾量较对照增加了226.02%;罗娜等[27]从降香黄檀、黄檀根际土壤中分离的菌株JT-K21液体摇培5 d的解钾率达到221.18%;鞠伟[28]从杨树根际分离的菌株JW-7液体摇培7 d的解钾率可达38.70%;陈易等[29]从紫色土中分离得到的菌株XD-K-2液体摇培7 d解钾率较对照高出124%;李新新等[30]从江西红壤中筛选的菌株G4液体摇培7 d的解钾率达27.62%。由此可见, 不同钾矿物分解细菌的解钾能力存在较大差异。本研究分离得到51株溶硅或释钾功能的菌株, 仅有NR33的溶硅与释钾综合效果较好, 较对照分别增加了65.70%与29.30%, 具有良好的研究价值。
目前, 钾矿物分解细菌研究最多的是环状芽孢杆菌(Bacillus circulans)、胶质芽孢杆菌(B.mucilaginosus)和土壤芽孢杆菌(B.edaphicus)等, 而报道的能分解硅酸盐和铝硅酸盐矿物的细菌则多达8个门、20多个属[31]。本研究获得的14株溶硅兼具释钾功能的钾矿物分解细菌分属于6个属, 其中伯克霍尔德菌属为优势类群。经鉴定, 筛选出的溶硅兼具释钾活性最高的菌株NR33也属于伯克霍尔德菌属, 说明毛竹林溶硅兼释钾的钾矿物分解细菌表现出较高的物种多样性, 且伯克霍尔德菌属内资源值得进一步发掘。
本研究获得一批兼具溶硅与释钾功能的细菌, 并对其溶硅与释钾能力进行了测定, 其中NR33表现出高效溶硅释钾能力。下一步将对菌株NR33发酵条件进行优化, 争取在提高其溶硅释钾能力的基础上, 降低大规模发酵生产成本, 以期为改善毛竹林土壤肥力, 研制开发毛竹林微生物菌肥提供科学依据。
| [1] | 楼一平, 吴良如, 邵大方, 等. 毛竹纯林长期经营对林地土壤肥力的影响[J]. 林业科学研究, 1997, 10(2): 125–129. DOI:10.3321/j.issn:1001-1498.1997.02.003 |
| [2] | 赵建诚.毛竹氮素利用规律及影响因子研究[D].北京: 中国林业科学研究院, 2016. |
| [3] | 辉朝茂, 杨宇明, 郝吉明. 论竹子生态环境效益与竹产业可持续发展[J]. 西南林学院学报, 2003, 23(4): 25–29. |
| [4] | 刘广路, 范少辉, 苏文会, 等. 施肥时间对毛竹林生产力分配格局及土壤性质的影响[J]. 东北林业大学学报, 2011, 39(4): 62–66. DOI:10.3969/j.issn.1000-5382.2011.04.019 |
| [5] | 楼一平, 李艳霞, BUCKINGHAM K. 中国竹林可持续经营认证的必要性和可行性研究[J]. 竹子研究汇刊, 2008, 27(3): 1–7. DOI:10.3969/j.issn.1000-6567.2008.03.001 |
| [6] | 陈廷伟. 钾细菌[M]. 北京: 农业出版社, 1959. |
| [7] | 赵飞, 盛下放, 黄智, 等. 山东地区钾矿物分解细菌的分离及生物学特性[J]. 生物多样性, 2008, 16(6): 593–600. DOI:10.3321/j.issn:1005-0094.2008.06.010 |
| [8] | 曹建芳.硅酸盐矿物分解细菌的定向筛选及其活化土壤硅的研究[D].南京: 南京农业大学, 2010. |
| [9] | 盛下放, 黄为一. 硅酸盐细菌NBT菌株释钾条件的研究[J]. 中国农业科学, 2002, 35(6): 673–677. DOI:10.3321/j.issn:0578-1752.2002.06.016 |
| [10] | 林启美, 饶正华, 孙焱鑫, 等. 硅酸盐细菌的筛选及其对番茄营养的影响[J]. 中国农业科学, 2002, 35(1): 59–62. DOI:10.3321/j.issn:0578-1752.2002.01.012 |
| [11] | 连宾, SMITH D L, 傅平秋. 硅酸盐细菌在工农业生产中的应用及其作用机理[J]. 贵州科学, 2000, 18(1/2): 43–53. |
| [12] | 盛下放. 硅酸盐细菌在不同生境土壤中的分布[J]. 土壤, 2004, 36(1): 81–84. |
| [13] | 胡桦, 陈强, 李登煜, 等. 紫色土硅酸盐细菌的遗传多样性研究[J]. 土壤学报, 2007, 44(2): 379–383. DOI:10.3321/j.issn:0564-3929.2007.02.028 |
| [14] | 韩晓阳, 周波, 董玉惠, 等. 山东茶园土壤高活性解钾细菌的筛选鉴定及肥效研究[J]. 茶叶科学, 2018, 38(1): 78–86. DOI:10.3969/j.issn.1000-369X.2018.01.008 |
| [15] | 张晶晶, 李建贵, 郭艺鹏. 新疆核桃根际土壤中解钾菌的分离筛选及鉴定[J]. 经济林研究, 2016, 34(2): 30–34. |
| [16] | 中国科学院南京土壤研究所微生物室. 土壤微生物研究法[M]. 北京: 科学出版社, 1985. |
| [17] | 张小丽.胀袋酱油中产气微生物的分离、鉴定与特性研究[D].杭州: 浙江工商大学, 2015. |
| [18] | WELCH S A, ULLMAN W J. The effect of organic acids on plagioclase dissolution rates and stoichiometry[J]. Geochimica et Cosmochimica Acta, 1993, 57(12): 2 725–2836. DOI:10.1016/0016-7037(93)90386-B |
| [19] | 鲍世旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000. |
| [20] | BANO N, MUSARRAT J. Isolation and characterization of phorate degrading soil bacteria of environmental and agronomic significance[J]. Letters in Applied Microbiology, 2003, 36(6): 349–353. DOI:10.1046/j.1472-765X.2003.01329.x |
| [21] | HALL T A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT[J]. Nucleic Acids Symposium Series, 1999, 41: 95–98. |
| [22] | TAMURA K, STECHER G, PETERSON D, et al. MEGA6: molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 2013, 30(12): 2725–2729. DOI:10.1093/molbev/mst197 |
| [23] | CHAUDHARY D R, SAXENA J, LORENZ N, et al. Microbial profiles of rhizosphere and bulk soil microbial communities of biofuel crops switchgrass (Panicum virgatum L.) and Jatropha (Jatropha curcas L.)[J]. Applied and Environmental Soil Science, 2012, 2012: 906 864. |
| [24] | 孟勇, 艾文胜, 李美群, 等. 毛竹鞭根区土壤微生物数量及其与土壤养分含量的关系[J]. 湖南林业科技, 2015, 42(5): 1–5. DOI:10.3969/j.issn.1003-5710.2015.05.001 |
| [25] | 潘瑞炽. 植物生理学[M]. 6版. 北京: 高等教育出版社, 2008. |
| [26] | 盛下放, 黄为一, 曹晓英. 硅酸盐细菌NBT菌株解钾效能及对钾的吸持作用[J]. 植物营养与肥料学报, 2001, 7(4): 459–466. DOI:10.3321/j.issn:1008-505X.2001.04.017 |
| [27] | 罗娜, 周德明, 徐睿, 等. 降香黄檀、檀香根际解钾菌的筛选与活性研究[J]. 热带作物学报, 2016, 37(5): 964–970. DOI:10.3969/j.issn.1000-2561.2016.05.018 |
| [28] | 鞠伟.杨树根际高效解钾细菌的分离筛选与鉴定[D].南京: 南京林业大学, 2016. |
| [29] | 陈易, 程永毅, 郭涛, 等. 一株具紫色土亲和性解钾菌的筛选及促生效应[J]. 西南大学学报(自然科学版), 2016, 38(5): 58–65. |
| [30] | 李新新, 高新新, 陈星, 等. 一株高效解钾菌的筛选、鉴定及发酵条件的优化[J]. 土壤学报, 2014, 51(2): 381–388. |
| [31] | 王鹏.不同季节不同风化程度矿物表生可培养钾矿物分解细菌多样性研究[D].南京: 南京农业大学, 2011. |

 2018, Vol. 38
2018, Vol. 38


