文章信息
- 谢婉凤, 梁光红, 张飞萍
- XIE Wanfeng, LIANG Guanghong, ZHANG Feiping
- 松材线虫侵染对马尾松基因表达的影响
- Effect of Bursaphelenchus xylophilus infestation to the gene expression of Pinus massoniana
- 森林与环境学报,2018, 38(4): 481-487.
- Journal of Forest and Environment,2018, 38(4): 481-487.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2018.04.015
-
文章历史
- 收稿日期: 2018-04-08
- 修回日期: 2018-06-21
2. 福建农林大学林学院, 福建 福州 350002
2. College of Forestry, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
马尾松(Pinus massoniana Lamb.)是我国松树品种中分布最广、数量最多的用材树种。松材线虫[Bursaphelenchus xylophilus (Steiner & Bührer)]病则是危害松树生长的一种毁灭性病害。受松材线虫侵染后松树蒸腾作用减弱、松脂分泌减少, 最终整株枯萎死亡[1]。我国自1982年在江苏省首次发现该病后的25 a间, 全国病害发生面积超过11万hm2, 导致松树死亡5 000万株以上, 给林业造成了重大的经济损失[2-3]。可见, 松材线虫病害是马尾松生产过程中的主要危害因素之一。
植物体在遭受病害时, 其转录水平上的基因表达变化明显, 并影响植株对病害的防御能力。研究植物在受到病原侵害时的基因表达变化, 揭示其分子响应过程, 并从中寻找关键基因, 是利用现代生物学技术培育抗病马尾松品种的重要前提。当前, 不断发展的高通量测序技术为全面揭示植物体在不同环境条件下的转录水平响应并寻找调控植物抗逆防御关键基因提供重要基础。WESTERMANN et al[4]介绍了一种可以对病原菌和寄主同时进行RNA-Seq的技术, 此法不仅能够同时分析两者的基因表达, 而且还能分析病原菌与寄主的相互作用基因, 有利于深入揭示病原菌与寄主互作的相关机制。GAO et al[5]利用高通量RNA-Seq技术研究了抗疫病转基因马铃薯及其未转基因的野生型在晚疫病病原菌侵染下的转录组动态表达, 结果共检测到29 319个基因转录本, 在这些基因中, 有1 102个基因在相同处理时间下的转基因和野生型中的表达存在差异, 其中编码乙烯响应因子、纤维素合成酶、几丁质酶和因子诱导型细胞色素P450等31个与抗病能力密切相关的基因在转基因样本中被诱导表达, 而其在野生型中的表达则受到抑制。可见, 通过高通量测序技术获得丰富的转录组信息可为寻找关键基因提供有力保证。
松材线虫侵染也会引起马尾松中大量基因的表达发生变化, 由于目前数据库中尚无马尾松完整基因组数据, 使得马尾松中大部分基因的功能仍未知, 而揭示这些未知基因的功能需做大量的研究工作。针对此, 基于不同物种之间基因的同源性比对可以预测马尾松中部分基因的功能。谢婉凤[6]前期利用RNA-seq技术比较松材线虫侵染不同时间下的马尾松针叶中mRNA表达变化, 并对这些表达发生变化的mRNA进行同源性比对, 结果显示, 除了大部分功能未知的基因外, 一些与信号转导、植物抗病防御以及细胞生长代谢相关的基因得到鉴定, 其表达水平在松材线虫侵染后的马尾松中发生变化。其中, 信号转导相关基因是植物感受病原侵入并传递信息的重要因子, 植物抗病防御相关基因则在植物受病原菌侵染后的抗病能力调节中发挥作用, 因而对这些功能基因的动态表达情况进行研究能够进一步揭示它们在马尾松抗病防御过程中的重要作用。据此, 本研究在上述基础上, 利用实时荧光定量PCR (qPCR)检测松材线虫侵染下的马尾松针叶中的信号转导以及抗逆相关基因的动态表达, 揭示马尾松响应松材线虫侵染的基因表达变化行为, 为利用现代分子生物学技术培育抗病马尾松品种提供理论基础。
1 材料与方法 1.1 供试材料供试马尾松取自福建林业科学院的2年生幼苗, 并种植于福建农林大学森林保护研究所温室中。供试松材线虫分离自福建省龙岩市、南平市、三明市、漳州市的马尾松疫木, 课题组前期通过致病力检测显示漳州市的马尾松疫木分离获得的松材线虫虫株具有较强致病力, 松材线虫虫株在拟盘多毛孢菌(Pestalotiopsis sp.)菌落上纯培养[7]。
1.2 研究方法 1.2.1 松材线虫侵染马尾松松材线虫的悬浮液制备及接种马尾松的方法参照徐华潮等[7]和谢婉凤等[8]前期采用的皮接法, 在距离马尾松基部10 cm的主茎的一侧用无菌刀片斜切1个长度约1 cm的伤口, 伤口深至木质部, 继而在伤口内固定一个经灭菌处理的脱脂棉球, 用封口膜将棉球固定形成斜漏斗状, 并往棉球中注入100 μL松材线虫悬浊液, 使得每株马尾松接种松材线虫的数量为2 000条, 其间保湿24 h以保证松材线虫侵染成功, 并以接种100 μL无菌水的马尾松作为对照, 处理组与对照组均放置于30 ℃温室中培养。在接种后第1、2、3天, 分别取处理组和对照组马尾松的针叶, 液氮速冻, 用于总RNA的提取。每个处理时间及其对照均设3个重复。
1.2.2 总RNA提取及逆转录采用天根生化科技(北京)有限公司的RNAprep Pure多糖多酚植物总RNA提取试剂盒分别提取处理与对照马尾松针叶组织中的总RNA, 再采用TIANscript RT Kit (cDNA第一链合成试剂盒)对总RNA进行逆转录, 合成单链cDNA。
1.2.3 qPCR检测基因的动态表达本研究检测了编码钙结合蛋白(calcium-binding protein, CBP), 类受体蛋白激酶(receptor-like protein kinase, RLK), 富亮氨酸重复受体激酶-类丝氨酸/苏氨酸蛋白激酶(leucine-rich repeat receptor-like serine/threonine-protein kinase), 热激同源70 kDa蛋白(heat shock cognate 70 kDa protein, Hsc70), 烟碱酰胺合成酶基因(nicotianamine synthase, NAS), 几丁质酶(chitinase), DNA/RNA聚合酶超家族蛋白(DNA/RNA polymerases superfamily protein), 类三角形四肽超家族蛋白异构体9 (tetratricopeptide repeat-like superfamily protein isoform 9), 脱水响应蛋白(dehydration responsive protein), 细胞壁水解酶(cell wall-associated hydrolase), 细胞色素P450单加氧酶超家族(cytochrome P450 mono-oxygenase superfamily)和细胞色素P450 (cytochrome P450)等基因的表达情况(表 1), 并以肌动蛋白(actin)为内参基因, 采用Primer Premier 5.0设计各基因的qPCR扩增引物(表 2)。qPCR试剂采用北京全式金生物技术有限公司的EasyScript® One-step RT-PCR SuperMix, 并在Applied Biosystems实时荧光定量PCR仪器上完成。对照组样本中的mRNA的表达量归一化(normalize)为1, 侵染组与对照组的相对表达变化量采用2-ΔΔCT法进行计算[9], 处理组与对照组之间的显著性差异分析采用T检验法(P < 0.05), 并用“*”表示处理组与对照组存在显著性差异。
| 预测功能 Predict function | 基因 Gene |
| 钙结合蛋白 Calcium-binding protein | |
| 类受体蛋白激酶 Receptor-like protein kinase | |
| 信号传导 Signal transduction | 富亮氨酸重复受体激酶-类丝氨酸/苏氨酸蛋白激酶 Leucine-rich repeat receptor-like serine/threonine-protein kinase |
| 热激同源70 kDa蛋白 Heat shock cognate 70 kDa protein | |
| 烟碱酰胺合成酶基因 Nicotianamine synthase | |
| 防御基因 Defense gene | 类三角形四肽超家族蛋白异构体 9 Tetratricopeptide repeat-like superfamily protein isoform 9 |
| 几丁质酶 Chitinase | |
| DNA复制相关 DNA replication | DNA/RNA聚合酶超家族蛋白 DNA/RNA polymerases superfamily protein |
| 水分胁迫相关 Water Stress | 脱水响应蛋白 Dehydration responsive protein |
| 细胞壁水解相关 Cell wall hydrolysis | 细胞壁水解酶 Cell wall-associated hydrolase |
| 解毒相关 Detoxification | 细胞色素P450单加氧酶超家族 Cytochrome P450 mono-oxygenase superfamily 细胞色素 P450 Cytochrome P450 |
| 候选基因 Candidate gene | 上游引物序列 Forward primer sequence | 下游引物序列 Reverse primer sequence |
| 钙结合蛋白 Calcium-binding protein | 5′-GAGGCGGAGATTGATGGAG-3′ | 5′-ACAGCGGCAGCGGAGTTT-3′ |
| 富亮氨酸重复受体激酶-类丝氨酸/苏氨酸蛋白激酶 Leucine-rich repeat receptor-like serine/threonine-protein kinase | 5′-TGAGACACTCGGTTTGTTGGC-3′ | 5′-CAGTTGGAGGAAAGTCGTCGGTA-3′ |
| 类受体蛋白激酶 Receptor-like protein kinase | 5′-GCTAAACGGCTCGGAATG-3′ | 5′-GCGGTTGCGTATCAGTCA-3′ |
| 热激同源70 kDa蛋白 Heat shock cognate 70 kDa protein | 5′-CGCTGGGAGTCGTTGAA-3′ | 5′-ACCACGCCGTCCTATGT-3′ |
| 烟碱酰胺合成酶 Nicotianamine synthase | 5′-TCCGCCGTCACCTTCT-3′ | 5′-TTCGGTCCCGCCTAAT-3′ |
| 几丁质酶 Chitinase | 5′-CGAGGGCAAGGGATTCTA-3′ | 5′-ATTCCTGGCTGTTGATGGC-3′ |
| DNA/RNA聚合酶超家族蛋白 DNA/RNA polymerases superfamily protein | 5′-TCAGTTCCGCTTATCACCCG-3′ | 5′-CATCCGCACTTCGCTTCTC-3′ |
| 类三角形四肽超家族蛋白异构体9 Tetratricopeptide repeat-like superfamily protein isoform 9 | 5′-ATGTGCTCATCGGGCTCT-3′ | 5′-AGGGTGACTTGGCTTGT-3′ |
| 细胞色素P450单加氧酶超家族 Cytochrome P450 mono- oxygenase superfamily | 5′-AATCCGTCGTAGGCAACA-3′ | 5′-GCCCGCCACATAGAAAT-3′ |
| 细胞色素P450 Cytochrome P450 | 5′-GTCGGAAACCTCCACCAAC-3′ | 5′-TAGGGACTGAGCCCAAGC-3′ |
| 细胞壁水解酶 Cell wall-associated hydrolase | 5′-CTCTAACCAAACTCCGAATACC-3′ | 5′-CGCACTTCCGATACCTCCAT-3′ |
| 脱水响应蛋白 Dehydration responsive protein | 5′-ATACTCATCTCGCCCACC-3′ | 5′-GAGCGTTCTGTAAGCCTGT-3′ |
| 肌动蛋白 Actin | 5′-CCTTGGCAATCCACATC-3′ | 5′-TCACCACTACGGCAGAAC-3′ |
图 1为利用qPCR检测的松材线虫侵染1、2、3 d的马尾松较其对照样本中信号转导基因的表达变化。结果显示, 松材线虫侵染后, 钙结合蛋白、类受体蛋白激酶、富亮氨酸重复受体激酶-类丝氨酸/苏氨酸蛋白激酶、热激同源70 kDa蛋白基因在侵染样本中的表达量均低于对照样本。其中, 钙结合蛋白在植物与病菌互作信号转导途径(plant-pathogen interaction)中参与Ca2+信号通路; 类受体蛋白激酶通过胞外结构域识别病原信号分子, 发生磷酸化、去磷酸化反应而开启或关闭下游靶蛋白, 调节植物固有免疫反应, 诱导抗病防御反应; 热激同源70 kDa蛋白则能够降低植物的活性氧自由基(reactive oxygen species, ROS)含量, 减少ROS对植物细胞膜的伤害, 同时也影响ROS在植物逆境中传递信号的作用。受松材线虫侵染的马尾松的这些基因在受侵染的样本中下调表达将不利于植株对病原信号分子的识别, 影响抗性防御。
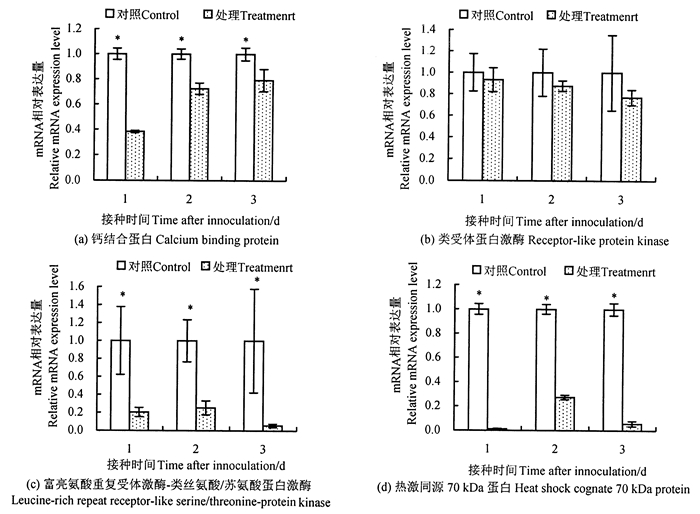
|
图 1 病原信号转导相关基因的动态表达 Fig. 1 Dynamic expression of pathogen signal transduction genes |
植物-病菌互作途径中的信号传递相关基因的表达变化可引起下游的病害防御相关基因的表达变化。图 2为松材线虫侵染后马尾松防御基因的动态表达, 其中, 编码烟碱酰胺合成酶和类三角形四肽超家族蛋白异构体9的基因在受侵染的马尾松中表达量均低于对照样本, 而几丁质酶基因则在松材线虫侵染后第1天的马尾松针叶中的表达水平显著高于对照植株, 随着时间的延长, 该基因在处理样本中的表达量逐渐降低, 在接种第2、3天的处理样本中的表达低于对照样本。由此可见, 松材线虫侵染抑制了马尾松中病害防御基因的表达, 可能影响其对松材线虫侵害的防御系统的调控。

|
图 2 防御基因的动态表达 Fig. 2 Dynamic expression of defense genes |
松材线虫侵染同样影响马尾松中跟遗传物质复制相关的基因的表达, 本研究发现, 与DNA复制相关的基因, DNA/RNA聚合酶超家族蛋白在松材线虫侵染不同时间下的样本中的表达量均低于对照样本(图 3)。可见松材线虫侵染还影响了马尾松针叶细胞中遗传物质的复制过程。
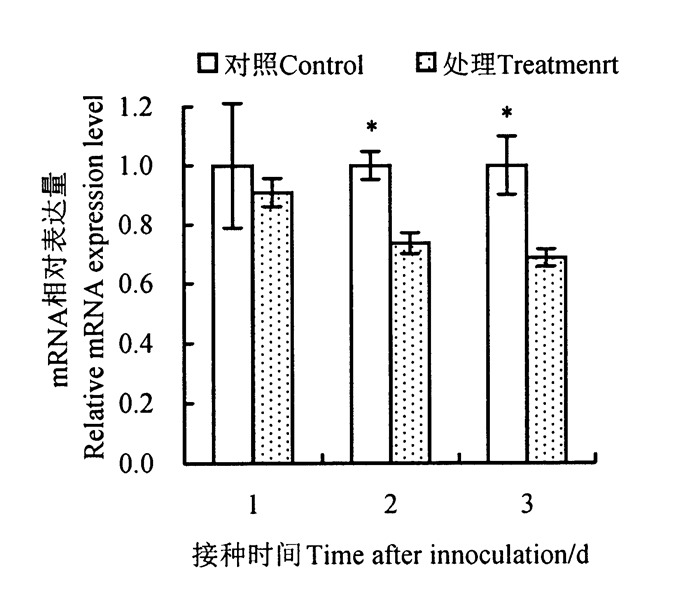
|
图 3 DNA/RNA聚合酶超家族蛋白基因的动态表达 Fig. 3 Dynamic gene expression of DNA/RNA polymerases superfamily protein |
图 4为脱水响应蛋白的编码基因的动态表达。松材线虫侵染致使马尾松针叶逐渐失水并枯萎, 本研究发现受侵染的马尾松针叶中的脱水响应蛋白的编码基因较对照组下调表达, 这可能是受侵染的马尾松针叶对水分缺失的基因响应。

|
图 4 脱水响应蛋白基因的动态表达 Fig. 4 Dynamic gene expression of dehydration responsive protein |
qPCR检测还显示, 松材线虫侵染明显影响了马尾松针叶中与解毒功能相关的细胞色素P450和细胞色素P450单加氧酶超家族基因的表达, 其中编码细胞色素P450的成员基因在松材线虫接种后第1天的马尾松针叶的表达较对照样本有所下调, 接种后第2天, 基因的表达丰度提高, 并高于对照样本, 接种后第3天则在处理样本中的表达量低于对照样本[图 5(a)]。
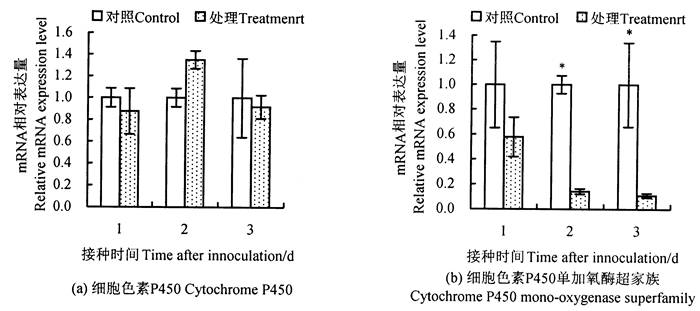
|
图 5 细胞色素P450及其单加氧酶基因的动态表达 Fig. 5 Dynamic gene expression of cytochrome P450 and cytochrome P450 mono-oxygenase superfamily |
与之相对, 编码细胞色素P450单加氧酶超级家族的基因在松材线虫接种后第1、2、3天的马尾松针叶的表达量均低于对照, 可见松材线虫侵染明显抑制了马尾松中该基因的表达[图 5(b)]。
2.6 马尾松针叶中细胞壁水解酶基因的动态表达细胞壁水解酶基因在处理样本中的表达较对照样本低(图 6), 表明马尾松在防御松材线虫侵染过程中具有自我调节作用。

|
图 6 细胞壁水解酶基因的动态表达 Fig. 6 Dynamic gene expression of cell wall-associated hydrolase |
研究不同环境条件下, 生物体中功能基因的动态表达是揭示其生物学响应机制的重要过程, 明确该过程对了解生物体应对环境变化的适应调节机制具有十分重要的意义。松材线虫侵染往往导致松树的最终枯萎死亡, 而在这一过程中存在着信号转导、抗逆防御、代谢等相关基因的表达变化过程[10-12]。本研究利用qPCR检测了松材线虫侵染下的马尾松中的信号转导、防御响应、DNA复制、解毒相关基因的动态表达情况, 结果发现松材线虫侵染抑制了马尾松中的这些通路的大部分基因的表达。
在松材线虫的侵染下, 马尾松中的一些与信号转导相关的基因如类受体蛋白激酶[13]、钙结合蛋白[14]、热激同源70 kDa蛋白[15]等表达下调, 从而影响马尾松对病原侵入的信号传递, 并将影响植物中一些病原识别元件如NBS-LRR类抗病蛋白的表达。NBS-LRR是植物防御病原微生物侵害的重要因子, 该基因的增强表达能够提高植物对植物病原微生物的防御能力[16-17]。松材线虫侵染下马尾松针叶中这些基因表达呈下调趋势, 将不利于马尾松的抗病能力的积累。
此外, 下游的编码烟碱酰胺合成酶、类三角形四肽超家族基因也下调表达, 这些基因编码的蛋白是植物在逆境胁迫下表达的一类蛋白[18-20], 其表达丰度体现植物对逆境的响应敏感度。几丁质酶也是主要的植物病程相关蛋白(PR蛋白)之一[21-22], 真菌、细菌、病毒都可能诱导特定植物的某些几丁质酶的活性迅速上升[22]。本研究发现马尾松中几丁质酶基因在松材线虫侵染1 d的组织中迅速显著提高表达, 体现了马尾松对松材线虫侵害的快速响应, 然而这些基因在侵染第2天的马尾松中迅速下调表达, 并在第3天中的表达水平进一步降低, 这些结果预示松材线虫侵染对马尾松抗性的抑制作用, 可能导致马尾松的全身性伤害。与此同时, 参与细胞解毒作用的细胞色素P450相关基因的表达也发生变化, 细胞色素P450是一类大家族, 含有多个基因成员, 不同的成员基因对胁迫因子的响应程度也存在差异[23-24]。本研究中编码细胞色素P450单加氧酶超家族的基因在松材线虫侵染不同时间下的马尾松中的表达均低于对照组, 而细胞色素P450基因的表达则呈现先下调后上调再下调的表达变化趋势, 该结果也体现了不同成员基因的响应差异, 而随着侵染时间的延长, 这类基因的表达均低于对照组, 将不利于马尾松的解毒作用而导致植株系统抗性的不断减弱。
植物对病原防御能力的下降也使得遗传物质复制相关的基因发生相应的变化, 其中参与细胞分裂过程中DNA复制的DNA/RNA聚合酶超家族蛋白的基因下调表达, 将影响细胞的生命活动过程[25]。
综上, 笔者前期利用RNA-seq测序技术研究了松材线虫侵染后马尾松转录组的表达变化, 结果发现与信号转导、抗病防御、生长及解毒相关的多个基因在受侵染的马尾松的表达较其对照样本低[6]。本研究利用实时荧光定量PCR检测技术进一步研究了这些基因在松材线虫侵染不同时间下的马尾松中的动态表达情况。结果显示大部分基因在松材线虫侵染后的马尾松中的表达水平显著降低, 研究结果进一步证实了松材线虫侵染对马尾松抗病相关基因表达的抑制作用, 其中与信号转导相关的基因对马尾松的应激响应及调控下游的抗病基因的表达具有重要作用。因此, 揭示松材线虫侵染不同时间长度下, 马尾松中的基因表达变化, 可初步阐述松材线虫侵染导致马尾松枯萎死亡的基因表达变化过程及引起相关代谢通路强度变化的基因响应, 并为利用现代分子生物学技术培养抗病马尾松品种提供基因资源。
| [1] | FUKUDA K. Physiological process of the symptom development and resistance mechanism in pine wilt disease[J]. Journal of Forest Research, 1997, 2(3): 171–181. DOI:10.1007/BF02348216 |
| [2] | 程瑚瑞, 林茂松, 钱汝驹. 拟松材线虫(Bursaphelenchus mucronatus)的形态诊断和致病性研究[J]. 南京农业大学学报, 1986, 9(2): 55–61. |
| [3] | ZHAO B G. Pine wilt disease in China[M]//ZHAO B G, FUTAI K, SUTHERLAND J R, et al. Pine wilt disease. Tokyo: Springer, 2008: 18-25. |
| [4] | WESTERMANN A J, GORSKI S A, VOGEL J. Dual RNA-seq of pathogen and host[J]. Nature Reviews Microbiology, 2012, 10(9): 618–630. DOI:10.1038/nrmicro2852 |
| [5] | GAO L, TU Z J, MILLETT B P, et al. Insights into organ-specific pathogen defense responses in plants:RNA-seq analysis of potato tuber-Phytophthora infestans interactions[J]. BMC Genomics, 2013, 14: 340. DOI:10.1186/1471-2164-14-340 |
| [6] | 谢婉凤.松材线虫侵染下马尾松的生理与分子变化研究[D].福州: 福建农林大学, 2017: 45-62. |
| [7] | 徐华潮, 骆有庆, 张琴. 松材线虫自然侵染对黑松、马尾松针叶含水量、色素及抗氧化酶活性的影响[J]. 林业科学, 2012, 48(11): 140–143. DOI:10.11707/j.1001-7488.20121123 |
| [8] | 谢婉凤, 李慧敏, 黄爱珍, 等. 马尾松响应松材线虫侵染的基因动态表达变化[J]. 福建农业学报, 2017, 32(4): 403–409. |
| [9] | LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402–408. DOI:10.1006/meth.2001.1262 |
| [10] | ZHENG H Y, XU Y, XU F Y, et al. A comparative proteomics analysis of Pinus massoniana inoculated with Bursaphelenchus xylophilus[J]. Pakistan Journal of Botany, 2015, 47(4): 1 271–1 280. |
| [11] | HIRAO T, FUKATSU E, WATANABE A. Characterization of resistance to pine wood nematode infection in Pinus thunbergii using suppression subtractive hybridization[J]. BMC Plant Biology, 2012, 12: 13. DOI:10.1186/1471-2229-12-13 |
| [12] | SANTOS C S, PINHEIRO M, SILVA A I, et al. Searching for resistance genes to Bursaphelenchus xylophilus using high throughput screening[J]. BMC Genomics, 2012, 13: 599. DOI:10.1186/1471-2164-13-599 |
| [13] | MORILLO S A, TAX F E. Functional analysis of receptor-like kinases in monocots and dicots[J]. Current Opinion in Plant Biology, 2006, 9(5): 460–469. DOI:10.1016/j.pbi.2006.07.009 |
| [14] | YÁÑEZ M, GIL-LONGO J, CAMPOS-TOIMIL M. Calcium binding proteins[M]. Calcium Signaling: Springer, 2012: 461-482. |
| [15] | WANG W, VINOCUR B, SHOSEYOV O, et al. Role of plant heat-shock proteins and molecular chaperones in the abiotic stress response[J]. Trends in Plant Science, 2004, 9(5): 244–252. DOI:10.1016/j.tplants.2004.03.006 |
| [16] | DANGL J L, JONES J D. Plant pathogens and integrated defence responses to infection[J]. Nature, 2001, 411(6 839): 826–833. |
| [17] | HANIN M, BRINI F, EBEL C, et al. Plant dehydrins and stress tolerance:versatile proteins for complex mechanisms[J]. Plant Signaling & Behavior, 2011, 6(10): 1 503–1 509. |
| [18] | ZHANG Z X, ZHENG Y Z. Overexpression of nicotianamine synthase (NAS) gene results in enhanced drought tolerance in perennial ryegrass[J]. Biotechnology & Biotechnological Equipment, 2008, 22(4): 938–941. |
| [19] | ROSADO A, SCHAPIRE A L, BRESSAN R A, et al. The Arabidopsis tetratricopeptide repeat-containing protein TTL1 is required for osmotic stress responses and abscisic acid sensitivity[J]. Plant Physiology, 2006, 142(3): 1 113–1 126. DOI:10.1104/pp.106.085191 |
| [20] | YAMAMOTO T, IKETANI H, IEKI H, et al. Transgenic grapevine plants expressing a rice chitinase with enhanced resistance to fungal pathogens[J]. Plant Cell Reports, 2000, 19(7): 639–646. DOI:10.1007/s002999900174 |
| [21] | NEUHAUS J M. Plant chitinases (PR-3, PR-4, PR-8, PR-11)[M]//DATTA S K, MUTHUKRISHNAN S. Pathogenesis-related proteins in plants. Boca Raton: CRC Press, 1999: 77-105. |
| [22] | SHARMA P, BØRJA D, STOUGAARD P, et al. PR-proteins accumulating in spruce roots infected with a pathogenic Pythium sp. isolate include chitinases, chitosanases and β-1, 3-glucanases[J]. Physiological and Molecular Plant Pathology, 1993, 43(1): 57–67. DOI:10.1006/pmpp.1993.1040 |
| [23] | SCHULER M A. Plant cytochrome P450 monooxygenases[J]. Critical Reviews in Plant Sciences, 1996, 15(3): 235–284. DOI:10.1080/07352689609701942 |
| [24] | MORANT M, BAK S, MØLLER B L, et al. Plant cytochromes P450:tools for pharmacology, plant protection and phytoremediation[J]. Current Opinion in Biotechnology, 2003, 14(2): 151–162. DOI:10.1016/S0958-1669(03)00024-7 |
| [25] | BEBENEK K, KUNKEL T A. Functions of DNA polymerases[J]. Advances in Protein Chemistry, 2004, 69(1): 137–165. |

 2018, Vol. 38
2018, Vol. 38


