文章信息
- 李慧敏, 谢婉凤, 冯丽贞, 陈慧洁, 刘宏毅, 叶小真
- LI Huimin, XIE Wanfeng, FENG Lizhen, CHEN Huijie, LIU Hongyi, YE Xiaozhen
- PmACRE基因的克隆及遗传转化拟南芥
- Isolation of PmACRE gene and its transformation in Arabidopsis thaliana
- 森林与环境学报,2018, 38(1): 13-19.
- Journal of Forest and Environment,2018, 38(1): 13-19.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2018.01.003
-
文章历史
- 收稿日期: 2017-08-15
- 修回日期: 2017-10-12
2. 福建农林大学金山学院, 福建 福州 350002
2. Jinshan College, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
植株为抵御病原菌的侵害,在生长发育过程中形成了一系列复杂的抗病机制,其中一类是通过抗病R基因介导的防御反应[1]。研究报道,植物抗病R基因对真菌、细菌、病毒、线虫等多种病原有广谱抗性[2]。随着分子生物学的发展,抗病基因的克隆与功能验证使得植物的抗病机制逐渐被了解,也成为快速发掘植物抗性基因的一种简便、经济的有效手段,为揭示基因的作用机制提供便利。林木等木本植物基因资源丰富, 遗传多样性复杂,但林木病虫害的病原种类多,变异速度快,分离、纯化工作不易进行,以致许多天然优良基因尚未被分离利用,大部分基因的功能仍处于未知状态。为了深入研究林木基因的功能,研究者越来越多地将基因进行克隆并导入模式植物中验证[3-4]。拟南芥生长周期短、遗传转化容易,因此模式植物拟南芥用来研究外源基因是当前植物科学前沿研究的热点,为目标基因在其体内的研究提供便利,也缩短林木中基因功能的研究周期。
马尾松(Pinus massoniana Lamb.)在我国分布广,适应性强,是荒山造林的先锋树种。其木材用途广、经济价值高,是工农业生产上的重要用材树种[5]。近年来, 由于松材线虫的入侵导致马尾松林大面积枯萎死亡,造成严重的经济和生态损失[6]。关于松材线虫病(pine wilt disease)国内外已经有了大量的研究,然而由于松材线虫病的致病机制十分复杂,以致防治松材线虫病存在一定的困难,目前还没有特别有效的防治措施[7-8]。课题组前期利用RNA-seq技术研究了松材线虫侵染后马尾松的基因表达变化,通过比较发现, 在松材线虫侵染下,马尾松中Disease Resistant Gene的表达受到抑制,随着松材线虫接种量的不断加大,该基因的下调倍数不断增加,且在受侵染的马尾松茎干、枝条和针叶等组织中的表达均较未受侵染的对照组下调表达[9]。比对发现该基因与樟子松(Pinus sylvestris var. mongolica)Avr9/Cf-9 rapidly elicited (ACRE)gene高度同源,其编码的蛋白含有富含亮氨酸重复(leucine-rich repeats,LRR)结构域,在植物的抗病防御中具有重要作用[10-11]。为弄清R基因在松树响应松材线虫侵染时所发挥的作用,从马尾松茎干中克隆PmACRE基因并进行同源性比对,构建植物表达载体并进行拟南芥的遗传转化,获得转基因拟南芥阳性植株,研究结果将为马尾松抗病品种的选育、开发及运用奠定坚实基础。
1 材料与方法 1.1 材料 1.1.1 植物材料及菌种马尾松为种植于福建农林大学森林保护研究所的4年生植株,用于遗传转化的拟南芥为实验室种植,大肠杆菌感受态细胞Trans-T1、pEASY Blunt simple克隆载体均购自北京全式金生物技术有限公司,农杆菌AGL1购自BIOMED公司,植物表达载体pCambia3301 pACT2-2×FLAG-GFP(又命名为PFGFP Bar 137)由福建农林大学海峡联合研究院基础林学与蛋白质组学研究中心惠赠。
1.1.2 工具酶及分子生物学试剂T4 DNA连接酶、SmaI和MluI、Phusion® High-Fidelity DNA Polymerase均购自BioLabs;RNA prep Pure多糖多酚植物总RNA提取试剂盒、FastQuant cDNA第一链合成试剂盒、普通琼脂糖凝胶DNA回收试剂盒以及质粒小提试剂盒均购自天根生化科技(北京)有限公司;其它生化试剂均为国产分析纯。
1.2 方法 1.2.1 引物设计采用Primer 6.0软件分别设计引物(表 1)。
| 引物名称Primers name | 引物序列Primers sequence | 产物长度Product length/bp |
| DRG-F | F:5′-CGACGCGTGCTCAAGGCCGACATACTGATTGTC-3′ | 862 |
| DRG-R | R:5′-TCCCCCGGGCCTTTGAATCGAGGCCCAGATATCC-3′ | |
| GFP-F | F:5′-TACCAGCAGAACACC-3′ | 123 |
| GFP-R | R:5′-CTCCAGCAGGACCAT-3′ | |
| 注:下划线的碱基为所加酶切位点。Note: underlined bases were the restriction sites. | ||
首先取适量4年生的马尾松的茎干于预冷的研钵中,加液氮迅速研磨成粉末状,再参照天根公司多糖多酚植物总RNA提取试剂盒说明书提取总RNA,最后用30 μL RNase-Free ddH2O溶解RNA,1.2%琼脂糖凝胶电泳检测,紫外分光光度计测定浓度。用天根FastQuant cDNA第一链合成试剂盒对已纯化的Total RNA进行反转录合成cDNA第一条链,将合成的cDNA第一条链置于-80 ℃冰箱保存备用。
根据松树R基因的CDS序列设计带有酶切位点的特异性引物DRG-F、DRG-R(下划线标记为酶切位点,上游为MluI,下游为SmaI)。以马尾松cDNA为模板,进行PCR扩增,扩增条件为98 ℃预变性30 s;98 ℃变性10 s,55 ℃退火30 s,72 ℃延伸30 s,循环32次;72 ℃延伸5 min。将PCR扩增产物在1.2%琼脂糖凝胶中进行电泳,然后在紫外灯下切下目的条带,再回收目的片段。
将回收的目的条带连接到pEASY Blunt simple载体,转化大肠杆菌Trans-T1感受态细胞,在含有Kana的LB培养基上培养,挑选出阳性克隆以通用引物M13进行菌液PCR检测,送至上海生工公司测序。
1.2.3 表达载体的构建与鉴定用MluI-SmaI酶切体系对pEASY Blunt simple-PmACRE、PFGFP Bar 137载体进行双酶切,酶切反应体系见表 2。连接产物进行琼脂糖凝胶电泳检测、回收目的基因片段及载体片段,用T4 DNA连接酶连接后,转化大肠杆菌Trans-T1感受态细胞,卡那霉素筛选阳性克隆,使用菌落PCR验证确定正确的重组子,并送至上海生工公司测序,将成功构建的重组质粒命名为PFGFP Bar 137-PmACRE。
| 成分Components | 体积Volume/μL |
| 质粒DNA | 20 |
| CutSmart Buffer | 5 |
| SmaI | 1 |
| ddH2O | 24 |
| MluI | 1 |
| 注:反应体系先在25 ℃水浴锅中反应1 h,加入MluI酶后混合均匀,在37 ℃水浴锅中反应1 h,而后加入10 μL 6×loading buffer使反应终止。Note: the reaction system was first reacted in 25 ℃ thermostat water bath for 1 h, and then mixed with MluI enzyme to react in 37 ℃ thermostat water bath for 1 h, after that adding 10 μL 6×loading buffer to stop the reaction. | |
将重组质粒PFGFP Bar 137-PmACRE通过冻融法导入农杆菌AGL1,再利用花序浸染法转化拟南芥,直至收获种子并干燥。将经过春化的种子撒在拌有Basta筛选液的营养土里,等出苗7 d左右再喷洒Basta溶液,每3 d喷洒1次,共筛选3次,对存活下来的阳性苗进行移栽。以初步筛选出的阳性转化苗的幼嫩叶片为材料,用改良CTAB法小量提取拟南芥基因组DNA。以DNA为模板,非转基因拟南芥基因组DNA为阴性对照,PFGFP Bar 137-PmACRE质粒DNA为阳性对照,以PmACRE基因特异性引物DRG-F、DRG-R以及绿色荧光蛋白基因的引物GFP-F、GFP-R进行转基因植株的PCR鉴定,PCR反应条件:98 ℃预变性30 s;98 ℃变性10 s,55 ℃退火30 s,72 ℃延伸30 s,共32个循环;最后72 ℃延伸5 min。
2 结果与分析 2.1 马尾松总RNA的纯度鉴定提取的马尾松幼苗总RNA,经电泳检测完整性,清晰可见28 S和18 S rRNA(图 1)。测定RNA在260、230、280 nm的紫外吸收值,A260/A280值为1.96,A260/A230值为2.0。说明提取的总RNA没有降解,完整性好,纯度比较高,可以用于后续反应。
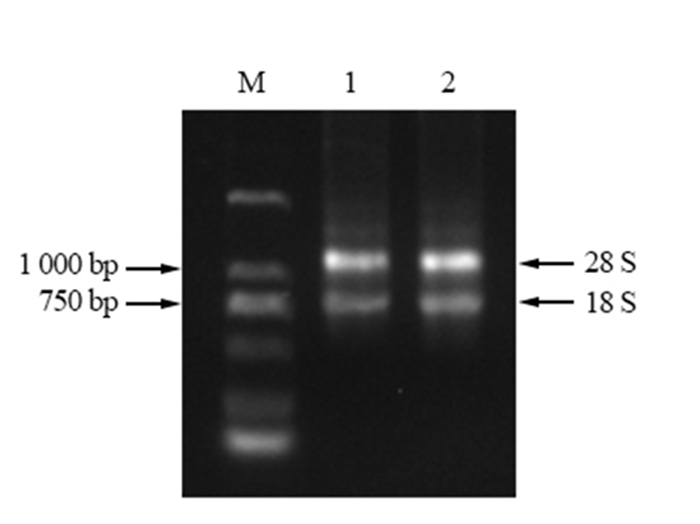
|
图 1 马尾松总RNA Fig. 1 The total RNA extracted from P. Massoniana |
利用带MluI-SmaI酶切位点的引物,从马尾松cDNA中扩增得到大约862 bp的片段(图 2)。回收克隆,将测序得到的cDNA序列使用NCBI上的Vector screen工具,去载体后得到了长度862 bp的序列。cDNA序列使用BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对,比对结果(图 3)显示从马尾松中扩增获得的R基因的cDNA序列与NCBI上提交的樟子松Avr9/Cf-9 rapidly elicited (ACRE)gene序列相似性为99%,错配率为0,因此将克隆出的马尾松R基因命名为PmACRE,并将序列提交至GenBank数据库中,获得基因序列登录号:MF630966。
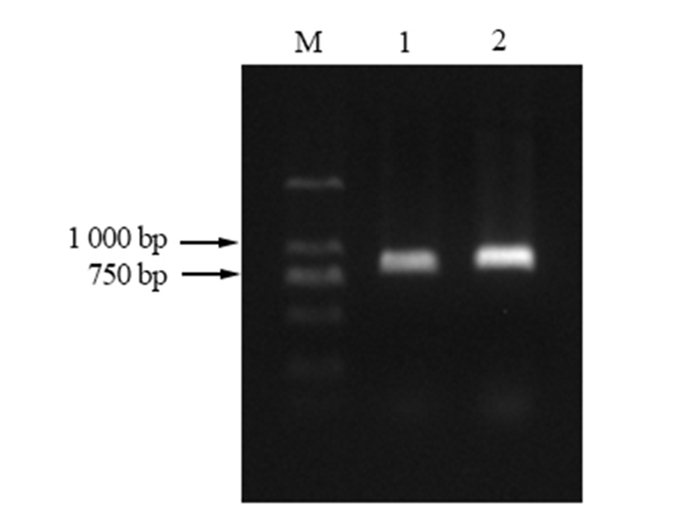
|
图 2 cDNA-PCR扩增产物 Fig. 2 PCR amplification productions of cDNA 注:泳道M,DL2000;泳道1-2,PmACRE。 Note: LaneM, DL2000;Lane1-2, PmACRE. |
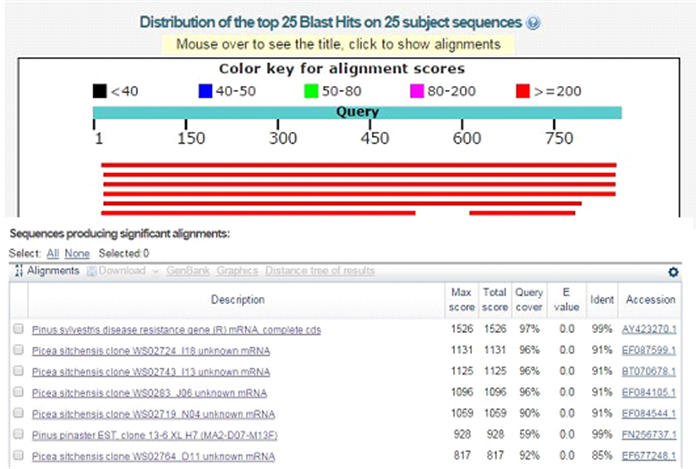
|
图 3 R基因cDNA的BLAST比对结果 Fig. 3 Result of blastn |
利用DNAMAN软件分析PmACRE基因的开放阅读框(ORF),大小为624 bp,编码207个氨基酸,翻译的氨基酸序列中含有一段串联的氨基酸残基的亮氨酸重复序列,序列为LPVLQKLSPL,这是多数植物抗病基因表达蛋白特有的保守序列(LXXLXXLXXL)(图 4)。
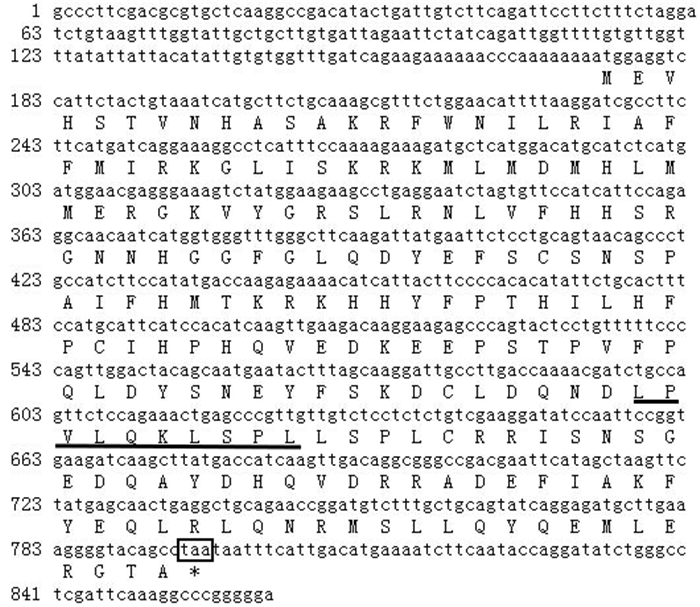
|
图 4 PmACRE基因cDNA序列及其推导的氨基酸序列 Fig. 4 cDNA sequence and deduced amino acid sequence of PmACRE gene 注:下划线部分表示亮氨酸重复区,*表示终止密码子。 Note: underlined part denotes leucine-rich repeat region; *indicates stop codon. |
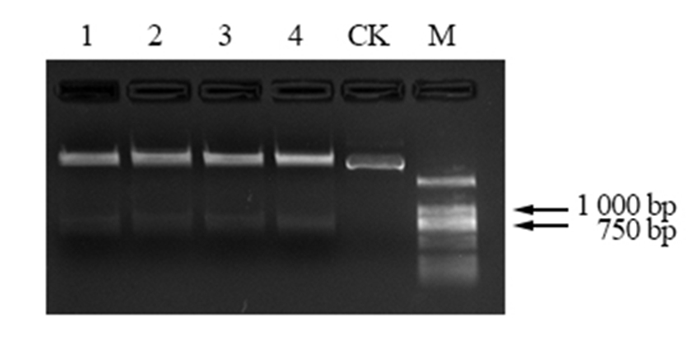
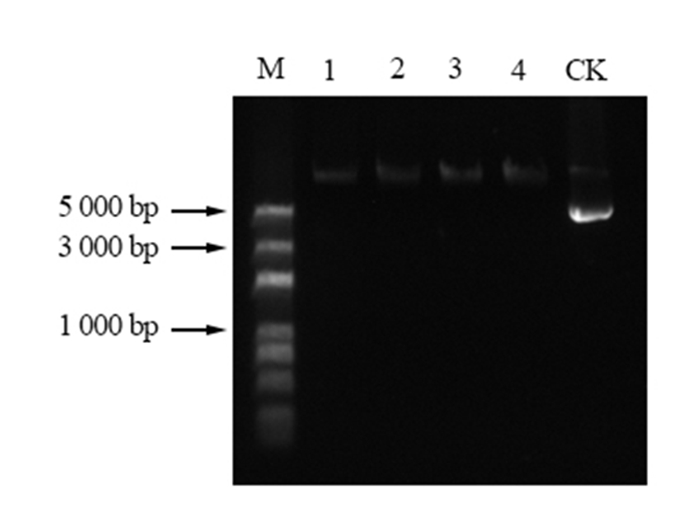
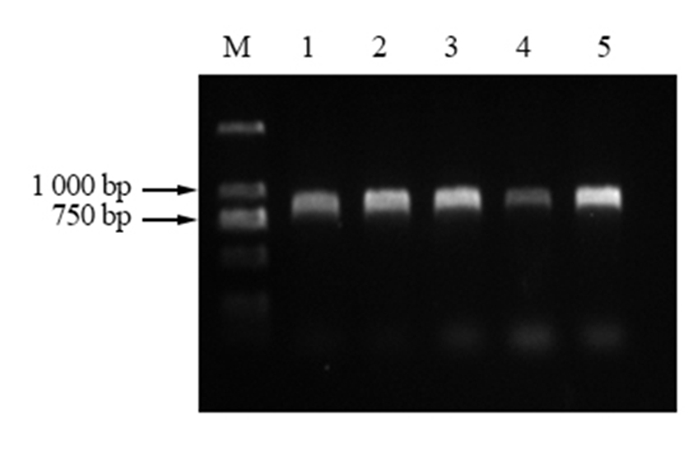
用MluI和SmaI双酶切克隆载体pEASY Blunt simple-PmACRE(图 5)和PFGFP Bar 137(图 6),将目的基因片段和PFGFP Bar 137载体片段用T4 DNA连接酶连接,转化大肠杆菌Trans-T1,通过蓝白斑筛选阳性克隆并进行PCR扩增及测序验证。从图 7中可以看出,PCR的扩增产物经过琼脂糖凝胶电泳检测,获得一条约862 bp的条带,说明构建的植物表达载体已经成功将马尾松ACRE基因整合进去。载体完成示意图见图 8。
|
图 5 pEASY Blunt simple-PmACRE酶切分析 Fig. 5 Enzyme analysis of pEASY Blunt simple-PmACRE 注:泳道M,DL2000;泳道1-4,pEASY Blunt simple-PmACRE酶切结果,CK,pEASY Blunt simple-PmACRE质粒。 Note: LaneM, DL2000;Lane1-4, pEASY Blunt simple-PmACRE restriction analysis results, CK, pEASY Blunt simple-PmACRE plasmid. |
|
图 6 PFGFP Bar 137酶切分析 Fig. 6 Enzyme analysis of PFGFP Bar 137 注:泳道M,DL2000plus;泳道1-4,PFGFP Bar 137酶切结果;CK,PFGFP Bar 137质粒。 Note: LaneM, DL2000plus; Lane1-4, PFGFP Bar 137 restriction analysis results; CK, PFGFP Bar 137 plasmid. |
|
图 7 重组质粒PFGFP Bar 137-PmACRE的PCR验证结果 Fig. 7 Verification of recombinant plasmid PFGFP Bar 137-PmACRE by PCR 注:泳道M,DL2000;泳道1-5,PFGFP Bar 137-PmACRE。 Note: LaneM, DL2000;Lane1-5, PFGFP Bar 137-PmACRE. |

|
图 8 植物表达载体PFGFP Bar 137-PmACRE示意图 Fig. 8 Construction overview of PFGFP Bar 137-PmACRE vector |
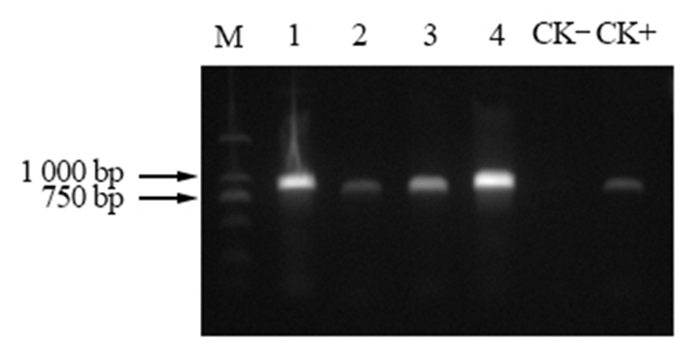
用含有PFGFP Bar 137-PmACRE的农杆菌AGL1浸染拟南芥的花序,通过农杆菌转化并经过Basta溶液筛选获得转基因拟南芥(图 9),阳性拟南芥植株移栽成活后,以叶片为材料提取拟南芥基因组DNA为模板,以PFGFP Bar 137-PmACRE质粒DNA为阳性对照,野生型拟南芥总DNA为阴性对照,经双重PCR扩增鉴定。获得的4株转PFGFP Bar 137-PmACRE拟南芥都是PCR阳性植株(图 10、图 11),证明已获得转马尾松PmACRE基因的拟南芥。

|
图 9 抗性拟南芥的生长情况 Fig. 9 Growth after spraying Basta of resistant Arabidopsis |
|
图 10 ACRE基因遗传转化拟南芥的PCR检测 Fig. 10 PCR amplification of transformation A.thaliana with ACRE gene 注:泳道M,DL2000;泳道1-4,ACRE;CK-,野生型拟南芥;CK+,PFGFP Bar 137-PmACRE。 Note: LaneM, DL2000;Lane1-4, ACRE; CK-, Wild type A.thaliana; CK+, PFGFP Bar 137-PmACRE. |

|
图 11 GFP基因PCR扩增检测 Fig. 11 PCR amplification productions of GFP gene 注:泳道M,DL2000;泳道1-4,GFP;CK-,野生型拟南芥。 Note: LaneM, DL2000;Lane1-4, GFP; CK-, Wild type A.thaliana. |
植物抗病性及其作用机制是当今植物病理学和植物抗病育种研究的热点,研究内容主要集中在抗病性反应[12]、抗病信号转导途径[12-13]、抗病基因和防卫基因[14-17]等方面。在长期进化过程中,植物与病原物之间相互作用、相互影响、协同进化。植物与病原物相互作用的过程中,植物体内发生一系列的信号传递,并激发植物的防御体系,使植物产生抗病性反应。然而植物对各种逆境所作出的种种反应本质上是由于多种基因共同作用的结果,多种因素抑制或者促进植物基因的表达以应对不良的胁迫,而抗性相关基因是植物与病原物互作过程中的关键因子[18]。在植物的抗病过程中,许许多多的R基因参与了植物抗病防卫反应。研究表明,ACRE基因编码的蛋白含有LRR结构域,LRR具有高亲和的结构域,在植物的生长发育和防卫反应中具有重要作用,是植物免疫反应的重要组成部分,其类似基因也是植物抗病信号转导过程中的重要因子[10, 19-20]。因此,ACRE及其类似基因在植物抗病基因工程中具有广泛的应用前景。
松材线虫病是松树的毁灭性灾害,但其致病机理一直存在争议[21]。松树对松材线虫的抗病和感病性作为生产中的关键性影响因子,从此方向探究松树对松材线虫抗病和感病性的内在机理对于指导松树抗松材线虫育种具有重要的理论意义和实践价值。GHEYSEN et al[22]研究表明,线虫在侵入寄主植物时可以诱导寄主植物复杂的基因表达,这些分子表达包括接种线虫时造成的伤口和胁迫反应,涉及分子识别、信号传导、放大及表达等一系列过程。袁广胜[23]研究显示在植物的防御反应中,R基因直接或间接识别病原的激发子,产生起始信号源,其本身不具有抗病作用,R基因将识别信号传至细胞内,通过信号转导途径或相关的代谢途径,诱导防卫基因迅速表达,产生抗性,从而阻止或减缓病原的增殖。茆振川等[24]在研究根结线虫与植物的分子互作时发现线虫侵染寄主植物时,线虫的侵入可激发抗性寄主植物中防卫基因的表达,出现不亲合反应,使寄主能在一定水平上抵御线虫的进一步侵染,从而表现出抗线虫性状。在松材线虫侵染下,马尾松中R基因的表达受到抑制,并随着松材线虫接种量的加大,下调倍数不断增加[9]。为进一步揭示R基因在松树响应松材线虫侵染时所发挥的作用,从马尾松中克隆得到cDNA序列全长为862 bp的PmACRE基因,利用DNAMAN软件分析PmACRE基因的开放阅读框, 完整编码区长度624 bp,编码207个氨基酸,编码的蛋白含有富含亮氨酸重复结构域。构建了植物表达载体PFGFP Bar 137-PmACRE,进而对模式植物拟南芥进行遗传转化,经过Basta溶液筛选后初步得到转基因拟南芥植株。双重PCR检测结果证实了PmACRE基因已成功整合到拟南芥的基因组中。该研究结果为深入揭示R基因调控马尾松抗松材线虫病的重要过程及培育马尾松抗松材品种奠定坚实基础。
| [1] | BAO Z, YANG H, HUA J. Perturbation of cell cycle regulation triggers plant immune response via activation of disease resis-tance genes[J]. Proceedings of the National Academy of Sciences of the United Stastes of America, 2013, 110(6): 2407–2412. DOI:10.1073/pnas.1217024110 |
| [2] | PANWAR P, JHA A K, PANDEY P K, et al. Functional markers based molecular characterization and cloning of resistance gene analogs encoding NBS-LRR disease resistance proteins in finger millet (Eleusine coracana)[J]. Molecular Biology Reports, 2011, 38(5): 3427–3436. DOI:10.1007/s11033-010-0452-0 |
| [3] | 李少锋, 苏晓华, 张冰玉. 林木基因克隆研究进展[J]. 植物学报, 2011, 46(1): 79–107. |
| [4] | 尹佟明. 林木基因组及功能基因克隆研究概述[J]. 遗传, 2010, 32(7): 677–684. |
| [5] | 张星耀. 中国松材线虫病危险性评估及对策[M]. 北京: 科学出版社, 2011. |
| [6] | 潘沧桑. 松材线虫病研究进展[J]. 厦门大学学报(自然科学版), 2011, 50(2): 476–483. |
| [7] | 张锴, 梁军, 严冬辉, 等. 中国松材线虫病研究[J]. 世界林业研究, 2010, 23(3): 59–63. |
| [8] | ZHENG H, XU M, XU F, et al. A comparative proteomics analysis of Pinus massoniana inoculated with Bursaphelenchus xylophilus[J]. Pakistan Journal of Botany, 2015, 47(4): 1271–1280. |
| [9] | XIE W, HUANG A, LI H, et al. Identification and comparative analysis of microRNAs in Pinus massoniana infected by Bursaphelenchus xylophilus[J]. Plant Growth Regulation, 2017, 83(2): 223–232. DOI:10.1007/s10725-016-0221-8 |
| [10] | LI G S, ASIEGBU F O. Induction of Pinus sylvestris PsACRE, a homology of Avr9/Cf-9 rapidly elicited defense-related gene following infection with root rot fungus Heterobasidion annosum[J]. Plant Science, 2004, 167(3): 535–540. DOI:10.1016/j.plantsci.2004.04.025 |
| [11] | ROWLAND O, LUDWIG A A, MERRICK C J, et al. Functional analysis of Avr9/Cf-9 rapidly elicited genes identifies a protein kinase, ACIK1, that is essential for full Cf-9-dependent disease resistance in tomato[J]. Plant Cell, 2005, 17(1): 295–310. DOI:10.1105/tpc.104.026013 |
| [12] | 丁丽娜, 杨国兴. 植物抗病机制及信号转导的研究进展[J]. 生物技术通报, 2016, 32(10): 109–117. |
| [13] | WU L T, DU C F, ZENG Z, et al. Study on the signal transduction pathway of plant defense to pathogens[J]. Agricultural Science & Technology, 2014, 15(4): 517–519. |
| [14] | 张艳. 植物抗病防卫相关基因的克隆及其转化烟草的研究[D]. 福州: 福建农林大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10389-1011164718.htm |
| [15] | 戴小枫, 陈捷胤, 田李, 等. 植物抗病基因和提高植物抗病性的方法[P]. 2012-09-05. |
| [16] | 王友红, 张鹏飞, 陈建群. 植物抗病基因及其作用机理[J]. 植物学通报, 2005, 22(1): 92–99. |
| [17] | 袁亮, 张伟彬. 植物抗病基因作用机理及克隆研究进展[J]. 安徽农业科学, 2009, 37(4): 1513–1515. |
| [18] | JONES J D G, DANGL J L. The plant immune system[J]. Nature, 2006, 444(7117): 323–329. DOI:10.1038/nature05286 |
| [19] | JIA R Z, MING R, ZHU Y J. Genome-wide analysis of nucleotide-binding site (NBS) disease resistance (R) genes in sacred lotus (Nelumbo nucifera Gaertn. ) reveals their transition role during early evolution of land plants[J]. Tropical Plant Biology, 2013, 6(2): 98-116. |
| [20] | HEESE A, LUDWIG A A, JONES J. Rapid phosphorylation of a syntaxin during the Avr9/Cf-9-race-specific signaling pathway[J]. Plant Physiology, 2005, 138(4): 2406–2416. DOI:10.1104/pp.105.063032 |
| [21] | 骆有庆, 张星耀. 中国森林重大生物灾害[M]. 北京: 中国林业出版社, 2003. |
| [22] | GHEYSEN G, FENOLL C. Gene expression in nematode feeding sites[J]. Annual Review of Phytopathology, 2002, 40(4): 191–219. |
| [23] | 袁广胜. 玉米抗穗粒腐病差异表达基因的分离及其功能分析[D]. 雅安: 四川农业大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10626-1011222367.htm |
| [24] | 茆振川, 谢丙炎, 杨之为, 等. 根结线虫与植物的分子互作[J]. 园艺学报, 2006, 33(4): 901–907. |

 2018, Vol. 38
2018, Vol. 38


