文章信息
- 饶丽莎, 许珊珊, 黄田盛, 王培, 曹光球, 林思祖
- RAO Lisha, XU Shanshan, HUANG Tiansheng, WANG Pei, CAO Guangqiu, LIN Sizu
- 不同逆境胁迫下杉木Cu/Zn-SOD基因表达分析
- Analysis of Cu/Zn-SOD gene expression in Chinese fir under different stress
- 森林与环境学报,2018, 38(1): 7-12.
- Journal of Forest and Environment,2018, 38(1): 7-12.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2018.01.002
-
文章历史
- 收稿日期: 2017-08-29
- 修回日期: 2017-11-01
2. 国家林业局杉木工程技术研究中心, 福建 福州 350002
2. State Forestry Administration Engineering Research Center of Chinese Fir, Fuzhou, Fujian 350002, China
杉木[Cunninghamia lanceolata (Lamb.) Hook.]是我国南方重要的速生用材树种[1], 铝毒被认为是我国南方富铁铝化酸性土壤中限制杉木生长的最重要障碍因子之一[2]。在我国一些杉木主产区夏季高温少雨,冬季寒冷干燥,极端低温和干旱现象频发。因此,杉木在生长过程中经常遭受各种逆境胁迫(铝毒害、低温和干旱等)。逆境胁迫容易引起植物体内活性氧代谢失衡,导致植物体内活性氧大量积累造成氧化损伤,从而最终使植物生长受抑。逆境胁迫下,为保护细胞免受活性氧的伤害,植物在长期进化过程中,建立了一套酶促和非酶促系统组成的抗氧化体系[3]。超氧化物歧化酶(superoxide dismutase,SOD)作为酶促抗氧化系统中重要组成部分,在清除植物体内超氧阴离子自由基(reactive oxygen speices, ROS),减轻其对细胞的损伤,维持细胞膜的结构和功能中起着十分关键的作用[4]。SOD是一类广泛存在于植物体内的金属酶类,根据金属辅基的不同通常将SOD分为3种不同的类型,即Cu/Zn-SOD、Mn-SOD和Fe-SOD[5]。研究表明, 在这3种不同类型的SOD中,Cu/Zn-SOD在清除活性氧中尤为关键,该酶是植物抗氧化系统的第一道防线,与植物众多抗逆性密切相关[6-7]。GUPTA et al[8]研究发现豌豆(Pisum sativum Linn)Cu/Zn-SOD基因转化烟草(Nicotiana tabacum L.)植株,SOD活性提高了3倍。紫花苜蓿(Medicago sativa L.)中克隆的Cu/Zn-SOD基因转化到矮牵牛[Petunia hybrida (J.D.Hooker) Vilmorin]植株中进行过量表达,能显著提高矮牵牛植株的耐冷性[9]。类似的研究结果在棉花(Gossypium spp.)[10]植物中也有发现,因此Cu/Zn-SOD基因对于清除活性氧维持植物正常生理功能具有重要意义。近年来在木薯(Manihot esculenta Crantz)[11]、丹参(Salvia miltiorrhiza Bge.)[12]、油菜(Brassica napus L.)[13]、莲(Nymphaea L.)[14]、烟草[15]、水稻(Oryza sativa)[16]、拟南芥[Arabidopsis thaliana (L.) Heynh.][17]、甘蔗(Saccharum officinarum)[18]等植物中克隆获得Cu/Zn-SOD基因并进行了逆境胁迫下的表达分析,进一步证实了Cu/Zn-SOD基因在调控植物对逆境胁迫耐性中具有重要作用。
目前对杉木Cu/Zn-SOD基因在逆境胁迫下的分子机理未见报道。鉴于此,文中根据Cu/Zn-SOD基因的全长序列,运用荧光定量PCR(real-time polymerase chain reaction,qRT-PCR)技术探究不同逆境胁迫下杉木Cu/Zn-SOD基因的表达情况,同时研究其SOD活性的变化,为进一步探究杉木Cu/Zn-SOD基因在逆境胁迫中的功能及抗逆育种的分子机制提供理论依据。
1 材料与方法 1.1 材料处理及超氧化物歧化酶活性指标测定以杉木020组培苗作为试验材料,选取长势大小一致的组培苗接种到MS液体培养基中,培养温度25 ℃,湿度70%,光照周期为16 h光照,8 h黑暗,光照密度150 μmol·m-2·s-1。预培养1周后分别用4 ℃低温、0.054 6 g·mL-1甘露醇、2 mmol·L-1铝离子和300 mmol·L-1的NaCl进行胁迫。采用3组重复试验,取在未处理0 h(CK)和胁迫培养下不同时间点的组培苗(低温胁迫0、6、12、24、48、96 h;干旱胁迫0、12、24、48 h;铝胁迫0、4、8、16、24 h;盐胁迫0、12、24、36、48 h),液氮冷冻后保存于-80 ℃冰箱备用。分别取对照组和各胁迫处理后的杉木组培苗0.2 g,液氮研磨后,采用氮蓝四唑光化还原法测定SOD活性[19]。
1.2 总RNA的提取和cDNA的合成取100 mg杉木组培苗加入液氮迅速研磨,直至研磨成粉末状,采用天根公司的多糖多酚植物总RNA提取试剂盒提取总RNA。利用紫外分光光度计和1%琼脂糖凝胶电泳检测RNA的质量。采用TaKaRa生物公司的PrimeScript RT reagent Kit with gDNA Eraser试剂盒进行cDNA第一链合成。
1.3 荧光定量PCR分析试验以杉木Actin为内参基因,设计引物F1:5′-CAGCAACTGGGATGATATGG-3′,R1:5′-ATTTCGCTTTCAGCAGTGGT-3′;扩增杉木Cu/Zn-SOD基因设计引物F2:5′-ATTATAGGACGAGCTGTGGTTG-3′,R2:5′-AGTCTTCCGCCAGCATTT-3′。
qRT-PCR反应采用TaKaRa生物公司的SYBR©Premix Ex TaqTTM(Tli RNaseH Plus)试剂盒,在ABI7500荧光定量PCR仪上进行试验。每个试验样品3个重复。反应条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火34 s,40个循环。
1.4 数据处理通过内参基因进行归一化比较,根据目的基因和内参基因标准品的拷贝数与其相对应的循环阈值(cycles threshold,CT),选用2-△△Ct法对目的基因的相对表达量进行分析[20]。
2 结果与分析 2.1 杉木总RNA检测提取各胁迫处理的杉木总RNA,经1%琼脂糖凝胶电泳检测(图 1)。RNA三条条带完整,且28 S的亮度为18 S的两倍,5 S的亮度最淡。吸光值(A260/A280)均在1.8~2.0之间,可知样品总RNA完整性好,可进行后续cDNA合成试验。
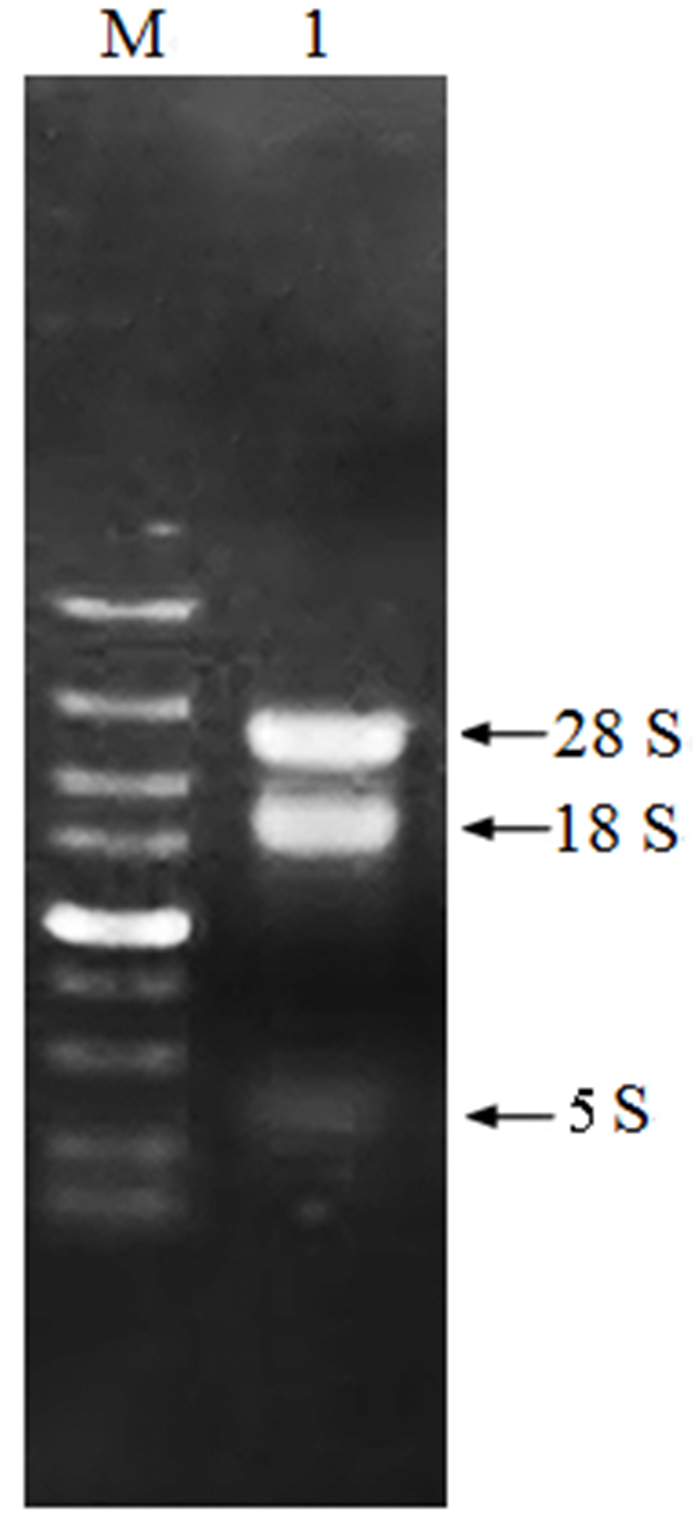
|
图 1 总RNA电泳图 Fig. 1 Electrophoretogram of total RNA 注:M. 2 000 DNA分子量标准;1.总RNA。 Note: M. DL2 000 DNA marker; 1.total RNA. |
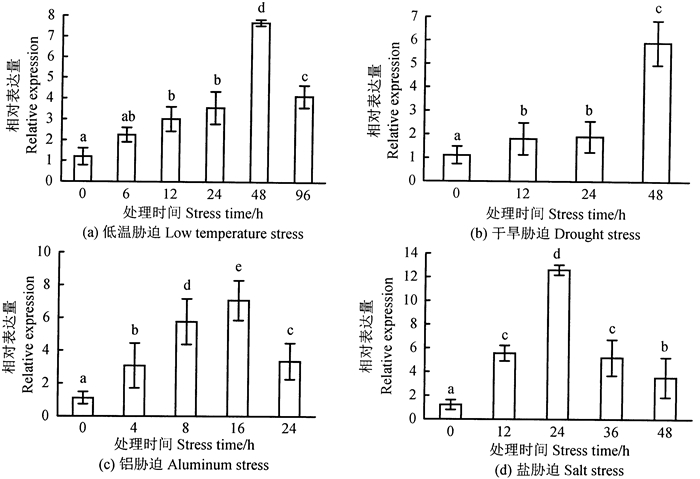
低温胁迫容易引起植物体内活性氧代谢失衡,造成活性氧积累,从而影响植物生长。SOD作为抗氧化酶系统的重要组成部分,在保护细胞膜免受损伤,维护细胞膜结构和功能的稳定,增强植物在低温下的耐性中具有重要作用。由图 2(a)可知,与对照相比,短时间(6 h)低温胁迫处理就能诱导杉木组培苗Cu/Zn-SOD基因相对表达量增加,随胁迫时间延长,Cu/Zn-SOD基因相对表达量呈现出逐渐增加的趋势,当低温胁迫时间达到48 h时达到峰值,此时Cu/Zn-SOD基因相对表达量是对照的6.4倍,继续延长胁迫时间至96 h,Cu/Zn-SOD基因相对表达量则出现下调,尽管此时Cu/Zn-SOD基因相对表达量下降,但其仍显著高于对照处理,是对照组的3.44倍。
|
图 2 不同胁迫下杉木组培苗Cu/Zn-SOD基因相对表达量 Fig. 2 Cu/Zn-SOD gene relative expression of Chinese fir tissue culture seeding under different stress treatment 注:不同小写字母表示处理间显著性水平(P < 0.05)。 Note: different lowercase indicate significant different among treatments at P < 0.05. |
当植物处于干旱逆境时,大量的活性氧在植物细胞内产生,在一定条件下转变成自由基激活SOD基因表达。随时间的推移,杉木组培苗Cu/Zn-SOD基因相对表达量逐渐增加,在48 h内均显著高于对照组[图 2(b)]。胁迫12 h和24 h,Cu/Zn-SOD基因相对表达量达到对照的1.7倍左右;胁迫48 h,Cu/Zn-SOD基因相对表达量达到峰值,是对照的5.3倍。由此推测,Cu/Zn-SOD基因可能在调控杉木苗适应干旱环境中发挥重要作用。
2.2.3 铝胁迫下杉木Cu/Zn-SOD基因的表达经2 mmol·L-1铝离子胁迫,杉木组培苗Cu/Zn-SOD基因相对表达量随着时间延长呈现先上升后下降的趋势[图 2(c)]。在16 h时, Cu/Zn-SOD基因相对表达量最高,是对照的6.4倍;胁迫24 h,Cu/Zn-SOD基因相对表达量开始降低,是对照的3倍。可能是胁迫16 h前体细胞未受损伤,SOD基因相对表达量增大从而消除自由基,而胁迫16 h后体细胞损伤,SOD基因相对表达量下降。
2.2.4 盐胁迫下杉木Cu/Zn-SOD基因的表达盐胁迫可在一定程度上破坏植物体内的离子平衡和渗透压,从而引起植物体内代谢紊乱,导致活性氧积累,从而造成自由基伤害。杉木组培苗中Cu/Zn-SOD基因相对表达量在48 h内呈先上升后下降的趋势,显著高于对照组,在24 h时,Cu/Zn-SOD基因相对表达量达到峰值,此时Cu/Zn-SOD基因相对表达量是对照的10.49倍[图 2(d)]。继续延长胁迫时间至48 h,Cu/Zn-SOD基因相对表达量则出现下降,但其表达量仍显著高于对照处理,是对照组的2.95倍。
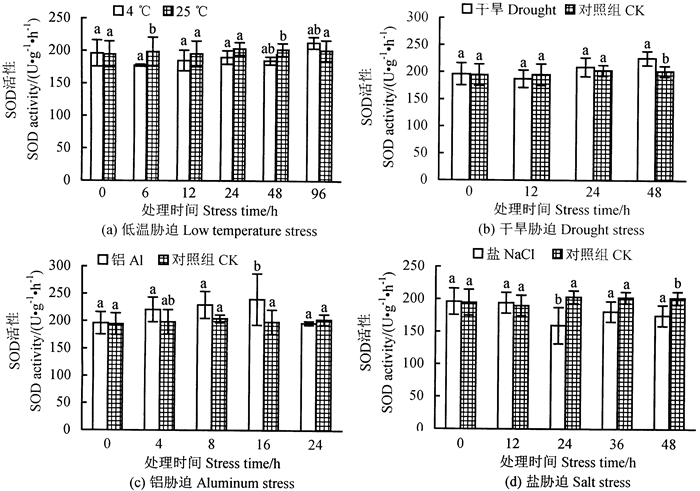
2.3 不同胁迫对超氧化物歧化酶活性的影响 2.3.1 低温胁迫对超氧化物歧化酶活性的影响经低温胁迫后杉木组培苗的SOD活性的变化情况如图 3(a)所示。在4 ℃胁迫下,SOD活性发生了明显变化,与对照相比,SOD活性整体呈现先下降后上升的变化趋势。在常温25 ℃下,SOD活性差异不大,在190~210 U·g-1·h-1范围内变化。试验组6 h时,SOD活性降低10.55%,在96 h时,SOD活性达到最大。
|
图 3 不同胁迫对杉木组培苗SOD活性的影响 Fig. 3 Effect of different stress treatmen in SOD activity of Chinese fir tissue culture seeding 注:不同小写字母表示处理间显著性水平(P < 0.05)。 Note: different lowercase indicate significant different among treatments at P < 0.05. |
干旱胁迫下, 杉木组培苗的SOD活性整体呈现上升的趋势,对照组的SOD活性相对一致,在24 h时,干旱胁迫下的SOD活性高于对照组,在48 h时,变化量最大[图 3(b)]。
2.3.3 铝胁迫对超氧化物歧化酶活性的影响铝胁迫下, 杉木组培苗的SOD活性变化显著,与对照相比,SOD活性整体呈现先升高后降低的变化趋势[图 3(c)]。在16 h时,SOD活性增加了20.85%,达到一个峰值,24 h时SOD活性降低,低于对照组。说明经过铝胁迫处理的杉木组培苗SOD活性与对照组相比有显著差异,表明铝胁迫对SOD活性存在影响。
2.3.4 盐胁迫对超氧化物歧化酶活性的影响盐胁迫下,杉木组培苗的SOD活性呈现先下降后上升的变化趋势[图 3(d)]。12 h时, SOD活性略高于对照组,而在24 h时, SOD活性降低了21.57%,达到最小值,36 h后, SOD活性相对上升但仍低于对照组。
3 讨论与结论在正常生长条件下,植物体内活性氧自由基产生和清除始终保持着动态平衡,当植物遭受外界胁迫时,这种动态平衡就会被打破,从而导致活性氧迅速积累,当活性氧累积超过植物自身调节能力时,就会发生膜脂过氧化并引发连锁反应,导致细胞膜系统受损,细胞内组分外渗,引起代谢紊乱。为保护细胞免受活性氧的损害,在长期进化过程中植物建立一套酶性抗氧化系统, 如SOD、过氧化物酶(peroxidase, POD)、过氧化氢酶(catalase,CAT)等和非酶性抗氧化系统, 如抗坏血酸(ascorbic acid,AA)和谷胱甘肽(glutathione,GSH)组成的抗氧化防御体系[21]。SOD是清除活性氧的第一道防线,主要催化超氧物阴离子自由基(O2-)歧化形成过氧化氢(H2O2),随后在POD和CAT的作用下形成水,保护细胞免受伤害[22-23]。Cu/Zn-SOD是植物体内不同SOD类型中分布最广以及稳定性最高的一种同工酶,其表达量的高低和植物抗逆性密切相关。王盛等[18]研究表明,在甘蔗中Cu/Zn-SOD基因主要在绿色组织中表达,且其在不同逆境胁迫下的表达量均迅速上调,从而增强甘蔗对逆境胁迫的耐性。姚冉等[24]通过分子生物学手段从一株地热芽孢杆菌(Geobacillus)中克隆得到Cu/Zn-SOD基因并转化到烟草中,结果表明,与野生型植株相比,烟草Cu/Zn-SOD基因对盐胁迫的耐性得到显著提升。此外,植物在不同生长发育阶段、不同的组织或不同胁迫条件下,SOD活性表现出明显差异。一般抗性强的植物其体内往往具有较高的SOD活性,因此说明SOD活性与植物抗逆性相关[25]。
前人研究结果表明,低温胁迫能显著诱导植物体内SOD基因的迅速表达,增强植物对低温胁迫的抗性[26]。文中发现低温胁迫下杉木组培苗中Cu/Zn-SOD基因表达也受到迅速诱导(6 h),在48 h时达到峰值,随后其表达量迅速下降,导致Cu/Zn-SOD基因表达量出现下降的原因可能就是由于长时间低温胁迫导致杉木组培苗不可逆损伤,造成其抗寒能力下降。SOD活性整体呈现先下降后上升的变化趋势,基因表达量与SOD活性表现并不完全一致暗示可能存在转录后调控事件。文中的研究结果与低温胁迫下普通小麦(Triticum aestivum L.)烟农19幼苗叶中Fe-SOD基因表达量变化相似[20]。除了冷胁迫可以迅速诱导Cu/Zn-SOD基因表达,其他逆境胁迫,例如东方山羊豆(Galega orientalis L.)[27]和甘蔗[18]在干旱胁迫和盐胁迫下均能显著诱导Cu/Zn-SOD快速表达,呈现上调趋势。与前人研究结果类似,文中发现随干旱胁迫时间的延长,杉木组培苗Cu/Zn-SOD基因表达量增加,高于对照,48 h时表达量达到最高水平,暗示杉木Cu/Zn-SOD基因可能在干旱胁迫中具有重要作用。众所周知,铝胁迫迅速诱导活性氧在植物体内积累,导致氧化损伤,从而最终抑制植物生长。类似地,铝胁迫下杉木组培苗Cu/Zn-SOD基因表达量同样呈上升趋势,而且其表达量均高于对照,说明Cu/Zn-SOD基因在杉木应对铝毒胁迫过程中具有一定的作用。盐胁迫下,杉木组培苗Cu/Zn-SOD基因表达量变化幅度最大,胁迫24 h表达量上升10.49倍,当盐胁迫超过24 h后,该基因表达量呈现逐渐下降趋势,推测杉木Cu/Zn-SOD基因在盐胁迫一定时间内能对杉木起到调节保护作用,而这种随着胁迫时间延长表达量下降,可能是由于杉木自身较为敏感,长时间胁迫处理使其体内活性氧过量积累造成严重损失,引起细胞各部位代谢紊乱,从而最终引起该基因表达量下降。由此可见,不同逆境胁迫均能快速诱导杉木Cu/Zn-SOD基因表达,暗示Cu/Zn-SOD基因可能在调控杉木在不同逆境胁迫耐性中具有重要作用。同时文中在胁迫条件下测定了杉木组培苗SOD活性的变化,研究表明SOD活性发生相对变化,酶含量均高于对照组。不同胁迫下基因表达量与SOD活性变化趋势不一致,但均呈先上升后下降的表达趋势,这一方面可能由于SOD活性是由不同基因成员编码,它的活性并不完全由单一基因所决定,而是由多个基因家族成员共同调控,另一方面,这种不一致性暗示Cu/Zn-SOD基因表达可能存在转录后调控事件。文中证实了杉木Cu/Zn-SOD基因能对不同逆境胁迫条件产生响应,暗示在逆境胁迫下,当植物体内细胞受到伤害时,杉木可能通过诱导Cu/Zn-SOD基因的表达,增加SOD活性,从而减轻逆境胁迫对杉木造成的伤害。研究结果为通过基因工程手段改良杉木抵抗逆境胁迫能力,增强杉木对逆境胁迫的耐性,从而增加酸性土壤上杉木产量提供理论依据。
| [1] | 郑仁华, 施季森, 翁玉榛, 等. 福建省杉木育种战略研究[J]. 林业工程学报, 2008, 22(2): 1–6. |
| [2] | 曹世江, 黄东, 叶义全, 等. 铝钙复合作用对杉木幼苗抗氧化能力的影响[J]. 森林与环境学报, 2017, 37(2): 136–141. |
| [3] | 胡一鸿, 牛健康. 超氧化物歧化酶研究进展[J]. 生物学教学, 2005, 30(1): 2–4. |
| [4] | KIMK Y, LEE S Y, CHO Y S, et al. Molecular characterization and mRNA expression during metal exposure and thermal stress of copper/zinc-and manganese-superoxide dismutases in disk abalone, Haliotis discus discus[J]. Fish & Shellfish Immunology, 2007, 23(5): 1043–1059. |
| [5] | OGAWA K, KANEMATSU S, ASADA K. Intra and extra-cellular localization of "cytosolic" CuZn-superoxide dismutase in spinach leaf and hypocotyls[J]. Plant & Cell Physiology, 1996, 37(6): 790–799. |
| [6] | SONG F N, YANG C P, LIU X M, et al. Effect of salt stress on activity of superoxide dismutase (SOD) in Ulmus pumila L[J]. Journal of Forestry Research, 2006, 17(1): 13–16. DOI:10.1007/s11676-006-0003-7 |
| [7] | MANKOVSKY M, ZIV V, NEVO N, et al. Cu/Zn superoxide dismutase plays important role in immune response[J]. The Journal of Immunology, 2003, 170(6): 2993–3001. DOI:10.4049/jimmunol.170.6.2993 |
| [8] | GUPTA A S, HEINEN J L, HOLADAY A S, et al. Increased resistance to oxidative stress in transgenic plants that overexpress chloroplastic Cu/Zn superoxide dismutase[J]. Proceedings of the National Academy of Sciences of the United States of America, 1993, 90(4): 1629–1633. DOI:10.1073/pnas.90.4.1629 |
| [9] | 平璐. 紫花苜蓿Cu/Zn-SOD基因在矮牵牛中的表达及其耐冷性分析[D]. 长春: 吉林农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10193-1016732386.htm |
| [10] | 马淑娟, 喻树迅, 范术丽, 等. 转棉花叶绿体Cu/Zn-SOD基因烟草的获得及其功能的初步验证[J]. 分子植物育种, 2007, 5(3): 319–323. |
| [11] | LEE H S, KIM K Y, YOU S H, et al. Molecular characterization and expression of a cDNA encoding copper/zinc superoxide dismutase from cultured cells of cassava (Manihot esculenta Crantz)[J]. Molecular & General Genetics MGG, 1999, 262(4/5): 807–814. |
| [12] | 纪砚耘, 化文平, 王喆之. 丹参铜锌超氧化物歧化酶(Cu/Zn-SOD)基因的克隆与生物信息学分析[J]. 陕西师范大学学报(自然科学版), 2011, 39(3): 56–61. |
| [13] | 杨鸯鸯, 李云, 丁勇, 等. 甘蓝型油菜Cu/ZnSOD和FeSOD基因的克隆及菌核病菌诱导表达[J]. 作物学报, 2009, 35(1): 71–78. |
| [14] | 朱虹琳, 董臣, 刁英, 等. 莲铜锌超氧化物歧化酶cDNA的克隆和序列分析[J]. 武汉大学学报(理学版), 2006, 52(4): 475–480. |
| [15] | BOWLER C, ALLIOTTE T, DE LOOSE M, et al. The induction of manganese superoxide dismutase in response to stress in Nicotiana plumbaginifolia[J]. The EMBO Journal, 1989, 8(1): 31–38. |
| [16] | KAMINAKA H, MONTA S, TOKUMOTO M, et al. Molecular cloning and characterization of a cDNA for an iron-superoxide dismutase in rice (Oryza sativa L.)[J]. Bioscience, Biotechnology, and Biochemistry, 2014, 63(2): 302–308. |
| [17] | KLIEBENSTEIN D J, DIETRICH R A, MARTIN A C, et al. LSD1regulates salicylic acid induction of copper zinc superoxide dismutase in Arabidopsis thaliana[J]. Molecular Plant-Microbe Interactions, 1999, 12(11): 1022–1026. DOI:10.1094/MPMI.1999.12.11.1022 |
| [18] | 王盛, 张保青, 黄杏, 等. 甘蔗Cu/Zn-SOD的克隆和表达分析[J]. 中国农业科学, 2013, 46(15): 3277–3284. DOI:10.3864/j.issn.0578-1752.2013.15.023 |
| [19] | 路文静. 植物生理学实验教程[M]. 北京: 中国林业出版社, 2012: 169-233. |
| [20] | 李钰, 郑文寅, 冯春, 等. 非生物逆境胁迫下普通小麦烟农19幼苗FeSOD基因表达分析[J]. 作物杂志, 2016(4): 75–79. |
| [21] | 李合生. 现代植物生理学[M]. 北京: 高等教育出版社, 2006. |
| [22] | ALSCHER R G, ERTUTK N, HEATH L S. Role of superoxide dismutases (SOD) in controlling oxidative stress in plants[J]. Journal of Experimental Botany, 2002, 53(372): 1331–1341. DOI:10.1093/jexbot/53.372.1331 |
| [23] | 郭兴, 潘登奎, 罗晓丽. 植物超氧化物歧化酶的研究及其在基因工程中的应用[J]. 山西农业科学, 2008, 36(3): 3–6. |
| [24] | 姚冉, 李轶女, 张志芳, 等. Cu/Zn-SOD基因植物表达载体的构建及其在烟草中的表达[J]. 生物技术通报, 2012(11): 78–82. |
| [25] | 李金华, 王丰, 廖亦龙, 等. 水稻种子活力的生理生化及遗传研究[J]. 分子植物育种, 2009, 7(4): 772–777. |
| [26] | 金忠民, 沙伟, 谭大海. 低温胁迫对蓝萼香茶菜幼苗保护酶系统的影响[J]. 高师理科学刊, 2004, 24(2): 54–56. |
| [27] | 李玉坤, 王学敏, 高洪文, 等. 东方山羊豆Cu/ZnSOD基因的克隆及表达分析[J]. 遗传, 2012, 34(1): 95–101. |

 2018, Vol. 38
2018, Vol. 38


