文章信息
- 魏子涵, 袁斌玲, 陈茜, 邱娜菲, 陈颖
- WEI Zihan, YUAN Binling, CHEN Xi, QIU Nafei, CHEN Ying
- 聚乙二醇处理对‘717’杂交杨组培苗的影响
- Effect of polyethylene glycol treatment on hybrid poplar (Populus tremula×P.alba '717-1B4') in vitro culture
- 森林与环境学报,2017, 37(4): 412-417.
- Journal of Forest and Environment,2017, 37(4): 412-417.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2017.04.005
-
文章历史
- 收稿日期: 2017-02-27
- 修回日期: 2017-07-11
2. 南京林业大学生物与环境学院, 江苏 南京 210037
2. College of Biology and Environment, Nanjing Forestry University, Nanjing, Jiangsu 210037, China
我国干旱、半干旱地区面积占国土总面积的45.0% 以上,干旱已成为我国乃至全球面临的最重要生态问题,也是限制植物生长和作物产量的最主要因子之一,随着地球变暖和降水模式的改变,情况将愈发严重[1]。干旱会引起植物渗透胁迫,降低叶片水势导致吸水困难,进而对植物生长产生不利影响,如降低展叶率和叶面积,减少叶片生长速度,加速植物衰老等[2],相关研究已广泛开展[3-6]。杨树(Populus)是我国主要的用材林和防护林树种,品种多,被广泛栽培,但在干旱、半干旱地区,由于灌溉条件的缺乏,杨树的生长受到严重抑制,降低了杨树的经济和生态效益[7]。‘INRA 717-1B4’杂交杨(Populus tremula L. × P. alba L.,‘717’杂交杨)是从欧洲山杨和银白杨的杂交群体中选育出的优良品种,具有较强的耐逆性,对植被恢复、防止水土流失和盐碱地修复具有很大的应用价值,又可用于生物质能源和纤维能源开发[8-9]。目前对‘717’杂交杨的抗逆性已经有了一些研究,如‘717’杂交杨在镉胁迫下净光合效率和生长受到抑制[10],转基因的‘717’杂交杨中Fe-SOD基因在干旱胁迫下,较野生型有较强的表达[8],但干旱胁迫对‘717’杂交杨的抗氧化性研究还尚未见报道。
近年来,组织培养技术以其经济、可控、节约空间和时间等优点已成为研究植物胁迫的重要手段,特别是对生长周期长的木本植物[11], 该研究系统对木本植物早期抗性研究、快速发掘抗性基因具有重要价值。本研究以‘717'杂交杨组培苗为试验材料,采用不同浓度聚乙二醇(polyethylene glycol,PEG)6000对其进行模拟干旱胁迫处理。研究‘717'杂交杨对干旱胁迫的生理响应、抗氧能力及耐受性,为‘717'杂交杨对干旱胁迫响应、扩大栽培范围、提高生态防护功能、增加林农和企业的收益提供理论依据。
1 材料与方法 1.1 材料来源‘717'杂交杨无菌苗来自于南京林业大学组织培养室。
1.2 试验方法 1.2.1 苗木扩繁以‘717'杂交杨无菌苗2 cm带芽茎段为外植体,接种在1/2 MS+0.25 g·L-1MES[2-(N-吗啉)乙磺酸]+0.2 g·L-1 L-谷氨酸的分化培养基上进行茎段诱导,30 d左右长至5.0~6.0 cm;取2.0~3.0 cm的顶芽,接种在MS+0.2 mg·L-1 BA+200 mg·L-1泛酸钙+0.25 g·L-1 MES+0.2 g·L-1L-谷氨酸的生根培养基上进行培养,50 d后选取长势一致的组培苗进行处理。
1.2.2 模拟干旱胁迫以不加PEG的生根培养基为对照,以在生根培养基中添加2.5%、5.0%、10.0% PEG模拟干旱试验。每瓶接入1株组培苗,每处理20株苗。
培养基均添加3.0%蔗糖、0.65%琼脂,培养温度为(25±2) ℃,光照强度为55 μmol·m-2·s-1,光照时间为14 h·d-1。分别培养10 d和20 d后,将苗取出,洗净培养基,取中部叶片称重后放入-70 ℃冰箱保存用于生理指标测定,对剪去叶片后的植株进行株高、主根长测定。
1.3 指标测定丙二醛(malondialdehyde,MDA)含量测定采用硫代巴比妥酸比色法,超氧化物歧化酶(superoxide dismutase,SOD)活性测定采用抑制NBT光化还原法,过氧化氢酶(catalase,CAT)活性测定采用紫外吸收法,过氧化物酶(peroxidase,POD)活性测定采用愈创木酚法,抗坏血酸过氧化物酶(ascorbate peroxidase,APX)采用紫外吸收法,过氧化氢(H2O2)含量测定采用硫酸钛法,上述指标测定均参照赵世杰法[12];还原型抗坏血酸(ascorbic acid,AsA)含量、还原型谷胱甘肽(reduced glutathione,GSH)含量、谷胱甘肽还原酶(glutathione reductase,GR)活性3指标测定参照陈建勋法[13]。GR活性测定方法有所改良,样品用0.05 mmol·L-1磷酸缓冲液(pH值7.0) 研磨提取,4 ℃ 8 000 r·min-1下,离心15 min, 取上清液。2.5 mL的样品测定体系包括:1.0 mmol·L-1NADPH,2.0 mL pH值为7.8的磷酸缓冲液、5.0 mmol·L-1氧化型谷胱甘肽(oxidized glutathione,GSSH)和粗酶液,在紫外/可见分光光度计下测定340 nm处的光密度值。
1.4 数据处理试验3次重复,所得数据计算平均值和标准误,采用SPSS 17.0软件进行方差分析。
2 结果与分析 2.1 PEG处理对‘717'杂交杨生长的影响PEG处理对‘717'杂交杨组培苗的生长产生了一定的影响。PEG处理后,‘717'杂交杨的叶面积较对照减小,10.0%PEG处理的叶片出现了卷曲、干枯、变黄的症状,但仍可见腋芽长出。10 d时,主根长和茎长的增减趋势一致,都随PEG浓度上升呈先上升后下降的趋势。2.5%PEG处理时,茎长较对照显著增加了28.5%(P < 0.05) [图 1(a)],主根长较对照增长了19.3%[图 1(b)]。说明2.5%PEG浓度可以促进‘717'杨的生长。与对照相比,5.0%和10.0%PEG处理20 d时‘717'杂交杨茎长和主根长较对照显著降低(P < 0.05),10.0%PEG处理使得‘717'杂交杨的生长较对照降低,根长、茎长分别较对照减少25.3%和23.0%。
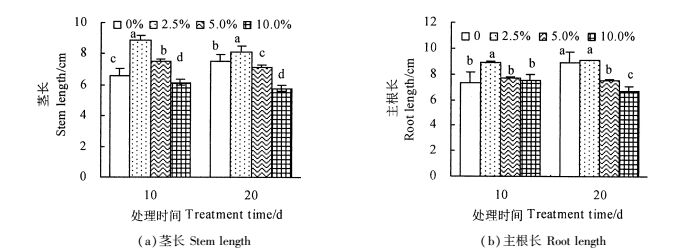
|
图 1 不同浓度PEG处理对‘717'杂交杨植株生长的影响 Fig. 1 Effect of different PEG doses on plant growth of '717' hybrid poplar plantlet |
PEG处理后,H2O2含量随着PEG浓度增加而增加,且均较对照显著增加(P<0.05),10.0%PEG处理10 d和20 d时,H2O2含量分别是对照的5.1和4.0倍[图 2(a)]。2.5%PEG处理10 d时,MDA含量出现轻微下降, 5.0%和10.0%PEG处理10 d时, MDA含量则较对照显著增加(P < 0.05)。处理20 d时,MDA含量随PEG浓度的增加而增加,10.0%PEG处理后,‘717'杂交杨MDA含量较对照显著增加了18.8%[图 2(b)]。
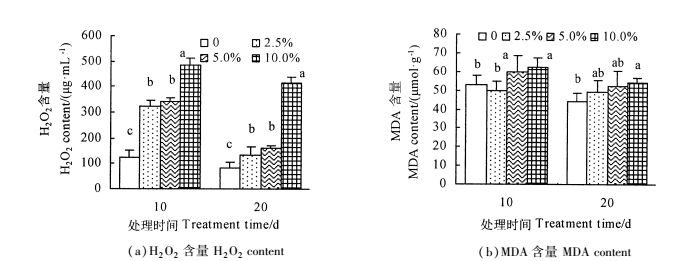
|
图 2 不同浓度PEG处理对‘717'杂交杨H2O2和MDA含量的影响 Fig. 2 Effect of different PEG doses on H2O2 and MDA content of '717' hybrid poplar plantlet |
不同浓度PEG处理下,‘717'杂交杨组培苗的5种抗氧化酶活性均有着不同的变化。PEG处理使得SOD活性呈现随着PEG浓度增大而减弱的趋势[图 3(a)],10.0%PEG处理10 d和20 d时,SOD活性分别较对照降低26.6%,40.7%(P < 0.05)。干旱处理10 d,POD活性随着PEG浓度的增加而上升[图 3(b)],分别较对照上升18.8%,20.5%和32.6%(P < 0.05)。处理20 d时,POD活性均较对照显著增加(P < 0.05)。CAT活性在PEG干旱处理后显著增加(P < 0.05),2.5%PEG处理10 d时,CAT活性是对照的2.1倍[图 3(c)]。PEG处理20 d时,CAT活性较对照显著增强,10.0%PEG处理时较5.0%PEG处理下降,各处理较对照分别增加了37.7%,69.4%和60.9%。PEG干旱处理后,APX活性均呈上升趋势[图 3(d)],各处理相较于对照显著增加(P < 0.05),5.0%和10.0%PEG处理间不存在显著差异,10.0%PEG处理10 d和20 d时,APX活性分别是对照的1.8和1.5倍。2.5%PEG处理时,GR活性与对照没有明显差异(P>0.05)。5.0%和10.0%PEG处理20 d时,GR活性均较对照显著增加(P < 0.05),其中5.0%PEG处理时活性强于其他处理,是对照的1.8倍[图 3(e)]。
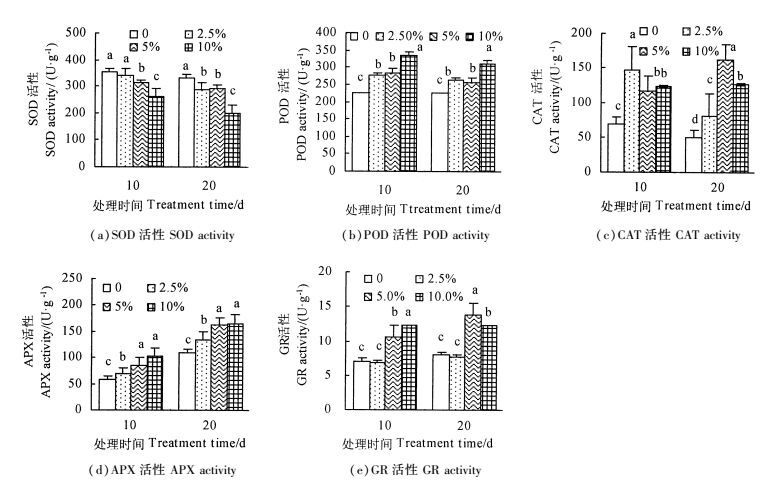
|
图 3 不同浓度PEG处理对‘717'杂交杨5种抗氧化酶活性的影响 Fig. 3 Effect of different PEG doses on the activity of five protective enzymes of '717' hybrid poplar plantlet |
PEG干旱胁迫后,随着PEG浓度增大,AsA含量呈上升趋势。AsA含量在5.0%和10.0%PEG处理10 d时相比于对照显著增加(P < 0.05),分别较对照增加73.5%和74.8%。干旱胁迫20 d时,各处理相较于对照都是显著增加(P < 0.05),其中10.0%PEG处理时,AsA含量较对照增加了70.9%[图 4(a)]。PEG处理10 d时,2.5%PEG处理时GSH含量较对照显著增加(P < 0.05),是对照的1.9倍。20 d干旱胁迫时,GSH含量显著增加(P < 0.05),分别较对照增加了35.3%,46. 6%和44.7%[图 4(b)]。
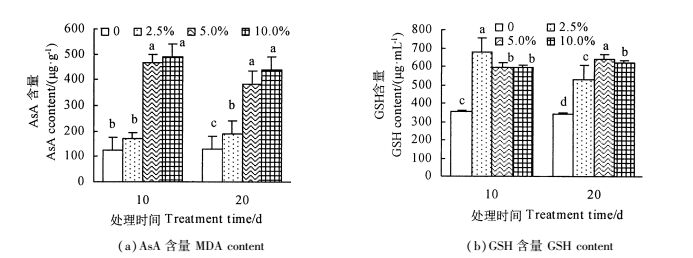
|
图 4 不同浓度PEG处理对‘717'杂交杨AsA和GSH含量的影响 Fig. 4 Effect of different PEG doses on AsA and GSH content in '717' hybrid poplar plantlet |
在土壤或者培养基中,植物的根系是吸收水分最重要的器官,也是干旱胁迫最直接的影响部位[14]。植物的地上部分高度也可以部分反应干旱对植物的影响。本研究中,2.5%PEG处理时,‘717'杂交杨茎长和根长均较对照显著增长,说明较低浓度的PEG(2.5%)处理可以促进‘717'杨的生长。而10.0%PEG使其根长和茎长较对照下降,说明已经对‘717'杂交杨产生了毒害作用,抑制其生长。
干旱胁迫也会引起氧化胁迫,造成活性氧(Reactive oxygen species, ROS)过量形成,主要有H2O2、·OH、O2·-等,这些活性氧的产生与清除如果无法达到平衡,超出植物自身清除活性氧的能力,就会对蛋白质、膜质、DNA等单分子物质造成严重损伤[15]。活性氧也会使得细胞膜透性增加,有学者认为膜脂过氧化产物MDA含量的高低,可以作为抗旱指标[16]。本研究中,H2O2含量在处理10 d和20 d时均随着PEG浓度增加而升高。‘717'杂交杨在PEG处理10 d时,MDA含量在较高浓度(5.0%和10.0%)PEG处理时较对照有了显著的增加,而在2.5%PEG处理时,MDA含量较对照轻微的减少。在PEG处理20 d时,MDA含量随着PEG浓度的增加而增加,这和对漾濞核桃幼苗在PEG模拟的干旱胁迫下的结果基本一致[17],说明干旱程度的加剧促进了H2O2合成,在较高浓度的PEG(5.0%和10.0%)处理较长时间(20 d)后,体内活性氧的产生和清除平衡被打破,膜脂过氧化作用加重。
ROS主要依靠SOD、POD、CAT、APX、GR等酶系统和抗氧化物质AsA、GSH、叶黄素、维生素E等组成的非酶系统来完成清除[11]。有研究表明,干旱胁迫下SOD、POD和CAT活性增强,能加快活性氧的清除,可以维持活性氧代谢平衡、保护膜结构[18-19]。本次研究中,‘717'杂交杨SOD活性随着干旱胁迫加深而下降,‘南林895'杨[20]在高浓度(75~100 mmol·L-1)盐处理下SOD活性也较对照降低。POD活性在PEG处理下均较对照显著上升,但H2O2含量在处理后也呈现上升趋势,有报道表明,叶片POD活性的增强可能主要参与生长量的调控,而不是保护植物组织缓解H2O2引起的氧化损伤[21]。CAT是C3植物中清除H2O2关键酶,本研究中,CAT活性在2.5%PEG处理10 d和5.0%PEG处理20 d时迅速上升,可以看出较低浓度干旱胁迫刺激了‘717'杂交杨的CAT活性的提高,而处理时间的延长使得‘717'杨对干旱环境的敏感度降低。在10.0%PEG处理时,CAT活性下降,表明细胞内受到的氧化伤害加剧,这和杨淑红[22]对‘中红杨'和‘2025'杨在干旱胁迫下的报道结果一致。
APX是叶绿体中清除H2O2最重要的酶,GR酶是维持GSH/GSSG (氧化型谷胱甘肽)正常比值、NADPH再生的关键,AsA和GSH本身就是活性氧的清除剂,植物体内适量的AsA、GSH承担着APX、GR作用发挥的重要角色[23]。本研究中,‘717'杂交杨APX活性和AsA含量均随着PEG浓度的增加而增加,GR活性在2.5%PEG处理10 d时,相对于对照而言有轻微的减弱,而在相同条件下GSH含量却显著的增加,但两者在10.0%PEG处理20 d时都呈一定程度的下降。MDA含量增减趋势和GR活性基本一致,说明MDA含量影响着植物体内抗坏血酸-谷胱甘肽循环。而且,‘717'杂交杨的叶片具有增强AsA再生的能力,GR、APX活性和GSH含量水平的上升可以证明这点。
综合看来,低浓度(2.5%)PEG处理促进了‘717'杂交杨根和茎的增长,而10.0%PEG使其生长显著下降,对‘717'杂交杨产生了毒害作用。随着干旱程度加剧,H2O2和MDA含量上升,‘717'杂交杨叶片中ROS发生积累。CAT活性在低浓度(2.5%)PEG处理时较对照出现显著的升高,POD和APX活性随着PEG浓度增加而增强,这些均有利于清除细胞中的ROS。在10.0%PEG处理20 d时,SOD、CAT、GR活性都出现了不同程度的减弱,说明‘717'杂交杨细胞内部活性氧自由基积累过多,膜脂过氧化作用破坏了细胞膜的稳定性,从而抗氧化酶活性降低。在干旱处理下,AsA和GSH含量均高于对照,10.0%PEG处理时GSH含量轻微的减弱。可见低浓度(2.5%) PEG处理下的干旱胁迫刺激了‘717'杂交杨,提高了抗氧化酶活性和抗氧化剂含量,而高浓度(10.0%) PEG处理时,细胞的ROS清除平衡被打破,加剧了氧化伤害。
| [1] | BAI J P, GAO H J, YANG H Y, et al. Comparison of ultrastructural and physiological changes of potato (Solanum tuberosum L.) plantlets subjected to salt and modeling drought stresses[J]. Acta Physiologiae Plantarum, 2016, 38(7): 182. DOI:10.1007/s11738-016-2202-y |
| [2] | PARIDA A K, DAS A B. Salt tolerance and salinity effects on plants:a review[J]. Ecotoxicology and Environmental Safety, 2005, 60(3): 324–349. DOI:10.1016/j.ecoenv.2004.06.010 |
| [3] | 白江平, 胡开明, 高慧娟, 等. 马铃薯StSnRK2家族转录表达对渗透胁迫的响应及生理指标相关性分析[J]. 植物科学学报, 2016, 34(4): 602–613. DOI:10.11913/PSJ.2095-0837.2016.40602 |
| [4] | 王艺, 丁贵杰. 干旱胁迫对马尾松菌根化苗木生长的影响[J]. 森林与环境学报, 2016, 36(2): 173–179. |
| [5] | 马芳蕾, 陈莹, 聂晶晶, 等. 4种芒属观赏草对干旱胁迫的生理响应[J]. 森林与环境学报, 2016, 36(2): 180–187. |
| [6] | 陈颖, 徐彩平, 汪南阳, 等. 盐胁迫下水杨酸对南林895杨组培苗抗氧化系统的影响[J]. 南京林业大学学报(自然科学版), 2012, 36(6): 17–22. |
| [7] | 侯庆春, 韩蕊莲. 黄土高原植被建设中的有关问题[J]. 水土保持通报, 2000, 20(2): 53–56. |
| [8] | MOLINA-RUEDA J J, TSAI C J, KIRBY E G. The Populus superoxide dismutase gene family and its responses to drought stress in transgenic poplar overexpressing a pine cytosolic glutamine synthetase (GS1a)[J]. PLoS One, 2013, 8(2): e56421. DOI:10.1371/journal.pone.0056421 |
| [9] | COLEMAN H D, CANOVAS F M, MAN H M, et al. Enhanced expression of glutamine synthetase (GS1a) confers altered fibre and wood chemistry in field grown hybrid poplar (Populus tremula×alba) (717-1B4)[J]. Plant Biotechnology Journal, 2012, 10(7): 883–889. DOI:10.1111/j.1467-7652.2012.00714.x |
| [10] | DURAND T C, SERGEANT K, PLANCHON S, et al. Acute metal stress in Populus tremula×P. alba (717-1B4 genotype):leaf and cambial proteome changes induced by cadmium2+[J]. Proteomics, 2010, 10(3): 349–368. DOI:10.1002/pmic.v10:3 |
| [11] | RAI M K, KALIA R K, SINGH R, et al. Developing stress tolerant plants through in vitro selection:an overview of the recent progress[J]. Environmental and Experimental Botany, 2011, 71(1): 89–98. DOI:10.1016/j.envexpbot.2010.10.021 |
| [12] | 赵世杰, 史国安, 董新纯. 植物生理学实验指导[M]. 北京: 中国农业科学技术出版社, 2002. |
| [13] | 陈建勋, 王小峰. 植物生理学实验指导[M]. 广州: 华南理工大学出版社, 2006. |
| [14] | 张静, 崔颖, 孙尧, 等. 不同程度干旱胁迫对油菜种子萌发及幼苗生长特性的影响[J]. 干旱地区农业研究, 2011, 29(2): 164–167, 179. |
| [15] | 班兆军, 关军锋, 李莉, 等. 非生物胁迫下植物体内活性氧产生和抗氧化机制的研究概述[J]. 中国果菜, 2012(5): 40–47. |
| [16] | 李锋, 李木英, 潘晓华, 等. 不同水稻品种幼苗适应低磷胁迫的根系生理生化特性[J]. 中国水稻科学, 2004, 18(1): 48–52. |
| [17] | 陈永坤, 汪宇. PEG模拟干旱胁迫对漾濞核桃幼苗抗性物质的影响[J]. 西南林业大学学报, 2013, 33(4): 103–106. |
| [18] | 刘锦春, 钟章成, 何跃军. 干旱胁迫及复水对喀斯特地区柏木幼苗活性氧清除系统的影响[J]. 应用生态学报, 2011, 22(11): 2836–2840. |
| [19] | XU Q Z, HUANG B R. Antioxidant metabolism associated with summer leaf senescence and turf quality decline for creeping bentgrass[J]. Crop Science, 2004, 44(2): 553–560. DOI:10.2135/cropsci2004.5530 |
| [20] | 汪南阳, 陈颖, 董红忠, 等. 盐胁迫对'南林895'杨组培再生芽生根及抗氧化能力的影响[J]. 林业科技开发, 2012, 26(4): 30–34. |
| [21] | CAVALCANTI F R, OLIVEIRA J T A, MARTINS-MIRANDA A S, et al. Superoxide dismutase, catalase and peroxidase activities do not confer protection against oxidative damage in salt-stressed cowpea leaves[J]. New Phytologist, 2004, 163(3): 563–571. DOI:10.1111/nph.2004.163.issue-3 |
| [22] | 杨淑红, 宋德才, 刘艳萍, 等. 土壤干旱胁迫和复水后3个杨树品种叶片部分生理指标变化及抗旱性评价[J]. 植物资源与环境学报, 2014, 23(3): 65–73. |
| [23] | SAIRAM R K, SRIVASTAVA G C, AGARWAL S, et al. Differences in antioxidant activity in response to salinity stress in tolerant and susceptible wheat genotypes[J]. Biologia Plantarum, 2005, 49(1): 85–91. DOI:10.1007/s10535-005-5091-2 |

 2017, Vol. 37
2017, Vol. 37


