文章信息
- 黄娟, 吴鹏飞, 魏志超, 王玉珍, 马祥庆
- HUANG Juan, WU Pengfei, WEI Zhichao, WANG Yuzhen, MA Xiangqing
- 杉木愈伤组织及再生芽分化的细胞学观察
- Cytohistological observation on callus and regeneration bud differentiation of Cunninghamia lanceolata
- 森林与环境学报,2017, 37(4): 392-397.
- Journal of Forest and Environment,2017, 37(4): 392-397.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2017.04.002
-
文章历史
- 收稿日期: 2017-03-09
- 修回日期: 2017-04-10
2. 国家林业局杉木工程技术研究中心, 福建 福州 350002
2. State Forestry Administration Engineering Research Center of Chinese Fir, Fuzhou, Fujian 350002, China
杉木[Cunninghamia lanceolata (Lamb.) Hook.]是我国主要建筑和纸浆用材树种,因生长快、产量高、材质好等特点,广泛用于我国南方人工造林。近年来,随着人们对优质杉木木材需求的日益增加,发掘和利用抗逆性特性基因进行基因工程手段培育优质杉木成为当前研究热点,目前国内外通过杉木遗传转化实现优质植株再生体系的建立只有少数获得成功[1-4]。研究表明,遗传转化成功的关键是外源基因导入具有再生能力的细胞中,而植株再生过程中,获得优良胚性愈伤组织和再分化成不定芽是关键[5-7]。因此,研究杉木愈伤组织的形成及再分化的发生规律至关重要。
截至目前,席梦利等[8]在杉木成熟合子胚的不定芽发生中进行细胞初步研究,研究表明两种未经过愈伤组织阶段的不定芽发生均为直接器官发生。除此之外,国内外还未见杉木愈伤组织和再生芽形成过程的细胞组织学观察的相关报道。前人在多种植物的愈伤组织诱导研究中发现,植物激素对愈伤组织的诱导、增殖、再分化起着重要作用[9-15]。在前人研究基础上,以杉木茎段为外植体进行组织培养,利用显微镜观察愈伤组织形成及愈伤组织分化过程中的器官发生和形态变化,一方面揭示愈伤组织形成过程中的细胞组织学变化规律,为杉木通过愈伤组织建立植株再生体系提供参考;另一方面通过愈伤组织再生芽分化过程中的细胞组织学周期变化,为通过遗传转化培育优质新型杉木提供技术支撑。
1 材料与方法 1.1 试验材料以组织培养两个月的020杉木无性系苗茎段为外植体,以MS培养基为基本培养基,植物激素2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2, 4-D),萘乙酸(1-naphthylacetic acid,NAA),6-苄氨基腺嘌呤(6-benzylaminopurine,6-BA), 激动素(kinetin,KT),噻苯隆(thidiazuron,TDZ);琼脂0.7%,水解酪蛋白0.5%,蔗糖2.5%,pH值5.8,于120 ℃高温灭菌30 min,冷却凝固后备用。
愈伤组织诱导:MS+2, 4-D1 mg·L-1+NAA2 mg·L-1+TDZ0.01 mg·L-1;MS+2, 4-D1 mg·L-1+6-BA2 mg·L-1+KT0.5 mg·L-1,在(25±1) ℃的暗培养条件下进行培养,以产生的两种质地愈伤组织(质地疏松型和质地均匀型)为试验材料。
愈伤组织再分化:6-BA0.5 mg·L-1+KT1.5 mg·L-1+琼脂粉7 g·L-1+糖25 g·L-1,在(25±1) ℃,光照1 000 lx,16 h·d-1光周期条件下进行培养。
1.2 试验方法 1.2.1 不同类型的愈伤组织细胞学观察将愈伤组织除去琼脂后放在培养瓶中用注射器胶皮头进行充分捣碎,吸取上层清液,滴1滴于干净载玻片上,体式显微镜观察并拍照。
1.2.2 愈伤组织形成及再分化过程中的细胞学观察培养3 d后开始取材,以后每隔3 d进行取样。将愈伤组织诱导阶段的外植体和不同发育阶段(愈伤组织形成期、增殖期、再生芽分化期)的愈伤组织先用固定液(38%福尔马林-醋酸-70%酒精)固定24 h,再冲洗、脱水、透明、浸蜡、包埋处理,最后用Leica RM2255全自动轮式石蜡切片机进行切片,厚度为8 μm,番红-固绿复染,光学树脂封片,Nikon-Eclipse显微镜观察拍照。
2 结果与分析 2.1 愈伤组织形成过程中的细胞学观察 2.1.1 不同质地愈伤组织结构差异在MS+2, 4-D1 mg·L-1+6-BA2 mg·L-1+KT0.5 mg·L-1培养基上,愈伤组织质地均匀,细胞较小,胞质较厚、染色深、细胞核大、细胞形态较规则,具有分生组织细胞的特点,为胚性愈伤组织(图 1A)。在MS+2, 4-D1 mg·L-1 +NAA2 mg·L-1+TDZ0.01 mg·L-1培养基上,愈伤组织质地疏松,细胞较大,胞质稀薄、染色浅、细胞核小、性状不规则,不具有分化活性,为非胚性愈伤组织(图 1C)。在两种培养基上均会在某个时间段发现胚性与非胚性愈伤组织同时存在的现象(图 1B)。

|
图 1 两种不同质地的愈伤组织细胞学观察 Fig. 1 Cytological observation on two different textures callus 注:A.胚性细胞(100×);B.胚与非胚性细胞(100×);C.非胚性细胞(500×)。 Note: A.embryogenic cells(100×); B.embryogenic and non-embryogenic cells(100×); C.non-embryogenic cells(500×). |
在愈伤组织诱导培养基上,茎段在培养开始的7 d内,肉眼可见茎段切口处开始失绿膨胀并有向四周扩散趋势,此时期外植体在微形态和细胞学上无明显差异。组织切片观察表明,培养3 d、近切口处的表皮细胞部分破碎,表皮、皮层的薄壁细胞开始分裂并增大,细胞质浓缩,细胞核变大,表现为向分生细胞的回复变化,同时其他部位的表皮细胞则完整,这一时期称为起动期(图 2A箭头处表示茎段切口处表皮细胞开始分裂)。

|
图 2 愈伤组织形成的细胞学观察 Fig. 2 Cytological observation of callus formation 注:A.茎纵切面,愈伤组织起动期(100×); B.茎横切面,薄壁组织脱分化,并形成分生细胞团(200×); C.茎表面产生细密的愈伤组织(20×); D.体视显微镜下瘤状突起(20×); E.薄壁细胞二分裂(400×); F.多边形细胞分裂区(200×)。Note: A.vertical section, begining of callus(100×); B.cross section, dedifferentiation of parenchyma and formation of meristemoid cluster(200×); C.callus appeared at the incision of stem segment(20×); D.strumae under stereo microscope(20×); E.bipartition of parenchyma cell two division(400×); F.polygon cell division(200×). |
组织培养10 d后,茎段组织转变成米黄色,整个组织由于细胞不断分裂明显增大,在切口处形成少量愈伤组织。组织切片观察表明,近切口处的表皮细胞发生破裂和解体,同时细胞分裂活动向内发展,中间维管束的薄壁细胞已经脱分化,并在局部形成具有高度分裂能力,排列紧密的分生细胞团(图 2B箭头所示);细胞体积进一步减小,这一时期以细胞的活跃分裂为主要特征,在这些活跃分裂的部位通常已无法辨认原来的细胞组织。培养15~20 d后体视显微镜观察可发现茎段组织切口及表面逐渐出现大量细密的愈伤组织(图 2C),随后肉眼可见茎段组织整体愈伤组织化,体视显微镜下可见整个茎段表面出现大量球形颗粒状细胞团的米黄色愈伤组织——瘤状突起物(图 2D),此时茎外植体原有的组织结构和形态完全消失,相当于愈伤组织分裂期。可见,愈伤组织分裂期主要是由茎段表皮细胞经过脱分化后产生脱分化细胞,随后细胞不断分裂从而加速愈伤组织扩大。切片观察发现,在愈伤组织形成过程中,有两种细胞分裂方式。两种细胞分裂方式首先都是由愈伤组织的内部薄壁细胞通过脱分化形成分生细胞,不同的是一种通过细胞壁内陷将细胞分裂成两个(图 2E箭头所示),该分裂方式在后期器官分化中多次出现;另一种则是通过多次有丝分裂最终形成由多边形细胞构成的细胞分裂区(图 2F箭头所示),该分裂方式主要是增加愈伤组织的细胞数量从而扩增愈伤组织的体积。根据愈伤组织形成期的细胞结构变化可发现,外植体细胞经过脱分化(转变成未分化的细胞)后形成了细胞大小相对稳定但结构较无序的愈伤组织。
2.2 愈伤组织增殖过程中的细胞学观察在愈伤组织形成的第10天,可观察到愈伤组织的细胞逐渐向组织内部分裂并不断分化出新的薄壁细胞,其中部分细胞开始出现维管组织分化,最终逐渐形成拟分生组织(具有旺盛的分裂能力)。将形成的愈伤组织分别接种在诱导和再分化两种培养基上进行观察,可发现愈伤组织在增殖过程中出现两种类型的维管组织分化。愈伤组织在培养基上均先通过内部的薄壁细胞脱分化再次恢复到分生细胞状态即形成分生细胞,但在诱导培养基上,这种分生细胞横向伸长逐渐分化成形成层状细胞,此后该层状细胞一侧分化成维管分子,进而形成线型维管组织(图 3A);在再分化培养基上,这种分生细胞进行平周分裂方式增加细胞层次,进而最终形成团状维管组织,此后该维管组织进行垂周分裂形成维管组织节(图 3B箭头所示)。在维管组织周围的薄壁细胞可进行细胞分裂而形成“生长中心”,这种成团的维管组织其细胞排列呈鸟巢状结构(图 3C)。
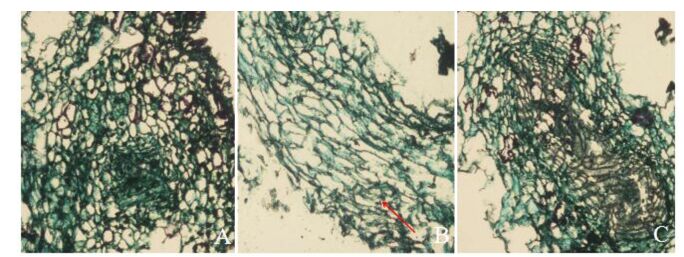
|
图 3 愈伤组织增殖过程的细胞学观察 Fig. 3 Cytological observation of callus differentiation 注:A.线性维管组织(200×); B.维管组织节(200×); C.鸟巢状维管组织(200×)。 Note: A.linear vascular tissue(200×); B.vascular nodule(200×); C.nest-shaped vascular tissue(200×). |
在试验中发现杉木的再生芽发生方式有两种,通过外植体直接发生和通过愈伤组织再分化形成。肉眼发现外植体直接发生是从茎段的叶腋处萌发形成,细胞观察在叶腋近表层细胞进行平周和垂周分裂形成分生组织突起,随后突起两侧细胞加速分裂发育成叶原基,最后整体组成腋芽原基并进一步发育形成肉眼可见的不定芽(图 4A)。愈伤组织再分化切片观察表明,当细胞质浓、细胞核大的分生细胞团出现后,愈伤组织开始发生器官原基分化。在添加6-BA0.5 mg·L-1+KT1.5 mg·L-1的再生芽诱导培养基上培养10天左右,观察到愈伤组织近表皮层的部分分生细胞团分化为各种畸形突出物,突出于愈伤组织表面,这些突出物有的为波浪形突起(图 4B箭头所示),有的类似芽原基的形状,其表面均有表皮组织覆盖。在这种突出物分化后7 d,即可观察到表层的分生细胞团单向极性生长,最终分生细胞团分化出正常芽原基(图 4C),可说明芽原基是由愈伤组织的表层细胞发生形成,为“外起源”发生方式。20~24 d时,切片观察到原有的分生细胞团进一步形成大量芽原基(图 4D),最终不断分化出叶原基形成肉眼可见的芽(图 4E、F)。

|
图 4 芽分化的细胞学观察 Fig. 4 Cytological observation of regeneration bud differentiation 注:A.箭头示芽从茎段叶腋处长出(100×); B.愈伤组织表面波浪形突出物(200×); C.芽原基突出表皮层(200×); D.多个芽原基(400×); E.肉眼可见多个再生芽; F.叶原基形成(400×)。Note: A.bud from stems axillae(100×); B.wave-like protrusion of callus surface (200×); C.bud primordium extrude epidermal layer(200×); D.mutiple bud primordiums(400×); E.multiple regenerated shoots; F.leaf primordium formation(400×). |
愈伤组织是由外植体表皮层中的薄壁细胞通过脱分化成分生细胞,随后细胞并不断向内扩增,最终整个外植体由内向外逐渐愈伤组织化。这在菘蓝(Isatis indigotica Fortune)[16]离体培养过程中愈伤组织和再生芽发生的细胞组织学观察结果一致,即愈伤组织是由子叶切口处表皮层细胞通过脱分化产生的。但油橄榄(Olea europaea L.)和罗汉松[Podocarpus macrophyllus (Thunb.) D. Don]的愈伤组织起源于皮层,红杉[Sequoia sempeervirens (Lamb.) Endl.]的愈伤组织起源于形成层和射线[17]。以上几种愈伤组织的起源方式不同,进一步证明创伤刺激只是促进细胞增殖的原因之一,而外植体不受植株对某组织的控制,再给予营养物质与生长调节剂是细胞增殖的重要因素。
愈伤组织形成的本身就是组织分化的过程,有许多研究报道愈伤组织可进一步分化成其他组织,但它们与器官再生无直接关系[18-20]。该研究发现愈伤组织在分化形成再生芽过程中,最早活化而进行分裂的是维管束中的薄壁细胞以及维管束鞘细胞,这与许智宏等[21]在烟草(Nicotiana tabacum L.)叶愈伤组织和芽形成的细胞学观察研究中的发现相似。
杉木通过愈伤组织进行再生芽分化为“外起源”发生方式。再生芽是由愈伤组织的部分薄壁细胞通过脱分化回复到分生细胞状态后进一步形成拟分生组织,再通过平周分裂和垂周分裂产生组织分化后形成。关于拟分生组织(分生组织节)有许多研究报道,分生组织节是愈伤组织的生长中心,由薄壁细胞经脱分化形成,这些组织节具有可塑性,可形成芽或根的原基[22-25]。在杉木愈伤组织培养过程中分生组织节的形成是常见现象,这与后期器官分化有关。倪德祥等[26]在凹叶景天(Sedum emarginatum Migo)叶片诱导愈伤组织时,也发现愈伤组织表层细胞进行平周和垂周有规律的分裂,分生细胞团进一步形成生长锥,产生芽的原基,并不断地在生长锥上形成叶原基。但也有报道发现芽再生过程中不见有分生组织节或维管组织节的存在,更不是直接从结节状结构分化形成[17, 27]。其次有研究发现在形成的愈伤组织再生芽过程中,芽原基除在表层分生组织中分化形成“外起源”外,也可以起源于组织较深处的分生组织细胞,即“内起源”[21];番茄(Lycopersicon esculentum Mill.)[28]离体培养中不定芽通常发生在愈伤组织的周边区, 也可起源于维管组织节周围的形成层状细胞,这可能与试验材料(草本植物或木本植物)不同有关。
利用石蜡切片技术观察了杉木茎段愈伤组织诱导和芽再生的分化过程,诱导的愈伤组织能进一步培养分化出再生芽,表明杉木能通过愈伤组织再分化进行植株再生。杉木通过愈伤组织产生再生芽的方式为外起源,在接种后10 d出现畸形突出物,表明导入外源基因的最佳时期应是愈伤组织接种于再生芽培养基上的5~10 d内。杉木从外植体到愈伤组织再分化成不定芽需要经历脱分化-再分化过程。
| [1] | 席梦利, 施季森. 不同因素对农杆菌介导的杉木转化效率的影响[J]. 林业科学, 2007, 43(3): 46–50. |
| [2] | 席梦利, 施季森. 杉木遗传转化受体系统的建立[J]. 南京林业大学学报(自然科学版), 2006, 30(6): 7–11. |
| [3] | 姚甲宝. 杉木遗传转化体系的研究[D]. 南京: 南京林业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10298-2010253515.htm |
| [4] | 席梦利. 杉木转基因受体系统的建立及遗传转化研究[D]. 南京: 南京林业大学, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10298-2004092382.htm |
| [5] | CHAI M L, JIA Y F, CHEN S, et al. Callus induction, plant regeneration, and long-term maintenance of embryogenic cultures in Zoysia matrella(L.) Merr[J]. Plant Cell, Tissue and Organ Culture, 2011, 104(2): 187–192. DOI:10.1007/s11240-010-9817-2 |
| [6] | OKAMURA M, TANIGUCHI T, KONDO T. Efficient embryogenic callus induction and plant regeneration from embryonic axis explants in Quercus acutissima[J]. Journal of Forest Research, 2001, 6(2): 63–66. DOI:10.1007/BF02762489 |
| [7] | 唐巍, 罗晓艳, SAMUELSV. 植物激素和抗生素调节的转基因火炬松愈伤组织的生长和分化[J]. 遗传学报, 2002, 29(2): 166–174. |
| [8] | 席梦利, 施季森. 杉木成熟合子胚器官发生和体胚发生[J]. 林业科学, 2006, 42(9): 29–33, 148. |
| [9] | 张建瑛, 姜思佳, 刑亚娟, 等. 胡桃楸胚性愈伤组织诱导与体细胞胚胎发生[J]. 植物研究, 2010, 30(1): 22–26. |
| [10] | 吴丽君. 湿地松器官性愈伤组织诱导与增殖[J]. 西南林业大学学报, 2008, 28(6): 49–52, 56. |
| [11] | 黄翠, 景丹龙, 王玉兵, 等. 水杉愈伤组织诱导及植株再生[J]. 植物学报, 2010, 45(5): 604–608. |
| [12] | 王娟, 毕玮, 普晓兰, 等. 小叶龙竹(Dendrocalamus barbatus)愈伤组织诱导及植株再生[J]. 植物生理学报, 2012, 48(4): 359–363. |
| [13] | 王伟达, 李成浩, 杨静莉, 等. 杂种落叶松未成熟胚的体细胞胚发生和植株再生[J]. 林业科学, 2009, 45(8): 34–38. DOI:10.11707/j.1001-7488.20090806 |
| [14] | SANTNER A, CALDERON-VILLALOBOS L I A, ESTELLE M. Plant hormones are versatile chemical regulators of plant growth[J]. Nature Chemical Biology, 2009, 5(5): 301–307. DOI:10.1038/nchembio.165 |
| [15] | 崔凯荣, 邢更生, 周功克, 等. 植物激素对体细胞胚胎发生的诱导与调节[J]. 遗传, 2000, 22(5): 349–354. |
| [16] | 王凯基, 张丕方, 倪德祥, 等. 几种木本植物组织培养的愈伤组织形成和器官再生[J]. 植物学报, 1981, 23(2): 97–178. |
| [17] | 曾建军, 孙一铭, 孙敏, 等. 菘蓝离体培养过程中愈伤组织和再生芽发生的细胞组织学观察[J]. 西南师范大学学报(自然科学版), 2004, 29(6): 1069–1072. |
| [18] | 朱向涛, 王雁, 彭镇华, 等. 牡丹愈伤组织扫描电镜观察[J]. 林业科学研究, 2011, 24(5): 609–612. |
| [19] | 林荣双, 王庆华, 梁丽琨, 等. TDZ诱导花生幼叶的不定芽和体细胞胚发生的组织学观察[J]. 植物研究, 2003, 23(2): 169–171. |
| [20] | 王凯基, 张丕方, 倪德祥, 等. 油橄榄(Olea europaea L.)组织培养的细胞组织学研究:Ⅱ.组织分化和器官发[J]. 植物学报, 1979, 21(3): 225–230. |
| [21] | 许智宏, 刘桂云. 烟草叶组织培养中愈伤组织和芽形成的细胞学观察[J]. 植物学报, 1980, 22(1): 1–5. |
| [22] | 秦磊, 成仿云, 钟原, 等. 牡丹愈伤组织发生和分生结节形成的细胞组织学研究[J]. 西北植物学报, 2012, 32(8): 1579–1586. |
| [23] | 郝岗平, 杜希华, 史仁玖, 等. 银杏幼嫩茎段培养诱导愈伤组织及其细胞学研究[J]. 西北植物学报, 2003, 23(4): 648–652. |
| [24] | 暨淑仪, 严学成, 王毅军. 茶叶片愈伤组织形成的细胞组织学观察[J]. 茶叶, 1995, 21(2): 11–13. |
| [25] | 刘克斌, 李曙轩. 番茄叶组织培养中愈伤组织形成和器官发生的细胞学和微形态学研究[J]. 广西植物, 1991, 11(3): 240–246. |
| [26] | 倪德祥, 易莹, 张丕方, 等. 凹叶景天叶片离体培养的形态发生[J]. 上海农业学报, 1987, 3(1): 73–78. |
| [27] | 姜清彬, 仲崇禄, 陈羽, 等. 细枝木麻黄离体培养过程中愈伤组织和再生芽的细胞组织学观察[J]. 热带亚热带植物学报, 2015, 23(1): 37–42. DOI:10.11926/j.issn.1005-3395.2015.01.006 |
| [28] | 陈火英, 张建华, 俞俊棠, 等. 番茄离体培养过程中器官发生的细胞组织学观察[J]. 武汉植物学研究, 2001, 19(2): 91–178. |

 2017, Vol. 37
2017, Vol. 37


