文章信息
- 陈凌艳, 何丽婷, 赖金莉, 何舒婷, 吴玉香, 郑郁善
- CHEN Lingyan, HE Liting, LAI Jinli, HE Shuting, WU Yuxiang, ZHENG Yushan
- 银丝竹不同叶色叶绿素合成及叶结构差异
- The variation of chlorophyll biosynthesis and the structure in different color leaves of Bambusa multiplex 'Silverstripe'
- 森林与环境学报,2017, 37(4): 385-391.
- Journal of Forest and Environment,2017, 37(4): 385-391.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2017.04.001
-
文章历史
- 收稿日期: 2017-04-14
- 修回日期: 2017-07-13
竹类是园林植物界重要的观赏植物类型。其中,彩叶竹种又因其叶片上丰富的条纹状叶色备受人们青睐,这些年来在园林植物应用领域备受关注。银丝竹(Bambusa multiplex ‘Silverstripe' R. A. Young)是一种观赏性状优良的彩叶丛生小径竹,株高可达5~6 m,是孝顺竹[Bambusa multiplex (Lour.) Raeusch. ex Schult.]的栽培型,叶片多为深绿色,少数叶片间有白色纵条纹,偶见全白色叶片。然而该花叶特性表达不稳定,会随着栽培条件和叶片生长发生改变。
目前对花叶竹类的研究主要集中在矮小型混生竹种花叶矢竹(Pseudosasa japonica f. akebonosuji H. Okamura)和地被竹种白纹阴阳竹(× Phyllosasa tranquillans ‘Shiroshima')、白纹椎谷笹(Sasaella glabra f. albostriata Muroi)、菲黄竹[Pleioblastus viridistriatus (Regel) Makino]、黄条金刚竹(Pleioblastus kongosanensis f. aureostriatus Muroi & Yu.Tanaka)等个别竹种上。王啸晨等[1]对白纹阴阳竹和白纹椎谷笹的叶片结构进行了对比分析,发现这两个彩叶竹种的白色叶片部分的叶肉细胞发生了叶绿体变异;杨海芸[2]对花叶矢竹的花叶呈色机理开展了研究,发现早期光诱导蛋白基因ELIPs可能是导致花叶矢竹叶片失绿的诱因之一;徐丽丽等[3]、许冰清等[4]分别对花叶矢竹光系统I和光系统Ⅱ反应中心蛋白的编码基因psaA和psbD进行了克隆和功能分析,表明这两个基因在不同叶色上的差异可能与光保护机制有关。大量研究表明[5-7],植物叶片发生黄化或白化现象与植株叶绿体结构发育不良和叶绿素合成受阻有关。本研究以银丝竹为研究对象,通过研究其不同叶色叶片的结构,测定叶片色素含量及叶绿素合成前体含量,初步探讨银丝竹花色叶形成的原因,为进一步开展分子水平机理研究奠定基础。
1 材料与方法 1.1 试验材料试验材料来源于福建农林大学百竹园的银丝竹分株苗,分株苗栽培于福建农林大学竹类研究所苗圃。试验所用叶片均采自植株第二轮成熟枝条。根据不同颜色条纹在叶片上的分布面积将银丝竹的叶片分为4组:全绿叶片、绿底白纹叶片(浓绿及中绿叶色面积超过50%,且间有白或黄绿色条纹的叶片)、白底绿纹叶片(黄绿及白叶色面积超过50%,且间有浓绿或中绿色条纹的叶片)、全白叶片(图 1)。

|
图 1 银丝竹不同叶色叶片 Fig. 1 Different color leaves of B. multiplexcv'Silverstripe' |
银丝竹不同叶色叶片光合色素含量测定参照李合生[8]的方法,略有改动:分别取银丝竹全绿、全白、绿底白纹和白底绿纹叶片若干,洗净叶片表面的污渍,去掉中脉并剪碎,各称取0.25 g,浸入25 mL丙酮与无水乙醇的混合液(V丙酮:V无水乙醇=1:1) 中浸提48 h至叶片完全变白,以丙酮和无水乙醇混合液为空白对照,在波长为470、663、645 nm处测定光密度(optical density,OD)值,并计算叶绿素a,叶绿素b及类胡萝卜素含量,重复3次。
1.2.2 叶绿素合成前体的测定δ-氨基乙酰丙酸(5-aminolevulinic acid,ALA)的测定参照张帆等[9]的方法,略有改动:称取叶片0.4 g,用液氮充分研磨后装至10 mL离心管,每管加入4 mL提取液(质量分数为4%的三氯乙酸),使用高速离心机(LoboGene 1736R,丹麦,转头半径为89.5 mm),以13 400 r·min-1转速离心10 min,取1 mL上清液至2 mL离心管,并加入500 μL NaAc(1 mol·L-1)和50 μL乙酰丙酮,沸水浴10 min后冷却到室温,再使用高速离心机(转头半径为96.4 mm),以12 900 r·min-1转速离心10 min,取1.5 mL上清液加入1.5 mL的显色剂(Ehrlich-Hg试剂)在黑暗中反应15 min后,在553 nm处测定其OD值,重复3次。
胆色素原(porphobilinogen,PBG)的测定参照BOGORAD[10]的方法,略有改动:称取叶片0.2 g,液氮研磨后装至10 mL离心管,每管加入4 mL提取缓冲液[0.6 mol·L-1三羟甲基氨基甲烷[tris (hydroxymethyl) aminomethane,Tris],0.1 mol·L-1乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),pH值8.2]充分匀浆后,使用高速离心机(转头半径为89.5 mm),以13 400 r·min-1转速离心10 min,取1.5 mL上清液加入1.5 mL显色剂(Ehrlich-Hg试剂),在黑暗中反应15 min后,在553 nm处测定OD值,重复3次。
尿卟啉原Ⅲ(uroporphyrinogen Ⅲ,Urogen Ⅲ)和粪卟啉原Ⅲ(coproprophyrinogen Ⅲ,Coprogen Ⅲ)的测定参照BOGORAD[10]的方法,略有改动:称取叶片0.2 g,液氮研磨后装至10 mL离心管,每管加入4 mL磷酸缓冲液(0.067 mol·L-1 pH值6.8) 混匀;将所得悬浮液使用高速离心机(转头半径为89.5 mm),以13 400 r·min-1转速离心10 min,取2.5 mL上清液并加入200 μL质量分数为1%的Na2S2O3,涡旋震荡均匀;所得混合液在100 J·s-1强光下照射20 min后用冰醋酸调节pH值到3.5,然后用10 mL乙醚进行萃取,重复3次,测定获得的水相在405.5 nm处的OD值以检测Urogen Ⅲ的含量;再将萃取3次后合并的乙醚萃取液用3 mL 0. 1 mol·L-1的盐酸萃取3次,将获得的盐酸相合并,测定盐酸相在399.5 nm的OD值以检测Coprogen Ⅲ的含量,重复3次。
原卟啉Ⅸ(protoporphyrin Ⅸ,Proto Ⅸ)、镁原卟啉Ⅸ(Mg-protoporphyrin Ⅸ,Mg-Proto Ⅸ)和原叶绿素(protochlorophyllide,Pchlide)的测定参照杨海芸[2]的方法:取0.5 g去叶脉鲜叶,加入25 mL 80%碱性丙酮(V丙酮:V0.1 mol·L-1 NH3·H2O=8:2),研磨提取后,分别在波长575、590和628 nm处测得OD值,用A表示,并代入公式(1) ~(3) 计算各自含量(μmol·g-1),重复3次。
| ${C_{{\rm{ProtoⅨ}}}} = 0.180{\rm{ }}16{A_{575}} - 0.040{\rm{ }}36{A_{628}} - 0.045{\rm{ }}15{A_{590}}$ | (1) |
| ${C_{{\rm{Mg - ProtoⅨ}}}} = 0.060{\rm{ }}77{A_{590}} - 0.019{\rm{ }}37{A_{575}} - 0.003{\rm{ }}423{A_{628}}$ | (2) |
| ${C_{{\rm{Pchlide}}}} = 0.035{\rm{ }}63{A_{628}} + 0.007{\rm{ }}225{A_{590}} - 0.029{\rm{ }}55{A_{575}}$ | (3) |
式中:CProtoⅨ为原卟啉Ⅸ含量,CMg-ProtoⅨ为镁原卟啉Ⅸ含量,CPchlide为原叶绿素含量,A为光密度值。
将全绿叶片的叶绿素合成前体物质含量设为1,其他3类叶色叶片叶绿素合成前体含量以相对于全绿色叶片含量的比值表示。
1.2.3 石蜡切片制作与观察选择银丝竹全绿和全白叶片进行显微结构观察。制作银丝竹叶片石蜡切片的方法综合参照李正理[11]、王艳芳等[12]、陈海魁[13]方法,选择全绿叶和全白叶各5片,切成长约0.5 cm×0.5 cm的方块,使用标准固定液(V福尔马林:V醋酸:V50%酒精=5:5:90) 抽气真空固定24 h。经脱水、浸蜡、包埋、染色后,用全自动切片机(LEICA RM2235,德国)切片(厚度8~10 μm),烘干后脱蜡,并用Nikon光学显微镜(CI-L,日本)观察切片。
1.2.4 透射电镜样品制作与观察根据石蜡切片观察结果,选择全绿叶片和全白叶片进行叶绿体超微结构分析。透射电镜样品制作参照王啸晨等[1]的方法,稍有改动:分别将不同叶色叶片切成0.2 cm× 0.4 cm,浸入2.5%戊二醛固定液(V市售25%戊二醛溶液:VH2O:V0.2 mol·L-1磷酸缓冲液=1:4:5),在4 ℃下固定24 h,而后用pH值为7.0、浓度为0.1 mol·L-1的磷酸缓冲液缓冲液冲洗1遍,再用1%锇酸固定2 h,后用0.1 mol·L-1磷酸缓冲液冲洗,最后将样品置于体积分数为30%、50%、70%、80%、90%、100%丙酮中梯度脱水,树脂包埋后,使用Hitachi HT7700透射电镜观察。
1.3 数据处理试验所得数据用Microsoft Excel和SPSS 19.0进行统计,采用单因素方差分析和LSD法进行差异显著性检验。
2 结果与分析 2.1 叶片光合色素含量的变化由表 1可知,各叶色间叶片光合色素含量差异极显著(P<0.01),且随着叶片绿色面积比例的下降而呈现显著下降趋势。在全白叶片中,叶绿素a,叶绿素b,类胡萝卜素含量均显著低于其他叶色。与全绿叶片相比,全白叶片中叶绿素a和叶绿素b含量仅为全绿叶片的1.5%,类胡萝卜素含量仅为全绿叶片的1.6%。
| 叶片类型Leaf type | 光合色素含量Photosynthetic pigment content/(mg·g-1) | |||
| 叶绿素a Chlorophyll a | 叶绿素b Chlorophyll b | 叶绿素a+b Chlorophyll a+b | 类胡萝卜素 Carotenoid | |
| 全绿叶片Whole green leaf | 26.958±0.1044a | 9.296±0.2093a | 36.254±0.3130a | 5.112±0.0107a |
| 绿底白纹Green leaf with white stripes | 18.197±0.1532b | 4.184±0.0489b | 22.381±0.2009b | 4.238±0.0377b |
| 白底绿纹White leaf with green stripes | 15.855±0.2329c | 3.479±0.0642c | 19.335±0.2958c | 3.660±0.0449c |
| 全白叶片Whole white leaf | 0.417±0.0397d | 0.144±0.0127d | 0.562±0.0523d | 0.084±0.0127d |
| 1) 不同的字母表示差异极显著,P < 0.01。Note:different letters indicate a significant difference at P < 0.01. | ||||
从图 2可以看出,4种叶色叶片叶绿素合成前体的相对含量差异显著(P < 0.05)。根据叶绿素含量差异的显著性,重点关注全绿叶片和全白叶片叶绿素合成前体物质含量的比值。发现从δ-氨基乙酰丙酸至粪卟啉原Ⅲ的合成过程中,全白叶片的尿卟啉原Ⅲ和粪卟啉原Ⅲ含量较其他叶色有了显著提高,说明由粪卟啉原Ⅲ至原卟啉Ⅸ的转化受到了阻碍,导致白色叶片中积累了含量较高的尿卟啉原Ⅲ和粪卟啉原Ⅲ。
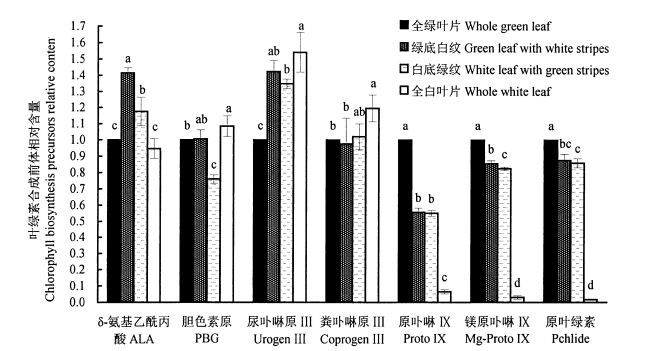
|
图 2 银丝竹不同叶色叶片叶绿素合成前体相对含量的变化 Fig. 2 Relative content variation of chlorophyll biosynthesis precursor in different color leaves of B. multiplex'Silverstripe' 注:误差线代表的是测定数据的标准误差;不同的字母表示差异显著(P < 0.05)。 Note:vertical bars in the figure indicate standard error. Different letters indicate a significant difference at P < 0.05. |
而从粪卟啉原Ⅲ至原卟啉原Ⅸ合成过程中,全白叶片的转化率急剧下降,下降的幅度达到94.50%。全白叶片中原卟啉原Ⅸ的含量只有全绿叶片的6.52%,绿底白纹叶片和白底绿纹叶片的含量仅为全绿叶片的54.35%和52.12%,差异极显著(P<0.01)。由此推测,银丝竹叶片中白色叶肉组织的产生可能与叶绿素生物合成受阻有关。
2.3 叶片显微结构分析观察银丝竹叶片的石蜡切片,发现两种叶色叶片的表皮区域没有显示出明显差异,叶片的上表皮细胞呈椭圆状,大小均匀,其间有3~5个泡状大细胞组合为扇形向内深入叶肉细胞;下表皮细胞形状不规则;叶肉组织由3~5层细胞组成(图 3)。对比两种颜色叶片的叶肉细胞,可见绿色叶肉细胞颜色较深,细胞内容物较多(图 3a);白色叶肉细胞内容物缺失明显,且多数细胞内空腔体积较大(图 3b)。由此可以推测影响叶片颜色差异的原因主要集中在叶肉细胞内容物的差异上,其具体差异需要进一步通过超微切片观察叶肉细胞的超微结构。
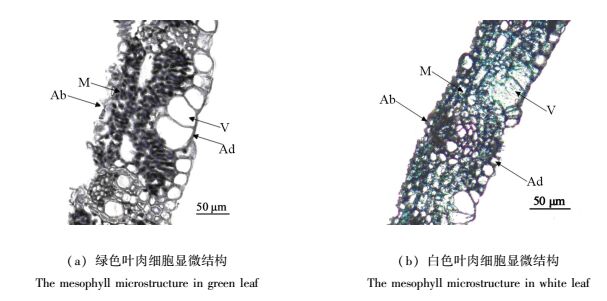
|
图 3 银丝竹叶片横切显微结构 Fig. 3 The mesophyll microstructure in different color leaves of B. multiplex'Silverstripe' 注:Ad-上表皮;Ab-下表皮;M-叶肉细胞;V-泡状结构。 Note: Ad means adeaxial epidermis, Ab means abaxial epidermis, M means mesophyll, V means bulliform cell. |
对银丝竹全白叶片和全绿叶片叶肉细胞透射电镜的观察,可见,银丝竹全绿叶片中细胞结构丰富,线粒体、叶绿体、细胞核、液泡等清晰可见,结构完整(图 4a);叶绿体膜边界清晰,呈梭状或长椭圆形,类囊体片层结构垛叠紧实,基粒结构清晰,噬锇颗粒零散分布在叶绿体内(图 4b)。
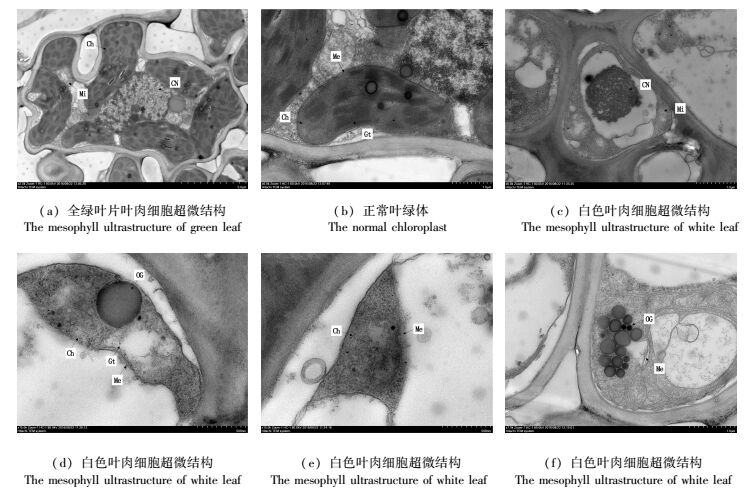
|
图 4 银丝竹叶肉细胞超微结构 Fig. 4 The mesophyll ultrastructure in different color leaves of B. multiplex'Silverstripe' 注:Me-叶绿体膜;Ch-叶绿体;Gt-基粒;OG-嗜锇颗粒;CN-细胞核;Mi-线粒体。 Note: Me means chloroplast membrane, Ch means chloroplast, Gt means granum-thylakoid, OG means osmiophilic granule, CN means cell nucleus, Mi means miitochondria. |
银丝竹全白叶片中,可见细胞核、线粒体等细胞器,但多数细胞内无完整叶绿体结构(图 4c)或偶见部分发育不良的叶绿体,呈现出基粒类囊体片层不规则或呈空泡状(图 4d),叶绿体膜结构模糊,无完整边界(图 4e)等形态,在多数细胞内可见较明显的嗜锇颗粒(图 4f)。
由此可知,白色叶肉细胞中叶绿体形态不健全或叶绿体缺失是导致银丝竹叶片失绿的原因。
3 讨论叶绿素的生物合成是一个复杂的化学变化过程,分为4个阶段15个反应,涉及15种酶[14-15]。第一阶段是由谷氨酸形成ALA后,由2分子ALA合成胆色素原PBG;第二阶段是由PBG异构化为环状的尿卟啉原Ⅲ,再由尿卟啉原Ⅲ脱羧生成粪卟啉原Ⅲ,继而形成了环状骨架后,氧化为原卟啉Ⅸ,生成的原卟啉螯合作用于镁离子,则形成了镁原卟啉,再经过甲基化和环化作用,形成了单乙烯基原叶绿素酯a;第三阶段是在叶绿素酯氧化还原酶的催化作用下,单乙烯基叶绿素酯a还原成叶绿素酯a;第四阶段是植醇尾巴与叶绿素酯a IV环的丙酸酯化,就形成了叶绿素a。在这一过程中,任何一个步骤受阻都将阻断叶绿素的合成,影响植物的叶绿素含量[16]。
目前,已有不少相关学者做了关于叶绿素合成途径受阻导致叶色突变的研究:孙捷音等[17]在对油菜叶绿素b减少突变体Cr3529的研究中发现其叶绿素合成过程受阻于PBG至尿卟啉原Ⅲ的过程中;张帆等[9]在对杨树进行镉处理中,发现镉阻碍了杨树叶片叶绿素生物合成过程,其阻碍位点在由尿卟啉原Ⅲ至粪卟啉原Ⅲ转化的过程中;王颖等[18]研究表明,菠菜叶片在盐胁迫条件下将发生叶绿素合成受阻,受阻位点在PBG至尿卟啉原Ⅲ的过程中;田韦韦等[19]对文心兰浅绿条纹突变体进行研究,结果表明其叶绿素合成受阻于PBG至尿卟啉原Ⅲ的转化步骤中;吕明等[20]在研究荠菜型油菜L638-y黄化叶片叶绿素缺乏原因时发现其叶绿素合成受阻于尿卟啉原Ⅲ至原卟啉原Ⅸ的过程中;ZHANG et al [21]在对水稻叶色突变体chl1和chl9研究中发现该突变体叶绿素合成受阻位点发生在原卟啉原Ⅸ到镁原卟啉的部位;杨海芸[2]在对花叶矢竹的花色叶片差异研究中发现,白色叶片产生的原因是原卟啉原Ⅸ至叶绿素a的合成过程受阻;LI et al[22]对凤梨白色和绿色叶片差异进行了研究,发现其白色叶片在PBG至尿卟啉原Ⅲ的合成过程中受阻,导致了叶色变化。以上研究均表明,在整个叶绿素生物合成的过程中只要有一个位点的转化合成受阻,都将导致受阻位点之前的产物含量上升,而受阻位点之后的所有产物含量都会下降,从而直接导致叶绿素无法正常合成,表现为叶色变浅或变白。在本研究中,银丝竹叶片呈现出4种类型的叶色,4类叶片光合色素含量呈显著差异,其中全白叶片中叶绿素a、叶绿素b及类胡萝卜素含量均显著少于全绿色叶片。进一步对不同叶色银丝竹叶绿素合成前体的含量进行测定,结果表明,在叶绿素合成过程中,全白叶片中原卟啉原Ⅸ、镁原卟啉和叶绿素原酯的含量极显著低于对照,说明导致银丝竹叶片失绿的原因是叶绿素合成受阻,受阻点可能位于粪卟啉原Ⅲ至原卟啉原Ⅸ的过程中。此转变过程需要粪卟啉原Ⅲ氧化酶参与作用,并受HEMF基因的调控[14],该过程是否还受到其他代谢酶类的调控及其具体调控机制仍需要进一步研究。
银丝竹的叶色差异不仅仅体现在叶绿素合成途径的受阻,还表现在叶绿体结构的形成中。对银丝竹叶片石蜡切片的观察,可知,全绿叶片、全白叶片及花叶叶片从结构上并无明显差异,但全白叶片中细胞内容物明显少于前两种叶片;进一步观察全绿叶片和全白叶片在细胞内容物上的超微结构,发现全白叶片中无叶绿体或仅有发育不良的叶绿体结,未见清晰的基粒类囊体结构,可见基质中零散分布嗜锇颗,叶绿体膜结构模糊破碎或消失。可见,呈现白色的叶片结构无法承当正常的光合作用。王啸晨等[1]在对白纹阴阳竹和白纹椎谷笹的显微结构研究中有着类似的结论。许多研究表明,当植株胁迫导致叶绿素合成通路受阻时,类囊体结构无法形成,导致其叶绿体结构发育不良[23]; ZHOU et al[24]在对刺槐幼苗进行铅胁迫研究时发现,高浓度的铅(1 400 mg·kg-1)会降低植株的叶绿素含量,并且使植株叶片中的叶绿体膜结构破裂,类囊体排列无序或消失。而嗜锇颗粒的分布,说明这一部分细胞可能参与类囊体膜的合成,为后期叶片转绿奠定生理基础[25]。
4 结论银丝竹叶片呈现出白色性状的原因在于其叶片叶绿素生物合成过程受阻,受阻点位于粪卟啉原Ⅲ至原卟啉原Ⅸ的转化过程中,叶绿素合成的受阻也将进一步阻碍叶绿体类囊体的形成,使得叶绿体无法正常发育,这也是银丝竹花色叶出现的生理本质。
| [1] | 王啸晨, 岳祥华, 吴杰, 等. 2种观赏彩叶竹形态结构的观察与分析[J]. 中国农学通报, 2012, 28(16): 233–238. DOI:10.11924/j.issn.1000-6850.2012-0513 |
| [2] | 杨海芸. 花叶矢竹叶色变异机理研究[D]. 北京: 北京林业大学, 2015. |
| [3] | 徐丽丽, 安苗苗, 姜可以, 等. 花叶矢竹psaA基因克隆及功能分析[J]. 竹子研究汇刊, 2015, 34(1): 41–48. |
| [4] | 许冰清, 安苗苗, 姜可以, 等. 花叶矢竹叶绿体psbD基因的克隆与功能分析[J]. 浙江农林大学学报, 2015, 32(4): 557–565. DOI:10.11833/j.issn.2095-0756.2015.04.010 |
| [5] | 谭伟, 梁婷, 翟衡. 乙草胺对葡萄叶片光合和叶绿素荧光特性及叶绿体结构的影响[J]. 应用生态学报, 2012, 23(8): 2185–2190. |
| [6] | 皮本阳, 戴林建, 方杰. 烟草叶绿体结构及发育影响因素的研究进展[J]. 作物研究, 2013, 27(2): 203–206. |
| [7] | 宗学凤, 罗力, 吕典华, 等. 水稻叶片全生育期黄化突变体ylg3叶绿素合成特性研究[J]. 西南大学学报(自然科学版), 2013, 35(11): 21–26. |
| [8] | 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2002. |
| [9] | 张帆, 万雪琴, 翟晶. 镉处理下增施氮对杨树叶绿素合成和叶绿体超微结构的影响[J]. 核农学报, 2014, 28(3): 485–491. DOI:10.11869/j.issn.100-8551.2014.03.0485 |
| [10] | BOGORAD L. Porphydn synthesis[C]//COLOWICK S P, KAPHA N O. Methods in enzymology. New York:Academic Process, 1962:885-891 |
| [11] | 李正理. 植物制片技术[M]. 北京: 北京科学出版社, 1987: 138-148. |
| [12] | 王艳芳, 叶淄, 刘昊, 等. 不同发育时期苹果果实组织石蜡切片制作探究[J]. 果树学报, 2014, 31(5): 973–976. |
| [13] | 陈海魁. 几种植物组织石蜡制片技术的探讨[J]. 安徽农业科学, 2014, 42(28): 9677–9681. DOI:10.3969/j.issn.0517-6611.2014.28.007 |
| [14] | 王平荣, 张帆涛, 高家旭, 等. 高等植物叶绿素生物合成的研究进展[J]. 西北植物学报, 2009, 29(3): 629–636. |
| [15] | 董立花, 杨勇, 韩巧红, 等. 宽叶吊兰叶绿素生物合成的昼夜节律变化[J]. 植物科学学报, 2015, 33(4): 528–535. DOI:10.11913/PSJ.2095-0837.2015.40528 |
| [16] | 潘瑞炽. 植物生理学[M]. 北京: 高等教育出版社, 2012: 77-79. |
| [17] | 孙捷音, 张年辉, 杜林方. 油菜叶绿素b减少突变体Cr3529叶绿素生物合成的研究[J]. 西北植物学报, 2007, 27(10): 1962–1966. DOI:10.3321/j.issn:1000-4025.2007.10.006 |
| [18] | 王颖, 郭世荣, 束胜, 等. 外源亚精胺对盐胁迫下菠菜叶绿素合成前体含量的影响[J]. 西北植物学报, 2015, 35(10): 2026–2034. |
| [19] | 田韦韦, 王彩霞, 田敏, 等. 文心兰浅绿条纹突变体的生理生化及叶绿素荧光特性研究[J]. 西北植物学报, 2015, 35(10): 2012–2017. |
| [20] | 吕明, 刘海衡, 毛虎德, 等. 芥菜型油菜黄化突变体叶片叶绿素合成代谢变化[J]. 西北植物学报, 2010, 30(11): 2177–2183. |
| [21] | ZHANG H T, LI J J, YOO J H, et al. Rice Chlorina-1 and Chlorina-9 encode ChlD and ChlI subunits of Mg-chelatase, a key enzyme for chlorophyll synthesis and chloroplast development[J]. Plant molecular biology, 2006, 62(3): 325–337. DOI:10.1007/s11103-006-9024-z |
| [22] | LI X, SURAPATHRUDU K, HE Y H, et al. Physiological characterization and comparative transcriptome analysis of white and green leaves of Ananas comosus var. bracteatus[J]. PLOS One, 2017. DOI:10.1371/journal.pone.0169838 |
| [23] | BELYAEVA O B, LITVIN F F. Pathways of formation of pigment forms at the terminal photobiochemical stage of chlorophyll biosynthesis[J]. Biochemistry Moscow, 2009, 74(13): 1535–1544. DOI:10.1134/S0006297909130070 |
| [24] | ZHOU J, JIANG Z P, MA J, et al. The effects of lead stress on photosynthetic function and chloroplast ultrastructure of Robinia pseudoacacia seedlings[J]. Environment Science and Pollution Research International, 2017. DOI:10.1007/s11356-017-8713-2 |
| [25] | 时向东, 焦枫, 范豪杰, 等. 烤烟叶片发育过程中栅栏细胞超微结构的变化[J]. 烟草科技, 2010, 274(5): 46–47. |

 2017, Vol. 37
2017, Vol. 37


