文章信息
- 黄娟, 吴鹏飞, 李惠通, 马祥庆
- HUANG Juan, WU Pengfei, LI Huitong, MA Xiangqing
- 杉木不同器官愈伤组织和再生芽的诱导效率
- Efficiency of callus and regeneration bud induction from different explants of Cunninghamia lanceolata
- 森林与环境学报,2017, 37(2): 129-135.
- Journal of Forest and Environment,2017, 37(2): 129-135.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2017.02.001
-
文章历史
- 收稿日期: 2016-10-21
- 修回日期: 2017-01-22
2. 国家林业局杉木工程技术研究中心, 福建 福州 350002
2. State Forestry Administration Engineering Research Centre of Chinese Fir, Fuzhou, Fujian 350002, China
杉木[Cunninghamia lanceolata (Lamb.) Hook.]是我国重要的商品用材和南方主要造林树种。播种育苗、扦插育苗、嫁接育苗等常规育苗方式造成苗木参差不齐,现代生物组织培养技术能够有效地克服杉木传统育苗缺陷。目前,有关杉木组织培养快繁方面的研究虽已有大量报道,但多数是通过外植体进行不定芽直接器官发生方式进行组培快繁的研究[1-5]。近几年,随着人们对杉木良种壮苗的需求日益增加,分子生物学不断发展,利用基因工程手段将各种优良基因导入杉木,对于培育抗寒、抗病虫害、优质的杉木种质意义重大。有相关研究表明,通过间接器官发生途径可实现高效再生,可为植物遗传转化体系提供高效受体系统6-8。
有关杉木通过愈伤组织进行间接器官发生建立再生体系只有少数报道9-10。其中同时以杉木实生苗子叶、下胚轴、组培苗茎段、未成熟胚进行愈伤组织诱导及再生芽诱导效率的研究国内外鲜有报道。本课题组以子叶、下胚轴、未成熟胚、组培苗茎段4种材料为外植体,系统比较研究基本培养基、不同激素组合及浓度对愈伤组织和再生芽诱导效率的影响,旨在为杉木体细胞杂交和遗传转化研究筛选和建立高频再生能力的植物受体系统提供科学依据。
1 材料与方法 1.1 试验材料种子来源于福建省漳平五一国有林场 (北纬25°02′,东经117°29′) 的杉木1.5代种子园;未成熟胚取自福建农林大学校园内2015年7月份采集的未成熟杉木球果。种子使用前在4 ℃冰箱中保存;茎段取自实验室组织培养的020无性系组培苗。
1.2 试验方法 1.2.1 材料处理未成熟胚。首先将球果用流水冲洗1 h,超纯水冲洗2遍,其次在超净工作台上用镊子取出球果中的未成熟种子,再次用75%的酒精处理30 s,升汞处理10 min,用无菌蒸馏水漂洗4~5次,洗完后用灭菌干燥滤纸吸水,最后用镊子剖去种皮得未成熟胚,备用。
下胚轴、子叶。将在人工气候箱发芽10 d的种子苗先用超纯水冲洗5遍,再在超净工作台用75%的酒精处理1 min,0.1%升汞处理10 min,最后用无菌蒸馏水漂洗4~5次,洗完后用灭菌干燥滤纸吸水,切取5 mm长段,备用。
1.2.2 培养基与培养条件愈伤组织诱导培养基选用MS、1/2MS、DCR三种基本培养基。植物激素有2,4-D (2,4-二氯苯氧乙酸),NAA (萘乙酸),6-BA (6-苄基腺嘌呤),KT (激动素),TDZ (噻苯隆),具体浓度设计见表 1。琼脂0.7%,水解酪蛋白0.5%,蔗糖2.5%,pH值5.8。
| 水平 Level |
不同激素浓度/(mg·L-1) | ||||
| 2,4-D | NAA | TDZ | 6-BA | KT | |
| 1 | 1.0 | 2.0 | 0.01 | ||
| 2 | 1.0 | 1.0 | 0.01 | ||
| 3 | 2.0 | 0.01 | 2.0 | ||
| 4 | 1.0 | 0.01 | 1.0 | ||
| 5 | 1.0 | 1.0 | 1.0 | ||
| 6 | 2.0 | 1.0 | 1.0 | ||
再生芽诱导培养基选用MS基本培养基,6-BA 0.5~1.0 mg·L-1,KT 1.0~1.5 mg·L-1以及不加激素,共5个处理。琼脂0.7%,蔗糖2.5%,pH值5.8。
培养条件:愈伤组织诱导采用暗培养,愈伤不定芽诱导采用1 000 lx,光周期12 h·d-1,相对湿度60%~70%。
1.2.3 数据统计方法采用随机区组设计,每天观测外植体形态变化,30 d后统计愈伤组织诱导率和不定芽分化率、再生芽诱导率3项指标。研究不同基本培养基、不同激素浓度组合对外植体愈伤组织诱导情况和不定芽分化以及愈伤组织再分化情况的影响。3项指标的计算见公式 (1)~(3)。
| $ 愈伤组织诱导率/\% = 诱导出愈伤组织的外植体个数/接种外植体数 \times 100 $ | (1) |
| $ 不定芽分化率/\% = 长出不定芽的外植体个数/接种外植体数 \times 100 $ | (2) |
| $ 再生芽诱导率/\% = 长出不定芽的愈伤个数/接种愈伤数 \times 100 $ | (3) |
由表 2可知,在NAA+6-BA+TDZ激素组合处理下,子叶与下胚轴愈伤组织诱导率最高 (79.5%,90.4%);未成熟胚在2,4-D+BA+KT激素组合处理下愈伤组织诱导率最高 (81.3%);组培苗茎段在2,4-D+NAA+TDZ激素组合处理下愈伤组织诱导率最高 (76.7%)。其中子叶与下胚轴在最适激素组合处理下有体胚产生 (图 5a)。部分外植体在愈伤组织诱导过程中会直接分化出不定芽,其中以子叶、下胚轴在2,4-D+6-BA+KT激素组合处理下直接不定芽发生达最高 (15.3%,16.6%),其次未成熟胚在2,4-D+NAA+TDZ激素组合处理下直接不定芽分化最高 (13.3%)。
| 激素组合 Hormone combination |
外植体 Explant |
接种数 Inoculation number |
诱导出愈伤组织数 Induced callus |
愈伤组织诱导率 Callus induction rate/% |
不定芽诱导率 Rate of explants forming buds/% |
| 2,4-D+NAA+TDZ | 子叶 Cotyledon | 154 | 109 | 70.8 | 11.6 |
| 下胚轴 Hypocotyl | 176 | 139 | 79.0 | 8.5 | |
| 未成熟胚 Immature embryo | 300 | 198 | 66.0 | 13.3 | |
| 组培苗茎段 Stem of sterile seedlings | 150 | 115 | 76.7 | 7.3 | |
| 2,4-D+6-BA+KT | 子叶 Cotyledon | 150 | 77 | 51.3 | 15.3 |
| 下胚轴 Hypocotyl | 150 | 78 | 52.0 | 16.6 | |
| 未成熟胚 Immature embryo | 300 | 244 | 81.3 | 8.3 | |
| 组培苗茎段 Stem of sterile seedlings | 150 | 110 | 73.3 | 14.0 | |
| NAA+6-BA+TDZ | 子叶 Cotyledon | 122 | 97 | 79.5 | 8.1 |
| 下胚轴 Hypocotyl | 146 | 132 | 90.4 | 8.2 | |
| 未成熟胚 Immature embryo | 300 | 224 | 74.7 | 8.3 | |
| 组培苗茎段 Stem of sterile seedlings | 150 | 100 | 66.7 | 8.0 |

|
图 1 不同外植体愈伤组织的诱导与不定芽的发生 Fig. 1 Callus induction and adventitious buds from different explants |
|
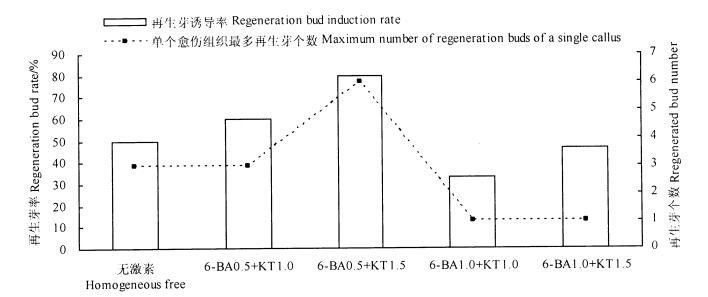
图 4 不同处理对愈伤组织再生芽诱导的影响 Fig. 4 The effect of different hormone concentrations on the regeneration bud induction from callus |

|
图 5 愈伤组织再分化 Fig. 5 Callus differentiation |
对于愈伤组织的诱导,不同的外植体在不同激素组合中愈伤组织化时间不同,愈伤组织形成部位不同。未成熟胚在最适培养基上,7 d左右肉眼可观察到胚表面或边缘裂开,整个外植体呈现膨胀状态,10 d左右可观察到一层米白色细小愈伤化组织;下胚轴在最适培养基上,10 d可见胚轴切口处出现膨胀,15 d胚轴中间先膨胀后两端出现米绿色细小颗粒状愈伤组织;子叶在最适培养基中,7 d可见叶片中间开始变黄卷曲并在切口处膨胀,15 d从内向外开始出现一层浅绿色的愈伤组织;由于组培苗茎段前期是把所有针叶除去,所以整个茎段都是切口,故在最适培养基上5 d就开始出现膨胀,10 d可见切口处出现细密的绿色愈伤化组织,15 d整个茎段愈伤化,愈伤组织由内向外扩增。外植体诱导的愈伤组织随着时间的增长,其体积不断扩大。其中未成熟胚诱导出的愈伤组织增长时间较长,50 d后才会变为茶色。除未成熟胚诱导的愈伤组织较为疏松 (图 1c),其余均为质地均匀且表面颗粒状的愈伤组织 (图 1a、b、d)。
2.1.2 激素浓度对不同外植体愈伤组织诱导的影响由图 2、图 3可知,不同激素浓度对不同外植体愈伤组织诱导具有明显差异。下胚轴、子叶愈伤组织诱导率在NAA 2.0 mg·L-1+6-BA 2.0 mg·L-1+TDZ 0.01 mg·L-1激素组合中均最高 (97.4%、95.2%),在2,4-D 1.0 mg·L-1+NAA 2.0 mg·L-1+TDZ 0.01 mg·L-1激素组合中的愈伤组织诱导率其次,分别为91%和80%;未成熟胚愈伤组织诱导率在2,4-D 2.0 mg·L-1+6-BA 1.0 mg·L-1+KT 1.0 mg·L-1激素组合中最高 (92.7%),在NAA 1.0 mg·L-1+6-BA 1.0 mg·L-1+TDZ 0.01 mg·L-1激素组合中愈伤组织诱导率其次,达84.7%;组培苗茎段在2,4-D 1.0 mg·L-1 +NAA 2.0 mg·L-1 +TDZ 0.01 mg·L-1激素组合中愈伤组织诱导率最高 (86.7%),在2,4-D 2.0 mg·L-1 +6-BA 1.0 mg·L-1 + KT 1.0 mg·L-1激素组合中愈伤组织诱导率其次 (76%)。部分外植体在愈伤组织诱导过程中直接分化出不定芽,其中子叶、下胚轴在2,4-D 1.0 mg·L-1+6-BA 1.0 mg·L-1+KT 1.0 mg·L-1激素组合中直接不定芽发生达最高 (17.6%和21.1%)(图 1e)。
同种激素组合浓度不同时,不同外植体愈伤组织诱导率显著不同。其中以子叶和组培苗茎段最为显著,子叶在最适激素组合NAA+6-BA+TDZ中,不同激素浓度其愈伤组织诱导率分别为95.2%、63.3%;组培苗茎段在最适激素组合2,4-D+NAA+TDZ中,不同激素浓度其愈伤组织诱导率分别为86.7%、66.7%。并且在愈伤组织诱导过程中,子叶和下胚轴形态变化最大。
2.1.3 基本培养基对不同外植体愈伤组织诱导的影响将不同外植体同时接种于添加NAA 2.0 mg·L-1、6-BA 2.0 mg·L-1、TDZ 0.01mg·L-1的MS、1/2MS、DCR三种基本培养基上,接种10 d后,不同外植体在3种基本培养基上均出现不同程度的膨胀。其中以子叶、下胚轴以及未成熟胚的膨胀幅度最大,接种16 d后,4种外植体在3种培养基上均出现愈伤组织化。30 d后进行各种指标统计,结果见表 3。1/2MS培养基上的子叶、下胚轴诱导的愈伤组织较疏松且均比MS培养基诱导量少,1/2MS培养基诱导的子叶、下胚轴愈伤组织均为米绿色,未成熟胚和组培苗茎段分别为米色和翠绿色;在DCR培养基上,4种外植体诱导的愈伤组织均比MS、1/2MS培养基的紧密 (图 1f) 且诱导量最少。但3种基本培养基只有DCR培养基诱导出的愈伤组织可以维持60 d不褐化。
| 外植体 Explant |
基本培养基 Basal media |
接种数量 Inoculation number |
愈伤组织 诱导个数 Induced callus |
愈伤组织诱导率 Callus induction rate/% |
愈伤组织质地 Callus texture |
愈伤组织颜色 Callus color |
| 子叶 Cotyledon |
MS | 50 | 44 | 88 | 均匀颗粒 Homogeneous | 绿色 Green |
| 1/2MS | 50 | 35 | 70 | 较疏松 Loose | 米绿色 Light green | |
| DCR | 50 | 27 | 54 | 较紧密 Compact | 米色 Beige | |
| 下胚轴 Hypocotyl |
MS | 50 | 47 | 94 | 均匀颗粒 Homogeneous | 绿色 Green |
| 1/2MS | 50 | 40 | 80 | 较疏松 Loose | 米绿色 Light green | |
| DCR | 50 | 29 | 58 | 较紧密 Compact | 米色 Beige | |
| 未成熟胚 Immature embryo |
MS | 50 | 34 | 68 | 均匀颗粒 Homogeneous | 米色 Beige |
| 1/2MS | 50 | 41 | 82 | 均匀颗粒 Homogeneous | 偏透明 Transparent | |
| DCR | 50 | 28 | 56 | 较紧密 Compact | 白色 White | |
| 组培苗茎段 Tube seedlings stem |
MS | 50 | 38 | 76 | 均匀颗粒 Homogeneous | 米绿色 Light green |
| 1/2MS | 50 | 29 | 58 | 均匀颗粒 Homogeneous | 米绿色 Light green | |
| DCR | 50 | 26 | 52 | 较紧密 Compact | 米绿色 Light green |
将诱导出的愈伤组织接种于不同激素浓度的MS培养基上,接种10 d后,愈伤组织出现不同程度绿色再生芽点。6-BA 0.5 mg·L-1+KT 1.5 mg·L-1培养基上的愈伤组织在接种15 d后最先长出小芽,6-BA 0.5 mg·L-1+KT 1.0 mg·L-1培养基上的愈伤组织在接种20 d后分化出小芽。接种30 d后,统计分析不同激素浓度下愈伤组织再生芽分化情况,研究结果如图 4。6-BA 0.5 mg·L-1+KT 1.5 mg·L-1培养基上的愈伤组织再生芽分化率最高 (80%),其次为6-BA 0.5 mg·L-1+KT 1.0 mg·L-1和无添加激素2种培养基,再生芽分化率分别为60%和50%。但在无激素的培养基中,一段时间后再生芽出现营养不良的黄化现象。
另外,愈伤组织诱导不定芽发生时,表现出明显的向光性和极性 (图 5b)。不定芽会向光源较强的方向弯曲,在靠近顶芽的一端先发生不定芽,且不定芽发生的数量较多。
2.2.2 不同质地的愈伤组织对再生芽诱导的影响将不同质地的愈伤组织接种于6-BA 0.5 mg·L-1+KT 1.5 mg·L-1的MS培养基上,接种7 d后,发现均匀偏疏松的愈伤组织开始出现绿色再生芽基;接种10 d后,均匀型愈伤组织才有绿色再生芽基形成;接种16 d后,较紧密的愈伤组织也出现绿色的再生芽基。接种30 d后,统计分析不同质地愈伤组织对再生芽诱导的影响,发现均匀偏疏松的愈伤组织再生芽诱导率最高 (65%),其次是均匀型愈伤组织 (55%),但质地均匀的单个愈伤组织最大可以分化6个再生芽 (图 5c)。
| 愈伤组织质地 Callus texture |
愈伤组织接种数 Inoculated callus |
诱导出再生芽的愈伤组织个数 Callus induced regeneration bud |
再生芽诱导率 Regeneration bud induction rate/% |
单个愈伤组织最大再生芽个数 Maximum number of regeneration buds of a single callus |
| 疏松 Loose | 40 | 26 | 65.00 | 3 |
| 均匀 Homogeneous | 40 | 22 | 55.00 | 6 |
| 致密 Compact | 40 | 13 | 32.50 | 2 |
不同培养基成分对不同外植体具有选择性调控。本试验研究发现,在含有2,4-D培养基中组培苗茎段愈伤组织诱导率更高,而未成熟胚在含有2,4-D+KT的培养基中愈伤组织诱导率更高,子叶、下胚轴在NAA与6-BA的培养基中愈伤组织诱导率最高。本研究还发现在含有TDZ与6-BA的培养基中,不同外植体均会出现不同程度的体胚发生。这与MATHUR et al 研究乔松 (Pinus wallichiana A.B. Jacks) 合子胚器官发生的结果一致。这可能是不同激素的作用机理不同或者不同器官其细胞内对激素有着不同识别位点从而产生不同的生物代谢反应。由于TDZ与KT均不是植物自身含有的细胞分裂素,因此在使用过程中应当低浓度配合使用,使植物产生更高的愈伤化效果以更好实现生物学的效应。本研究结果还发现,3种基本培养基对不同外植体愈伤诱导率有显著区别,其中MS>1/2MS>DCR培养基的愈伤组织诱导率,这是因为MS、1/2MS培养基中NO3-和NH4+含量均大于DCR培养基。有研究表明,在木本植物的体细胞胚胎和不定芽中NO3-和NH4+是主要因素。低浓度NH4NO3更有利于体胚和不定芽发生,高浓度NH4NO3有利于愈伤组织发生。研究发现DCR培养基诱导愈伤组织较为紧密且增长持续时间较长,这可能由于DCR培养基中肌酸含量多 (是MS的2倍),该肌酸能提供愈伤组织增长所需的营养。
3.2 外植体与愈伤组织诱导大量研究结果表明,不同外植体或不同基因型的同一外植体诱导愈伤组织发生能力有所不同,这些是制约木本植物愈伤高频诱导的内在因素[14]。在木本植物愈伤组织诱导研究过程中,研究者通常采用成熟与未成熟胚、叶片等外植体来诱导愈伤组织[15-18],但也有研究者用胚的子叶、下胚轴成功诱导出愈伤组织[19]。本研究采用未成熟胚、实生苗子叶、下胚轴以及组培苗茎段4种不同外植体作为试验材料,研究发现不同外植体其愈伤组织诱导率明显不同。首先可能与材料的营养繁殖能力以及细胞组织的成熟度存在关系;其次由于这4种材料来自不同母本,其基因型不同。这与唐巍等[20]、GŁOWACKA et al[21]研究的结果——不同基因型的同种外植体其愈伤诱导频率明显不同相似。
3.3 激素与愈伤组织再生芽KT是种非天然细胞分裂素。其主要生理作用是促进细胞分化、分裂、生长,尤其对诱导愈伤组织长芽表现很强的调控能力。据不完全统计,已有近100种木本植物在组织培养中常用KT进行愈伤组织再生芽分化[22-25]。本研究也发现,当KT浓度越高其愈伤组织再生芽诱导率越高,当KT浓度为6-BA浓度3倍时,愈伤组织再分化率最高。
3.4 愈伤组织质地与愈伤组织再生芽大量研究表明,不同外植体在不同的培养基诱导出的愈伤组织质地会出现显著区别,不同质地的愈伤组织再生芽能力也有所不同[26]。一般愈伤组织质地分3种类型:一是均匀偏疏松;二是表面有颗粒状细胞团的均匀型愈伤组织;三是致密型,颗粒状细胞团有管状细胞。本研究表明,偏疏松的愈伤组织再生芽诱导率更高,均匀质地的愈伤组织单个再生芽分化个数最多,说明愈伤组织再生芽分化能力差异与愈伤组织的多态性存在一定关系。
4 小结不同外植体离体后在适当条件下均能诱导出愈伤组织。由此可见,愈伤组织诱导的成败关键不是外植体的来源和种类,而是培养条件,其中激素的种类和浓度最为重要。其次外植体的类型 (材料的幼态或成年态) 和外植体原来在植株上所处的位置 (它反映了内源激素的水平) 对愈伤组织诱导存在影响。不同质地的愈伤组织在适当条件下均能诱导再生芽,质地均匀偏疏松的愈伤组织诱导芽数更多,胚性愈伤组织具有更高再分化能力。愈伤组织在无激素培养基中其再生芽诱导率也可以达50%,说明诱导出的愈伤组织含有一定的内源激素和营养物质,在短时间内满足其再分化所需条件。
| [1] | 欧阳磊, 郑仁华, 翁玉榛, 等. 杉木优良无性系组培快繁技术体系的建立[J]. 南京林业大学学报 (自然科学版), 2007, 31(3): 47–51. |
| [2] | 朱木兰, 王骥, 卫志明. 杉木再生系统的比较研究[J]. 分子细胞生物学报, 2007, 40(4): 239–244. |
| [3] | 阙国宁. 杉木组培嫩梢增殖与复壮的分析[J]. 林业科学研究, 1989(6): 546–551. |
| [4] | 阙国宁. 杉木组织培养的初步研究[J]. 林业科学, 1980, 16(S1): 137–140. |
| [5] | 吴擢溪, 李振问, 吴大忠. 杉木组织培养繁殖体系建立的研究[J]. 福建林学院学报, 1991, 11(1): 67–74. |
| [6] | TZFIRA T, CITOVSKY V. Agrobacterium-mediated genetic transformation of plants: biology and biotechnology[J]. Current Opinion in Biotechnology, 2006, 17(2): 147–154. |
| [7] | ROMMENS C M. All-native DNA transformation: a new approach to plant genetic engineering[J]. Trends in Plant Science, 2004, 9(9): 457–464. |
| [8] | 王关林. 植物基因工程[M]. 北京: 科学出版社, 2014. |
| [9] | 席梦利, 施季森. 杉木合子胚愈伤组织的诱导及植株再生[J]. 南京林业大学学报 (自然科学版), 2006, 30(2): 6–10. |
| [10] | 陈剑勇. 杉木茎尖诱导愈伤组织及植株再生研究[J]. 西南林业大学学报, 2009, 29(5): 37–41. |
| [11] | MATHUR G, NADGAUDA R. In vitro plantlet regeneration from mature zygotic embryos of Pinus wallichiana A.B. Jacks[J]. Plant Cell Reports, 1999, 19(1): 74–80. |
| [12] | 黄健秋, 卫志明. 松属树种的组织培养和原生质体培养[J]. 植物学报, 1994, 11(1): 34–42. |
| [13] | ROUNT G R, MOHAPATRA A, JAIN S M. Tissue culture of ornamental pot plant: a critical review on present scenario and future prospects[J]. Biotechnology Advances, 2006, 24(6): 531–560. |
| [14] | BONGA J M, KLIMASZEWSKA K K, ADERKAS P V. Recalcitrance in clonal propagation, in particular of conifers[J]. Plant Cell Tissue & Organ Culture, 2009, 100(3): 241–254. |
| [15] | 王祎, 赵彤彤, 杨魏, 马辉, 丁令智, 梁艳, 沈海龙. 红松成熟合子胚愈伤组织诱导的适宜培养条件[J]. 森林工程, 2015, 10(2): 5–7,13. |
| [16] | 耿菲菲, 肖丰坤, 吴涛, 等. 思茅松成熟胚的胚性愈伤组织诱导与增殖[J]. 东北林业大学学报, 2015, 43(5): 59–63. |
| [17] | 徐刚标, 何方, 陈良昌. 银杏愈伤组织诱导与继代培养的研究[J]. 中南林业科技大学学报, 1999, 10(3): 32–36. |
| [18] | 张建瑛, 张海峰, 田新华, 等. 长白落叶松组织培养中愈伤组织的诱导[J]. 黑龙江生态工程职业学院学报, 2012, 13(2): 15–16. |
| [19] | 张丽杰, 赵丽蒙, 陆秀君, 等. 水曲柳子叶和下胚轴愈伤组织和体胚的诱导[J]. 分子植物育种, 2015, 13(7): 1645–1652. |
| [20] | 唐巍, 郭仲琛. 火炬松 (Pinus teada L.) 合子胚愈伤组织的器官发生和植株再生[J]. 实验生物学报, 1998, 31(1): 87–93. |
| [21] | GŁOWACKA K, JEZOWSKI S, KAZMAREK Z. The effects of genotype, inflorescence developmental stage and induction medium on callus induction and plant regeneration in two Miscanthus species[J]. Plant Cell Tissue & Organ Culture, 2010, 102(1): 79–86. |
| [22] | 顾淑荣, 朱至清, 赵敬芳, 等. 白皮松雌配子体愈伤组织的诱导和分化[J]. 植物学报, 1994, 11(3): 217–221. |
| [23] | 杨模华, 李志辉, 张冬林, 等. 马尾松嫩茎愈伤组织保持、增殖与不定芽分化培养[J]. 中国农学通报, 2011, 27(10): 12–17. |
| [24] | 张文泉, 闫伟. 樟子松愈伤诱导及植株再生的初步研究[J]. 中南林业科技大学学报, 2012, 32(11): 37–41. |
| [25] | 庞晓峰, 王伟达, 李成浩, 等. 长白落叶松愈伤组织诱导与不定芽分化[J]. 东北林业大学学报, 2008, 36(2): 5–7. |
| [26] | 陈发菊, 赵德修, 杨映根, 等. 水母雪莲愈伤组织的多态性及其再分化条件的研究[J]. 华中师范大学学报 (自然科学版), 2000, 34(3): 331–335. |

 2017, Vol. 37
2017, Vol. 37



