文章信息
- 林小琴, 马志慧, 何宗明, 陈宇, 彭亦如, 林思祖
- LIN Xiaoqin, MA Zhihui, HE Zongming, CHEN Yu, PENG Yiru, LIN Sizu
- 杉木种子多酚提取工艺优化
- Optimization of ultrasonic-assisted extraction process for polyphenols from the seeds of Chinese fir
- 森林与环境学报,2017, 37(1): 47-53.
- Journal of Forest and Environment,2017, 37(1): 47-53.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2017.01.008
-
文章历史
- 收稿日期: 2016-04-25
- 修回日期: 2016-05-29
2. 国家林业局杉木工程技术研究中心, 福建 福州 350002;
3. 福建农林大学生命科学学院, 福建 福州 350002;
4. 福建师范大学化学与化工学院, 福建 福州 350117;
5. 福建师范大学福建省高分子材料重点实验室, 福建 福州 350007
2. State Forestry Administration Engineering Research Center of Chinese Fir, Fuzhou, Fujian 350002, China;
3. College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China;
4. College of Chemistry and Chemical Engineering, Fujian Normal University, Fuzhou, Fujian 350117, China;
5. Fujian Provincial Key Laboratory of Polymer Materials, Fujian Normal University, Fuzhou, Fujian 350007, China
“多酚”涵盖了所有单宁和单宁的衍生物[1],药学研究表明,酚类具多种促进健康的生物活性,如抗菌[2]、抗癌[3]、抗炎[4]、抗糖尿病[5]等;一些重要的生物学特性也都与酚类物质有关,如抗氧化性[6]、基因表达和同化酶的调控[7]以及代谢通路的调控[8]等;此外,酚类物质对植物生长具有抑制作用[9],还可能导致植物种子败育[10]。由于酚类物质具有多方面的功能,已成为国内外研究的热点。
杉木[Cunninghamia lanceolata (Lamb.) Hook.]是中国南方重要的速生用材树种之一,具有十分重要的经济价值,但它的种子往往受各种因素的影响导致败育。由于胚胎败育而丧失生活力的种子称为涩粒,涩粒率高是杉木种子发芽率低的根本原因之一[11]。据前人研究表明,与健全种子(以下简称健籽)相比,杉木涩粒中明显含有更多的酚类物质[12],但到底含有哪些酚类物质,至今未得到解答。目前关于植物的酚类提取工艺已多有研究,但关于杉木种子酚类物质提取方面的研究鲜见报道。鉴于此,采用超声波-微波辅助技术提取杉木涩粒和健籽的多酚,通过单因素试验和正交试验,探索杉木涩粒和健籽多酚提取的最佳工艺,为后期开展酚类物质介导的杉木涩粒形成机制提供有力的技术支持。
1 材料与方法 1.1 材料和试剂杉木种子购自福建省三明市尤溪国有林场,为2013年11月采集的成熟期混合种子(包含70个优良无性系),该林场杉木从2009年开始采种。人工掰开种子以鉴别涩粒和健籽,分装保存于4 ℃冰箱,备用。
无水乙醇、无水碳酸钠(上海国药集团化学试剂有限公司)、福林酚试剂(北京索莱宝科技有限公司)均为国产分析纯;没食子酸(阿拉丁)为分析标准品。
1.2 仪器和设备高通量组织研磨器(SCIENTZ-192;宁波新芝生物科技股份有限公司);超声-微波协同萃取仪(CW-2000,新拓微波溶样测试技术有限公司);Nano Quant酶标仪(Infinite© 200 Pro,Tecan Austria GmbH);数显恒温水浴锅(HH-4,常州国华电器有限公司)。
1.3 试验方法 1.3.1 多酚提取工艺流程分别称取0.5 g杉木涩粒和健籽,液氮速冻后用高通量组织研磨器充分研磨,加入一定浓度的乙醇溶液,在不同超声波条件下进行涩粒和健籽的多酚提取并过滤,将滤液转移至棕色瓶中,保存于-20 ℃冰箱。
1.3.2 没食子酸标准曲线的建立制备浓度为0.25 mg·mL-1的没食子酸标准液,以此为母液配制浓度为0、0.05、0.10、0.15、0.20、0.25 mg·mL-1的系列标准液。分别吸取各浓度没食子酸标准液0.2 mL于6个10 mL棕色离心管中,加入0.4 mL福林酚试剂,充分摇匀,5 min后加入2 mL 10% Na2CO3溶液,用超纯水定容至5 mL,充分摇匀,50 ℃水浴1 h后在765 nm波长处分别测得其吸光值,得没食子酸浓度和吸光值的标准曲线方程为A=2.749 3C+0.054 2,相关系数R2=0.999 8。
1.3.3 杉木涩粒及健籽多酚提取量的计算分别精确吸取0.2 mL稀释适当倍数的涩粒和健籽提取液于10 mL棕色离心管中,按1.3.2 步骤处理后在765 nm波长处测得其吸光值。样品中的多酚含量以没食子酸标准品计算,并按公式(1) 计算多酚提取量。
| $P = NCV/M$ | (1) |
式中:P为多酚提取量(mg·g-1);N为提取液稀释倍数;C为由没食子酸标准曲线测得的提取液多酚浓度(mg·mL-1);V为提取液的体积(mL);M为原料的质量(g)。
1.3.4 单因素试验以0.5 g杉木涩粒和健籽粉末作为提取对象,以多酚提取量作为考察指标,针对提取次数(1、2、3、4次)、提取时间(10、15、20、25、30、35 min)、乙醇浓度(0、20%、40%、60%、80%、100%)、提取温度(30、40、50、60、70、80 ℃)、液料比(20:1、30:1、40:1、50:1、60:1、70:1) 分别进行单因素试验,每次试验重复3次,超声波的固定功率为500 W。
1.3.5 正交试验通过单因素试验,可知各因素对杉木涩粒和健籽多酚提取量的影响状况,以此为依据,选择乙醇浓度、提取温度、液料比和提取时间为考察因素,进行正交试验,进一步对杉木涩粒和健籽的多酚提取工艺进行优化。
1.3.6 数据分析所有数据均用Microsoft Office Excel 2007 和PASW Statistic 18软件处理、分析。
2 结果与分析 2.1 单因素对杉木种子多酚提取效果的影响 2.1.1 提取次数对杉木种子多酚提取效果的影响从图 1可知,在相同条件下,杉木涩粒的多酚提取量高于健籽的多酚提取量,两者相差67倍左右。涩粒和健籽提取1次的多酚提取量均占总提取量的85%以上,随着提取次数的增加,多酚提取量虽有所增加,但增加的量很少,故后续试验提取1次即可。
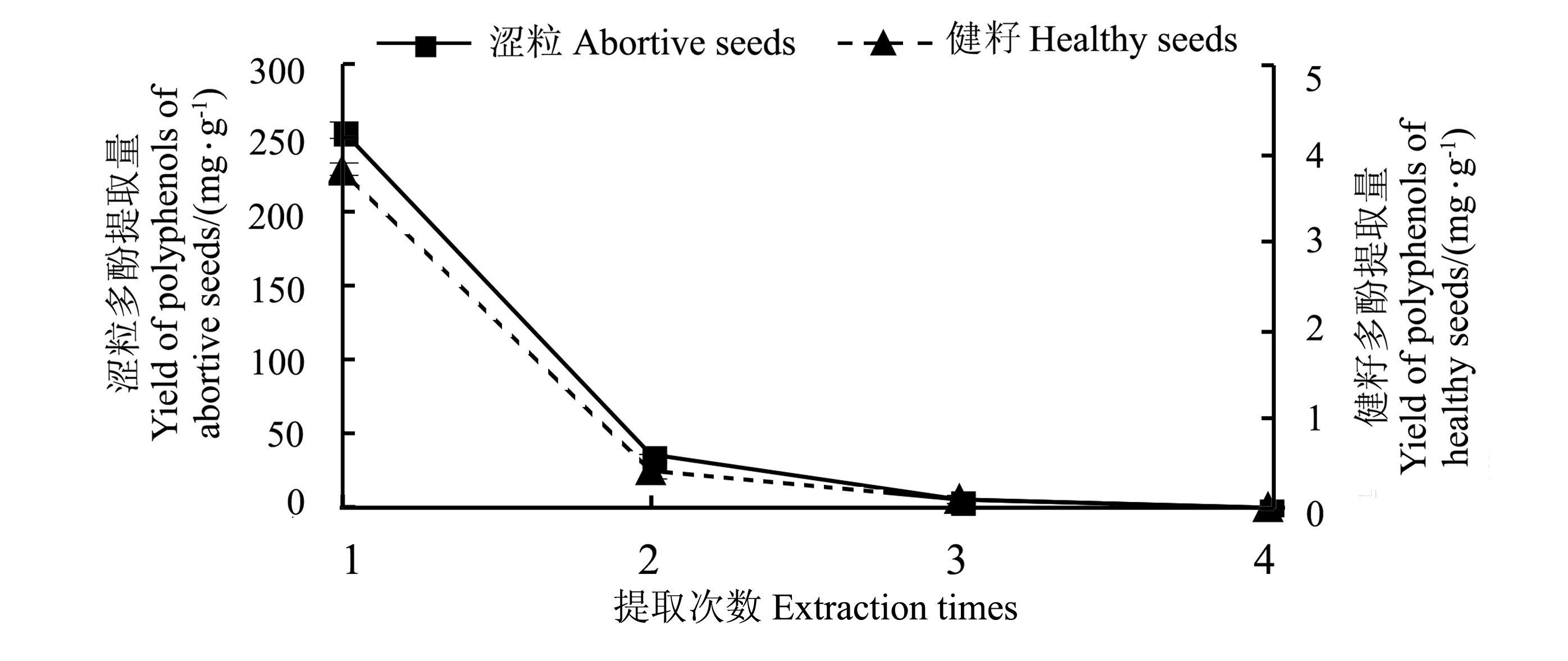
|
图 1 提取次数对多酚提取量的影响 Fig. 1 Effect of extraction times on the yield of polyphenols |
从图 2可知,在10~15 min内,涩粒的多酚提取量呈增长趋势,并在提取15 min处达到最高值,为296.76 mg·g-1,而后随着时间的延长呈递减趋势。其原因可能是涩粒中有效成分相对单一,超声作用使涩粒中的酚类物质在15 min之内快速溶解,但随着时间的延长,涩粒中的酚类物质易受光热等条件的影响而被氧化分解,导致多酚提取量下降。因此,涩粒多酚提取时间确定为15 min。健籽的多酚提取效率与涩粒的大体相反,提取时间为30 min时,多酚提取量达到最大值,可能是健籽主要成分比较复杂,需要更多的超声时间使有效物质基本渗出,但多酚充分溶解后,再延长处理时间就会使析出的多酚降解。综合考虑,健籽的提取时间确定为30 min。
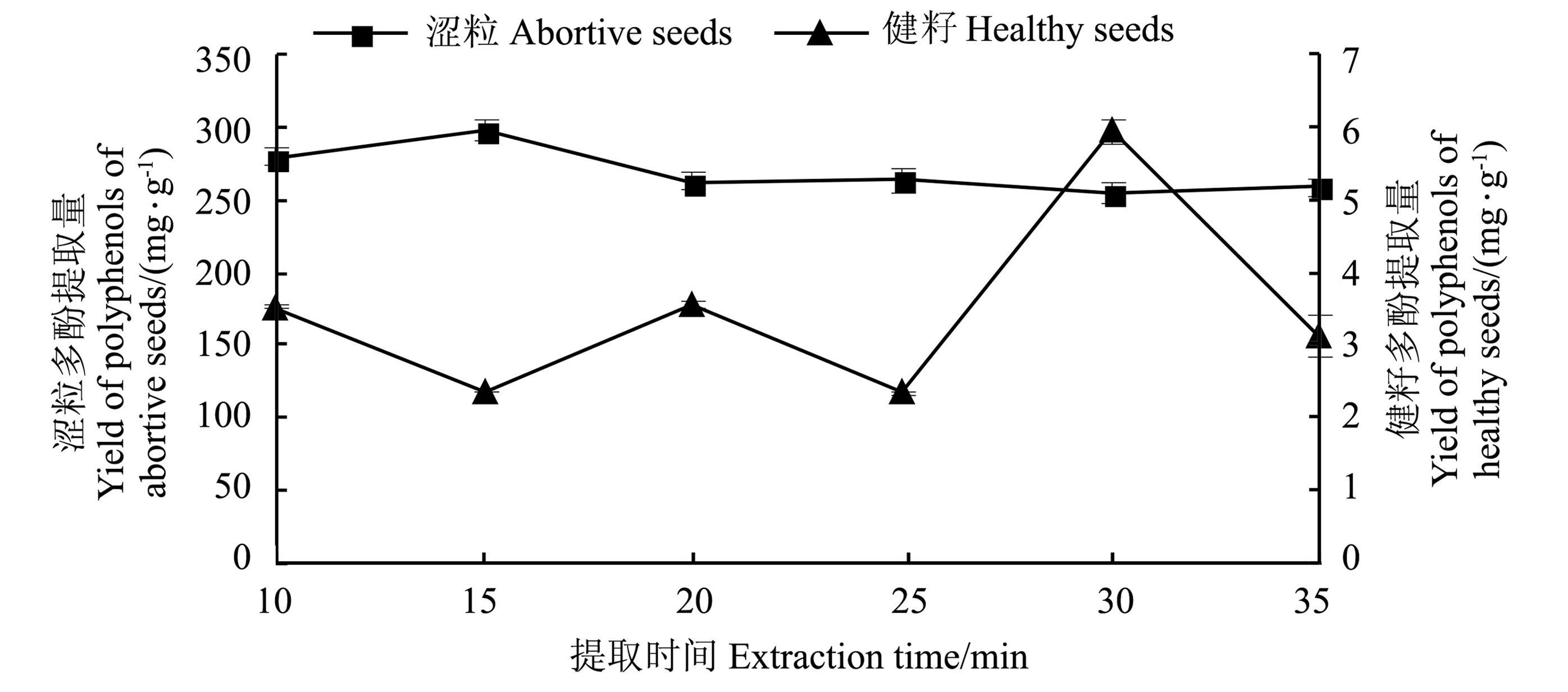
|
图 2 提取时间对多酚提取量的影响 Fig. 2 Effect of extraction duration on the yield of polyphenols |
从图 3可知,乙醇浓度低于60%时,涩粒多酚提取量随着乙醇浓度的增大而增加,在乙醇浓度为60%时,提取量达到最大值,当乙醇浓度高于60%时提取量下降,根据相似相溶原理,涩粒中的酚类物质与60%乙醇的极性相似,且中弱极性的酚类物质含量较多。此外,虽然乙醇是有机溶剂,能够破坏氢键和疏水键,有利于酚类物质的溶解,但乙醇浓度过高,醇溶性的其他杂质也会增多,与酚类物质形成竞争关系,从而导致多酚提取量下降。随着乙醇浓度的增高,健籽多酚提取量不断增加,当乙醇浓度为100%时,健籽多酚提取量达到最大值,初步推测健籽中的酚类物质多为醇溶性,故在后续的试验中用100%乙醇作为健籽多酚提取剂。
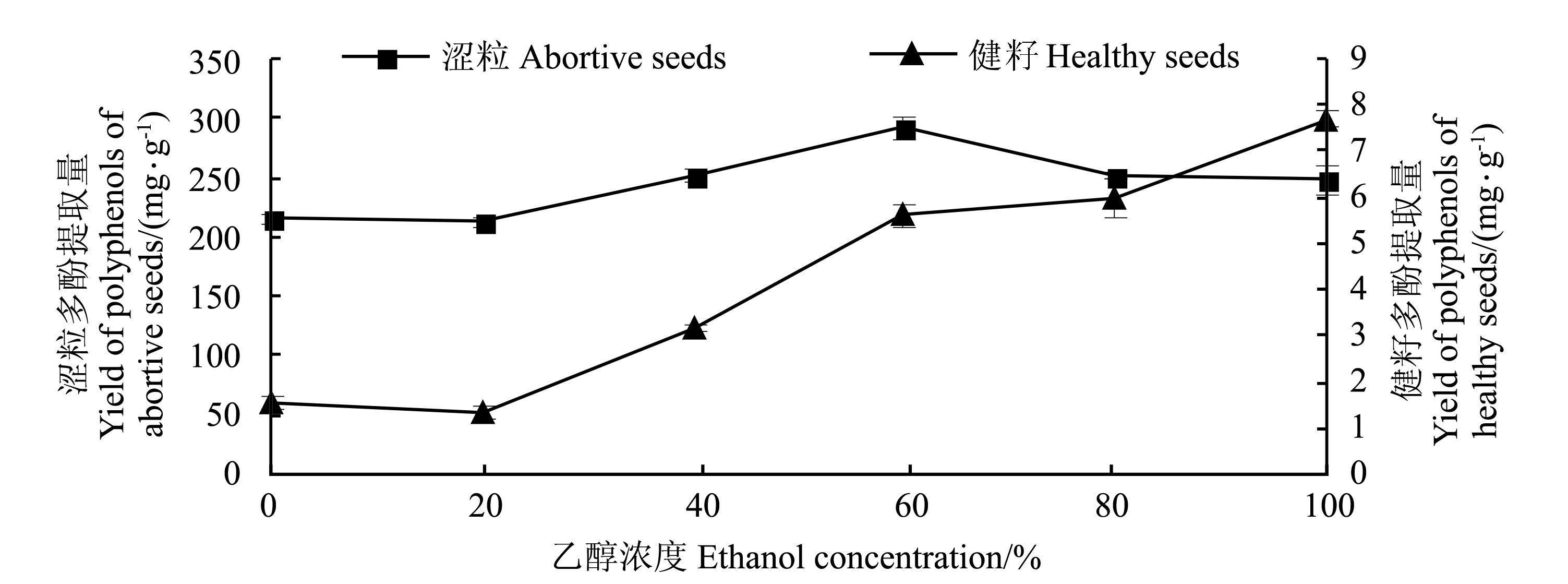
|
图 3 乙醇浓度对多酚提取量的影响 Fig. 3 Effect of ethanol concentration on the yield of polyphenols |
从图 4可知,涩粒的多酚提取量在40~50 ℃时急剧上升,而在50~60 ℃时又极速下降,之后趋于平稳,可见50 ℃为涩粒多酚提取的最佳温度。主要原因可能是一定范围内的升温能使分子运动速率和渗透扩散速率的加快,有利于酚类物质的溶解,但温度过高,会使酚类物质发生氧化或聚合反应,其分子结构和理化性质可能会受到破坏,所以多酚提取量反而会减少[13]。健籽的多酚提取量在30~40 ℃内有所上升,并在40 ℃时达到最大值,为10.21 mg·g-1,之后总体呈下降趋势。在后续的试验中,健籽多酚提取温度为40 ℃。
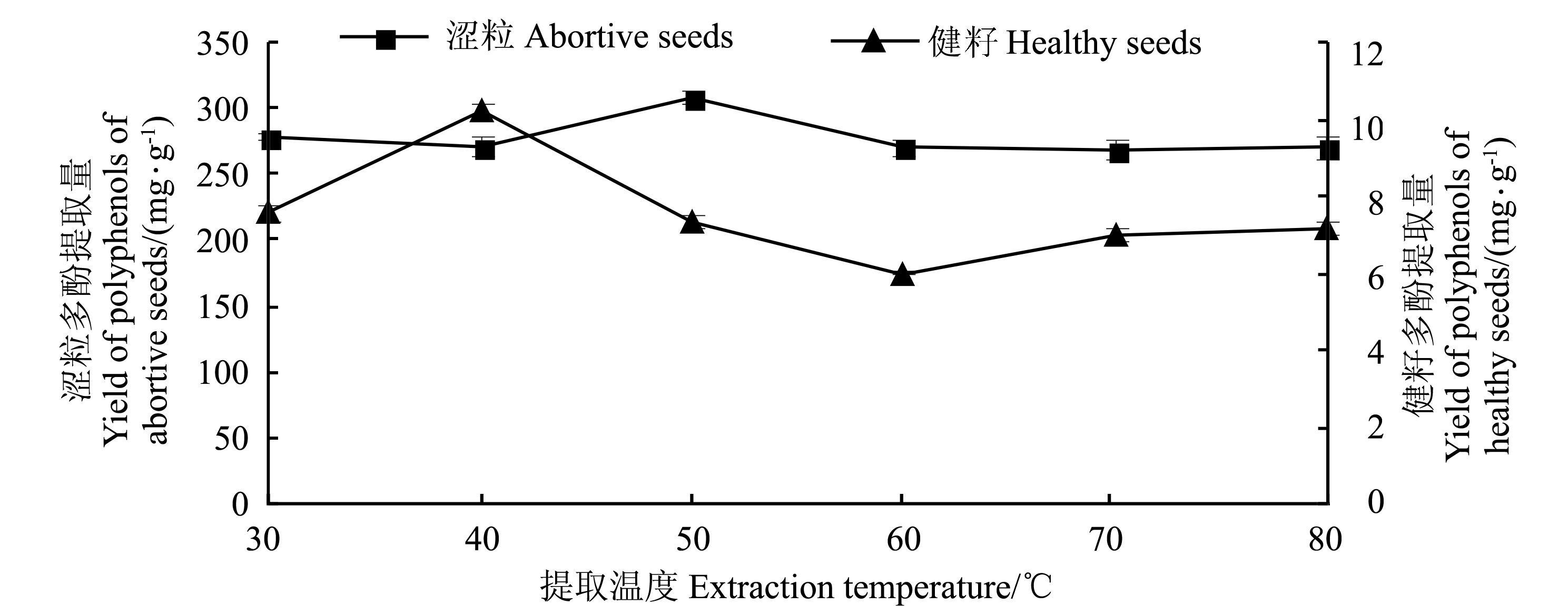
|
图 4 提取温度对多酚提取量的影响 Fig. 4 Effect of treatment temperature on the yield of polyphenols |
随着液料比的增大,涩粒多酚提取量也不断增大,在液料比为50:1 (mL:g)后,多酚提取量趋于平稳(图 5)。说明提取剂体积一定程度的增大有利于多酚的溶解,一方面可能是因为增加溶剂的体积可以增大溶剂与物料的接触面积,从而使酚类物质溶解得更充分[14],另一方面,溶剂体积适当的增加,使物料体系与溶剂体系的质量浓度梯度增大,加快了物质流动速率。综合考虑,在后续试验中统一选择液料比为50:1 (mL:g)。健籽的多酚提取量随着液料比的增加而减少,可能是健籽中酚类物质本身就少,一定体积的无水乙醇能充分使其溶解,而健籽中成分比较复杂,不断增加乙醇的体积会使其他醇溶性的杂质增多,总而影响了酚类物质的测定。因此,健籽多酚提取的液料比20:1最为理想。

|
图 5 液料比对多酚提取量的影响 Fig. 5 Effect of solvent-to-sample ratio on the yield of polyphenols |
考虑到乙醇浓度、提取温度、液料比和提取时间的交互作用可能会对杉木种子多酚提取效果产生不同的影响,进一步选择乙醇浓度、提取温度、液料比和提取时间作为考察因素,进行正交试验。涩粒和健籽的正交试验因素及水平见表 1和表 2 ,结果见表 3和表 4。
| 水平Level | A乙醇浓度Ethanol concentration/% | B提取温度Extraction temperature/℃ | C液料比Solvent-to-sample ratio/(mL:g) | D提取时间Extraction duration/min |
| 1 | 50 | 40 | 40:1 | 10 |
| 2 | 60 | 50 | 50:1 | 15 |
| 3 | 70 | 60 | 60:1 | 20 |
| 水平Level | A乙醇浓度Ethanol concentration/% | B提取温度Extraction temperature/℃ | C液料比Solvent-to-sample ratio/(mL:g) | D提取时间Extraction duration/min |
| 1 | 80 | 30 | 20:1 | 25 |
| 2 | 90 | 40 | 25:1 | 30 |
| 3 | 100 | 50 | 30:1 | 35 |
| 试验编号Test number | A | B | C | D | 多酚提取量The yield of polyphenols/(mg·g-1) |
| 1 | 1 | 1 | 1 | 1 | 312.43 |
| 2 | 1 | 2 | 2 | 2 | 324.45 |
| 3 | 1 | 3 | 3 | 3 | 353.72 |
| 4 | 2 | 1 | 2 | 3 | 306.33 |
| 5 | 2 | 2 | 3 | 1 | 362.83 |
| 6 | 2 | 3 | 1 | 2 | 317.48 |
| 7 | 3 | 1 | 3 | 2 | 365.69 |
| 8 | 3 | 2 | 1 | 3 | 305.72 |
| 9 | 3 | 3 | 2 | 1 | 301.02 |
| K1 | 990.60 | 984.45 | 935.63 | 976.28 | |
| K2 | 986.64 | 993.00 | 931.80 | 1 007.62 | |
| K3 | 972.43 | 972.22 | 1 082.24 | 965.77 | |
| k1 | 330.20 | 328.15 | 311.88 | 325.43 | |
| k2 | 328.88 | 331.00 | 310.60 | 335.87 | |
| k3 | 324.14 | 324.07 | 360.75 | 321.92 | |
| R | 6.06 | 6.93 | 50.15 | 13.95 |
| 试验编号Test number | A | B | C | D | 多酚提取量The yield of polyphenols/(mg·g-1) |
| 1 | 1 | 1 | 1 | 1 | 5.56 |
| 2 | 1 | 2 | 2 | 2 | 5.20 |
| 3 | 1 | 3 | 3 | 3 | 6.50 |
| 4 | 2 | 1 | 2 | 3 | 8.75 |
| 5 | 2 | 2 | 3 | 1 | 5.06 |
| 6 | 2 | 3 | 1 | 2 | 6.32 |
| 7 | 3 | 1 | 3 | 2 | 11.45 |
| 8 | 3 | 2 | 1 | 3 | 9.35 |
| 9 | 3 | 3 | 2 | 1 | 18.42 |
| K1 | 17.26 | 25.76 | 21.23 | 29.04 | |
| K2 | 20.13 | 19.61 | 32.37 | 22.98 | |
| K3 | 39.22 | 31.24 | 23.01 | 24.59 | |
| k1 | 5.75 | 8.59 | 7.08 | 9.68 | |
| k2 | 6.71 | 6.54 | 10.79 | 7.66 | |
| k3 | 13.07 | 10.41 | 7.67 | 8.20 | |
| R | 7.32 | 3.88 | 3.71 | 1.48 |
由极差分析可知,涩粒和健籽正交试验结果中R值最小的分别为A因素和D因素,故将其作为空白列进行方差分析(表 5和表 6)。从表 5可知,液料比对涩粒多酚提取效果具有显著的影响(Sig.=0.012<0.05) ,而提取温度和乙醇浓度对涩粒多酚提取效果影响不显著。由表 3可知,涩粒多酚提取量最高的为A3B1C3D2组合,涩粒多酚提取量达到365.69 mg·g-1。经极差分析比较可知,在选定的范围内,各因素对杉木涩粒多酚提取量影响的主次顺序为C>D>B>A,且最优组合为A1B2C3D2,由于试验设计中不包含该组合,为验证正交试验结果,用A1B2C3D2组合提取杉木涩粒多酚,重复3次。结果表明,该组合条件下,涩粒的平均多酚提取量为383.22 mg·g-1,说明通过极差分析选出的涩粒多酚提取条件优于A3B1C3D2组合,即涩粒多酚的最佳提取方案是以50%乙醇为提取剂,液料比为60:1(mL:g),在提取温度为50 ℃条件下处理15 min,提取1次。
| 变异来源 Sources of variation | 平方和 Sum of squares | 自由度 df | 均方 Mean square | F值 F value | Sig. |
| 提取温度 Extraction temperature/℃ | 72.720 | 2 | 36.360 | 1.195 | 0.456 |
| 液料比 Solvent-to-sample ratio(mL:g) | 4 904.595 | 2 | 2 452.297 | 80.586 | 0.012 |
| 提取时间 Extraction duration/min | 316.009 | 2 | 158.004 | 5.192 | 0.161 |
| 误差 Error | 60.862 | 2 | 30.431 | - | - |
| 总计Total | 5 354.186 | - | - | - | - |
| 变异来源 Sources of variation | 平方和 Sum of squares | 自由度 df | 均方 Mean square | F值Fvalue | Sig. |
| 乙醇浓度 Ethanol concentration/% | 94.990 | 2 | 47.495 | 14.437 | 0.065 |
| 提取温度 Extraction temperature/℃ | 22.568 | 2 | 11.284 | 3.430 | 0.226 |
| 液料比 Solvent-to-sample ratio(mL:g) | 23.875 | 2 | 11.938 | 3.629 | 0.216 |
| 误差 Error | 6.579 | 2 | 3.290 | - | - |
| 总计 Total | 148.012 | - | - | - | - |
从表 6可知,乙醇浓度、提取温度和液料比对健籽多酚的提取效果没有显著的影响。从表 4可以看出,健籽多酚提取量最高的为A3B3C2D1组合,健籽多酚提取量达到18.42 mg·g-1。经极差分析可知,各因素对健籽多酚提取量影响的主次顺序为A>B>C>D,且最佳组合为A3B3C2D1,为考察其稳定性,用该组合对健籽进行多酚提取,重复3次。结果表明该组合条件下,健籽的平均多酚含量为18.36 mg·g-1,相对标准偏差为0.65%,说明在最佳组合条件下,健籽多酚的提取量能保持稳定,证明该提取条件可靠。
3 结论与讨论杉木涩粒的研究始于20世纪60年代,研究的主要目的在于解释涩粒形成的原因,并提出相应的措施来改善涩粒率高的现象,取得了一定的成果[11, 15-16]。关于杉木涩粒多酚含量高于健籽的论述早有报道,黄烺增等[17]研究表明成熟期涩粒的多酚含量为36.75%,健籽的为5.79%;郑郁善等[16]研究则表明成熟期涩粒多酚含量为6.50%,健籽的仅为0.15%;高智慧等[12]研究认为5个不同产地之间涩粒和健籽的多酚含量并无显著差异,涩粒含量在21.21%~24.06%之间,健籽含量在2.07%~3.82%之间。上述报道中测定酚类含量的方法多为磷钼酸-钨酸钠比色法,但均未对其提取方法进行说明。各学者的研究结果差异较大,除考虑到杉木种子本身所具有的遗传特性所带来的差异外,还有可能是提取方法不统一所导致的,鉴于此,建立一套完善的适合杉木种子酚类物质的提取方法是十分必要的。在最优工艺条件下,涩粒的多酚提取量为(383.22±1.23) mg·g-1,健籽多酚提取量为(18.36±0.069) mg·g-1,优化效果显著,认为涩粒的多酚含量显著高于健籽,与前人研究结论基本一致[12, 16-17]。该方法的建立不仅可为评价不同家系和不同生长阶段杉木种子酚类物质含量差异研究提供理论基础,同时还可为后期开展酚类物质介导的杉木涩粒形成机制提供有力的技术支持。
样品研磨多采用研钵或粉碎机,用时较长,操作繁琐,试验样品粉碎用高通量组织研磨器研磨,采用的是封闭式一次性离心管,有效地避免了样品间的交叉污染,对同一组织样品设定相同的研磨程序,可获得相同的研磨效率,提高了样品间的重复性,且能在3 min之内粉碎48个单管样品,大大缩短了研磨时间,样品的研磨效果相较于传统研磨方式更为均匀、充分。
在后续研究中,应采集单株上不同月份的涩粒和健籽进行多酚含量测定与物质鉴定,分析涩粒形成过程中酚类物质含量的变化状况,了解各个发育阶段中涩粒和健籽的主要差异代谢物,在一定程度上解释涩粒形成的原因,并提出有效的防治措施,从而提高杉木种子的质量与产量。
| [1] | HASLAM E. Plant polyphenols:vegetable tannins revisited[M]. Cambridge: CUP Archive, 1989 . |
| [2] | PAYRA D, NAITO M, FUJⅡ Y, et al. Hydrophobized plant polyphenols:self-assembly and promising antibacterial,adhesive,and anticorrosion coatings[J]. Chemical Communications, 2016, 52(2): 312–315. |
| [3] | ZHANG L, SHAMALADEVI N, JAYAPRAKASHA G K, et al. Polyphenol-rich extract of Pimenta dioica berries (Allspice) kills breast cancer cells by autophagy and delays growth of triple negative breast cancer in athymic mice[J]. Oncotarget, 2015, 6(18): 16379–16395. |
| [4] | TSAI H C, LI Y C, YOUNG T H, et al. Citrus polyphenol for oral wound healing in oral ulcers and periodontal diseases[J]. Journal of the Formosan Medical Association, 2015, 115(2): 100–107. |
| [5] | SUN Q, WEDICK N M, TWOROGER S S, et al. Urinary excretion of select dietary polyphenol metabolites is associated with a lower risk of type 2 diabetes in proximate but not remote follow-up in a prospective investigation in 2 cohorts of US women[J]. The Journal of Nutrition, 2015, 145(6): 1280–1288. |
| [6] | FORINO M, TARTAGLIONE L, DELL'AVERSANO C, et al. NMR-based identification of the phenolic profile of fruits of Lycium barbarum (goji berries). Isolation and structural determination of a novel N-feruloyl tyramine dimer as the most abundant antioxidant polyphenol of goji berries[J]. Food Chemistry, 2016, 194: 1254–1259. |
| [7] | SEERAM N P, ADAMS L S, ZHANG Y, et al. Blackberry,black raspberry,blueberry,cranberry,red raspberry,and strawberry extracts inhibit growth and stimulate apoptosis of human cancer cells in vitro[J]. Journal of Agricultural and Food Chemistry, 2006, 54(25): 9329–9339. |
| [8] | XUE B, XIE J L, HUANG J C, et al. Plant polyphenols alter a pathway of energy metabolism by inhibiting fecal Bacteroidetes and Firmicutes in vitro[J]. Food & Function, 2016, 7(3): 1501–1507. |
| [9] | 姚瑞玲, 王胤, 项东云, 等. 邓恩桉插条生根抑制物质鉴定[J]. 福建林学院学报, 2010, 30(3): 275–278. |
| [10] | CHEN W, LV L X. Relationship between litchi embryo abortion and phenolic inhibitors[J]. Acta Botanica Sinica, 2002, 44(2): 168–172. |
| [11] | 余象煜, 李平, 何福基, 等. 杉木败育种子及其涩粒物质的研究[J]. 西北植物学报, 1989, 9(4): 252–256. |
| [12] | 高智慧, 朱治平. 杉木种子发育生理、涩籽成因及降低败育措施的研究[J]. 林业科学研究, 2000, 13(6): 659–666. |
| [13] | 陈金玉, 曾健, 李春美. 龙眼核多酚提取工艺的正交试验优化及其分离纯化与结构表征[J]. 食品科学, 2015, 36(16): 31–37. |
| [14] | 陈蓉, 吴启南. 响应面法优化芡实种皮多酚的提取工艺研究[J]. 食品工业科技, 2013, 34(13): 205–210. |
| [15] | 何福基. 杉木种子涩籽成因的初步研究[J]. 浙江林学院学报, 1985, 2(2): 79–80. |
| [16] | 郑郁善, 俞新妥, 罗水河, 等. 杉木种子园丰产的生理生化性状相关研究[J]. 福建林学院学报, 1993, 23(2): 105–112. |
| [17] | 黄烺增, 谢永强, 齐清琳, 等. 杉木种子涩籽胚败育过程及其生理生化指标[J]. 福建林学院学报, 1993, 23(4): 401–406. |

 2017, Vol. 37
2017, Vol. 37


