文章信息
- 冯丽贞, 杨婕, 叶小真, 陈慧洁, 李慧敏
- FENG Lizhen, YANG Jie, YE Xiaozhen, CHEN Huijie, LI Huimin
- EuPOD基因克隆与焦枯病菌胁迫表达分析
- Cloning of EuPOD gene from Eucalyptus grandis×E. tereticornis and its expression analysis infected by Calonectria pseudoreteaudii
- 森林与环境学报,2016, 36(4): 392-396.
- Journal of Forest and Environment,2016, 36(4): 392-396.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2016.04.002
-
文章历史
- 收稿日期: 2016-06-23
- 修回日期: 2016-09-08
2. 福建农林大学森林保护研究所, 福建 福州 350002
2. Institute of Forest Protection, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
外源的生物或非生物胁迫会引起植物体内活性氧的产生与清除平衡状态的改变,导致活性氧(reactive oxygen species, ROS)的大量积累。如不能及时清除,ROS将会破坏生物大分子而造成细胞氧化损伤,最终导致植物衰弱甚至死亡[1]。过氧化物酶(peroxidase,POD)广泛存在于在植物体内,是细胞抵御活性氧伤害的抗氧化酶系统的主要成分之一,主要参与植物的抗逆反应,与植物的抗病性具有正相关性,特别是用病原菌侵染后,抗病品种的过氧化物酶活性迅速上升,其活性和表达受到植物生长发育和环境应答中不同信号的调节[2-4]。我们的前期研究也表明,不同抗性的桉树品系POD活性的大小可作为桉树抗焦枯病能力的生理生化指标[5]。目前已从荔枝(Litchi chinensis Sonn.)、大蒜芥(Sisymbrium altissimum L.)、银杏(Ginkgo biloba L.)、香蕉(Musa nana Lour.)等植物相应组织中分离出POD基因[6-9]。
桉树(Eucalyptus spp.)为桃金娘科(Myrtaceae)桉树属(Eucalyptus)植物的总称,由于生长迅速、适应性强、产量高、木材用途广泛,其栽培生产受到广泛重视,已成为世界速生丰产造林树种之一[10]。在造纸业、生物能源方面有巨大的应用潜力[11]。桉树焦枯病(Calonectria leaf blight)是桉树苗圃及人工幼林的重要病害,严重威胁桉树的生产。尾细桉(E.grandis×E.tereticornis)是经过抗寒、抗病等测定的抗性品种,被广西国家桉树中心审定为桉树良种[10, 12]。前期已通过转录组测序(RNA sequencing,RNA-seq)和同位素标记相对和绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)技术研究了抗病品系尾细桉在焦枯病菌(Calonectria pseudoreteaudii)侵染下桉树差异表达谱和差异蛋白组,发现在焦枯病菌侵染下许多与ROS清除相关的基因表达发生改变,其中包括多个POD基因[13]。另外,MEYER et al[14]发现在与疫霉(Phytophthora cinnamomi)亲和互作时,桉树(E.nitens)POD基因的表达受到抑制。用Streptomyces sp.PM9处理巨桉(E.grandis)和蓝桉(E.globulus)时,可诱导其多酚氧化酶及POD酶活性提高,从而增加酚类化合物和黄酮类化合物的含量,最终对灰霉菌(Botrytis cinerea)产生抗性[15]。以对焦枯病菌高抗品系尾细桉为材料,对EuPOD基因进行克隆和同源性分析,并对受焦枯病菌胁迫下桉树POD基因在尾细桉体内的表达进行分析,以期为探索POD基因的生物学功能及利用基因工程培育优良林木品系奠定基础。
1 材料与方法 1.1 材料供试材料尾细桉(E.grandis×E.tereticornis);桉树焦枯病病原菌(Calonectria pseudoreteaudii)由福建农林大学森林保护研究所提供;质粒pDoner 207由福建农林大学功能基因组研究中心捐赠。
1.2 方法 1.2.1 孢子悬浮液的配制参照方中达[16]的方法将桉树焦枯病病原菌接种至马铃薯葡萄糖培养基(potato dextrose agar, PDA)培养基培养皿上,放置于28 ℃下避光培养7 d后,用灭过菌的dd H2O将分生孢子洗下,用显微镜计数法观察,配置成浓度为2.0×105个· mL-1的悬浮液,用于接种。
1.2.2 样品处理将苗龄3个月,苗高25 cm左右的扦插苗栽植于带土花盆,置于昼夜温度分别为25 、23 ℃,相对湿度90%,光照时间比14/10(光照14 h,黑暗10 h)的人工气候箱中,适应性培养7 d后,用75%酒精消毒,再用无菌水冲洗2-3遍,将制备好的分生孢子悬浮液用喷壶均匀喷洒于供试植株上,放入人工气候箱套上保鲜袋保湿培养。分别于接种后0 、12 、24 、48 、72 h进行叶片和枝条的采集,迅速放入2 mL的离心管中,置于液氮中速冻后放入-80 ℃冰箱备用。
1.2.3 总RNA提取与cDNA的获得参考杨婕等[17]的提取方法获得总RNA,利用琼脂糖凝胶电泳与超微量分光光度计(Denovix)检测RNA的浓度和完整性。以总RNA为模板,按照反转录试剂盒Prime ScriptTM RT reagent Kit with gDNA Eraser(TaKaRa)的操作说明合成cDNA,并置于-20 ℃备用。
1.2.4 EuPOD基因的扩增以cDNA为模板,用引物F3 、R3(表 1)做简并聚合酶链式反应(polymerase chain reaction, PCR)。引物用Primer Premier 5.0设计,由上海华大基因生物技术有限公司合成。反应程序: 94 ℃ 4 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 70 s,30 cycles;72 ℃ 7 min,4 ℃保存。琼脂糖凝胶电泳检测目的条带,目的片段回收纯化后并连接到pDoner 207用Gateway技术进行BP反应,转化DH5 α感受态细胞,菌液PCR鉴定阳性克隆后,送至上海华大基因生物技术有限公司测序。
| 引物名称 Primer | 序列 Sequence(5’-3’) | 片段长度 Length/bp |
| Actin | F1:TTCTACTATGTTCCCAGGTATCGC R1: GACCAGATTCATCATACTCACCCT | 194 |
| POD | F2:CCAGTCTCTGTGTCCGCAAAAC R2: TTAGCAAACTCCGTGTTGAAGTCC | 225 |
| EuPOD | F3:ACAAGTTTGTACAAAAAAGCAGGCTATGGAGGGTCGATTCTTTCCCA R3:ACCACTTTGTACAAGAAAGCTGGGTTCATGCATTAATGGCGGAGCA | 999 |
利用Primer 5预测EuPOD基因的氨基酸序列,并通过美国国立生物技术信息中心(National Center for Biotechnology Information, NCBI)数据库(http://blast.ncbi.nlm.nih.gov/Blast.cgi)对EuPOD基因进行相似性搜索,挑选出相似性较高的同源序列,用MEGA 5.0软件的Clustal W分析,以Neighbor-Jioning构建系统发育树。
1.2.6 实时荧光定量聚合酶链式反应分析根据TaKaRa公司的试剂盒SYBR Premix Ex TaqTM(Tli RNaseH Plus)的操作说明,在荧光定量PCR仪(Eppendorf)分析EuPOD基因在病原菌胁迫下的表达模式。以管家基因Actin作为参照基因校正和标准化目的基因。利用Primer 5软件设计特异性引物,引物序列见表 1。反应体系: 1 μL cDNA,0.3 μL Forward Primer, 0.3 μL Reverse Primer,5 μL SYBR Premix ExTaq,dd H2O补足10 μL。反应条件: 95 ℃ 2min;95 ℃ 30 s,60 ℃ 15 s,68 ℃ 20 s,40 cycles。每个样品重复3次,以0 h为参照,通过循环阈值(cycle threshold,Ct)来计算基因表达情况,以2-△△Ct方法分析相对表达量。
2 结果与分析 2.1 总RNA质量检测由图 1可知,提取的总RNA效果较好,28 S和18 S条带清晰,28 S的亮度约是18 S的2倍,无拖尾现象;紫外分光光度计检测OD260/OD280比值为2.11,OD260/OD230比值为2.48,说明所获得的RNA没有蛋白质的污染,具有较高的纯度和完整性,能满足后续试验的要求。

|
图 1 总RNA电泳图 Fig. 1 Electrophoretogram of total RNA 注:泳道1-3, 总RNA; 泳道4, MarkerⅢ。 Note : Lane1-3, Total RNA; Lane4, MarkerⅢ. |
根据桉树POD基因片段序列,设计特异性引物,获得长度约为1 000 bp的条带(图 2)。回收克隆,测序结果显示该片段长度为999 bp,推定蛋白含有332个氨基酸残基。BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)比对结果显示含有POD超基因家族的保守区,因此将该基因命名为EuPOD。
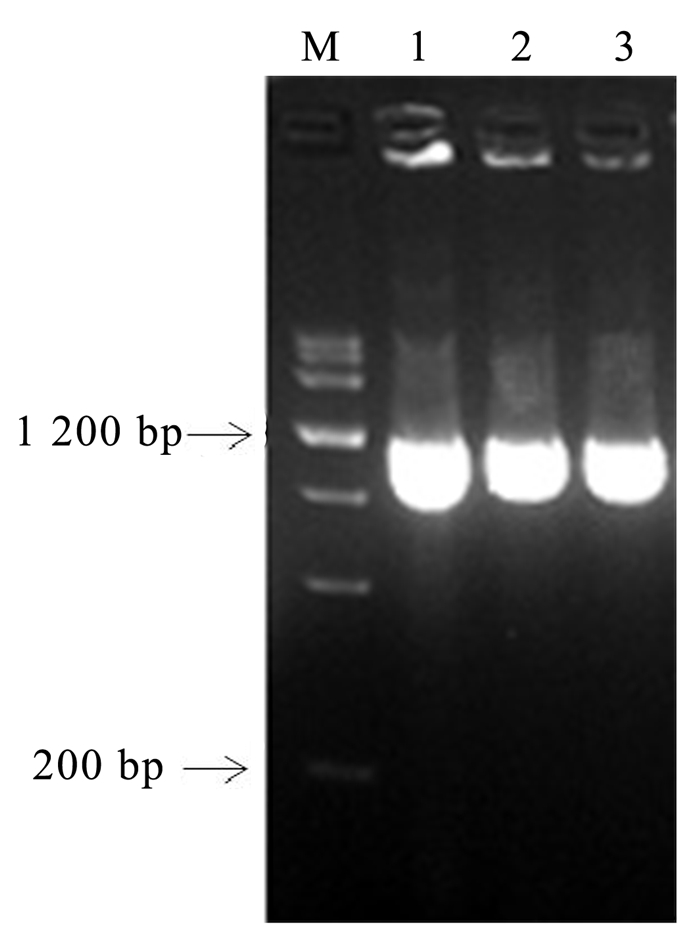
|
图 2 EuPOD基因序列的扩增结果 Fig. 2 The amplified result of EuPOD gene 注:泳道1, MarkerⅢ;泳道2-4, EuPOD。 Note : Lane1, MarkerⅢ; Lane2-4, EuPOD. |
利用BLAST进行氨基酸序列比对,结果表明: EuPOD编码的氨基酸序列与挑选出的苹果(Malus domestica Borkh)、可可(Theobroma cacao L.)、蓖麻(Ricinus communis L.)的同源性达到75%,与棉(Gossypium raimondii L.)、杨树(Populus trichocarpa Torr.& Gray)、木薯(Manihot esculenta Crantz)、草莓(Fragaria vesca L.)的同源性为73%,而与常用的模式植物,拟南芥[Arabidopsis thaliana (L.)Heynh.]同源性为67%,与番茄(Solanum lycopersicum Mill.)同源性为57%,与水稻(Oryza sativa Japonica Group)同源性更低,只有48%。
利用Clustal X1.83和MEGA 6软件分析,并采用Neighbor-Jioning算法构建进化树,结果显示(图 3),EuPOD与苹果聚为一类,说明与苹果亲缘关系较近,之后与可可、棉聚为一类,与草莓、杨树、蓖麻、木薯也聚为一类。EuPOD与拟南芥、番茄、水稻亲缘性较远。
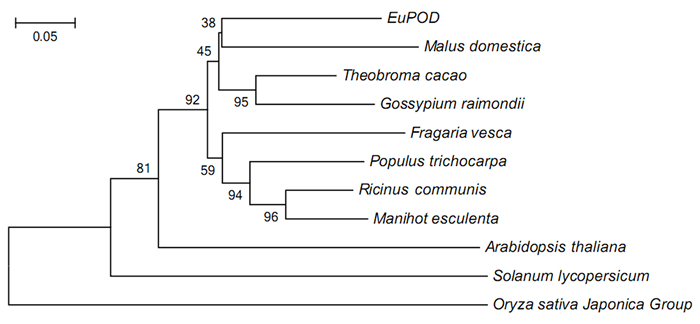
|
图 3 EuPOD系统进化树 Fig. 3 Phylogenetic tree of EuPOD 注:分支上的数值表示Bootstrap验证中基于1 000次重复该节点的可信度;标尺表示遗传距离。 Note: the numbers on the branches represent the rebiability perecent of bootstrap values based on 1 000 replication; the scale bar represents genetic distance. |
通过qRT-PCR成功扩增获得片段长度225 bp左右的目的片段(图 4),条带清晰且无非特异性杂带。以不同时间点的cDNA为模板进行荧光定量分析(图 5),EuPOD在病原菌侵染12 h的时候上调表达量最高,上调表达9.50倍,随后出现下降的趋势,说明EuPOD基因在抵抗病原菌侵染下发挥了重要作用。
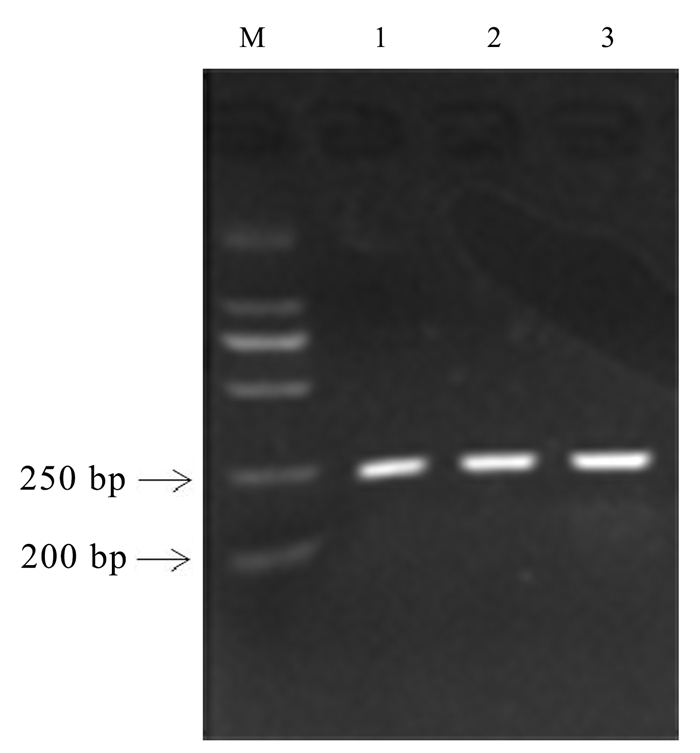
|
图 4 QRT-PCR结果 Fig. 4 Electrophoresis results of qRT-PCR 注:泳道1, Marker 2 000;泳道2-4, EuPOD。 Note : Lane1, Marker 2 000;Lane2-4, EuPOD. |

|
图 5 EuPOD在病菌浸染后不同时间的表达 Fig. 5 QRT-PCR analysis of the expression of EuPOD in different times under pathogens stress |
采用转基因技术培育抗病新品种,提高植物的抗病性,是防治植物病害的有效途径。研究表明,大量活性氧的产生会诱导过氧化物酶基因的表达量升高,过氧化物酶基因的转录与植物对病原菌的防御反应有关[3]。甘薯[Ipomoea batatas (L.)Lam.]过氧化物酶基因swpa1和swpn1转入烟草(Nicotiana tabacum L.)后,用能产生活性氧的有效物质甲基紫精(methyl viologen,MV)处理,烟草具有更高的POD活性,增加了抵抗活性氧胁迫和H2O2的清除能力[18]。本研究从若干个活性氧清除过程中表达发生变化的基因中挑选出一个POD基因(Eucgr.L02460.1),利用Gateway技术,从尾细桉中克隆了POD基因并命名为EuPOD,并对该基因进行序列分析,其全长999 bp,共编码332个氨基酸。通过选择与对EuPOD所编码的氨基酸序列同源性较高的种与模式植物,进行系统进化分析,发现与苹果、可可、棉亲缘关系最近;与模式植物拟南芥的亲缘关系较近,而拟南芥基因组中73个POD基因都具有相似的抗逆性[19],这为进一步验证桉树POD基因功能奠定基础。
QRT-PCR分析表明,当焦枯病菌侵染尾细桉叶片时,EuPOD基因在不同侵染时间的表达具有明显差异,在侵染12 h时受到高诱导表达,随着时间的推移,诱导表达量下降。该结果与薯蓣属(Dioscoreaspecies)植物对串珠链孢菌(Fusarium moniliforme Sheld.)、小麦对白粉菌及牧草对胶孢炭疽菌[Colletotrichum gloeosporioide (Penz.)Penz.and Sacc.]的抗性研究相一致[20-22]。前期对福建省主栽的11个桉树品系进行抗性研究,结果显示,无论健康叶还是病原菌接种后的病叶,POD活性均表现为抗病品系>中抗品系>中感品系>感病品系,因此将POD活性及其同工酶谱带作为对焦枯病抗性的早期鉴定生化指标[5]。总之,桉树受焦枯病菌侵染后,抗病品种通过过氧化物酶基因应激上调表达以提高自身的抗病性,研究结果将为探索该基因的生物学功能及利用基因工程培育桉树优良品系奠定坚实基础。
| [1] | SORKHEH K, SHIRAN B, ROUHI V, et al. Salt stress induction of some key antioxidant enzymes and metabolites in eight Iranian wild almond species[J]. Acta Physiologiae Plantarum, 2012, 34(1): 203–213. |
| [2] | WAGNER A M. A role for active oxygen species as second messengers in the induction of alternative oxidase gene expression in Petunia hybrida cells[J]. FEBS letters, 1995, 368(2): 339–342. |
| [3] | 蒋选利, 李振岐, 康振生. 过氧化物酶与植物抗病性研究进展[J]. 西北农林科技大学学报(自然科学版), 2001, 29(6): 124–129. |
| [4] | 王丽, 王曦烨, 彭方林, 等. RNAi抑制萝卜过氧化物酶基因的效果受光照影响[J]. 中国生物化学与分子生物学报, 2015, 31(4): 391–396. |
| [5] | 冯丽贞, 陈全助, 郭文硕, 等. 植物防御酶与桉树对焦枯病抗性的关系[J]. 中国生态农业学报, 2008, 16(5): 1188–1191. |
| [6] | 张永丽.荔枝果皮褐变过程中POD活性变化及其基因表达分析[D].海口:华南热带农业大学, 2007. http://cdmd.cnki.com.cn/article/cdmd-10565-2007146824.htm |
| [7] | 刘静静, 曲延英, 陈琴, 等. 大蒜芥SaPOD基因的克隆及序列分析[J]. 分子植物育种, 2015, 13(1): 150–155. |
| [8] | 程华, 李琳玲, 王燕, 等. 银杏过氧化物酶基因POD1的克隆及表达分析[J]. 华北农学报, 2010, 25(6): 44–51. |
| [9] | 王卓, 徐碧玉, 贾彩红, 等. 香蕉过氧化物酶基因表达和酶活性与香蕉抗枯萎病的关系[J]. 中国农学通报, 2013, 29(34): 115–121. |
| [10] | 陈全助. 桉树种系对焦枯病抗性的初步测定[J]. 福建林学院学报, 2010, 20(4): 297–299. |
| [11] | 黄国勤, 赵其国. 广西桉树种植的历史、现状、生态问题及应对策略[J]. 生态学报, 2014, 34(18): 5142–5152. |
| [12] | 刘奕清, 王大平. 尾细桉的组织培养和快速繁殖[J]. 西南农业大学学报(自然科学版), 2005, 27(2): 237–239. |
| [13] | CHEN Q Z, GUO W S, FENG L Z, et al. Transcriptome and proteome analysis of Eucalyptus infected with Calonectria pseudoreteaudii[J]. Journal of Proteomics, 2015, 115: 117–131. |
| [14] | MEYER F E, SHUEY L S, NAIDOO S, et al. Dual RNA-Sequencing of Eucalyptus nitens during Phytophthora cinnamomi Challenge Reveals Pathogen and Host Factors Influencing Compatibility[J]. Frontiers in Plant Science, 2016, 7: 191. |
| [15] | SALLA T D, ASTARITA L V, SANTARÉM E R. Defense responses in plants of Eucalyptus elicited by Streptomyces and challenged with Botrytis cinerea[J]. Planta, 2016, 243(4): 1055–1070. |
| [16] | 方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998 : 19 -39. |
| [17] | 杨婕, 郭文硕, 叶小真, 等. 巨桉叶片总RNA提取方法比较[J]. 基因组学与应用生物学, 2015, 34(6): 1272–1276. |
| [18] | YUN B W, HUH G H, LEE H S, et al. Differential resistance to methyl viologen in transgenic tobacco plants that express sweet potato peroxidases[J]. Journal of Plant physiology, 2000, 156(4): 504–509. |
| [19] | DUROUX L, WELINDER K G. The peroxidase gene family in plants: a phylogenetic overview[J]. Journal of Molecular Evolution, 2003, 57(4): 397–407. |
| [20] | CIOU J Y, LIN H H, CHIANG P Y, et al. The role of polyphenol oxidase and peroxidase in the browning of water caltrop pericarp during heat treatment[J]. Food Chemistry, 2011, 127(2): 523–527. |
| [21] | BAGA M, CHIBBAR R N, KARTHA K K. Molecular cloning and expression analysis of peroxidase genes from wheat[J]. Plant molecular biology, 1995, 29(4): 647–662. |
| [22] | HARRISON S J, CURTIS M D, MCINTYRE C L, et al. Differential expression of peroxidase isogenes during the early stages of infection of the tropical forage legume Stylosanthes humilis by Colletotrichum gloeosporioides[J]. Molecular plant-microbe interactions, 1995, 8(3): 398–406. |

 2016, Vol. 36
2016, Vol. 36

