文章信息
- 孙睿, 朱留刚, 封磊, 宋萍, 洪伟, 吴承祯
- SUN Rui, ZHU Liugang, FENG Lei, SONG Ping, HONG Wei, WU Chengzhen
- 雷公藤愈伤组织的生长特征及内酯醇的积累
- Growth traits and triptolide accumulation of Tripterygium wilfordii callus
- 森林与环境学报, 2016, 36(3): 306-311
- Journal of Forest and Environment, 2016, 36(3): 306-311.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2016.03.009
-
文章历史
- 收稿日期: 2016-01-10
- 修订日期: 2016-05-08
2. 福建农林大学资源与环境学院, 福建 福州 350002;
3. 福建省高校森林生态系统过程与经营重点实验室, 福建 福州 350002;
4. 武夷学院生态与资源工程学院, 福建 南平 354300
2. College of Resources and Environment, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China;
3. Fujian Provincial Key Laboratory of Forest Ecosystem Processing and Management, Fuzhou, Fujian 350002, China;
4. College of Ecology and Resource Engineering, Wuyi University, Nanping, Fujian 354300, China
雷公藤(Tripterygium wilfordii Hook. F.)系卫矛科(Celastraceae)雷公藤属的多年生木质藤本植物。雷公藤是中国传统的药用植物,也可用于农业杀虫,具有多种药理活性,能够祛风除湿、活血通络、消肿止痛,临床上已有多种应用。雷公藤植株含有多种生物活性物质,其中雷公藤内酯醇(triptolide)是最重要的药用成分之一。雷公藤内酯醇是一种二萜内酯化合物,具有抗免疫抑制、抗炎、抗肿瘤等多种药理活性,是目前国内外天然药物研究的热点之一[1]。然而,包括内酯醇在内的雷公藤药用成分含量极低,加之其生长缓慢,野生植物资源已经无法满足其在医药和农业上的需求。为解决雷公藤植物野生资源的短缺并保护其生长的原生态环境,通过现代生物工程技术生产雷公藤药用与农用活性物质是解决自然资源短缺、保护生态环境的重要途径之一。
在20世纪七八十年代,日本、加拿大等国就已开展了利用组织与细胞培养技术生产雷公藤次生代谢产物的研究,其从雷公藤转化的根中分离萜类化合物,利用雷公藤愈伤组织和悬浮细胞生产内酯醇和总生物碱等[2]。在中国,李琰等[3]研究了培养基及抗褐变剂对雷公藤愈伤组织生长和次生代谢产物影响。同时,李琰等还对雷公藤不定根进行了诱导,构建了不定根培养体系,分析了其中的雷公藤甲素含量[4],并研究了真菌诱导子和非生物诱导子对雷公藤不定根生长及次生代谢产物含量的影响[5]。但到目前为止,相关研究仍然十分有限,无法满足进一步工业化生产的需要。
本研究通过建立雷公藤愈伤组织,进一步研究愈伤组织的生长和生理生化特征,并对雷公藤内酯醇的积累情况进行分析,从而进一步为雷公藤细胞培养和活性成分工业化生产奠定理论和技术基础。
1 材料与方法 1.1 材料与仪器 1.1.1 植物材料应用雷公藤无菌组培苗作为外植体进行愈伤组织的诱导。雷公藤无菌组培苗来自福建省高校森林生态系统过程与经营重点实验室,种源地是福建泰宁。选取多次继代的、遗传性状稳定的雷公藤无菌组培苗,以幼茎、嫩叶、幼根为供试材料。其中,不同外植体对愈伤组织的诱导、生长及内酯醇含量影响的试验使用幼茎、嫩叶、幼根3种外植体,而其余试验所用外植体为嫩叶。
1.1.2 培养基试验所用培养基为MS、1/2 MS、B5、N6和White培养基,其中MS和1/2 MS为实验室自配,B5、N6、White购自青岛海博生物技术有限公司,各基础培养基中的激素组合均为2,4-D 1.0 mg·L-1 +NAA 0.1 mg·L-1 +KT 0.1 mg·L-1[6]。
1.1.3 主要仪器与试剂试验所用仪器主要有日本日立高效液相色谱仪L-2000系列、电子天平、PHS-2C 酸度计、高速冷冻离心机、超净工作台等。
雷公藤内酯醇标样购自福建省医学科学研究所。甲醇为色谱纯,水为超纯水,其他试剂均为分析纯。
1.2 愈伤组织的诱导取雷公藤无菌组培苗的幼茎、嫩叶及幼根,用无菌水冲洗干净,将叶切成大小为1 cm×1 cm,茎和根切成长度约1.5 cm小段,以每瓶3-4个外植体片段接种于培养基。不同外植体愈伤组织的鲜重和愈伤组织的内酯醇含量在经过连续继代培养3次以上进行测定。诱导率=愈伤组织形成的数目/接种的外植体数目×100%
1.3 愈伤组织细胞活力的测定应用氯化三苯四氮(TTC)还原法测定愈伤组织的细胞活力[7]。
1.4 愈伤组织生理生化指标的测定称取0.500 0 g愈伤组织,将1 mL预冷的0.1 mol·L-1磷酸缓冲液加入预冷的研钵中在冰浴上研磨成匀浆,加入缓冲液至终体积为5 mL,4 ℃下10 000 g离心20 min,上清液即为粗酶提取液。
采用核黄素—氯化硝基氮蓝四唑(NBT)光化还原法测定超氧化物歧化酶(SOD);过氧化物酶(POD)采用愈创木酚比色法测定;丙二醛(MDA)含量采用硫代巴比妥酸(TBA)加热显色法测定;根据苯丙氨酸解氨酶(PAL)与L-苯丙氨酸的反应产物肉桂酸在290 nm处的吸光值的变化来测定PAL的活性;采用考马斯亮蓝G-250染色法测定可溶性蛋白质(SP)含量;详细方法见参考文献[8]。各指标重复测定3次,取平均值。
1.5 雷公藤内酯醇的测定 1.5.1 样品制备取雷公藤愈伤组织样品烘干至恒重,粉碎、过筛。以甲醇作为浸提剂,将0.500 0 g愈伤组织粉末置入10 mL的离心管中,超声提取30 min,自然浸提约12 h,对样品4 000 r·min-1进行离心,取上清液,用10 mL容量瓶定容,然后用0.45 μm微孔滤膜过滤,滤液即为雷公藤内酯醇待测样品。
1.5.2 测定条件采用高效液相仪(HLPC)测定,色谱柱为XB-C18柱(5 μm,4.6 mm×250 mm);流动相为水;甲醇30;70;流速是1.0 mL·min-1;波长为218 nm;柱温为室温;10 μL进样量。
2 结果与分析 2.1 外植体种类对愈伤组织诱导的影响由图 1可见,雷公藤无菌组培苗嫩叶、幼茎的器官切口处形成了较明显的愈伤组织团块,且细胞团块较为紧实,具有较好的均一性,叶、茎愈伤组织的色泽明亮,多为黄绿色或奶白色。而由幼根诱导出的愈伤组织,切口愈伤组织团块较小,颜色表现为灰白色或深灰色,愈伤组织质地松散,均一性较差,有少量细根从愈伤组织上生出。
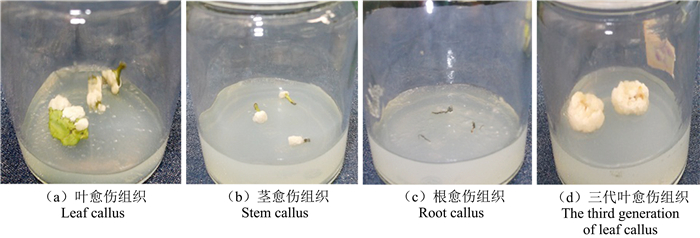
|
图 1 不同外植体愈伤组织的形态 Figure 1 Callus morphology of the different T. wilfordii explants |
在相同的诱导条件下,雷公藤根、茎、叶外植体愈伤组织的诱导率显示出一定的差异,其中叶外植体具有最高的诱导率,达到93.3%,茎外植体的诱导率略低于叶,为92.5%,根外植体则显示了最低的愈伤组织诱导率(68.3%)。3种外植体的出愈时间也不相同,叶和茎外植体的出愈时间约15 d,根外植体的出愈时间略早,在12 d左右。
雷公藤3种外植体诱导的愈伤组织在MS培养基上的生长趋势基本一致,大体可分为4个阶段(图 2):0-10 d为生长延迟期,10-40 d处于对数生长期,期间愈伤组织生长速度最快;40 -50 d处于生长稳定期,45 d时鲜重达到高峰; 50 d以后进入衰退期,开始出现褐化死亡的情况。但由生长曲线可见,3种愈伤组织的生长延迟期并不十分明显,整个生长期的生长速度变化并不大。从雷公藤愈伤组织的生长周期可知,为维持愈伤组织的继续生长,最好在40-45 d之间对愈伤组织进行继代培养。
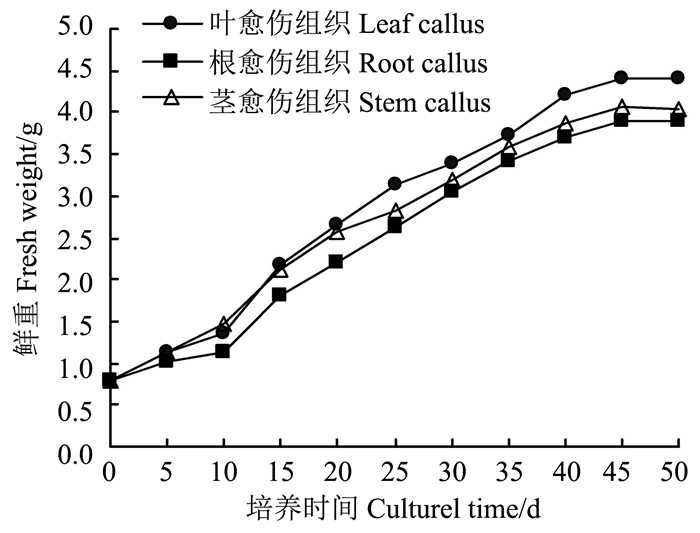
|
图 2 雷公藤愈伤组织生长曲线 Figure 2 Growth curve of T. wilfordii callus |
生物组织的细胞活力表示为活细胞占总细胞的百分比,该值的大小既可以反映生物组织的生长状况,也在一定程度上显示出组织的次生代谢情况。经检测,雷公藤根、茎、叶3种外植体的愈伤组织细胞活力值分别为1.5、2.7和4.9,最大的是叶愈伤组织,根愈伤组织的细胞活力最小。
2.2 不同培养基和不同pH值对愈伤组织诱导的影响不同的培养基具有不同的营养成分,因而其对愈伤组织的诱导和生长将会产生较大影响。本研究选择愈伤组织诱导效果最好的雷公藤无菌组培苗嫩叶为外植体材料,分析了MS、1/2 MS、B5、N6和White培养基对愈伤组织诱导的影响(图 3),结果显示,不同培养基上愈伤组织的诱导率呈现出较大差异,在MS培养基上愈伤组织的诱导率最高,为93.3%,其次是在White培养基上,1/2MS培养基上的愈伤组织具有最低的诱导率。愈伤组织在不同培养基上的生长状况也表现为在MS培养基上最好,其次是在White培养基和N6培养基上。
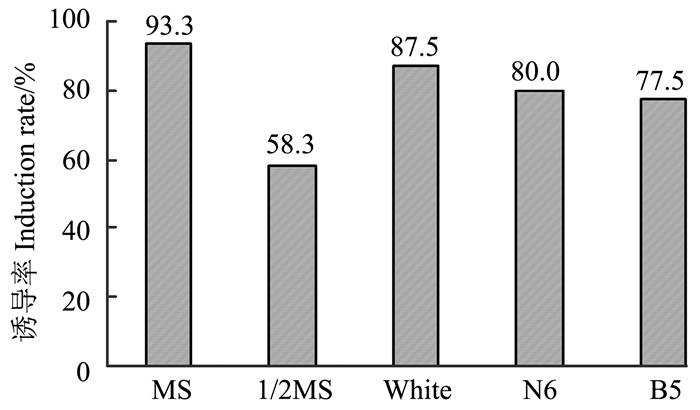
|
图 3 不同培养基对愈伤组织的诱导率的影响 Figure 3 Induction rate of callus on different media |
培养基的pH值会影响细胞对离子的吸收,从而影响细胞的生长。在不同pH值的MS培养基上,雷公藤愈伤组织的诱导率具有明显的差异(图 4)。当培养基pH值为5.8-6.1时,愈伤组织的诱导率高、生长速度快、生长状况好、颜色鲜艳。而当pH值超过该区间时,愈伤组织诱导率随pH值增加或减少均呈降低趋势。

|
图 4 pH值对愈伤组织诱导率的影响 Figure 4 Effects of different pH on the induction rate of callus |
以雷公藤叶外植体诱导愈伤组织并经多次继代培养后,选择质地疏松、颜色嫩绿的愈伤组织考察雷公藤愈伤组织培养过程中主要生理生化指标的动态变化。
由图 5可知,在培养至第4周时愈伤组织的SOD活性达到一个峰值,此阶段,愈伤组织生长旺盛,具有较强的抗干扰或胁迫的能力。随后SOD活性开始下降,培养至第6周时又往上升,第7周后升高至第4周时的水平,这一现象可能是由于培养后期生存环境的恶化、细胞的衰老和死亡,剌激了细胞SOD活性的提高以抵御不良环境。愈伤组织的POD活性与SOD活性的变化大体一致,随着培养时间的增加,POD活性先缓慢上升,第3-4周期间上升速度增加,在第4周时POD活性达到一个峰值,随后POD活性呈现先下降后再上升的变化,在培养至第8周时POD活性升高到较高的水平。
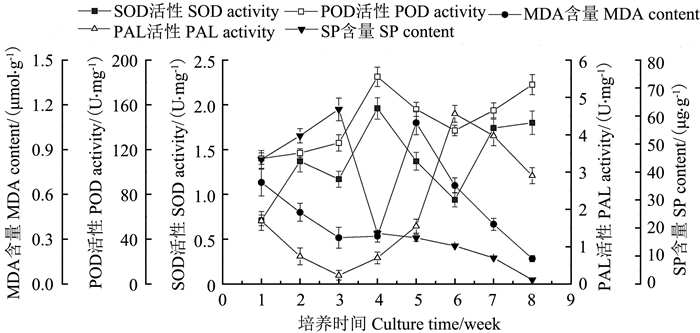
|
图 5 不同培养时间的愈伤组织SOD活性、POD活性、MDA含量、PAL活性及SP含量 Figure 5 Activity of SOD, POD and PAL and content of MDA and SP of the callus at different culture time |
从图 5可以看出,随着培养时间的增加,雷公藤愈伤组织的MDA含量在前面几周内一直下降,在第3、4周时处于低谷,至第5周时快速升高至一个峰值,随后又呈现明显的降低趋势。在第3、4周时愈伤组织正处于生长旺盛时期,细胞代谢活力高,自我调节能力强,细胞损伤程度低。而培养至第5周时,由于细胞的快速增殖带来的养分消耗和竞争、pH值等生长环境的改变,从而使细胞损伤开始增加。
雷公藤愈伤组织的PAL活性随着培养时间的增加呈现先降后升再降的变化(图 5)。在第3周时PAL活性降至一个低谷,可能是由于此时愈伤组织处于对数生长期、生存环境好、养分充足、细胞活力高,从而细胞的防卫反应等级低。随后,PAL活性呈现缓慢升高的趋势,可能是细胞在该阶段生长迅速,竞争剧烈,养分被大量消耗带来的反应。第5-6周期间愈伤组织的PAL则出现了快速上升的态势,以至于在第6周出现一个峰值,此时愈伤组织的生长正进入稳定期,似乎可以说明在此阶段细胞间竞争加大,生存环境由于自身的增殖产生恶化,从而使细胞提高防卫戒备等级,这也正是植物细胞本身反馈机制调节的结果。
随着愈伤组织的生长,其SP含量也发生了一定的变化。愈伤组织的SP含量在前3周呈较明显的上升趋势,到第3周时上升至一个峰值,随后则一直呈下降趋势。SP含量峰值的高低及出现的时间,可能与细胞生长速度等因素有关,也可能与蛋白质的合成、分泌、利用及细胞分裂有关[9]。
2.4 愈伤组织中雷公藤内酯醇的积累 2.4.1 内酯醇在不同器官或组织中的分布差异将雷公藤无菌组培苗叶、茎、根外植体诱导的愈伤组织的内酯醇含量,与无菌组培苗、野生苗不同器官的内酯醇含量进行比较,以考察雷公藤植株各器官及其愈伤组织中内酯醇分布的变异规律,结果如图 6所示。无论是野生苗还是无菌组培苗,植株根部的内酯醇含量明显高于茎和叶,但在由不同器官诱导的愈伤组织中,根愈伤组织中的内酯醇含量与叶的相近,均显著高于茎。3种不同来源的雷公藤器官或组织中,无菌组培苗根、茎、叶器官中的内酯醇含量显著高于野生苗各器官和各愈伤组织;而与野生苗相比,叶和根愈伤组织的内酯醇含量显著高于相应的野生叶和野生根,但茎愈伤组织的内酯醇含量略低于野生茎。
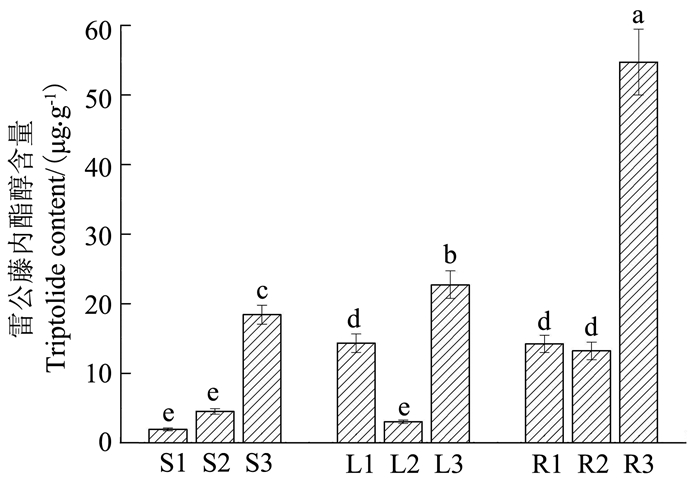
|
注:S1. 茎愈伤;S2. 野生茎;S3. 组培茎;L1. 叶愈伤;L2. 野生叶;L3. 组培叶;R1. 根愈伤;R2. 野生根;R3. 组培根。不同小写字母表示显著性差异,P < 0.05, n=3 。 Note: S1. stem callus; S2. wild stem; S3. tissue culture stem; L1. leaf callus; L2. wild leaf; L3. tissue culture leaf; R1. root callus; R2. wild root; R3, tissue culture root. Different lowercase letters denote significant difference, P < 0.05, n=3. 图 6 雷公藤内酯醇在不同器官或组织中的分布 Figure 6 Triptolide content in different organs or tissues |
以雷公藤内酯醇含量更高的叶愈伤组织为对象,研究愈伤组织中内酯醇含量的动态变化,结果如图 7所示,雷公藤愈伤组织中的内酯醇含量在培养的前5周呈较缓慢的上升趋势,从第5周开始上升速度增加,第7周时达到最大,随后下降。由此可见,培养时间对于愈伤组织雷公藤内酯醇的积累具有重要影响,在培养前期,愈伤组织生长快,细胞活力高,而次生代谢产物合成低,随着培养时间的增加,细胞间竞争增强,愈伤组织生长开始减缓,细胞活力降低,开始出现衰老现象,次生代谢产物积累增多,因此,与愈伤组织的生长速度在培养前期较大不同,内酯醇的积累在培养后期即愈伤组织生长缓慢时反而更高。
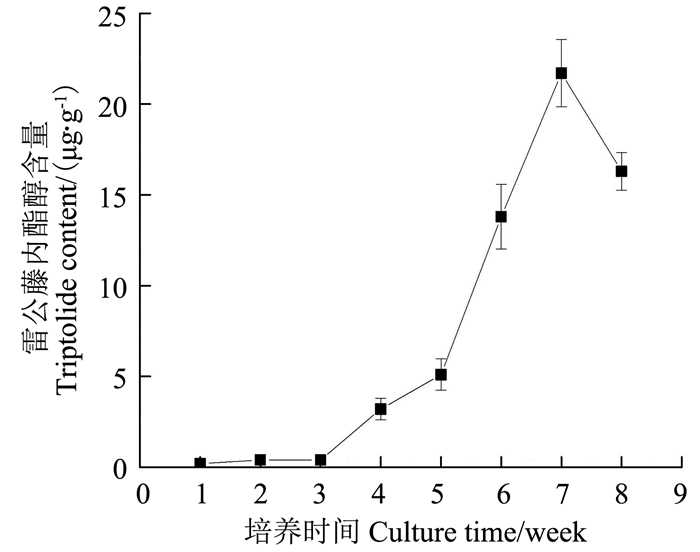
|
图 7 愈伤组织中的雷公藤内酯醇含量随培养时间的变化 Figure 7 Change of triptolide content in the callus with culture time |
同一植物不同器官组织生理状况不同其内源激素水平不同,因而不同生长部位的外植体材料对愈伤组织的形成有较大的影响[10]。王义等[10]的研究表明,膜荚黄芪无菌苗胚轴和主根是较好的愈伤组织诱导外植体来源。而苜蓿无菌苗不同外植体愈伤组织的诱导率从高到低为下胚轴、子叶、茎和叶片[11]。本研究利用雷公藤无菌组培苗的根、茎、叶作为外植物体材料诱导愈伤组织,其中叶外植体的愈伤组织诱导率最高,生长状况较好,细胞活力最高,是理想的外植体材料来源。培养基和pH值等因素决定着愈伤组织的生长环境,雷公藤叶外植体在pH值为5.8-6.1的MS培养基上诱导率最高,生长状况最好。李琰等[12]的研究亦显示,雷公藤愈伤组织在MS培养基上的增长量仅略低于6,7-V培养基而高于其它类型培养基,当pH值为5.8时,雷公藤愈伤组织的增长量达最大值。
植物在遭受各种逆境胁迫时,体内的活性氧含量增加,其在细胞内的积累能使得蛋白质氧化和生物膜受到伤害。SOD和POD等抗氧化酶协同作用能够防御和减缓活性氧及其他过氧化自由基过量累积对细胞系统的伤害,从而增强植物的抵抗能力。雷公藤愈伤组织在生长前期,SOD和POD活性均较低,而当愈伤组织进入生长中期(第4周)和末期(第8周)时,SOD和POD活性则均出现峰值,表明系统面临氧化胁迫,抗氧化酶活性在一定程度上受到促进,从而消除体内过多的活性氧,因此,此时MDA含量均处于低谷,表明抗氧化系统的启动减弱了细胞的过氧化伤害,同时,PAL活性受到抑制,细胞防卫等级降低。SOD和POD活性在第6周时均表现为受到抑制,可能是细胞生存环境由于自身的增殖产生恶化,降低了自我调节能力,导致SOD和POD活性降低,活性氧的产生与清除的平衡体系遭到破坏,此时,MDA含量较高,细胞膜脂过氧化较严重,PAL活性则受到促进,细胞防卫等级高,愈伤组织生长减缓。
研究显示,次生代谢产物含量高的植物或器官诱导出的愈伤组织的次生产物的含量通常亦会较高[13]。雷公藤内酯醇等次生代谢产物在雷公藤植株中的分布部位主要是根部,尤其是根皮中的含量,明显高于其他部位。然而,李琰等[12]认为雷公藤愈伤组织的次生物质含量并不完全遵从上述规律,由扦插苗根、幼茎、叶诱导的愈伤组织中,根愈伤组织的内酯醇含量最高,而叶愈伤组织的总生物碱含量最高。本研究中,无菌组培苗的内酯醇含量为根部>叶部>茎部,由无菌组培苗诱导的3种愈伤组织中,根愈伤组织的内酯醇含量与叶愈伤组织中的含量相近,均高于茎。
通常,次生代谢产物的积累与培养细胞的生长是呈负相关的,即大多数培养细胞在生长期的后期才会大量合成次生代谢产物[14, 15]。愈伤组织细胞中次生代谢产物的大量积累往往发生在愈伤组织生长减慢的时候。如花色素苷在愈伤组织中的含量高峰期正是愈伤组织生长变缓慢之时[16];甜菊糖苷在愈伤组织中的积累也是发生愈伤组织的缓慢生长期[17]。雷公藤叶愈伤组织中的内酯醇含量在生长周期的前期一直较低,到中后期积累量增加迅速,在后期其含量最大,亦表现出内酯醇积累与细胞生长负相关的规律。
| [1] | 颜晓艺,赵丹,吴承祯,等. 4种诱导剂对雷公藤幼苗叶片生长及内酯醇含量的影响[J]. 应用与环境生物学报,2015,21(4):607-615. |
| [2] | 祝传书,冯慧娜,薛璐莎,等. 雷公藤胚状体培养合成雷公藤甲素与总生物碱的初步研究[J]. 农业生物技术学报,2013,21(6):631-640. |
| [3] | 李琰,冯俊涛,王永宏,等. 抗褐变剂对雷公藤愈伤组织生长和次生代谢产物含量的影响[J]. 武汉植物学研究,2010,28(2):224-228. |
| [4] | 李琰,崔蕾,杨钰琪,等. 雷公藤不定根培养体系的建立及中试放大研究[J]. 中国中药杂志,2015,40(1):53-58. |
| [5] | 李琰,赵磊,崔蕾,等. 诱导子对雷公藤不定根生长和次生代谢产物含量的影响[J]. 生物工程学报,2015,31(5):734-743. |
| [6] | 李建鹃,洪伟,吴承祯,等. 雷公藤优良无性系组织培养技术的研究[J]. 福建林学院学报,2009,29(4):315-319. |
| [7] | IBORRA J L,GUARDIOLA J,MONTANER S,et al. 2,3,5-triphenyltetrazolium chloride as a viability assay for immobilized plant cells[J]. Biotechnology Techniques,1992,6(4):319-322. |
| [8] | 高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006. |
| [9] | 高桂珍,周吉源. 喜树细胞悬浮培养中生理生化指标的测定[J]. 武汉植物学研究,2003,21(3):259-261. |
| [10] | 王义,吴歌,杜研,等. 不同外植体及理化因子对膜荚黄芪愈伤组织形成的影响[J]. 吉林农业大学学报,2008,30(3):294-296,305. |
| [11] | 李波,彭丹,徐婉玉,等. 苜蓿不同外植体愈伤组织诱导效果及其相关性分析[J]. 种子,2016,35(2):73-75. |
| [12] | 李琰,冯俊涛,王永宏,等. 培养基及培养条件对雷公藤愈伤组织生长和次生代谢产物含量的影响[J]. 林业科学,2010,46(5):64-69. |
| [13] | 李琰,董娟娥,姜在民,等. 杜仲愈伤组织中次生代谢产物积累动态研究[J]. 西北植物学报,2004,24(11):2033-2037. |
| [14] | YEOMAN M M,LINDSEY K,MIEDZYBRODZKA M B,et al. Accumulation of secondary products as a facet of differentiation in plant cell and tissue cultures[M]//YEOMAN M M,TRUMAN D E S. Differentiation in Vitro. Cambridge:Cambridge University Press,1982:65-82. |
| [15] | 阮茜,郭勇. 磷限制培养中玫瑰茄细胞生长及花青素形成动力学[J]. 华南理工大学学报(自然科学版),1999,27(1):86-90. |
| [16] | 王惠珍. 穗冠花愈伤组织的诱导和花色素苷积累的研究[D]. 广州:华南师范大学,2002. |
| [17] | 谢绍萍,欧阳学智,洪维廉,等. 甜菊愈伤组织生长、分化与甜菊糖苷积累的关系[J]. 热带亚热带植物学报,1998,6(1):8-14. |

 2016, Vol. 36
2016, Vol. 36


