2. 上海海洋大学 极地研究中心, 上海 201306;
3. 大洋渔业资源可持续开发教育部重点实验室极地海洋生态系统研究室, 上海 201306;
4. 国家远洋渔业工程技术研究中心, 上海 201306
形态是认知生物体和建立生物分类系统的重要手段和途径。对于不同种类的生物而言,形态特征是界定分类地位,推测进化路径[1]的重要指标,而对于同种生物而言,形态特征可作为个体发育[2]、系统发生[2]、种群划分[3]与生理生态[4-5]等研究的重要工具。因此,如何更好地描述形态并分析结果是生物学研究的一个核心问题。20世纪80—90年代,BOOKSTEIN[6-7]和ROHLF[8]创立了几何形态测量学这一新方法,该方法摒弃了数据不同源性、不可重复性以及大小和形状无法分开讨论的缺点,被广泛地应用于各个领域。鱼类生态学是研究鱼类的生活方式,研究鱼类与环境之间相互作用关系的一门学科,其中环境对鱼类形态的影响占据了重要的部分。近些年来,几何形态测量学作为新兴技术手段已得到无数鱼类生态学者的应用,但仍缺乏系统性的回顾,因此,非常有必要对其进行详细的综述。本文简要介绍了几何形态测量学的发展与其方法,并对其在鱼类生态学中的应用进行了总结,对其未来的发展以及不足进行了展望。研究结果可为几何形态测量学在鱼类生态领域中的深入研究提供参考,尤其在一些新技术与方法的应用方面提供信息。
1 几何形态测量学的发展几何形态测量学萌芽于18世纪,当时较为常用的传统形态学手段无法满足随分类学发展而出现的对生物形态更为精细的描述要求。此后,许多学者将统计学、测量学、图形学等学科应用到形态学领域[9-12],几何形态测量学因而随着这些学科的发展而得到飞速发展,并逐渐广泛地应用于包括鱼类生态学在内的诸多领域。
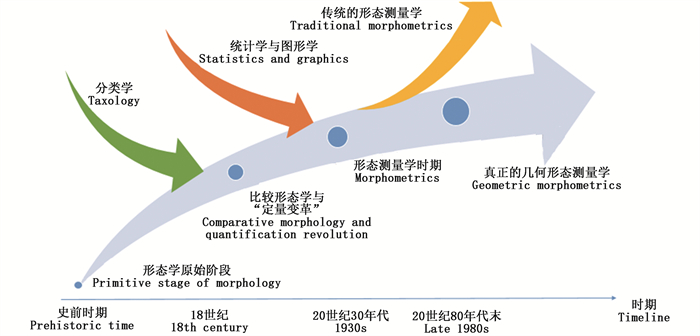
至今已有较多研究对几何形态测量学过去的发展趋势进行了概述[9-12]。概括来说,几何形态测量学发展史涵盖几个重要的时间节点(图 1):一是20世纪初的定量变革时期[13],一些生物学报告中利用体长等测量值进行平均值分析和组间比较,这意味着形态学描述从简单的定性描述转变为了较为精确的定量分析;二是形态计量学的形成[7, 14],20世纪30年代后,多变量统计方法渐趋成熟,各种统计方法逐渐应用到形态测量描述中,使得形态测量描述与统计学的结合愈发紧密;三是几何形态测量学逐渐与传统的形态计量学分离,几何形态测量学脱胎于传统的形态计量学,两者最主要的差异是后者比较地标点间的线性距离,而前者估算的是地标点间的几何关系或整体轮廓分析[14-15];四是以KENDALL为代表的统计学家发展了一套严格的形态分析的统计理论,使得多元统计分析和生物形态的直接可视化相结合成为可能[16];五是真正意义上的几何形态测量学的出现,20世纪80年代后期至90年代初期,BOOKSTEIN[6-7]、ROHLF等[8, 17]以数学形态学为基础,结合物理学中的能量学和力学方法,创立了几何形态测量学这一新方法。
|
图 1 几何形态测量学发展史 Fig. 1 History of geometric morphology |
几何形态测量学在生物学领域应用时,可分为图像准备、数据收集和数据分析3个步骤。
2.1 图像准备几何形态测量学分析的第一步是由二维或三维的数码图像中获得可分析的数据。二维图像的获取相对较简单,是目前使用最多的方法。但由于图像拍摄系统自身在摄录、储存以及重现等方面均会存在一定误差,所以用于研究的图像具有一定的要求。葛德燕等[18]详细阐述了获取图像所需的仪器和注意事项。例如,需添加比例尺以记录样本的实际大小并保证样本摆放位置、拍摄方位以及聚焦部位一致;白明等[10]还强调了图片文件不应过大或过小增加系统负担,图片尺寸应当接近以免导致频繁缩放图片从而使得图像失真;图像获取时要保证共轴性、共面性、一致性和可比性等性质[11]。此外,相机的选择要考虑像素、精确度、色调范围、色纯度和精度、白平衡以及图像噪声等因素。而三维图像获取比较复杂,一般需要专业设备,大体可分为表面形态和内部形态两类。如表面激光扫描仪、原子力显微镜等可以构建表面形态的三维图像,显微CT、同步辐射CT、激光共聚焦显微镜等可以构建内部形态的三维图像。生成的原始图像需要经过进一步的处理才可用于分析[19],目前使用较少。
2.2 数据收集和分析几何形态测量学分析的第二步是数据收集。数据收集的过程,即将形态矢量化、数字化的过程,即将生物体的形态或部分形态用地标点或曲线以数学的方法表示。地标点或曲线的选取原则为同源性、足够代表性、相对位置一致性、共面性和可重复性[11]。曲线一般在无法用地标点表示位置的情况下采用,通常会转化为地标点以利于分析数据收集。不可避免的两个问题便是测量方法和所测量的性状的选取。
几何形态测量学的第三步是数据分析,即将所测量的数据结合数学方法进行分析。根据样本形态的不同,所选择的测量方法也会有不同。例如,轮廓线法适用于具有平滑曲线轮廓的样本,地标点法适用于具有足够可分析地标点的样本,而滑动地标点法可作为以上两种方法的补充。其数据分析所用的方法依据测量方法的不同也会不同。因此,本文按照不同测量方法进行总结。
2.2.1 轮廓线法随着对生物形态的研究不断深入,研究随之开始着重于生物体的轮廓外形。因此,轮廓线法是最早应用的几何形态测量学方法。此方法已得到了多个学者的研究与归纳[20-21],其具体思路通常为:(1)首先在具有同源性的组织结构或边缘提取出具有同源性的组织边缘曲线,然后沿着边缘曲线选取特殊点进行数字化;(2)借助数学函数采用不断逼近的方式将所取点轮廓数值化;(3)将形态变量作为函数系数的多变量进行分析。
多年来,许多学者均发现轮廓线法具有不可避免的诸多缺陷。ADAMS等[22]详细阐述了轮廓线法的发展与不足。例如,对区域性变形的解析能力不足;基于不同方法的统计学分析、所选取的点不一致往往会产生不同的统计结果,无统一的理论可供借用以选择最佳方法等。近年来,轮廓线法的应用越来越少,大多限于鱼类耳石形态分析应用中。
轮廓线法用于鱼类耳石形态分析时,过去主要应用傅立叶分析法。一般来说,低谐次的傅里叶谐值在种类区分中作用较大,高谐次的傅里叶谐值在种群区分中作用较大[23-24]。然而,傅立叶分析法在耳石轮廓不规则或有所缺损时分析偏差较大[20, 25]。于是,近年来出现了小波变换分析法和曲率尺度空间分析法(curvature scale space)。这两种方法对曲线轮廓的描述均不会随着图像的尺寸变化、旋转或转换而发生改变,具有较好的稳定性[26]。
2.2.2 地标点法地标点法是目前几何形态测量学中使用最多的方法。地标点是生物样本具有生物和几何信息同源性的点,在一些情况下可以与传统形态学上的特定名词相对应。地标点可以为二维,也可以为三维。由于三维技术的特殊性,本文将在后文单独总结。地标点法的基本思路就是基于这些地标点利用数学方法去除非形态变异对分析的干扰后对形态进行重构分析。
地标点法的第一步是准确选取样本的地标点。白明等[10]及其他学者均在BOOKSTEIN[7]提出的三类地标点基础上对地标点的选取进行规范。目前,生物学中应用的地标点主要包括3类:(1)Ⅰ型地标点。主要是指不同组织间的交点,如鱼鳍与鱼体的接触点。Ⅰ型地标点是具有生物学意义的真正地标点;(2)Ⅱ型地标点。指结构中的凹陷或突起点,如尾叉的凹陷点。它是由相对位置所定义的假地标点;(3)Ⅲ型地标点。指结构的极值点,如最长点、最宽点等,即Ⅲ型地标点由相对其他地标点位置定义,严格来说属于半地标点[7, 15]。实际操作中,Ⅰ型或Ⅱ型地标点能够在每一样本的解剖学特征上准确找到,可重复性较强。
第二步是去除非形态变异的干扰,通常通过叠印的方法。叠印是通过平移、缩放和旋转衡量形态的差异,主要可分为布氏坐标法(Bookstein shape coordinates,BSC)、广义普鲁克提斯分析法(generalized Procrustes analysis,GPA)以及广义耐受适应法(generalized resistant fit,GRF)[9, 14, 18]。BSC需要采取坐标系统中两点作为基准,基线端点的选择对于结果影响较大,故当下应用较少。GPA是目前应用最广泛的叠印方法。该方法基于最小二乘法原理,将误差分摊到各个点上,故在样本可分析地标点较少时,会产生较大误差,此时基于中值分析的GRF更为适用。有时,3种方法呈现的结果差异可能较大。样本叠印后产生的地标点被称为普氏形状坐标(Procrustes shape coordinator)。该方法通过普氏叠加可得出一个图像化的结果,其为所有样本组的平均结果,称为平均形状,而平均形状周围散布着来自各个样本的对应地标点。个体与平均形状之间的差异叫做普氏残差(Procrustes residual)。两组普氏形状坐标之间的欧氏距离被称为普氏距离,通过普氏距离可以反映出两组地标点形态上的差异[19]。
第三步是利用变形网格进行形状比较。形态变化的可视化可以直观地呈现出样本形态变化的状况,这也是几何形态测量学相对传统形态计量学的优势之一[15]。这时形态差异可通过物体间地标点的相关一致性体现,也可以通过形态变异中多变量比较数据体现。最常用的是薄板样条插值法,该方法使得两个几何形状之间的形状差异或形状改变可以由变形的网格中读出[10]。但开展下一步的分析和比较往往还需利用特征分析及主成分分析等统计方法。
最后是数据的统计分析。通常,可仅对几何形态数据进行统计分析以解决大多数形态学问题;也可通过结合其他学科手段(如,分子、环境、耳石微化学、营养动力学等)解决涉及发育、进化、生态等方面的问题。
2.2.3 滑动半地标点法当所研究的样本特征中可以明确定位的地标点较少或反映形态信息不够细致时,地标点法的误差较大。此时,可以以地标点为基础,并结合半地标点进行形态分析,以保留形态更多的细节变化。
半地标点的概念由BOOKSTEIN[7]提出,指在样本轮廓线上并按照一定的规则(如按等长或等比例划分)确定的多个位点[27-28]。地标点和半地标点结合后极大地丰富了研究对象的形态信息,能够较为细致地反映研究对象连续的形状信息,半地标点能够补足地标点法和轮廓线法适用性不足的情况,如对于生物体不规则的形态分析和缺少真正地标点的形态分析。半地标点的不足在于其在数学意义上并不完整,在轮廓线上的分布有一定的任意性,而滑动技术可解决这一问题。滑动技术能够使得半地标点沿着曲线滑动,以减少参照形状与单个形状之间变形所需要的扭曲能,或减少对应地标点之间的距离,从而使形状之间的对应地标点尽量吻合[27]。此外,该方法不但在二维形态应用上取得了较好的效果,还可用于三维空间形态上[29]。
2.3 三维数据的获得、分析及其问题三维图像获取通常需要专业设备,可分为表面形态和内部形态两大类别,或可利用相机拍摄下样本不同的角度,再利用三维重建软件将二维照片转化为三维图像。选择仪器时,还需考虑各仪器可处理的样本类型、样本尺寸、样本处理方式、三维图像分辨率、结构可见性、结构间的可辨性等方面的不同[12]。
与二维数据分析不同,通过仪器生成的三维原始图像通常需要经过处理及重建,才能获得可供分析的三维图像文件[30]。与二维几何形态测量学类似,三维地标点数据文件也由地标点和半地标点的数据构成。
三维地标点数据的分析与二维地标点数据的分析过程较为类似,其也将傅里叶谐波与有限元等理论引入了形态变异的可视化中[31]。但三维数据分析目前掣肘之处在于当下技术还无法进行大量样本的定量分析,因其样本量少而具有局限性[18]。此外,三维分析软件并非特别丰富,较多针对二维图像的软件和算法在三维图像中无法应用或应用效果不好。
随着三维技术的不断发展,三维几何形态测量学正在对传统几何形态测量学研究领域进行补充和扩展。三维几何形态测量学相较于二维几何形态测量学有其不可替代的优点:一是精度更高,不存在三维投射至二维数据的损耗,可以反映更细微的结构(如耳石凸起等);二是适用性更广,可以反映内部结构或结构变化;三是误差更低,多角度下,非刚性结构的卷曲,不在同一平面的地标点等所带来的误差会大幅减少。但目前二维几何形态测量学的地位仍无法撼动,是因为由于技术的不成熟而导致三维几何形态测量学在应用中还存在一些问题。例如,现如今三维数据的获得还需要昂贵的设备支持;数据重建通常需要大量人力和计算资源的投入,无法进行大量样本的分析等。此外,目前大多数的学术刊物仍然是纸质的二维媒介,对于三维的图像无法充分表达等均限制了三维几何形态测量学的发展和应用。
3 在鱼类生态学研究中的应用几何形态测量学在鱼类生态学领域中主要通过研究鱼类样品的整体或部分形态特征,有时结合其他技术如分子技术、耳石微化学技术等,致力于寻找形态与生态的关联。主要的应用领域可分为以下几个方面,一是个体发育和地理环境导致的同种或相近种(同质组)鱼类的形态差异;二是分析同一进化枝内物种某些形态特征的进化规律;三是将形态、功能与生态结合起来进行分析,利用形态反映同一地点不同鱼类的生态位。
3.1 环境对个体发育影响20世纪90年代开始,陆续有研究将几何形态测量学应用到环境对多种鱼类个体发育所产生的影响而导致的形态变化中。环境对个体发育影响的研究多集中在描述不同环境下异速生长情况以及个体生长过程中各部分形态的变化中。早期已有较多研究利用形态计量学建立了鱼种的体长-体质量关系等异速生长模式。而几何形态测量学的应用使得更多因素能够融入分析并进行更精细的研究。VIGNON等[32-33]对具有溯河洄游习性的四线笛鲷(Lutjanus kasmira)的幼体(河口区)与成体(海洋)耳石进行差异分析,结果发现,个体生长和环境因素共同影响了耳石形态的变化,环境的变化使得耳石会有重构型的情况发生,且在栖息地改变后,耳石在形态变化的幅度和方向上表现出不同的个体发育模式。BERNAL-DURÁN等[34]通过地标点法对杯吸盘鱼(Sicyases sanguineus)的仔鱼和稚鱼进行研究,结果表明,在由表层习性过渡到底栖习性期间,该鱼种形状变化先于营养变化。SEARLE等[35]描述了智利不同水流速度环境中区毛鼻鲶(Trichomycterus areolatus)的形状差异,确定了水流速度环境对个体发育模式的影响——水流速度环境能够影响其个体发育轨迹,并且与低水速环境相比,高水速环境对于样本个体发育中的形状变化影响更大。JAHNSEN-GUZMÁN等[36]在摄食和形态水平上评估了体外寄生虫对石纹喉盘鱼(Gobiesox marmoratus)幼鱼的影响。几何形态测量学分析表明,通过早期个体发育,被寄生幼鱼和未被寄生幼鱼之间存在细微但显著的变化。体外寄生虫不会较大幅度地减少宿主的捕食。寄生幼鱼和未被寄生幼鱼在发育过程中发生的形态和摄食变化为解耦模式。寄生幼鱼通过浮游发育和吞食移动能力较弱的摄食对象维持更细长、更具水动力的体型。GERTH等[37]比较了个体发育过程中的沙美洲

目前,已确定了一些环境对形态影响的因素。HAAS等[38]发现,栖息地的物理特征催生了当地鱼类种群形态属性的变化。鱼类的体型可以通过饲养温度[39]、食物数量[40]和食物类型或喂养方式[41-42]予以改变。一种常用的研究模式是通过选择栖息地广布且环境条件相差较大的地理种群以研究整体或局部特征的适应性差异,这有助于理解不同环境条件下鱼类身体特征的多样性。BANO等[43]分析了不同生境诱导的条纹毛足鲈(Trichogaster fasciata)亚群的形态变异。总体而言,热带生境的个体体形呈流线型,头部倾斜,尾柄膨大;而静水生境个体的身体较深,头部较宽,尾柄较小。RAMLER等[44]通过地标点法量化了不同生境中
当利用几何形态测量学分析同一进化枝内物种的某些形态特征的进化规律时,往往会结合分子技术等手段。例如,COLOMBO等[48]使用了一种由49个物种和5个形态特征组成的新的时间校准系统发育图,这些特征表征了南极鱼类的身体大小和形状,以及浮力适应和栖息地偏好,以推断南极鱼类的适应辐射模式。FRUCIANO等[49]通过分析尼加拉瓜湖始丽鱼(Archocentrus centrarchus)的身体和咽颚形状的变化,并结合线粒体控制区和微卫星的遗传变异,描述了该物种在两个尼加拉瓜湖泊之间和湖内的变化,以确定其是否参与同域物种形成。李晓慧等[50]采用几何形态测量法并结合Micro CT扫描技术对黄河上游与柴达木水系格尔木河的花斑裸鲤(Gymnocypris eckloni)形态进行定量分析,讨论两水系花斑裸鲤是否存在先前研究未能发现的形态差异。结果显示:花斑裸鲤的两个地理种群在基于其头部形态轮廓二维坐标无差异,而花斑裸鲤两个地理种群背鳍支鳍骨插入椎骨间的相对位置这一形态特征则表现出显著性差异。FEILICH[51]由131个慈鲷属(Tilapia)的放射学照片中测量了身体和鳍的形态,以确定这些特征是否表现出相关进化。结果表明,身体、尾鳍、背鳍和臀鳍形状均表现出与运动生态形态学一致的强相关进化,表明体型进化并不是独立于其他特征而发生,而是在一系列其他形态变化中发生,这些变化增强了运动特化。HART等[52]通过洞穴鱼类(Amblyopsidae)研究洞穴特化对进化模式和节奏的影响后发现,有眼鱼和盲鱼具有不同的体型,但体型进化率无差异。WILSON等[53]通过南极鱼类鳃盖骨进化模型量化了形态差异、形状进化的系统发育模式以及稳定同位素值的生态相关性,以评估生态和形态差异在南极鱼类适应辐射中的相互关系。结果显示,鳃盖形状变化的主要进化轴反映了由宽且对称的锥形鳃盖至沿远侧边缘变窄的鳃盖的过程,并发现了沿底栖-中上层轴的鳃盖形状变化趋势,强调了该轴对南极鱼类辐射多样化的重要性,但近侧边缘仅发生轻微的形状变化。CHOLLET-VILLALPANDO等[54]对钻嘴鱼科(Gerreidae)物种耳石凹槽形状差异进行研究,试图解释由海洋栖息地向淡水栖息地的转变过程中各物种形态差异的变化;分类丰富度增加后属间形态差异的变化以及巴拿马地峡的地理隔离对姊妹物种形态造成的影响。
值得一提的是,虽然越来越多的研究人员强调以完全由环境引起的表型差异为特征的鱼类类群的重要性[55]。然而,这类表型差异多是数量遗传特征,通常由许多基因控制,并受这些基因表达环境的影响[56]。在自然选择和性选择的塑造下,它们反映了局部适应[57],但尚存在一些争议[58]。所以,此类研究有时还会结合其他数据,如寄生虫、分子标记(如,蛋白质等位酶、线粒体DNA、微卫星DNA)等。
3.3 功能形态与生态HUTCHINSON[59]将生态位定义为多维超空间中物种能够维持生存种群的体积,其中维是环境条件和资源(如光、营养物等)。这一概念的一个延伸是“功能生态位”,其维度由功能特征定义。在鱼类中,这些特征是形态测量或与觅食和饮食策略、食物网中的营养水平、大小、运动、移动性、生活方式、活动或栖息地分布有关的分类变量的组合。生物多样性可以用生态、分类和功能指数来衡量并置于模型中进行分析。其中,功能多样性被认为是生物多样性研究的关键,因为它解释了生物在生态系统中的作用。因此,一些学者致力于利用几何形态测量学数据描述功能特征以反映物种的生态位,如口裂可反映摄食、偏好的食物类型、在水体中的位置,甚至可侧面反映捕食策略[43],耳石与感觉系统相关故可反映生活水层与摄食、习性等[60];尾柄与鳍的形状与游泳性能和捕食策略有关[61],项峰(Nuchal humps)可能与求偶有关[62]等。熊鹰等[63]以长江中下游洪泛平原湖泊鱼类为例,探讨了鱼类功能性形态特征与其营养级位置之间的关系。结果表明:仅当鱼类为植食性鱼类和肉食性鱼类才有特化的功能性形态与之相适应,植食性鱼类具有较窄的口裂,而对肉食性鱼类而言,不同生活型的鱼类拥有各自特化的形态特征,如伏击型肉食性鱼类体型呈纺锤形,背鳍靠近头部,眼睛较大且靠上,头部面积较大;而追击型肉食性鱼类体型呈流线型,头部较小,背鳍和腹鳍靠近尾部;而杂食性鱼类在本研究中无更多证据证明有特化的外部形态。KUMAR等[64]通过描述功能特征确定了阿拉伯海东南部深海水域中7种常见鱼类之间功能生态位重叠的区分水平和程度。结果表明,物种之间的功能性状存在显著差异,提供了较低的功能生态位重叠,并证明了功能分析可有效推断物种的摄食和游泳策略。LOMBARTE等[60]对地中海不同水层生活的鱼类耳石进行分析后发现,大多数表层鱼类的耳石较小,而在陆坡底层的鱼类耳石较大,深渊层的鱼类耳石则大小适中,这种差异主要由内源性因素造成。RAJEESHKUMAR等[65]对印度深海水域的常见底栖
几何形态测量学在鱼类生态学领域中应用广泛,有着不可替代的优点,然而受制于当下技术和理论的不完善,其在应用中也有着一定的局限性。一是目前常用的二维几何形态测量学多将三维数据投射单一平面的二维数据使用,形态数据多有损耗,也极少使用其他角度的数据,例如眶间隔在传统形态学中是重要的分类依据,但在几何形态测量学中甚少使用;二是二维几何形态测量学研究的形态单元一般需为刚性结构,非刚性结构如鳍、鳃丝、口须等误差较大;三是对于细微结构如表面的纤毛、凸起凹陷等暂时还未发掘其用途,如在分析耳石随环境、食性等变化时对耳石表面凸起凹陷的分析甚少;四是在几何形态测量学分析中大部分软件不能处理缺失数据。
同时,几何形态测量学在鱼类生态领域中也有着广阔的待发掘领域。当前理论还未开发出一些数据和手段的最佳应用;例如,形态数据的叠印与分子技术中序列数据比对在基本原理上类似,几何形态测量学与生物信息学可能还有着较多的结合点;物理学中变形网格的扭曲能也未在几何形态测量学中发掘出更深的意义和应用。而在鱼类生态的实际应用中,如何将鱼类的功能形态与其系统发育结合起来也需要深入探讨;当下大部分研究仅利用简单形态测量数值比值反映功能形态,如何将几何形态测量学手段更好地结合进去;如何将三维数据与时间轴结合以研究鱼类整体形态变化,或在不伤害样本情况下更好地追踪其形态变化等问题尚待发掘。
| [1] |
NELSON J S, GRANDE T C, WILSON M V H. Fishes of the world[M]. 5th ed. Hoboken: Wiley, 2016.
|
| [2] |
MOSER H G, RICHARDS W J, COHEN D M, et al. Ontogeny and systematics of fishes[M]. La, Jolla: The American Society of Ichthyologists Herpetologists, 1984.
|
| [3] |
熊瑛, 郑元甲, 汤建华, 等. 海洋鱼类种群划分的研究方法及其在小黄鱼上的应用进展[J]. 海洋渔业, 2018, 40(1): 117-128. XIONG Y, ZHENG Y J, TANG J H, et al. Advances in survey methods for population identification in marine fishes and their application to small yellow croaker (Larimichthyspolyactis)[J]. Marine Fisheries, 2018, 40(1): 117-128. DOI:10.13233/j.cnki.mar.fish.2018.01.013 |
| [4] |
李明德. 鱼类分类学[M]. 3版. 天津: 南开大学出版社, 2013. LI M D. Fish ecology[M]. 3rd ed. Tianjin: Nankai University Press, 2013. |
| [5] |
魏华, 吴垠. 鱼类生理学[M]. 2版. 北京: 中国农业出版社, 2011. WEI H, WU Y. Fish physiology[M]. 2nd ed. Beijing: China Agriculture Press, 2011. |
| [6] |
BOOKSTEIN F L. Size and shape spaces for landmark data in two dimensions[J]. Statistical Science, 1986, 1(2): 181-222. |
| [7] |
BOOKSTEIN F L. Morphometric tools for landmark data: geometry and biology[M]. Cambridge: Cambridge University Press, 1991.
|
| [8] |
ROHLF F J, SLICE D. Extensions of the procrustes method for the optimal superimposition of landmarks[J]. Systematic Biology, 1990, 39(1): 40-59. |
| [9] |
ZELDITCH M L, SWIDERSKI D L, SHEETS H D. Geometric morphometrics for biologists[M]. 2nd ed. Washington, DC: Academic Press, 2012.
|
| [10] |
白明, 杨星科. 几何形态测量法在生物形态学研究中的应用[J]. 昆虫知识, 2007, 44(1): 143-147. BAI M, YANG X K. Application of geometric morphometrics in biological researches[J]. Chinese Bulletin of Entomology, 2007, 44(1): 143-147. |
| [11] |
白明, 杨星科, 李静, 等. 几何形态学: 关于形态定量比较的科学计算工具[J]. 科学通报, 2014, 59(10): 887-894. BAI M, YANG X K, LI J, et al. Geometric Morphometrics, a super scientific computing tool in morphology comparison[J]. Chinese Science Bulletin, 2014, 59(10): 887-894. |
| [12] |
白明, 杨星科. 三维几何形态学概述及其在昆虫学中的应用[J]. 昆虫学报, 2014, 57(9): 1105-1111. BAI M, YANG X K. A review of three-dimensional(3D) geometric morphometrics and its application in entomology[J]. Acta Entomologica Sinica, 2014, 57(9): 1105-1111. |
| [13] |
PALCI A, LEE M S Y. Geometric morphometrics, homology and cladistics: review and recommendations[J]. Cladistics, 2019, 35(2): 230-242. DOI:10.1111/cla.12340 |
| [14] |
陈新军, 方舟, 苏杭, 等. 几何形态测量学在水生动物中的应用及其进展[J]. 水产学报, 2013, 37(12): 1873-1885. CHEN X J, FANG Z, SU H, et al. Review and application of geometric morphometrics in aquatic animals[J]. Journal of Fisheries of China, 2013, 37(12): 1873-1885. |
| [15] |
张锋, 李萍. 几何形态测量学在古生物学研究中的应用概况[J]. 古生物学报, 2016, 55(4): 518-531. ZHANG F, LI P. Application of geometric morphometrics in palaeontologicalresearch[J]. Acta Palaeontologica Sinica, 2016, 55(4): 518-531. DOI:10.19800/j.cnki.aps.2016.04.012 |
| [16] |
陈新军, 方舟, 陈洋洋, 等. 几何形态测量学在水生生物中的应用[M]. 北京: 科学出版社, 2017. CHEN X J, FANG Z, CHEN Y Y, et al. Application of geometric morphometry to aquatic organisms[M]. Beijing: Science Press, 2017. |
| [17] |
ROHLF F J, BOOKSTEIN F L. Proceedings of the Michigan morphometrics workshop[C]. University of Michigan Museum of Zoology Special Publication, 1990: 1-380.
|
| [18] |
葛德燕, 夏霖, 吕雪霏, 等. 几何形态学方法及其在动物发育与系统进化研究中的应用[J]. 动物分类学报, 2012, 37(2): 296-304. GE D Y, XIA L, LYU X F, et al. Methods in geometric morphometrics and their applications in ontogenetic and evolutionary biology of animals[J]. Acta Zootaxonomica Sinica, 2012, 37(2): 296-304. |
| [19] |
李荣荣, 李生才, 张虎芳. 几何形态测量学及其在半翅目中的研究进展[J]. 山西农业大学学报(自然科学版), 2016, 36(4): 235-241. LI R R, LI S C, ZHANG H F. Geometric morphometrics and its advances in Hemiptera[J]. Journal of Shanxi Agricultural University(Natural Science Edition), 2016, 36(4): 235-241. |
| [20] |
LOONKER D, BANERJI P K. Fourier analysis to wavelet analysis[J]. Journal of Ramanujan Society of Mathematics and Mathematical Sciences, 2016, 5(1): 57-72. |
| [21] |
SMOLIN'SKI S, SCHADE F M, BERG F. Assessing the performance of statistical classifiers to discriminate fish stocks using Fourier analysis of otolithshape[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2020, 77(4): 674-683. |
| [22] |
ADAMS D C, ROHLF F J, SLICED E. Geometric morphometrics: ten years of progress following the 'revolution'[J]. Italian Journal of Zoology, 2004, 71(1): 5-16. |
| [23] |
CAMPANA S E, CASSELMAN J M. Stock discrimination using otolith shape analysis[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1993, 50(5): 1062-1083. |
| [24] |
侯刚, 王学锋, 朱立新, 等. 基于几何形态测量学的4种金线鱼矢耳石识别研究[J]. 海洋与湖沼, 2014, 45(3): 496-503. HOU G, WANG X F, ZHU L X, et al. Geometric morphometrics of sagittal otolith of four nemipterus fish species[J]. Oceanologia et Limnologia Sinica, 2014, 45(3): 496-503. |
| [25] |
HARBITZ A. Parameter-sparse modification of Fourier methods to analyse the shape of closed contours with application to otolith outlines[J]. Marine and Freshwater Research, 2016, 67(7): 1049-1058. |
| [26] |
TUSET V M, OTERO-FERRER J L, SILIPRANDI C, et al. Paradox of otolith shape indices: routine but overestimated use[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2021, 78(6): 681-692. |
| [27] |
BOOKSTEIN F L. Biometrics, biomathematics and the morphometric synthesis[J]. Bulletin of Mathematical Biology, 1996, 58(2): 313-365. |
| [28] |
MARTINEZ C M, ROHLF F J, FRISK M G. Re-evaluation of batoidpectoral morphology reveals novel patterns of diversity among major lineages[J]. Journal of Morphology, 2016, 277(4): 482-493. |
| [29] |
GONZALEZ P N, BARBEITO-ANDRÉS J, D'ADDONA L A, et al. Technical note: performance of semi and fully automated approaches for registration of 3D surface coordinates in geometric morphometric studies[J]. American Journal of Physical Anthropology, 2016, 160(1): 169-178. |
| [30] |
WASILJEW B D, PFAENDER J, WIPFLER B, et al. Do we need the third dimension? Quantifying the effect of the z-axis in 3D geometric morphometrics based on sailfin silversides (Telmatherinidae)[J]. Journal of Fish Biology, 2020, 97(2): 537-545. |
| [31] |
HEDRICK B P, ANTALEK-SCHRAG P, CONITH A J, et al. Variability and asymmetry in the shape of the spiny dogfish vagina revealed by 2D and 3D geometric morphometrics[J]. Journal of Zoology, 2019, 308(1): 16-27. |
| [32] |
VIGNON M, MORAT F, GALZIN R, et al. Evidence for spatial limitation of the bluestripe snapper Lutjanus kasmira in French Polynesia from parasite and otolith shape analysis[J]. Journal of Fish Biology, 2008, 73(10): 2305-2320. |
| [33] |
VIGNON M. Ontogenetic trajectories of otolith shape during shift in habitat use: Interaction between otolith growth and environment[J]. Journal of Experimental Marine Biology and Ecology, 2012, 420-421: 26-32. |
| [34] |
BERNAL-DURÁN V, LANDAETA M F. Feeding variations and shape changes of a temperate reef clingfish during its early ontogeny[J]. Scientia Marina, 2017, 81(2): 205-215. |
| [35] |
SEARLE P, MERCER M, HABIT E, et al. Ontogenetic shape trajectory of Trichomycterus areolatus varies in response to water velocity environment[J]. PLoS One, 2021, 16(6): e0252780. |
| [36] |
JAHNSEN-GUZMÁN N, BERNAL-DURÁN V, LANDAETA M. Parasitic copepods affect morphospace and diet of larvae of a temperate reef fish[J]. Journal of Fish Biology, 2018, 92(2): 330-346. |
| [37] |
GERTH C J, MAIA A. Shape analysis of the jaws between two minnow species over ontogeny[J]. Journal of Morphology, 2017, 278(10): 1412-1420. |
| [38] |
HAAS T C, BLUM M J, HEINS D C. Morphological responses of a stream fish to water impoundment[J]. Biology Letters, 2010, 6(6): 803-806. |
| [39] |
SALINAS P, MOLINA F, HERNÁNDEZ N, et al. Phenotypic response of male and neomale of O. mykissparr subjected to 8° and 16 ℃ water temperature during early life stage[J]. Aquaculture Reports, 2022, 22: 100996. |
| [40] |
钱周兴, 徐永清, 方一峰. 饥饿对鱼类的影响[J]. 生物学通报, 2006, 41(6): 9-11. QIAN Z X, XU Y Q, FANG Y F. The effects of starvation on fish[J]. Bulletin of Biology, 2006, 41(6): 9-11. |
| [41] |
许德高, 李学梅, 朱永久, 等. 不同投喂方式对鳙形态特征的影响[J]. 水产学报, 2016, 40(6): 873-881. XU D G, LI X M, ZHU Y J, et al. Morphological variations of bighead carp (Aristichthys nobilis) fed by feedstuff[J]. Journal of Fisheries of China, 2016, 40(6): 873-881. |
| [42] |
PERES-NETO P R, MAGNAN P. The influence of swimming demand on phenotypic plasticity and morphological integration: a comparison of two polymorphic charrspecies[J]. Oecologia, 2004, 140(1): 36-45. |
| [43] |
BANO F, SERAJUDDIN M. Ecomorphological variations and flow-induced phenotypic plasticity in Trichogaster fasciata using geometric and truss analysis[J]. Current Science, 2021, 120(3): 547-552. |
| [44] |
RAMLER D, PALANDAČIC' A, DELMASTRO G B, et al. Morphological divergence of lake and stream Phoxinus of Northern Italy and the Danube basin based on geometric morphometric analysis[J]. Ecology and Evolution, 2017, 7(2): 572-584. |
| [45] |
郭梁, 任伟征, 胡亮亮, 等. 传统稻鱼系统中"田鲤鱼"的形态特征[J]. 应用生态学报, 2017, 28(2): 665-672. GUO L, REN W Z, HU L L, et al. Morphological traits of indigenous field carps maintained in traditional rice-based farming systems[J]. Chinese Journal of Applied Ecology, 2017, 28(2): 665-672. |
| [46] |
BANO F, SERAJUDDIN M. Sulcus and outline morphometrics of sagittal otolith variability in freshwater fragmented populations of dwarf gourami, Trichogaster lalia (Hamilton, 1822)[J]. Limnologica, 2021, 86: 125842. |
| [47] |
IBÁÑEZ A L. Fish scale shape variation by year and by geographic location, could scales be useful to trace fish? A case study on the Gulf of Mexico[J]. Fisheries Research, 2014, 156: 34-38. |
| [48] |
COLOMBO M, DAMERAU M, HANEL R, et al. Diversity and disparity through time in the adaptive radiation of Antarctic notothenioid fishes[J]. Journal of Evolutionary Biology, 2015, 28(2): 376-394. |
| [49] |
FRUCIANO C, FRANCHINI P, RAFFINI F, et al. Are sympatrically speciating Midas cichlid fish special? Patterns of morphological and genetic variation in the closely related species Archocentrus centrarchus[J]. Ecology and Evolution, 2016, 6(12): 4102-4114. |
| [50] |
李晓慧, 汤永涛, 田菲, 等. 几何形态测量法结合Micro CT扫描对两水系花斑裸鲤的形态分析[J]. 水生生物学报, 2020, 44(4): 853-861. LI X H, TANG Y T, TIAN F, et al. Morphological analysis used by geometric morphometrics combined with micro CT among Gymnocypris eckloni in two drainage (Teleostei: Cyprinidae)[J]. Acta Hydrobiologica Sinica, 2020, 44(4): 853-861. |
| [51] |
FEILICH K L. Correlated evolution of body and fin morphology in the cichlid fishes[J]. Evolution, 2016, 70(10): 2247-2267. |
| [52] |
HART P B, NIEMILLER M L, BURRESS E D, et al. Cave-adapted evolution in the North American amblyopsid fishes inferred using phylogenomics and geometric morphometrics[J]. Evolution, 2020, 74(5): 936-949. |
| [53] |
WILSON L A, COLOMBO M, HANEL R, et al. Ecomorphological disparity in anadaptive radiation: opercular bone shape and stable isotopes in Antarctic icefishes[J]. Ecology and Evolution, 2013, 3(9): 3166-3182. |
| [54] |
CHOLLET-VILLALPANDO J G, DE LUNA E. A geometric morphometric approach for disparity of the sulcus acusticus of sagitta in species of Gerreidae (Teleostei: Perciformes)[J]. Organisms Diversity & Evolution, 2020, 20(2): 299-311. |
| [55] |
KASHEFI P, BANI A, EBRAHIMI E. Morphometric and meristic variations between non-reproductive and reproductive kutumfemales (Rutilus frisii kutum, Kamensky, 1901), in the southwest Caspian Sea[J]. Italian Journal of Zoology, 2012, 79(3): 337-343. |
| [56] |
PEICHEL C L, MARQUES D A. The genetic and molecular architecture of phenotypic diversity in sticklebacks[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2017, 372(1713): 20150486. |
| [57] |
DWIVEDI A K, DUBEY V K. Advancements in morphometric differentiation: a reviewon stock identification among fish populations[J]. Reviews in Fish Biology and Fisheries, 2013, 23(1): 23-39. |
| [58] |
陈璐, 黄伯炎, 薛丹, 等. 中国沿海  科鱼类DNA条形码研究及新记录种三线 科鱼类DNA条形码研究及新记录种三线 分类地位探讨[J]. 海洋渔业, 2017, 39(2): 121-130. 分类地位探讨[J]. 海洋渔业, 2017, 39(2): 121-130.CHEN L, HUANG B Y, XUE D, et al. DNA barcoding of Terapontidae and taxonomic status of a new record of Teraponputa in costal waters of China[J]. Marine Fisheries, 2017, 39(2): 121-130. |
| [59] |
HUTCHINSON G E. Concluding remarks[J]. Cold Spring Harbor Symposia on Quantitative Biology, 1957, 22: 415-427. |
| [60] |
LOMBARTE A, CRUZ A. Otolith size trends in marine fish communities from different depth strata[J]. Journal of Fish Biology, 2007, 71(1): 53-76. |
| [61] |
GATZ A J. Community organization in fishes as indicated by morphological features[J]. Ecology, 1979, 60(4): 711-718. |
| [62] |
TAKAHASHI T. Function of nuchal humps of a cichlid fish from Lake Tanganyika: inferences from morphological data[J]. Ichthyological Research, 2018, 65(3): 316-323. |
| [63] |
熊鹰, 张敏, 张欢, 等. 鱼类形态特征与营养级位置之间关系初探[J]. 湖泊科学, 2015, 27(3): 466-474. XIONG Y, ZHANG M, ZHANG H, et al. Preliminary research on relationship between fish functional morphology and trophic position[J]. Journal of Lake Sciences, 2015, 27(3): 466-474. |
| [64] |
KUMAR K A, TUSET V M, MANJEBRAYAKAT H H, et al. Functional approach reveals low niche overlap among common deep-seafishes from the south-eastern Arabian Sea[J]. DeepSea Research Part Ⅰ: Oceanographic Research Papers, 2017, 119: 16-23. |
| [65] |
RAJEESHKUMAR M, KUMAR V A, OTERO-FERRER J L, et al. Differentiating morpho-functional patterns of the five most common deep-sea benthic anglerfishes (Lophiiformes) from Andaman and Nicobar Islands (eastern Indian Ocean)[J]. Scientia Marina, 2020, 84(4): 369-384. |
| [66] |
TUSET V M, OLIVAR M P, OTERO-FERRER J L, et al. Morpho-functional diversity in Diaphus spp. (Pisces: Myctophidae) from the central Atlantic Ocean: ecological and evolutionary implications[J]. DeepSea Research Part Ⅰ: Oceanographic Research Papers, 2018, 138: 46-59. |
| [67] |
FARRĚ M, TUSETV M, CARTES J E, et al. Depth-related trends in morphological and functional diversityof demersal fish assemblages in the western Mediterranean Sea[J]. Progress in Oceanography, 2016, 147: 22-37. |
| [68] |
TUSET V M, LOMBARTE A, BARICHE M, et al. Otolith morphological divergences of successful Lessepsian fishes on the Mediterranean coastal waters[J]. Estuarine, Coastal and Shelf Science, 2020, 236: 106631. |
2. Center for Polar Research, Shanghai Ocean University, Shanghai 201306, China;
3. Polar Marine Ecosystem Laboratory, Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
4. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31

