2. 中国水产科学研究院黄海水产研究所, 山东 青岛 266071;
3. 大洋渔业资源可持续开发教育部重点实验室, 上海 201306;
4. 国家远洋渔业工程技术研究中心, 上海 201306;
5. 农业农村部大洋渔业开发重点实验室, 上海 201306;
6. 农业农村部大洋渔业资源环境科学观测实验站, 上海 201306
中国枪乌贼(Uroteuthis chinensis)隶属头足纲(Cephalopoda)枪乌贼科(Loliginidae)尾枪乌贼属(Uroteuthis),为大陆架海域暖水性物种,又名台湾枪乌贼[1]。主要分布在南海大陆架和中国台湾海峡中南部海域,以闽南-台湾浅滩渔场资源尤为丰富[2]。中国枪乌贼在我国近海头足类的产量中占有很大比例,在南海北部海域占头足类总产量的2/3以上,是我国的主要捕捞对象,也是灯光围网、光诱敷网和拖网作业的兼捕种类[3-4]。
年龄和生长是头足类生物学研究的核心内容。相关研究有助于全面了解头足类动物的生命过程,预测整个种群的数量和资源波动,为资源管理提供基础性的相关数据。借助耳石这一稳定结构来研究头足类年龄与生长是最有效的方法之一[5]。头足类耳石在头部的平衡囊里,它们由结构稳定的一对文石组成,起着维持平衡的作用。因其结构稳定,并且具有清晰的轮纹,所以被视为头足类年龄鉴定的良好材料[5-6], 而其中耳石日增量宽度可以反映出头足类的生长发育状况[7]。
根据2016年在南海北部采集的中国枪乌贼样本,对耳石进行研磨后通过读取轮纹数来计算其孵化日期,并测量耳石日增量宽度,采用梯度森林法筛选影响中国枪乌贼耳石日增量宽度的关键环境因子,再利用广义加性模型探究关键环境因子与耳石日增量宽度之间的关系,以此为中国枪乌贼的年龄与生长研究以及资源保护和管理提供科学依据。
1 材料与方法 1.1 采样区域与样本信息中国枪乌贼样本为2016年4—6月在南海北部海域(18°N~19°N,113°E~115°E)随机采集的150尾中国枪乌贼,其中雄性55尾,雌性95尾。采集的中国枪乌贼样本经冷冻保存并送至实验室进行生物学特征测定。用卷尺和电子天平等工具对中国枪乌贼的胴长和体质量等生物学特征进行测定,测定方法参照《海洋调查规范》(GB/T 12763.1—2007)中的有关内容进行。对胴长和体质量进行统计分组,胴长以50 mm为一组,体质量以100 g为一组。
1.2 耳石研磨和耳石日增量宽度读取本研究使用右耳石进行分析。耳石研磨的主要过程是把耳石放入矩形塑料模具中,倒入调配好的冷埋树脂包埋,并在阴凉处等待硬化。在打磨时,先以240目的防水耐磨粗砂纸研磨到接近耳石表面处,再以600、1 200、2 000目的防水耐磨砂纸研磨到核心,研磨过程中不断地在显微镜下进行观查,以防磨过核心。这样完成一面,然后重复上述程序完成另一面,待两面研磨到核心,再用0.3 mm氧化铝水绒布抛光研磨好的耳石切片[8]。将研磨好的耳石切片置于具有电荷耦合元件的光学显微镜下进行拍照,拍照所选取的倍数为40倍,将所得图像利用画图 3D软件进行日轮计数,所得结果即为样本日龄,用样本捕获日期减去所得日龄即为样本的孵化日期。根据孵化日期即可得出优势产卵月份。利用Image-J软件测量耳石日增量宽度,沿着同一个轴对所有样本的耳石日增量宽度进行测量(图 1)。读取最大生长轴的区域为耳石的吻区。每一个样本的耳石日增量宽度数据读取两次,然后将两次数据的平均值作为最终结果,以确保准确性。

|
图中耳石来源于中国枪乌贼雄性个体,胴长:172 mm,体质量:94 g,日龄:132 d。 Otolith in the figure comes from a male Uroteuthis chinensis, mentle length: 172 mm, body mass: 94 g, age: 132 days. 图 1 中国枪乌贼耳石日增量宽度测量方向 Fig. 1 Measurement direction of statolith daily increment width of Uroteuthis chinensis |
温度直接或间接地影响着头足类个体的生长发育、摄食、产卵繁殖和洄游迁移等生命活动,是影响头足类生长的一个重要环境因子[9]。混合层深度(mixed layer depth, MLD)与水温有着密切的关系,能够影响海域中饵料生物的丰度与分布[10]。海洋表层的营养物质在其输送过程中会发生辐合和辐散,这会导致海平面的上升和下降,因此海表面高度(sea surface height, SSH)代表了浮游生物及其捕食者潜在的聚集机制[11]。水流的强弱和方向影响着头足类的洄游距离和食物的可获性,因此海流是决定个体存活率的关键环境变量之一[12]。海表面盐度(sea surface salinity, SSS)也是影响头足类个体生长、新陈代谢和各种活动的一个重要环境因子[13]。因此,结合中国枪乌贼所处的海洋地理环境,研究选择以上环境因子作为探究耳石日增量的指标(表 1)。

|
表 1 研究涉及的环境因子 Tab.1 Description of environmental factors in this study |
每日环境数据下载于美国夏威夷大学国际太平洋研究中心(http://apdrc.soest.hawaii.edu/las/v6)。环境因子分析所选取区域为18°N~22°N,111°E~117°E,覆盖了中国枪乌贼洄游过程中涉及的海域[14]。上述环境因子的时间分辨率为天,空间分辨率均由Matlab软件处理为0.25°×0.25°。由于洄游特征和海洋环境因子的变化,将所有环境因子的日变化与个体的日生长相对应。
1.4 数据处理根据计算的孵化日期,将在同一月份孵化的样本分组到同一月组中。在每个月组中,将样本每天的耳石日增量宽度与其对应日期的环境因子取平均值即可得到该日期的生长数据和环境数据。测量所有标本的耳石日增量宽度至最小日龄(86 d),以确保整个样本的一致性。方差分析用于分析每月组的耳石增量宽度,t检验用于分析性别差异。
为了量化耳石日增量宽度与环境变量之间的关系,使用梯度森林法筛选关键的环境变量。梯度森林法可以使用多个潜在相关的变量作为预测变量,并提供响应变量的拟合优度和每个预测变量的权重[15]。因此采用梯度森林法对表 1中的环境因子进行筛选,选出影响耳石日增量宽度的关键环境因子。其中,以环境因子作为预测变量,将平均日增量宽度作为响应变量[16]。选择R语言中的“gradientForest”和“ extendedForest”软件包进行模型构建与分析[17]。
根据梯度森林法获得的预测变量的权重,选择累积性权重大于0.07的关键环境变量,利用广义加性模型(generalized additive models,GAM)分析个体耳石日增量宽度与关键环境因子之间的定量关系[18]。基于环境变量的共线性和一致性,对采用梯度森林法选择的关键环境因子进行多元线性回归分析。在把影响因子引入GAM模型之前,对梯度森林法筛选出的关键环境因子进行方差膨胀因子分析[16],剔除存在共线性的部分因子。最后,将耳石日增量宽度与不同环境变量建立平滑函数。因此,GAM模型为
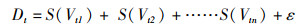 (1)
(1)
式中:Dt为响应变量,表示第t天的耳石日增量宽度;Vtn为关键环境因子的预测变量;S()为非线性函数;ε为误差项。使用赤池信息准则(akaike information criterion,AIC)和R2检验模型的拟合度并选择最佳模型,AIC值越小,表明模型的拟合效果越好[19]。采用“mgcv”软件包进行分析。
2 结果 2.1 胴长与体质量组成调查期间南海北部中国枪乌贼雄性个体的胴长为66~475 mm,平均胴长为199.73 mm,胴长优势组为150~200 mm,占群体的34.2%;体质量为14~767 g,平均体质量为184.2 g,体质量优势组为0~100 g,占群体的41.8%。中国枪乌贼雌性个体的胴长为88~417 mm,平均胴长为201.02 mm,胴长优势组为200~250 mm,占群体的35.8%;体质量为23~698 g,平均体质量为186.25 g,体质量优势组为0~100 g,占群体的36.8%(图 2)。本次调查的中国枪乌贼最大胴长为475 mm,最大体质量为767g,均为雄性个体。

|
图 2 中国枪乌贼胴长和体质量分布特征 Fig. 2 Distribution of mantle length and body mass for Uroteuthis chinensis |
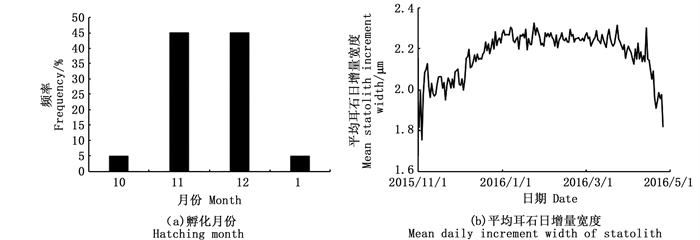
中国枪乌贼的孵化日期为2015年10月—2016年1月,其中孵化高峰期为11和12月,分别占总样本量的45%和45%(图 3a)。因此,本研究中的中国枪乌贼样本属秋冬季产卵群体。
|
图 3 中国枪乌贼孵化月份分布及平均耳石日增量宽度 Fig. 3 Hatching month distribution of Uroteuthis chinensis and mean daily increment width |
所有样本的耳石日增量宽度为1.76~2.33 μm,在2015年11月3日出现了耳石日增量宽度的最小值(1.76 μm),随后耳石日增量宽度开始波动升高,在2016年1月23日出现了耳石日增量宽度的最大值(2.33 μm),之后耳石日增量宽度又开始波动下降。总体而言,耳石日增量宽度呈现出先增加,在达到峰值后再减少的波动变化趋势(图 3b)。
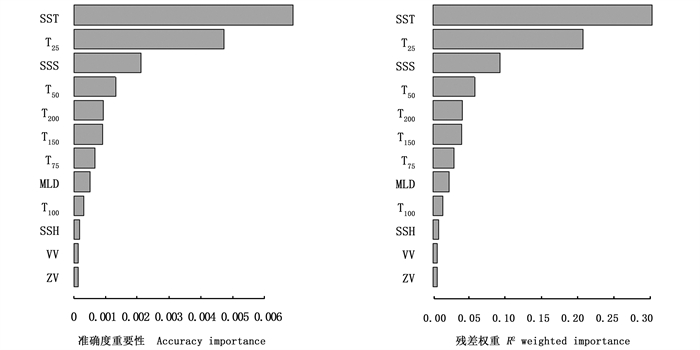
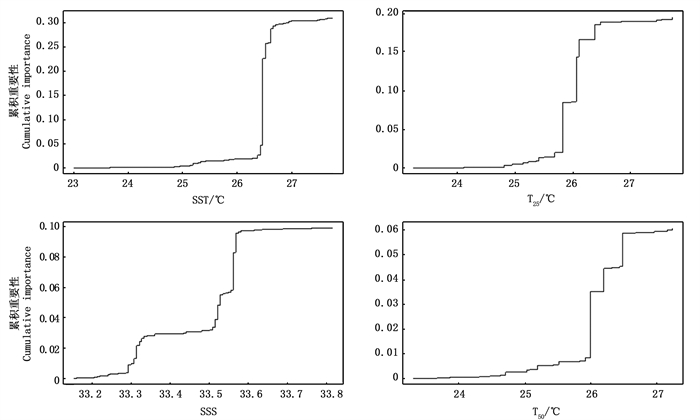
2.3 关键环境因子的筛选根据梯度森林法,选择SST、T25、SSS和T50作为影响耳石日增量宽度变化的关键环境因子(图 4)。其中耳石日增量宽度分别对SST(26~27 ℃)、T25(26~27 ℃)、SSS(33.5~33.6)和T50(26~27 ℃)存在较强的阈值响应(图 5)。
|
图 4 环境因子对耳石平均日增量宽度的权重 Fig. 4 Weight of environmental factors on mean daily increment width of statolith |
|
图 5 不同环境因子对耳石平均日增量宽度的累积重要性 Fig. 5 Cumulative importance of different environmental factors in relation to mean daily increment width of statolith |
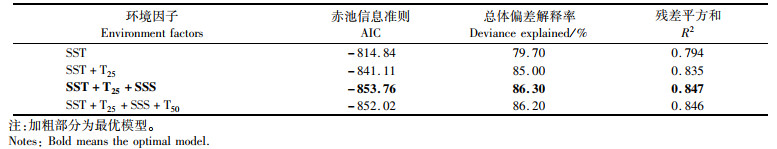
广义加性模型分析表明,由梯度森林法筛选出的关键环境因子与耳石日增量存在显著的相关性,这表明广义加性模型与梯度森林法对关键环境因子的选取具有一致性。选取SST、T25和SSS这3种环境因子组合的广义加性模型作为解释中国枪乌贼耳石日增量变化的最佳模型,其中AIC值为-853.76,R2为0.85,总体偏差解释率为86.30%(表 2)。
|
表 2 基于广义加性模型(GAM)关键环境因子对中国枪乌贼耳石日增量的影响 Tab.2 Significance of key environment factors on daily increment width in Uroteuthis chinensis based on the generalized additive model(GAM) analyses |
由GAM模型结果可知,SST为23~28 ℃时,耳石日增量宽度随着SST的增加呈下降趋势。当T25为23~28 ℃时,耳石日增量宽度随着T25的增加呈现逐渐下降的趋势。当SSS为33.2~33.8时,耳石日增量随着SSS的增加呈现逐渐下降的趋势(图 6)。

|
图中纵坐标s()是非线性函数,括号里的数字是定义的自由度。 The ordinate s() in the figure is a nonlinear function, and the numbers in parentheses are the defined degrees of freedom. 图 6 基于广义加性模型(GAM)分析SST,T25和SSS对中国枪乌贼耳石日增量宽度的影响 Fig. 6 Effects of SST, T25 and SSS on daily increment width for Uroteuthis chinensis based on generalized additive model(GAM) analyses |
研究发现,中国枪乌贼孵化高峰期为11—12月。南海北部地处低纬度地区,全年水温变动较稳定,因此全年均适宜头足类产卵繁殖[20]。从近似种的相关研究来看,WANG等[21]认为,环境对不同种群剑尖枪乌贼(Uroteuthis edulis)存在影响,结果认为冬季孵化的个体生长发育的速度较快,体型也相对较大,这是因为其在冬季孵化,主要在春夏季生长发育,此时有着较高的水温和丰富的饵料,有利于剑尖枪乌贼迅速生长。综上所述,枪乌贼所处海域的环境情况是影响个体生长发育的关键因素之一,也影响着个体的索饵、产卵和洄游等活动[22]。
耳石日增量宽度能够作为表征个体生长发育的指标,随着个体的生长与摄食活动的增强,耳石日增量的宽度逐步增加,此外栖息海域水温的升高也会使其变宽[23]。中国枪乌贼样本在第84 d时耳石日增量宽度最大,这表明群体此时处于快速生长阶段。中国枪乌贼在早期生长速度首先经历快速上升期,大约在孵化后3个月左右达到生长顶峰,随后随着外界环境变化和自身繁殖需要,个体生长速率保持稳定,并在孵化后6个月左右,生长速率逐渐下降(图 3b)。耳石日增量呈现出先增加后减小的变动趋势,这表明个体生活史基本特征受海洋环境因子的调节作用[24]。
3.2 关键环境因子的选择中国枪乌贼主要栖息在水深深度为15~170 m的海域,在近海海域进行定向的不同水深的南北洄游。金岳等[14]研究推测冬季孵化的枪乌贼的洄游路径基本为:每年冬季枪乌贼在海底礁石或砂砾上产卵,随着个体的生长发育,个体的游泳能力变强,开始向近岸海域做索饵洄游,同时也在更靠近表层的海域栖息。因此海水温度影响着头足类产卵的时间和空间,也影响着饵料食物的丰度和分布,从而影响种群早期的生长[25]。因此,根据其生活史栖息环境的变化,通过模型选择的SST、T25和SSS等环境因子也能够很好地解释相关变化规律。同时,研究也证实了梯度森林法可以有助于我们更好地理解多环境因子与头足类生长的关系。
3.3 关键环境因子对中国枪乌贼的影响广义加性模型分析显示,中国枪乌贼的耳石日增量宽度与水温呈负相关关系。一般中国枪乌贼个体在15~20 ℃内进行孵化,在该范围内随着水温的上升孵化率逐步增加,而仔稚鱼栖息在17~21 ℃[26]。因此,20~24 ℃时可能处于胚胎和仔稚鱼阶段,个体的摄食能力相对而言较弱,饵料丰度也较为匮乏,而在24~27 ℃时个体很可能已处于幼体阶段,随着海水温度升高,个体的游泳和摄食能力加强,这使得个体生长较快。如果水温过高,会对个体的生长产生不利影响,使个体的新陈代谢速率和活动能力下降[27],这可能会导致群体的早期生长在27 ℃后速度减慢。BARORD等[28]研究分析表明,虎斑乌贼(Sepia pharaonis)在23 ℃条件下食物耗费量比28 ℃时低。说明适当地降低水温,能够减少幼体的能量代谢,增强抗饥饿能力[29]。因而推测在23~28 ℃时耳石日增量与SST和T25呈负相关可能是因为在此范围内枪乌贼幼体抗饥饿能力比较差,而冬季海域内饵料又相对较少,从而影响了生长。枪乌贼类有昼夜垂直移动的普遍现象[30],夜间在表层进行觅食,白天潜入底层,因此除了海表面温度外不同水深水温也影响着枪乌贼的生长[31]。
盐度是影响枪乌贼生长的另一重要环境因子。相关研究表明,盐度对头足类的影响通常表现在间接方面,其间接影响是借助水团、海流等来展现出的[32]。王春琳等[33]研究表明,海水盐度处于等渗点时,乌贼不需进行消耗能量的渗透压调节,表现出良好的生长态势和最大的能量转换效率。而盐度偏离其等渗点,机体要用更多的能量维持内稳态,需要消耗更多的氧。本研究发现,SSS与耳石日增量宽度基本上呈负相关,因而推测产生此结果的原因是盐度过高,枪乌贼需消耗更多的能量用于渗透压调节,从而影响了生长。
4 结论本文采用梯度森林法筛选影响中国枪乌贼个体生长的关键环境因子,并通过广义加性模型建立耳石日增量与关键环境因子的关系,分析环境因子对个体生长的影响。研究结果表明,水温为23~28 ℃时,耳石日增量宽度随随着SST和T25的增加呈下降趋势;当SSS为33.2~33.8时,耳石日增量随着SSS的增加呈现逐渐下降的趋势。这可能由于在此环境内枪乌贼个体抗饥饿能力比较差且需要消耗大量的能量用于渗透压调节,从而影响了生长。本文只分析了10—翌年1月孵化的枪乌贼个体对环境因子的响应,后续研究中考虑采集全年各个月份孵化的样本,使样本能够覆盖更大的生活史范围,更全面的分析个体生长与环境因子之间的关系。
| [1] |
刘梦娜, 徐磊, 王雪辉, 等. 基于DNA条形码研究中国枪乌贼和鸢乌贼的食物种类组成[J]. 热带海洋学报, 2020, 39(4): 61-69. LIU M N, XU L, WANG X H, et al. Study on food contents of Uroteuthis chinensis and Sthenoteuthis oualaniensis based on COI sequence[J]. Journal of Tropical Oceanography, 2020, 39(4): 61-69. |
| [2] |
张壮丽, 叶孙忠, 洪明进, 等. 闽南-台湾浅滩渔场中国枪乌贼生物学特性研究[J]. 福建水产, 2008(1): 1-5. ZHANG Z L, YE S Z, HONG M J, et al. Biological characteristics of the Chinese squid (Loligo chinensis) in Minnan-Taiwan Shallow Fishing Ground[J]. Journal of Fujian Fisheries, 2008(1): 1-5. |
| [3] |
李渊, 孙典荣. 北部湾中国枪乌贼生物学特征及资源状况变化的初步研究[J]. 湖北农业科学, 2011, 50(13): 2716-2719, 2735. LI Y, SUN D R. Biological characteristics and stock changes of Loligo chinensis gray in Beibu Gulf, South China Sea[J]. Hubei Agricultural Sciences, 2011, 50(13): 2716-2719, 2735. |
| [4] |
李建华, 张鑫浩, 金岳, 等. 基于耳石和角质颚微结构的中国枪乌贼年龄与生长比较[J]. 海洋渔业, 2018, 40(5): 513-521. LI J H, ZHANG X H, JIN Y, et al. A comparative study on the age and growth of Uroteuthis chinensis, based on the microscopic structure of statoliths and beaks[J]. Marine Fisheries, 2018, 40(5): 513-521. |
| [5] |
马金, 陈新军, 刘必林, 等. 环境对头足类耳石微结构的影响研究进展[J]. 上海海洋大学学报, 2009, 18(5): 616-622. MA J, CHEN X J, LIU B L, et al. Review of the influence of environment factors on microstructure of statoliths of cephalopod[J]. Journal of Shanghai Ocean University, 2009, 18(5): 616-622. |
| [6] |
李楠, 俞骏, 方舟, 等. 基于耳石日龄信息的东海海域剑尖枪乌贼日龄、生长及种群结构研究[J]. 水产学报, 2021, 45(6): 887-898. LI N, YU J, FANG Z, et al. Age, growth and population structure of swordtip squid (Uroteuthis edulis) in the East China Sea based on statolith age information[J]. Journal of Fisheries of China, 2021, 45(6): 887-898. |
| [7] |
韩霈武, 王岩, 方舟, 等. 北太平洋柔鱼不同群体耳石日增量对海洋环境的响应研究[J]. 海洋学报, 2022, 44(1): 101-112. HAN P W, WANG Y, FANG Z, et al. Response of daily increment of statolith of neon flying squid (Ommastrephes bartramii) for different cohorts to marine environment in the North Pacific[J]. Haiyang Xuebao, 2022, 44(1): 101-112. |
| [8] |
马金, 刘必林, 陈新军, 等. 利用耳石鉴定头足类年龄与生长研究进展[J]. 海洋渔业, 2009, 31(3): 316-324. MA J, LIU B L, CHEN X J, et al. Advances on using statolith to study age and growth of cephalopod[J]. Marine Fisheries, 2009, 31(3): 316-324. |
| [9] |
薛薇, 李楠, 方舟. 剑尖枪乌贼个体生长年间差异及其影响因素[J]. 上海海洋大学学报, 2022, 31(3): 658-669. XUE W, LI N, FANG Z. Interannual variability of the swordtip squid (Uroteuthis edulis) and its relevant impact factors[J]. Journal of Shanghai Ocean University, 2022, 31(3): 658-669. |
| [10] |
YU W, CHEN X J, YI Q, et al. Influence of oceanic climate variability on stock level of western winter-spring cohort of Ommastrephes bartramii in the Northwest Pacific Ocean[J]. International Journal of Remote Sensing, 2016, 37(17): 3974-3994. DOI:10.1080/01431161.2016.1204477 |
| [11] |
张孝民, 朱清澄, 花传祥. 2013年北太平洋公海秋刀鱼渔场与海洋环境的关系[J]. 上海海洋大学学报, 2015, 24(5): 773-782. ZHANG X M, ZHU Q C, HUA C X. Fishing ground distribution of saury and its correlation with marine environment factors in the Northern Parcific high sea in 2013[J]. Journal of Shanghai Ocean University, 2015, 24(5): 773-782. |
| [12] |
FANG Z, LIU B L, CHEN X J, et al. Ontogenetic difference of beak elemental concentration and its possible application in migration reconstruction for Ommastrephes bartramii in the North Pacific Ocean[J]. Acta Oceanologica Sinica, 2019, 38(10): 43-52. |
| [13] |
乐可鑫, 蒋霞敏, 汪元, 等. 盐度对虎斑乌贼幼体生长与酶活的影响[J]. 热带海洋学报, 2015, 34(6): 64-72. LE K X, JIANG X M, WANG Y, et al. Salinity effects on growth and enzyme activity of juvenile Sepia pharaonis[J]. Journal of Tropical Oceanography, 2015, 34(6): 64-72. |
| [14] |
金岳, 李楠, 俞骏, 等. 基于耳石微化学的南海北部海域两种枪乌贼洄游路线初步研究[J]. 海洋与湖沼, 2021, 52(6): 1540-1548. JIN Y, LI N, YU J, et al. Preliminary study on the migration characteristic of two Loligo species in the northern South China Sea based on otolith microchemistry[J]. Oceanologia et Limnologia Sinica, 2021, 52(6): 1540-1548. |
| [15] |
ELLIS N, SMITH S J, PITCHER C R. Gradient forests: calculating importance gradients on physical predictors[J]. Ecology, 2012, 93(1): 156-168. |
| [16] |
SUN P, CHEN Q, FU C H, et al. Daily growth of young-of-the-year largehead hairtail (Trichiurus japonicus) in relation to environmental variables in the East China Sea[J]. Journal of Marine Systems, 2020, 201: 103243. |
| [17] |
LI N, WANG Y, FANG Z, et al. Relationships between daily growth of different groups of swordtip squid (Uroteuthis edulis) and environmental variables in the East China Sea[J]. Acta Oceanologica Sinica, 2022, 41(8): 52-61. |
| [18] |
YEMANE D, FIELD J G, LESLIE R W. Spatio-temporal patterns in the diversity of demersal fish communities off the south coast of South Africa[J]. Marine Biology, 2010, 157(2): 269-281. |
| [19] |
PLANQUE B, BELLIER E, LAZURE P. Modelling potential spawning habitat of sardine (Sardina pilchardus) and anchovy (Engraulis encrasicolus) in the Bay of Biscay[J]. Fisheries Oceanography, 2007, 16(1): 16-30. |
| [20] |
蔡研聪, 孙铭帅, 许友伟, 等. 南海北部近海头足类优势种及其生态位特征[J]. 应用生态学报, 2020, 31(8): 2793-2803. CAI Y C, SUN M S, XU Y W, et al. Dominant species of cephalopods and their niche characteristics in offshore of northern South China Sea[J]. Chinese Journal of Applied Ecology, 2020, 31(8): 2793-2803. |
| [21] |
WANG K Y, CHANG K Y, LIAO C H, et al. Growth strategies of the swordtip squid, Uroteuthis edulis, in response to environmental changes in the southern East China Sea-a cohort analysis[J]. Bulletin of Marine Science, 2013, 89(3): 677-698. |
| [22] |
JACKSON G D, DOMEIER M L. The effects of an extraordinary El Niño/La Niña event on the size and growth of the squid Loligo opalescens off southern California[J]. Marine Biology, 2003, 142(5): 925-935. |
| [23] |
BOUNKET B, GIBERT P, GENNOTTE V, et al. Otolith shape analysis and daily increment validation during ontogeny of larval and juvenile European chub Squalius cephalus[J]. Journal of Fish Biology, 2019, 95(2): 444-452. |
| [24] |
PECL G T, JACKSON G D. The potential impacts of climate change on inshore squid: biology, ecology and fisheries[J]. Reviews in Fish Biology and Fisheries, 2008, 18(4): 373-385. |
| [25] |
TAKAHARA H, KIDOKORO H, SAKURAI Y. High temperatures may halve the lifespan of the Japanese flying squid, Todarodes pacificus[J]. Journal of Natural History, 2017, 51(43/44): 2607-2614. |
| [26] |
YAMAGUCHI T, AKETAGAWA T, TAKAYAMA K, et al. Migratory routes of different sized swordtip squid (Uroteuthis edulis) caught in the Tsushima Strait[J]. Fisheries Research, 2019, 209: 24-31. |
| [27] |
ROSA R, SEIBEL B A. Synergistic effects of climate-related variables suggest future physiological impairment in a top oceanic predator[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(52): 20776-20780. |
| [28] |
BARORD G J, KEISTER K N, LEE P G. Determining the effects of stocking density and temperature on growth and food consumption in the pharaoh cuttlefish, Sepia pharaonis, Ehrenberg 1890[J]. Aquaculture International, 2010, 18(3): 271-283. |
| [29] |
文菁, 曹观蓉, 李施颖, 等. 环境因子对虎斑乌贼幼体存活率及行为的影响[J]. 水产科学, 2011, 30(6): 321-324. WEN J, CAO G R, LI S Y, et al. Effects of environmental factors on survival and behavior in juvenile cuttlefish Sepia pharaonis[J]. Fisheries Science, 2011, 30(6): 321-324. |
| [30] |
陈峰, 李楠, 方舟, 等. 浙江近岸海域春夏季剑尖枪乌贼栖息地分布变化规律[J]. 上海海洋大学学报, 2021, 30(5): 847-855. CHEN F, LI N, FANG Z, et al. Habitat distribution change pattern of Uroteuthis edulis during spring and summer in the coastal waters of Zhejiang Province[J]. Journal of Shanghai Ocean University, 2021, 30(5): 847-855. |
| [31] |
陈峰, 陈新军, 刘必林, 等. 西北太平洋柔鱼渔场与水温垂直结构关系[J]. 上海海洋大学学报, 2010, 19(4): 495-504. CHEN F, CHEN X J, LIU B L, et al. Relationship between fishing ground of Ommastrephes bartramii and vertical temperature structure in the northwestern Pacific Ocean[J]. Journal of Shanghai Ocean University, 2010, 19(4): 495-504. |
| [32] |
陈新军. 渔业资源与渔场学[M]. 北京: 海洋出版社, 2004: 29-212. CHEN X J. Fishery resources and fishery science[M]. Beijing: China Ocean Press, 2004: 29-212. |
| [33] |
王春琳, 吴丹华, 董天野, 等. 曼氏无针乌贼耗氧率及溶氧胁迫对其体内酶活力的影响[J]. 应用生态学报, 2008, 19(11): 2420-2427. WANG C L, WU D H, DONG T Y, et al. Oxygen consumption rate and effects of hypoxia stress on enzyme activities of Sepiella maindroni[J]. Chinese Journal of Applied Ecology, 2008, 19(11): 2420-2427. |
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, Shandong, China;
3. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
4. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
5. Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
6. Scientific Observing and Experimental Station of Oceanic Fishery Resources, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


