2. 上海海洋大学 水域环境生态上海高校工程研究中心, 上海 201306;
3. 上海海洋大学 水产与生命学院, 上海 201306;
4. 上海市奉贤区水产技术推广站, 上海 201419
浮游动物(Zooplankton)作为水生食物链的初级消费者,一定程度上能够有效调控浮游植物的群落结构,继而影响水体的初级生产力,是水域生态系统中的重要组成部分[1],在生态系统的物质循环、能量流动和信息传递过程中起到了至关重要的作用[2-3]。浮游动物是水环境质量评价的重要指示生物,其种类组成、优势种、密度及生物量等群落结构特征受水温、溶解氧、pH及氮磷等环境因子的制约,对水环境变化敏感[4-6]。对浮游动物的群落结构特征进行研究并分析其与环境因子的关系,可以客观反映水环境质量状况,预测其变化趋势[7]。
凡纳滨对虾(Litopenaeus vannamei),又称南美白对虾,是我国主要的对虾养殖品种[8-9]。养虾就是养水,养殖水环境的优劣直接影响对虾的生长[10]。不同养殖模式下,浮游动物群落结构与水质因子密切相关,养殖过程中浮游动物的多样性和群落结构会发生变化,继而影响对虾养殖。罗强等[11]研究了对虾工厂化养殖水体中浮游动物群落结构特征、演替规律及其与环境因素的关系,认为养殖过程中优势种由原生动物、轮虫、桡足类物种逐渐演变成单一的原生动物物种,温度、pH、营养盐等是影响浮游动物优势种演替的重要因素;李志斐等[12]研究发现,与凡纳滨对虾单养模式相比,混养鲮模式下能降低养殖水体总氮、总磷等含量,减少浮游生物数量,降低浮游动物多样性,促进养殖水体藻相稳定,有利于提高对虾产量;高欣等[13]研究发现,凡纳滨对虾高位养殖池塘叶绿素含量在养殖过程中呈现先上升后稳定的趋势,浮游动物以桡足类为主,pH、TN等是影响浮游动物优势种的主要驱动因子,养殖池中后期水质已处于富营养化状态,浮游生物群落不稳定;魏小岚等[14]研究认为循环水养殖系统对水中浮游动物多样性的影响是一种外界干扰影响,其规律为养殖前期浮游动物种类少、多样性低,中期多样性增高,后期又降低。这些研究多集中在养殖池塘内部,而对人工干预的养殖池塘与天然水体浮游动物群落结构差异的对比分析研究较少。
本文对凡纳滨对虾养殖池塘及外河道中的后生浮游动物进行了调查,比较分析人工养殖池塘与外河道天然水体中后生浮游动物的群落结构差异及其原因,并探究群落结构与环境因子之间的关系,以期为凡纳滨对虾的健康养殖和水生态系统平衡提供科学依据。
1 材料与方法 1.1 实验地点实验在上海市奉贤区某虾类养殖合作社(30°52′6.87″ N,121°22′52.96″ E)进行,合作社周围有农庄,靠近水源,共建有22个养殖池塘,分为露天养殖和大棚养殖。每个养殖池塘约占0.33 hm2,各配备4台叶轮式增氧机,平均水深1.5 m,养殖期间根据水位情况,进行补换水。凡纳滨对虾虾苗运抵后于2021年4月中旬开始第一茬养殖,每个养殖塘投放约25万尾虾,7月中旬出虾后再放入第二茬虾苗,10月底出虾,期间每天上午、下午各投喂一次饲料。选取其中的2、3、5号3个露天养殖塘以及养殖场外河道(引水河)上游3个点(图 1),进行采样。
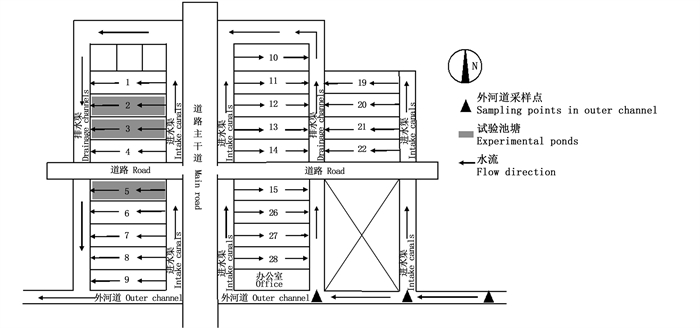
|
图 1 凡纳滨对虾养殖池塘及外河道采样点分布 Fig. 1 Distribution of Litopenaeus vannamei aquaculture ponds and outer channel sampling points |
样品采集:2021年5月上旬至10月上旬,每10天左右采集1次水样,共计16次。采样在8:00~10:00进行,现场测定WT、DO、pH,利用有机玻璃采水器在距离岸边约1 m,水面下约0.5 m处采集1 L水样,分装至广口塑料瓶保存,运回实验室,当天测完其他水质指标。
检测指标:按照《地表水和污水监测技术规范》(HJ/T 91——2002)中规定的方法,对WT、DO、pH、TN、TP、Chl.a、COD和SS等8个水质指标进行测定。
1.3 浮游生物检测参考《淡水浮游生物研究方法》[15]采集浮游生物样品,现场在1 L水样中加入15 mL鲁哥试剂固定,带回实验室静置24~48 h后浓缩至30 mL,在显微镜下多片计数后取平均值。浮游动物鉴定参照《中国淡水轮虫志》[16]、《中国动物志淡水枝角类》[17]和《中国动物志淡水桡足类》[18];浮游植物鉴定参照《中国淡水藻类》[19]。
1.4 数据处理与分析采用Jaccard相似性指数(K)比较养殖塘与外河道水体中后生浮游动物物种组成的相似性,计算公式如下:
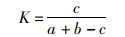 (1)
(1)
式中:a为养殖塘的物种数;b为外河道的物种数;c为养殖塘和外河道的共有物种数。当0≤K<0.25时,为极不相似;0.25≤K<0.50时,为轻度相似;0.50≤K<0.75时,为中等相似;0.75≤K<1时,为极相似; K=1时,为完全相似[20]。
采用Shannon-Wiener生物多样性指数(H’)、Gleason-Margalef物种丰富度指数(D)、优势度(Y)来分析浮游动物多样性结构特征[21],计算公式如下:
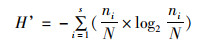 (2)
(2)
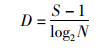 (3)
(3)
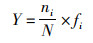 (4)
(4)
式中:N为各采样点所有物种总密度,ind./L;ni为第i种物种的总密度;fi为第i种物种在各采样点出现的频率;S为各采样点总物种数;优势度Y≥0.02时,即确定为浮游生物优势种。参照表 1[22]对水体污染状况进行评价。

|
表 1 浮游生物多样性指数评价标准 Tab.1 Evaluation criteria of plankton biodiversity index |
利用综合营养状态参数TLI(Σ) 进行水体富营养化评价[23],计算公式为
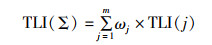 (5)
(5)
式中:ωj为第j种参数的营养状态参数的相关权重;TLI(j)为第j种参数的营养状态参数。以Chl.a作为基准参数,则可依据中国湖泊(水库)的Chl.a值,直接查找ωj值。评价分级标准见表 2。

|
表 2 综合营养状态指数分级标准 Tab.2 Crading standard of the comprehensive trophic level index |
采用Excel 2010和OriginPro统计分析软件进行公式计算及热图绘制;采用SPSS 19.0软件进行后生浮游动物与环境因子Pearson相关性分析;采用Canoco for Windows 4.5软件对后生浮游动物优势种密度进行去趋势对应分析(Detrended correspondence analysis,DCA),根据DCA分析结果的最大梯度长度值确定使用线性模型——冗余分析(Redundancy analysis,RDA),以揭示影响养殖池塘和外河道后生浮游动物群落差异的主要环境因子。
2 结果 2.1 后生浮游动物的群落结构 2.1.1 物种组成及优势种调查期间共鉴定出后生浮游动物33种(表 3),其中轮虫23种、枝角类6种、桡足类4种。均以小型轮虫为主,大型的浮游甲壳类动物(枝角类和桡足类)较少。养殖塘和外河道中均鉴定出后生浮游动物27种,其中养殖塘中轮虫种数(17种)低于外河道(18种),枝角类种数(6种)高于外河道(5种)。养殖塘与外河道中后生浮游动物的Jaccard相似性指数(K)为0.636,处于中等相似水平(0.50≤K < 0.75)。

|
表 3 后生浮游动物种类及优势度 Tab.3 Species and dominance of metazooplankton |
养殖塘和外河道中共鉴定出优势种6种(轮虫4种、枝角类1种和桡足类1种),共同优势种2种,为针簇多肢轮虫和广布中剑水蚤,养殖塘优势种数(6种)高于外河道(2种)。
2.1.2 密度和生物量从密度上看,养殖池塘5—6月以枝角类占主体,7月开始轮虫逐渐占优势(图 2),但总体上轮虫密度[(8 071.56±1 053.08)ind./L]最高,桡足类[(842.48±211.01)ind./L]最低;不同采样时间,养殖池塘中轮虫和枝角类密度差异显著(P < 0.05),桡足类差异不显著。在外河道中,枝角类密度[(205.94±43.94)ind./L]显著低于桡足类[(1 046.73±90.00)ind./L]和轮虫[(877.60±100.20)ind./L],7月以轮虫占主体,其他月份则主要以桡足类为主(图 3);不同采样时间轮虫、枝角类和桡足类密度差异均显著(P < 0.05)。图 4显示,外河道中后生浮游动物密度相对稳定,养殖塘中对虾养殖早期后生浮游动物密度低于养殖中后期,总体上养殖塘中后生浮游动物密度高于外河道。

|
图 2 养殖塘后生浮游动物密度百分比随时间的变化 Fig. 2 Temporal variation of metazooplankton density percentage in aquaculture ponds |
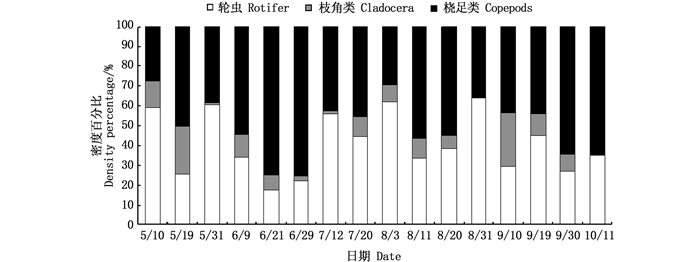
|
图 3 外河道后生浮游动物密度百分比随时间的变化 Fig. 3 Temporal variation of metazooplankton density percentage in outer channels |
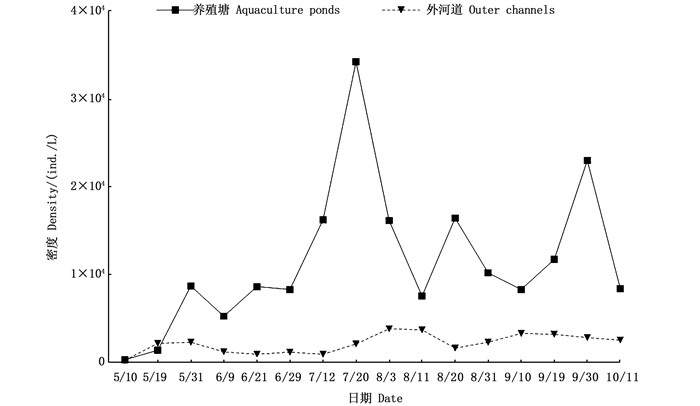
|
图 4 养殖塘和外河道中后生浮游动物密度随时间的变化 Fig. 4 Temporal variation of metazooplankton density in aquaculture ponds and outer channels |
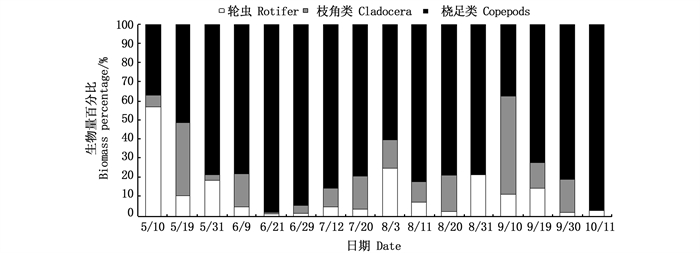
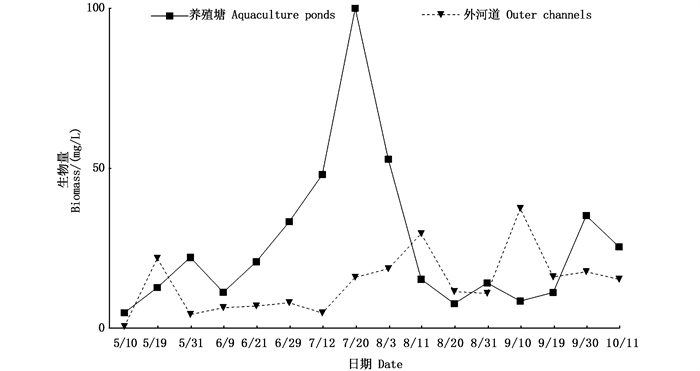
从生物量上看,养殖池塘5—6月以枝角类占主体,7—8月中旬以桡足类为主,8月下旬开始轮虫占优势(图 5),但总体上枝角类生物量[(9.77±1.78)mg/L]最高,轮虫[(7.55±0.92)mg/L]最低。在外河道中,桡足类生物量[(9.89±0.98)mg/L]显著高于枝角类[(2.86±0.77)mg/L]和轮虫[(1.32±0.30)mg/L],除了5月10日和9月10日分别以轮虫和枝角类占优势外,桡足类一直占主体(图 6)。不同采样时间,养殖池塘和外河道中轮虫、枝角类和桡足类的生物量差异均显著(P < 0.05)。养殖塘后生浮游动物生物量为4.9~100.2 mg/L,外河道后生浮游动物生物量为0.5~37.4 mg/L,总体上养殖塘中后生浮游动物生物量高于外河道(图 7)。

|
图 5 养殖塘后生浮游动物生物量百分比随时间的变化 Fig. 5 Temporal variation of metazooplankton biomass percentage in aquaculture ponds |
|
图 6 外河道后生浮游动物生物量百分比随时间的变化 Fig. 6 Temporal variation of metazooplankton biomass percentage in outer channels |
|
图 7 养殖塘和外河道中后生浮游动物生物量随时间的变化 Fig. 7 Temporal variation of metazooplankton biomass in aquaculture ponds and outer channels |
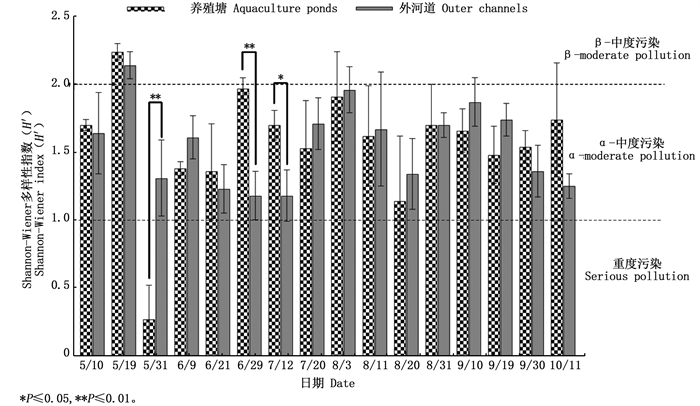
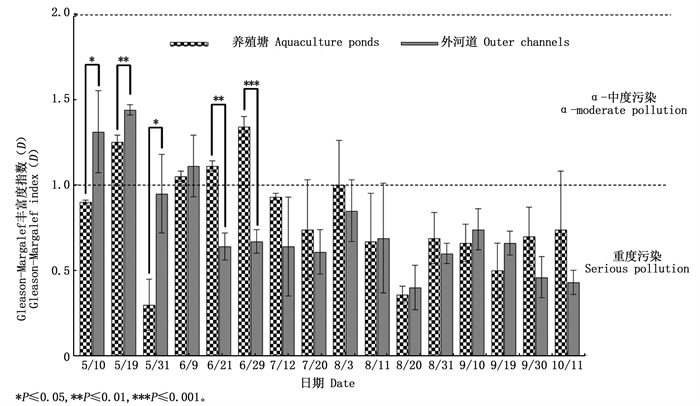
图 8显示,凡纳滨对虾养殖塘和外河道中Shannon-Wiener生物多样性指数(H’)变化范围分别为0.107~2.228和1.006~2.228,均值分别为1.56±0.48和1.55±0.34,均表现为α-中度污染;Gleason-Margalef物种丰富度指数(D)变化范围分别为0.214~1.411和0.278~1.558(图 9),均值分别为0.81±0.32和0.76±0.33,表现为重度污染,说明养殖塘和外河道的水环境质量均有待改善。ANOVA分析显示,除个别时间点外,总体上养殖塘和外河道中这两种指数均无显著性差异。
|
图 8 养殖塘和外河道中后生浮游动物Shannon-Wiener多样性指数随时间的变化 Fig. 8 Temporal variation of metazooplankton Shannon-Wiener diversity index in aquaculture ponds and outer channels |
|
图 9 养殖塘和外河道中后生浮游动物Gleason-Margalef丰富度指数随时间的变化 Fig. 9 Temporal variation of metazooplankton Gleason-Margalef richness index in aquaculture ponds and outer channels |
将养殖塘与外河道水质因子和浮游植物密度进行独立样本t检验,结果如表 4所示,养殖塘和外河道中浮游植物密度变化较大,除WT、pH和SS外,其他环境因子均存在显著性差异。其中养殖塘中TP和COD浓度显著高于外河道(P < 0.05),DO和TN浓度与浮游植物中的绿藻门、蓝藻门、硅藻门、隐藻门、裸藻门、甲藻门、黄藻门和金藻门密度极显著高于外河道(P < 0.01),而Chl.a含量则极显著低于外河道(P < 0.01)。

|
表 4 养殖塘与外河道环境因子(平均值±标准误) Tab.4 Environmental factors in aquaculture ponds and outer channels(Mean ± SE) |
依据湖泊(水库)营养状态评价标准[24],由TN、TP、Chl.a和COD等各单项指标可知,养殖塘与外河道均处于轻度富营养-中度富营养化水平。综合营养状态指数显示,养殖塘总体呈中度富营养化水平,外河道为轻度富营养化水平,两者间呈极显著差异。
2.2.2 后生浮游动物与环境因子的相关性分析对养殖塘后生浮游动物(轮虫、枝角类、桡足类)密度与水质指标、浮游植物(绿藻门、蓝藻门、硅藻门、隐藻门、裸藻门、甲藻门、黄藻门和金藻门)密度进行Pearson相关性分析(图 10),结果显示:后生浮游动物与WT、TN、TP、COD和浮游植物(隐藻门)具有相关性。其中,轮虫密度与TN呈显著正相关(P=0.033 < 0.05),与WT和COD呈极显著正相关(P < 0.01);枝角类密度与TP(P=0.017 < 0.05)和隐藻门(P=0.032 < 0.05)均呈显著正相关;桡足类密度与WT(P=0.034 < 0.05)呈显著正相关。
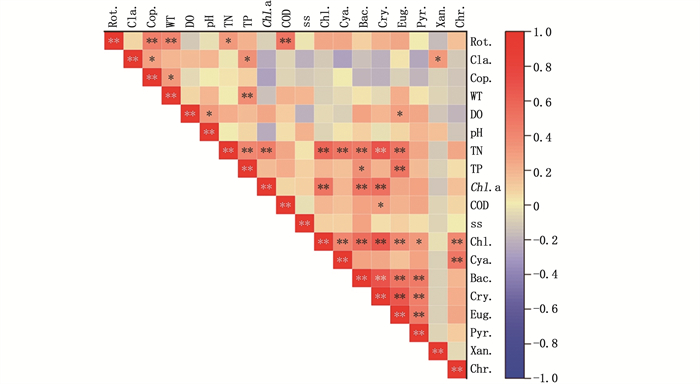
|
Rot.: 轮虫, Cla.: 枝角类, Cop.: 桡足类, Chl.: 绿藻门, Cya.: 蓝藻门, Bac.: 硅藻门, Cry.: 隐藻门, Eug.: 裸藻门, Pyr.: 甲藻门, Xan.: 黄藻门, Chr.: 金藻门; “**”表示极显著相关(P < 0.01), “*”表示显著性相关(P < 0.05); 下同。 Rot.: Rotifer, Cla.: Cladocera, Cop.: Copepods, Chl.: Chlorophyta, Cya.: Cyanophyta, Bac.: Bacillarrophyta, Cry.: Cryptophyta, Eug.: Euglenophyta, Pyr.: Pyrrophyta, Xan.: Xanthophyta, Chr.: Chrysophyta; "**" indicates extremely significant correlation(P < 0.01), "*" indicates significant correlation(P < 0.05); The same below. 图 10 养殖塘中后生浮游动物密度与环境因子的相关性 Fig. 10 Correlation between metazooplankton density and environmental factors in aquaculture ponds |
对外河道后生浮游动物(轮虫、枝角类、桡足类)密度与水质指标、浮游植物(绿藻门、蓝藻门、硅藻门、隐藻门、裸藻门、甲藻门和金藻门)密度进行Pearson相关性分析(图 11),结果显示:后生浮游动物与WT、DO、Chl.a、COD、SS和浮游植物(隐藻门、裸藻门和甲藻门)具有相关性。其中,轮虫密度与Chl.a呈显著负相关(P=0.012 < 0.05),与WT呈显著正相关(P=0.014 < 0.05),与浮游植物中的隐藻门、裸藻门和甲藻门密度呈极显著正相关(P < 0.01);枝角类密度与SS呈极显著正相关(P < 0.01);桡足类密度与COD呈显著负相关(P=0.028 < 0.05),与DO和Chl.a呈极显著负相关(P < 0.01)。

|
图 11 外河道中后生浮游动物密度与环境因子的相关性 Fig. 11 Correlation between metazooplankton density and environmental factors in outer channels |
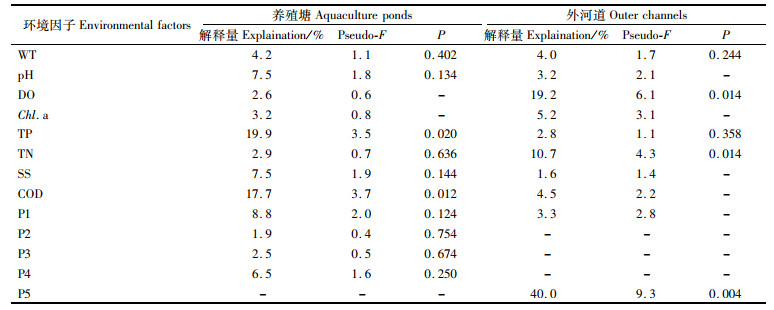
为了进一步探究凡纳滨对虾养殖塘环境因子对后生浮游动物的影响,将后生浮游动物优势种密度与8种水质因子及浮游植物优势属(小环藻属、菱形藻属、栅藻属和微囊藻属)进行RDA分析,结果显示,轴1和轴2的特征值分别为0.421和0.202,两轴累计解释物种变异的73.07%,表明轴1和轴2能很好地反映后生浮游动物与环境因子的关系。经蒙特卡罗检验后(表 5),TP和COD是影响后生浮游动物群落的显著因子(P < 0.05),解释量分别为19.9%、17.7%。其中,萼花臂尾轮虫、壶状臂尾轮虫、针簇多肢轮虫和暗小异尾轮虫与TP和COD均呈显著正相关;微型裸腹溞密度随着TP的增加而升高,随COD的升高而降低;广布中剑水蚤密度与TP呈正相关,与COD相关性较弱[图 12(a)]。
|
表 5 蒙特卡罗检验环境因子相关系数 Tab.5 Correlation coefficient of environmental factors by Monte Carlo test |

|
Z1: 萼花臂尾轮虫; Z2: 壶状臂尾轮虫; Z3: 针簇多肢轮虫; Z4: 暗小异尾轮虫; Z5: 微型裸腹溞; Z6: 广布中剑水蚤; P1: 小环藻属; P2: 菱形藻属; P3: 栅藻属; P4: 微囊藻属; P5: 隐藻属。 Z1: Brachionus calyciflorus; Z2: Brachionus urceus; Z3: Polyarthra trigla; Z4: Trichicerca pusilla; Z5: Moina micrura; Z6: Mesocyclops leuckarti; P1: Cyclotella; P2: Nitzschia; P3: Scenedesmus; P4: Microcystis; P5: Cryptomonas. 图 12 养殖塘及外河道中后生浮游动物密度与环境因子的RDA分析 Fig. 12 RDA analysis of metazooplankton density and environmental factors in aquaculture ponds and outer channels |
同理,为了进一步探究影响外河道后生浮游动物群落的影响因素,将后生浮游动物优势种密度与与8种水质因子及浮游植物优势属(小环藻属和隐藻属)进行RDA分析[图 12(b)],结果显示,轴1和轴2的特征值分别为0.576和0.369,两轴累计解释物种变异的100%,均能很好地反映后生浮游动物与环境因子的关系。蒙特卡罗检验表明,隐藻属、DO和TN是驱动外河道后生浮游动物群落的变化的主要环境因子(P < 0.05)(表 4)。其中,针簇多肢轮虫与隐藻属和TN呈正相关,与DO呈负相关;广布中剑水蚤与隐藻属、DO和TN均呈负相关。
3 讨论 3.1 后生浮游动物群落结构特征张韦等[25]研究发现,在主养凡纳滨对虾的池塘中,浮游动物主要以轮虫和枝角类为主,随着养殖的进行,枝角类和桡足类密度减少,7月末浮游动物种类达到最多,轮虫密度达到最大值。罗强等[11]在对虾工厂化养殖系统研究中发现,在整个养殖周期内,后生浮游动物主要以轮虫和桡足类居多,枝角类较少,养殖后期会出现一些耐污种类。本研究中凡纳滨对虾养殖期间,养殖塘后生浮游动物群落结构组成随对虾生长发生变化,养殖前期以大型浮游动物(尤其是枝角类)为主,轮虫种类数较少,而在养殖后期,轮虫种类数明显高于浮游甲壳类动物。究其原因主要是在养殖前期,幼虾的开口饵料是微藻、轮虫一类的小型浮游生物,随着时间变化,对虾个体增长,小型浮游生物的适口性降低,同时捕食大型浮游动物比例逐渐增加,使得养殖后期小型轮虫种类数大量增加。本研究发现,养殖塘和外河道中后生浮游动物均以小型轮虫为主,而大型的浮游甲壳类动物(枝角类和桡足类)相对较少,后生浮游动物的种类数、密度及生物量受轮虫影响最大,这与国内大多数淡水湖泊、水库和养殖塘等研究结果相似[26-28]。对鄱阳湖的研究发现,轮虫占鄱阳湖浮游动物总种类数的84%,总丰度的96%,是鄱阳湖浮游动物群落的绝对优势类群[3];对三峡库区干流浮游动物群落的调查发现,浮游动物小型化的现象从库尾到库首逐步明显[29];何京等[27]分析了在相同管理条件下,凡纳滨对虾养殖后期不同虾塘之间浮游生物种类组成、优势种群多样性之间的差异性及相关性,结果发现浮游生物与虾数量之间相互影响、相互制约,适宜的浮游生物密度有利于对虾产量的提高。
浮游动物运动能力弱,本实验中,尽管养殖塘与外河道水源相同,但水体流动程度不同,养殖塘相较于外河道天然流动水体来说较为封闭,流动性弱,且需要开设增氧机,投放饲料等化学品,人为干扰因素较多,这些都是导致其后生浮游动物群落结构与外河道产生差异的原因。本研究显示,养殖塘后生浮游动物总密度和优势种数均高于外河道,其中轮虫占绝对优势,这是由于养殖塘中残饵及粪便的分解会导致水中无机营养盐含量增高,为浮游植物生长提供了充足的营养,继而使浮游动物大量繁殖所致。有研究表明,随着氮磷营养盐浓度增加,轮虫种数和数目都增多,甲壳类的种类将减少,且轮虫因其独特的孤雌生殖方式,繁殖速度快,发育时间短,可以迅速适应复杂的水生态环境,形成优势类群[28]。当对虾数量较多时,大型浮游动物就会承受更大的捕食压力,致使其群落结构朝向小型化发展,轮虫等小型浮游动物逐渐演变成优势种群[21],这与本研究中养殖塘以轮虫优势种多,外河道优势种主要为浮游甲壳类动物结果一致。此外本研究中后生浮游动物生物量变化并不完全与密度变化一致,原因是密度与浮游动物个体数目有关,而生物量与浮游动物个体的大小有关。
3.2 后生浮游动物与环境因子的相关性本研究中,凡纳滨对虾养殖塘DO、TN、TP、COD浓度和浮游植物密度均显著高于外河道,且后生浮游动物密度和生物量总体上亦高于外河道。王超等[30]研究发现,养殖后期凡纳滨对虾单养池塘COD偏高,与本研究中随着养殖时间延长COD逐渐升高相一致。张韦等[25]则发现盐碱地凡纳滨对虾养殖过程中TN、TP呈先下降后上升趋势,养殖后期水质较前期有所改善,浮游生物种类丰富度有所提高,到后期趋于稳定,与本研究结果相一致。RDA排序结果显示,TP和COD是影响凡纳滨对虾养殖塘后生浮游动物群落结构的关键因子,这与其他学者的研究一致[11-12]。有研究表明,营养浓度变化是浮游动物群落结构时空变化的主要驱动因素[31],富营养化的水体中一般是耐污种类形成优势种群,本文也出现了类似结果,在营养程度较高的养殖塘中,萼花臂尾轮虫与壶状臂尾轮虫这类耐污染性强的α-中污染指示种占优,而营养程度相对较低的外河道中,针簇多肢轮虫这类耐污性相对弱一点的β-中污染指示种占优势。
不同水体环境下,影响浮游动物群落结构的主要环境因子有所差异。调查结果显示,外河道后生浮游动物优势种主要由轮虫中的针簇多肢轮虫和桡足类中的广布中剑水蚤组成,且主要受到浮游植物中的隐藻属、DO和TN的影响。浮游植物是浮游动物重要的食物来源之一,Pearson相关性分析显示,轮虫密度与浮游植物中的隐藻门、裸藻门和甲藻门密度呈极显著正相关,这可能是因为多数情况下轮虫偏食绿藻和硅藻,进而减少了隐藻、裸藻等的竞争压力[32]。一般情况下,轮虫密度与Chl.a含量呈正相关[33],但本实验中轮虫密度与Chl.a呈显著负相关,这与都雪等[34]的研究一致,可能是因为藻类的过度繁殖增加了水体有机物的呼吸作用,同时死亡藻类的分解作用也会降低水体溶解氧含量,通过影响其他水质因子变化,进而影响轮虫的群落结构[35]。水体中的N、P营养盐浓度一般通过影响浮游植物群落,从而间接影响浮游动物群落分布[36-39]。聂雪等[40]研究发现,氮水平升高使得水体的营养化水平提高,造成浮游植物大量繁殖,浮游植物及其分解后的碎屑可以为浮游动物提供更为丰富的食物来源,从而促进浮游动物的生长繁殖;计勇等[41]研究发现赣江中下游水质处于中营养至富营养状况,浮游动物密度与TN、TP等因子成正相关;随着氮磷营养盐含量的改变,水中的养分极大地影响浮游植物的分布,刺激浮游植物密度和生物量的增加[42],浮游动物密度和生物量随之增加。LI等[43]对太湖浮游生物的研究也表明,硝氮和氨氮是影响浮游动物分布的重要指标,与本研究天然水体外河道中针簇多肢轮虫密度与隐藻属和TN呈正相关结果相一致。此外,水体富营养化和水温升高均会导致水体DO含量降低,低氧环境会对水生态系统结构和功能的稳定产生重要影响[44-45]。本研究中RDA分析表明,天然水体外河道中后生浮游动物优势种密度与DO呈显著负相关,与郭坤等[32]认为春夏季节湖北长湖大部分优势种密度与DO呈负相关结果相一致。已有研究表明,低氧环境下捕食者与被捕食者都将迁移至有限的高氧环境中,致使被捕食者的数量逐渐降低[44],从而使浮游动物群落结构发生变化。
总体来说,受人为活动干扰的养殖塘后生浮游动物群落结构特征变化主要受到水质因子(TP和COD)的影响,而天然水体外河道后生浮游动物群落结构主要受生物因素(浮游植物中的隐藻属)和水质因子(DO和TN)共同影响。
| [1] |
RASHID C P, JYOTHIBABU R, ARUNPANDI N, et al. Microplastics in zooplankton in the eastern Arabian Sea: The threats they pose to fish and corals favoured by coastal currents[J]. Marine Pollution Bulletin, 2021, 173: 113042-113055. DOI:10.1016/j.marpolbul.2021.113042 |
| [2] |
ZHAO W T, DAI L L, CHEN X C, et al. Characteristics of zooplankton community structure and its relationship with environmental factors in the South Yellow Sea[J]. Marine Pollution Bulletin, 2022, 176: 113471-113481. DOI:10.1016/j.marpolbul.2022.113471 |
| [3] |
陈佳琪, 赵坤, 曹玥, 等. 鄱阳湖浮游动物群落结构及其与环境因子的关系[J]. 生态学报, 2020, 40(18): 6644-6658. CHEN J Q, ZHAO K, CAO Y, et al. Zooplankton community structure and its relationship with environmental factors in Poyang Lake[J]. Acta Ecologica Sinica, 2020, 40(18): 6644-6658. |
| [4] |
SHI Y Q, SUN S, LI C L, et al. Changes in the population structure of Calanus sinicus during summer-autumn in the southern Yellow Sea[J]. Acta Oceanologica Sinica, 2019, 38(8): 56-63. DOI:10.1007/s13131-019-1435-1 |
| [5] |
周绪申, 李娜, 孙博闻, 等. 白洋淀浮游生物群落结构的季节变化及其与环境因子的关系[J]. 水利水电技术, 2021, 52(8): 110-119. ZHOU X S, LI N, SUN B W, et al. Seasonal variation of plankton community structure in the Lake Baiyangdian and the relationship with environmental factors[J]. Water Resources and Hydropower Engineering, 2021, 52(8): 110-119. DOI:10.13928/j.cnki.wrahe.2021.08.011 |
| [6] |
张兆衡, 杨薇, 张子玥, 等. 渤海兴城-觉华岛海域海草床典型生物群落特征及其关键环境因子识别[J]. 北京师范大学学报(自然科学版), 2022, 58(1): 90-98. ZHANG Z H, YANG W, ZHANG Z Y, et al. Characteristics of typical biological communities and identification of key environmental factors in the seagrass bed of Xingcheng-Juehua Island, Bohai Sea[J]. Journal of Beijing Normal University (Natural Science), 2022, 58(1): 90-98. |
| [7] |
HUO Y Z, SUN S, ZHANG F, et al. Biomass and estimated production properties of size-fractionated zooplankton in the Yellow Sea, China[J]. Journal of Marine Systems, 2012, 94: 1-8. DOI:10.1016/j.jmarsys.2011.09.013 |
| [8] |
WEI M C, LIN Y T, CHEN K Y, et al. Study on feeding activity of Litopenaeus vannamei based on passive acoustic detection[J]. IEEE Access, 2020, 8: 156654-156662. DOI:10.1109/ACCESS.2020.3019529 |
| [9] |
FENG Z F, DONG W X, BU F, et al. Influence of dietary n-3 polyunsaturated fatty acids (PUFAs) on growth, PUFA composition and the expression of FAD6 and ELOV5 in pacific white shrimp (Litopenaeus vannamei)[J]. Aquaculture Research, 2021, 52(4): 1666-1676. DOI:10.1111/are.15019 |
| [10] |
孙世玉, 江敏, 金若晨, 等. 凡纳滨对虾池塘养殖过程中水质与虾虹彩病毒病发生的相关性[J]. 上海海洋大学学报, 2020, 29(5): 641-649. SUN S Y, JIANG M, JIN R C, et al. Correlation between water quality and shrimp hemocyte iridescent virus disease occurrence of Litopenaeus vannamei in ponds[J]. Journal of Shanghai Ocean University, 2020, 29(5): 641-649. |
| [11] |
罗强, 李健, 常志强, 等. 对虾工厂化养殖中浮游动物群落结构的变化规律[J]. 渔业科学进展, 2020, 41(2): 131-139. LUO Q, LI J, CHANG Z Q, et al. Changes in zooplankton community structure in industrial shrimp farming ponds[J]. Progress in Fishery Sciences, 2020, 41(2): 131-139. |
| [12] |
李志斐, 李家磊, 王金林, 等. 混养鲮对凡纳滨对虾养殖池塘浮游生物群落结构的影响[J]. 河南农业科学, 2018, 47(1): 126-133. LI Z F, LI J L, WANG J L, et al. Effects of ployculture with Cirrhinus molitorella on plankton community in intensive shrimp (Litopenaeus vannamei) farming pond[J]. Journal of Henan Agricultural Sciences, 2018, 47(1): 126-133. |
| [13] |
高欣, 景泓杰, 赵文, 等. 凡纳滨对虾高位养殖池塘浮游生物群落结构及水质特征[J]. 大连海洋大学学报, 2017, 32(1): 44-50. GAO X, JING H J, ZHAO W, et al. Community structure of plankton and water quality in marine high-place ponds with Pacific white leg shrimp Litopenaeus vannamei culture[J]. Journal of Dalian Ocean University, 2017, 32(1): 44-50. |
| [14] |
魏小岚, 李纯厚, 颉晓勇, 等. 对虾高位池循环水养殖水体浮游动物生态特征研究[J]. 农业环境科学学报, 2013, 32(1): 141-152. WEI X L, LI C H, XIE X Y, et al. Ecological characteristics of zooplankton in the higher place pond of shrimp recirculating aquaculture system[J]. Journal of Agro-Environment Science, 2013, 32(1): 141-152. |
| [15] |
章宗涉, 黄祥飞. 淡水浮游生物研究方法[M]. 北京: 科学出版社, 1991. ZHANG Z S, HUANG X F. Methods for the study on freshwater plankton[M]. Beijing: Science Press, 1991. |
| [16] |
王家楫. 中国淡水轮虫志[M]. 北京: 科学出版社, 1961. WANG J J. Freshwater rotifers fauna in China[M]. Beijing: Science Press, 1961. |
| [17] |
蒋燮治, 堵南山. 中国动物志·节肢动物门·甲壳纲·淡水枝角类[M]. 北京: 科学出版社, 1979. JIANG X Z, DU N S. Fauna sinica: crustacea: freshwater cladocera[M]. Beijing: Science Press, 1979. |
| [18] |
中国科学院动物研究所甲壳动物研究组. 中国动物志·节肢动物门·甲壳纲·淡水桡足类[M]. 北京: 科学出版社, 1979. Research Group of Carcinology, Institute of zoology, Academia sinica. fauna sinica: crustacea: freshwater copepoda[M]. Beijing: Science Press, 1979. |
| [19] |
胡鸿钧. 中国淡水藻类[M]. 上海: 上海科学技术出版社, 1980. HU H J. Freshwater algae in China[M]. Shanghai: Shanghai Science and Technology Press, 1980. |
| [20] |
申利亚, 赵丹, 马婕, 等. 上海青草沙水库生态护坡区浮游植物的群落结构[J]. 上海海洋大学学报, 2022, 31(2): 400-410. SHEN L Y, ZHAO D, MA J, et al. Phytoplankton community structure of ecological slope protection area of Shanghai Qingcaosha reservoir[J]. Journal of Shanghai Ocean University, 2022, 31(2): 400-410. |
| [21] |
张广帅, 吴婷婷, 闫吉顺, 等. 鸭绿江口近岸海域水质环境对冬季浮游动物群落结构的影响[J]. 生态学报, 2022, 42(1): 390-399. ZAHNG G S, WU T T, YAN J S, et al. Effects of the sea water environmental factors on zooplankton community nearshore of the Yalu River estuary in winter[J]. Acta Ecologica Sinica, 2022, 42(1): 390-399. |
| [22] |
徐雪, 姚文佳, 邢雨辉, 等. 苏州工业园区湖泊后生浮游动物群落结构及影响因子[J]. 生态学报, 2021, 41(10): 4023-4035. XU X, YAO W J, XING Y H, et al. Characteristics and influencing factors of metazoan zooplankton community structure in lakes of Suzhou Industrial Park[J]. Acta Ecologica Sinica, 2021, 41(10): 4023-4035. |
| [23] |
王明翠, 刘雪芹, 张建辉. 湖泊富营养化评价方法及分级标准[J]. 中国环境监测, 2002, 18(5): 47-49. WANG M C, LIU X Q, ZHANG J H. Evaluate method and classification standard on lake eutrophication[J]. Environmental Monitoring in China, 2002, 18(5): 47-49. |
| [24] |
金相灿, 屠清瑛. 湖泊富营养化调查规范[M]. 2版. 北京: 中国环境出版社, 1990. JIN X C, TU Q Y. Lake eutrophication survey specification[M]. 2nd ed. Beijing: China Environmental Press, 1990. |
| [25] |
张韦, 吴会民, 蔡超, 等. 主养凡纳滨对虾池塘水体理化因子及浮游生物变化特征[J]. 经济动物学报, 2019, 23(1): 29-35, 43. ZHANG W, WU H M, CAI C, et al. The physical-chemical factors and plankton properties of water in Litopenaeus vannamei dominated pond[J]. Journal of Economic Animal, 2019, 23(1): 29-35, 43. |
| [26] |
严航, 夏霆, 陈宇飞, 等. 太湖流域平水期水生态功能区浮游动物群落结构特征[J]. 长江流域资源与环境, 2021, 30(11): 2641-2650. YAN H, XIA T, CHEN Y F, et al. Analysis on structure characteristics of zooplankton community in water ecological function zones of Taihu Basin during normal season[J]. Resources and Environment in the Yangtze Basin, 2021, 30(11): 2641-2650. |
| [27] |
何京, 陈晨, 王一农, 等. 凡纳滨对虾设施养殖池塘浮游生物群落结构及多样性研究[J]. 生物学杂志, 2015, 32(3): 58-62, 67. HE J, CHEN C, WANG Y N, et al. Community structure and biodiversity of plankton in Litopenaeus vannamei culture pond[J]. Journal of Biology, 2015, 32(3): 58-62, 67. |
| [28] |
刘同琳, 陈皓若, 洪陈聪, 等. 苏州城区河道后生浮游动物群落结构与环境因子的关系[J]. 动物学杂志, 2021, 56(5): 674-685. LIU T L, CHEN H R, HONG C C, et al. Relationship between metazooplankton community structure and environmental factors in Suzhou Urban River[J]. Chinese Journal of Zoology, 2021, 56(5): 674-685. |
| [29] |
吴利, 唐会元, 龚云, 等. 三峡水库正常运行下库区干流浮游动物群落特征研究[J]. 水生态学杂志, 2021, 42(1): 58-65. WU L, TANG H Y, GONG Y, et al. Temporal-spatial distribution of zooplankton community in the main stem of three gorges reservoir under normal operation[J]. Journal of Hydroecology, 2021, 42(1): 58-65. |
| [30] |
王超, 蔺凌云, 尹文林, 等. 三种凡纳滨对虾池塘养殖模式环境因子变化和养殖效益的分析[J]. 海洋湖沼通报, 2018(3): 169-174. WANG C, LIN L Y, YIN W L, et al. Environmental factor and culture benefit analyses of three traditional Litopenaeus vannamei pond production models[J]. Transactions of Oceanology and Limnology, 2018(3): 169-174. |
| [31] |
刘振中, 赵文倩, 郭文莉, 等. 芡实分区刈割试验对陈瑶湖后生浮游动物群落结构的影响[J]. 生态学报, 2022, 42(1): 400-409. LIU Z Z, ZHAO W Q, GUO W L, et al. Effects of mowing experiment in different channel areas on metazooplankton community structure in Chenyao Lake[J]. Acta Ecologica Sinica, 2022, 42(1): 400-409. |
| [32] |
郭坤, 彭婷, 罗静波, 等. 长湖浮游动物群落结构及其与环境因子的关系[J]. 海洋与湖沼, 2017, 48(1): 40-49. GUO K, PENG T, LUO J B, et al. Community structure of zooplankton and the driving physicochemical factors in Changhu Lake[J]. Oceanologia et Limnologia Sinica, 2017, 48(1): 40-49. |
| [33] |
杨威, 张婷婷, 孙雨琛, 等. 淮北采煤塌陷区两个小型湖泊轮虫的群落结构特征[J]. 水资源保护, 2020, 36(1): 82-88, 96. YANG W, ZHANG T T, SUN Y C, et al. Community structure of rotifer in two small lakes of Huaibei excavating coal subsidence region[J]. Water Resources Protection, 2020, 36(1): 82-88, 96. |
| [34] |
都雪, 王齐东, 张超文, 等. 洪泽湖轮虫群落结构及其与环境因子的关系[J]. 湖泊科学, 2014, 26(2): 269-276. DU X, WANG Q D, ZHANG C W, et al. Community structure of rotifers in relation to environmental factors in Lake Hongze[J]. Journal of Lake Sciences, 2014, 26(2): 269-276. |
| [35] |
胡菊香, 吴生桂, 陈金生, 等. 巢湖富营养化对轮虫的影响研究[J]. 环境科学与技术, 2007, 30(12): 16-18, 68, 118. HU J X, WU S G, CHEN J S, et al. Effect of eutrophication on rotifers in Chaohu Lake[J]. Environmental Science & Technology, 2007, 30(12): 16-18, 68, 118. |
| [36] |
ARAUZO M. Harmful effects of un-ionised ammonia on the zooplankton community in a deep waste treatment pond[J]. Water Research, 2003, 37(5): 1048-1054. |
| [37] |
KIR M, SUNAR M C. Acute toxicity of ammonia and nitrite to sea bream, Sparus aurata (Linnaeus, 1758), in relation to salinity[J]. Journal of the World Aquaculture Society, 2018, 49(3): 516-522. |
| [38] |
RÍOS-ARANA J V, AGVERO-REYES L D C, WALLACE R L, et al. Limnological characteristics and rotifer community composition of Northern Mexico Chihuahuan Desert Springs[J]. Journal of Arid Environments, 2019, 160: 32-41. |
| [39] |
MARTINS J, OLIVA TELES L, VASCONCELOS V. Assays with Daphnia magna and Danio rerio as alert systems in aquatic toxicology[J]. Environment International, 2007, 33(3): 414-425. |
| [40] |
聂雪, 胡旭仁, 刘观华, 等. 鄱阳湖子湖"堑秋湖"过程中水位变化对浮游动物群落结构的影响[J]. 水生生物学报, 2019, 43(2): 402-414. NIE X, HU X R, LIU G H, et al. Effects of water level on zooplankton community during "Plate-Shaped Lake enclosed in autumn" in a Sub-Lake of the Poyang Lake[J]. Acta Hydrobiologica Sinica, 2019, 43(2): 402-414. |
| [41] |
计勇, 张洁, 孙晓秋, 等. 赣江中下游浮游动物时空分布特征及水质综合评价[J]. 河海大学学报(自然科学版), 2012, 40(5): 509-513. JI Y, ZHANG J, SUN X Q, et al. Spatio-temporal distribution characteristics of zooplankton and water quality assessment in middle and lower reaches of Ganjiang River[J]. Journal of Hohai University (Natural Sciences), 2012, 40(5): 509-513. |
| [42] |
GOGOI P, DAS S K, SARKAR S D, et al. Environmental factors driving phytoplankton assemblage pattern and diversity: insights from Sundarban eco-region, India[J]. Ecohydrology & Hydrobiology, 2021, 21(2): 354-367. |
| [43] |
LI C C, FENG W Y, CHEN H Y, et al. Temporal variation in zooplankton and phytoplankton community species composition and the affecting factors in Lake Taihu-a large freshwater lake in China[J]. Environmental Pollution, 2019, 245: 1050-1057. |
| [44] |
KEISTER J E, WINANS A K, HERRMANN B. Zooplankton community response to seasonal hypoxia: a test of three hypotheses[J]. Diversity, 2020, 12(1): 21-36. |
| [45] |
SLATER W L, PIERSON J J, DECKER M B, et al. Fewer copepods, fewer anchovies, and more jellyfish: how does hypoxia impact the Chesapeake bay zooplankton community?[J]. Diversity, 2020, 12(1): 35-60. |
2. Shanghai University Engineering Research Center for Water Environment Ecology, Shanghai Ocean University, Shanghai 201306, China;
3. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
4. Shanghai Fengxian District Aquatic Technology Promotion Station, Shanghai 201419, China
 2022,
Vol. 31
2022,
Vol. 31


