2. 国家远洋渔业工程技术研究中心,上海 201306;
3. 自然资源部海洋生态监测与修复技术重点实验室,上海 201306;
4. 大洋渔业资源可持续开发教育部重点实验室,上海 201306
凤鲚(Coilia mystus)俗称凤尾鱼、烤籽鱼、籽鲚,隶属鲱形目(Clupeiformes)鳀科(Engraulidae)[1],在我国沿海各地、朝鲜海域、日本海域及印度尼西亚沿海均有分布[2]。凤鲚曾是长江口五大渔业目标种之一[3],其渔获量在20世纪80年代时曾一度占据长江口鱼虾类总产量的48.6%[4]。
繁殖力和产卵分数是运用日产卵量方法(daily egg production method, DEPM)定量估计鱼类产卵群体生物量的两个重要参数[5]。繁殖力能够在一定程度上反映物种的生存能力及种群繁殖模式,其判断标准是怀卵量和产卵量[6]。凤鲚作为一种小型中上层鱼类,其繁殖力表现出很大的个体差异和年间差异。例如,2006—2007年长江口凤鲚的绝对繁殖力为3 093~36 786粒,不同个体之间的绝对繁殖力相差十几倍[7]。不同年份的长江口凤鲚绝对繁殖力也显示出很大的差异,如2012年凤鲚绝对繁殖力为7 338粒,1997—2003年为13 805粒[8-9]。产卵分数即每天产卵或即将产卵的雌性个体数量占雌性个体总数量的百分比,其倒数为繁殖频率。估算产卵分数常用方法主要包括产后滤泡法(postovulatory follicles method)和核移位法(migratory nucleus method)等[5],目前国内还未见凤鲚产卵分数相关的研究报道。
在长江大保护的大背景下,本文利用2018年5—7月和2019年5月及8月的长江口渔业资源调查数据,开展长江口凤鲚的个体繁殖力及其与体长、体质量、净体质量、性腺质量、肥满度、性腺指数等生物学指标关系的相关研究,并首次估算了长江口凤鲚的产卵分数,为长江口凤鲚渔业资源的养护和制定管理策略提供依据。
1 材料与方法2018年5—7月及2019年5月和8月在长江口水域(图 1)利用定置刺网对凤鲚产卵群体进行采集。每个站点按照总渔获物的10%进行随机取样,共采集凤鲚样品509尾,利用游标卡尺(精确到0.1 mm)测量凤鲚样品的全长、体长,利用电子天平称量其体质量(精确到0.01 g),将凤鲚解剖后称量净体质量、性腺质量,并取其耳石置于离心管中并加入体积分数为95%的乙醇溶液保存。对采集到的凤鲚耳石进行研磨切割,利用Olympus SZX6显微镜进行拍照观察,鉴定凤鲚的年龄。
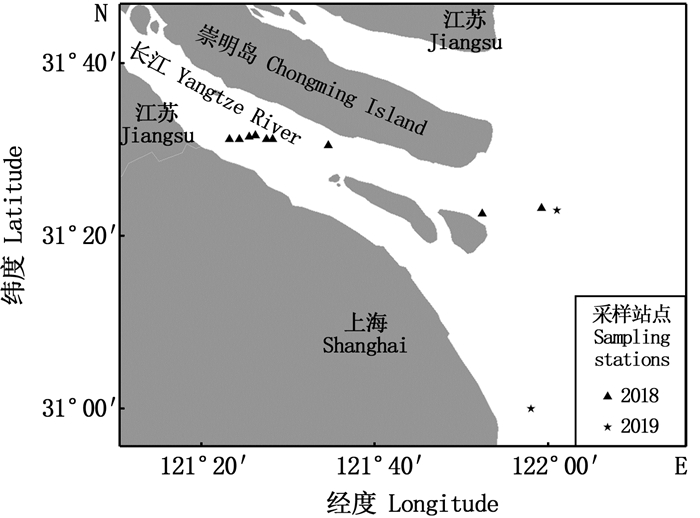
|
图 1 2018—2019年长江口凤鲚采样位置图 Fig. 1 Sampling stations of C.mystus in the Yangtze River Estuary from 2018 to 2019 |
从采集样品中选取凤鲚雌性个体297尾,雄性个体81尾,按照《鱼类生态学》上性腺分期标准[10],将凤鲚性腺的成熟程度划分为6个时期,判断凤鲚性腺的发育状况。并从凤鲚卵巢的前中后部各取约0.1 g样品混合均匀,用微量天平(精确到0.01 g)进行称量质量,使用5%的甲醛溶液对凤鲚样品进行固定,在Olympus SZX6显微镜下观察测定凤鲚样品的卵粒数目,计算凤鲚个体的绝对繁殖力,进一步计算凤鲚的相对繁殖力。从性腺发育Ⅲ~Ⅴ期的凤鲚雌性个体中随机选取30尾,每尾随机测定30粒卵用于计算凤鲚的卵径。对发育达到Ⅴ期的凤鲚卵巢进行切片分析,使用Olympus SZX6显微镜观察和记录出现核移位卵凤鲚的数目和比例,计算产卵分数。性腺指数(gonadosomatic index,GSI)、肥满度(K)、体长相对繁殖力(FL)以及体质量相对繁殖力(FW)计算公式如下:
 (1)
(1)
 (2)
(2)
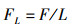 (3)
(3)
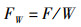 (4)
(4)
式中:IGSI为性腺指数GSI;W1为卵巢质量或精巢质量,g;W0为净体质量,g;L为体长,mm;F为绝对繁殖力,粒;W凤鲚体质量,g。
所有实验数据均采用Microsoft Excel 2016进行处理和绘图,数据分析及检验均采用SPSS 25.0。卡方检验用来检验雌雄凤鲚之间体长、体质量、净体质量、性腺质量、肥满度和性腺指数的显著性。F检验用来检验凤鲚繁殖力(绝对繁殖力、体长相对繁殖力、体质量相对繁殖力)同体长、体质量、净体质量、性腺质量、肥满度和性腺指数的显著性。采用指数、对数、线性等多个函数模型对凤鲚繁殖力同体长、体质量、净体质量和性腺质量进行回归,从中选取R2最大和AIC值最小的拟合模型作为最适模型。采用逐步回归分析建立凤鲚繁殖力与各生物指标的最优模型。以上检验显著性均取P < 0.05。
2 结果 2.1 生物学指标对2018和2019年的凤鲚样品生物学指标(体长、体质量、净体质量、性腺质量、肥满度和性腺指数)的测量结果如表 1所示。雌性个体的体长、体质量、性腺质量以及性腺指数均大于凤鲚雄性个体,但肥满度低于雄性个体。雌性和雄性凤鲚的体长、体质量以及性腺质量之间存在显著差异(P < 0.05)。
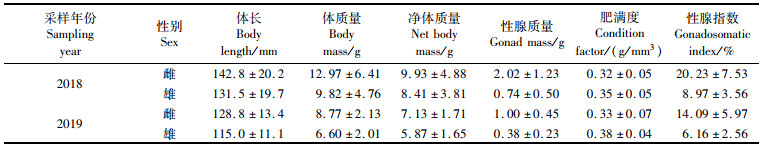
|
表 1 凤鲚的生物学指标 Tab.1 Biological indicators of C. mystus |
肥满度可以反映鱼类的生长状况[12],图 2是凤鲚雌性个体的肥满度随着时间和性腺成熟度的动态变化情况。随着时间的推移,凤鲚雌性个体的肥满度呈现下降趋势,不同月份之间肥满度存在显著差异(P < 0.05)。在Ⅱ~Ⅴ期,凤鲚个体肥满度随性腺的发育较为稳定,但在Ⅵ期产卵之后,肥满度下降。

|
图 2 不同月份和性腺成熟度的凤鲚雌性个体的肥满度变化 Fig. 2 Condition factors of female C.mystus by different sampling months and maturity stages |
凤鲚雌性个体性腺指数随月份和性腺成熟度的变化情况如图 3所示。经F检验,其性腺指数与时间无显著相关性(P>0.05)。性腺成熟度Ⅱ~Ⅴ期,性腺指数不断升高,Ⅴ~Ⅵ期时,性腺指数有所下降,凤鲚雌性个体的性腺指数与性腺成熟度存在显著相关性(P < 0.05)。

|
图 3 不同月份和性腺成熟度的凤鲚雌性个体性腺指数变化情况 Fig. 3 Gonadosomatic index of female C.mystus by different sampling months and maturity stages |
2018和2019年的凤鲚卵径频率分布情况如图 4所示。经计算,凤鲚的卵径为0.55~0.95 mm,均值为(0.70±0.09)mm。其中,2018年卵径均值为(0.68±0.05)mm,2019年为(0.70±0.03)mm,其中卵径为0.65~0.75 mm的个体占比约70%。
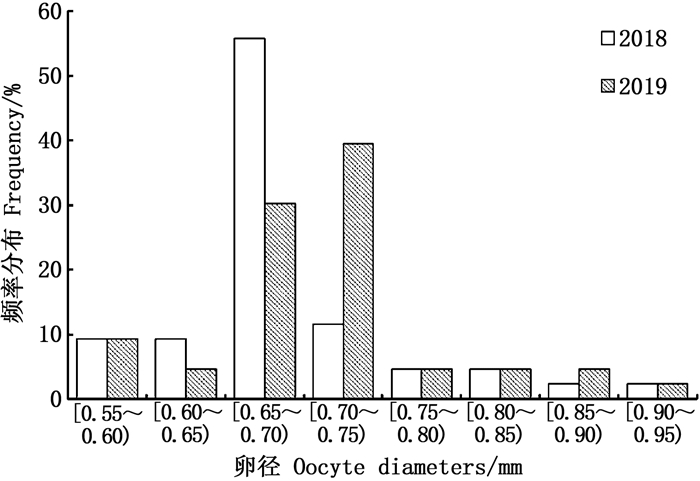
|
图 4 凤鲚卵径分布图 Fig. 4 Distribution of oocyte diameters of C. mystus |
2018年凤鲚的绝对繁殖力为1 869~34 908粒,均值为(1 1621±6 526)粒,2019年凤鲚的绝对繁殖力为1 958~11 760粒,均值为(6 131±2 585)粒;2018年体长相对繁殖力为15~189粒/mm,均值为(77±34)粒/mm,2019年体长相对繁殖力为16~96粒/mm,均值为(47±19)粒/mm;2018年体质量相对繁殖力为165~1 347粒/g,均值为(848±241)粒/g,2019年体质量相对繁殖力为254~1 439粒/g,均值为(700±269)粒/g。由表 2可知,随着凤鲚产卵群体年龄的增长,绝对繁殖力也不断地增大,不同世代凤鲚之间的绝对繁殖力、体长相对繁殖力差异显著(P < 0.05),而体质量相对繁殖力无明显差异(P>0.05)。

|
表 2 不同年龄组凤鲚的个体繁殖力 Tab.2 Fecundity of C. mystus in different age |
长江口凤鲚绝对繁殖力(F)与体长(L)、体质量(W)、净体质量(W0)和卵巢质量(W1)的关系如图 5所示。采用SPSS做线性回归分析并选取最优拟合方程,凤鲚雌性个体绝对繁殖力与体长的线性回归方程为F=217.59L-20 875(R2=0.55)、与体质量的线性回归方程为F=785.44W-28.81(R2= 0.67)、与净体质量的线性回归方程为F=998.24W0+62.62(R2=0.61)、与卵巢质量的线性回归方程为F=4 436.50W1+2 142.90(R2=0.84)。

|
图 5 凤鲚绝对繁殖力与生物学指标的关系 Fig. 5 Relationship between the individual absolute fecundity and biological indices of C. mystus |
长江口凤鲚体长相对繁殖力(FL)与体长(L)、体质量(W)、净体质量(W0)和卵巢质量(W1)的关系如图 6所示。凤鲚的体长相对繁殖力均随着体长、体质量、净体质量和卵巢质量的增加而增大,并呈线性正相关,其中凤鲚的体长相对繁殖力与卵巢质量的相关程度最高。凤鲚体长相对繁殖力与体长的线性拟合方程为FL=0.96L-68.76(R2=0.38)、与体质量的线性拟合方程为FL=3.65W+21.09(R2=0.51)、与净体质量的线性拟合方程为FL=4.53W0+22.55(R2=0.44)、与卵巢质量的线性拟合方程为FL=22.57W1+27.84(R2=0.76)。
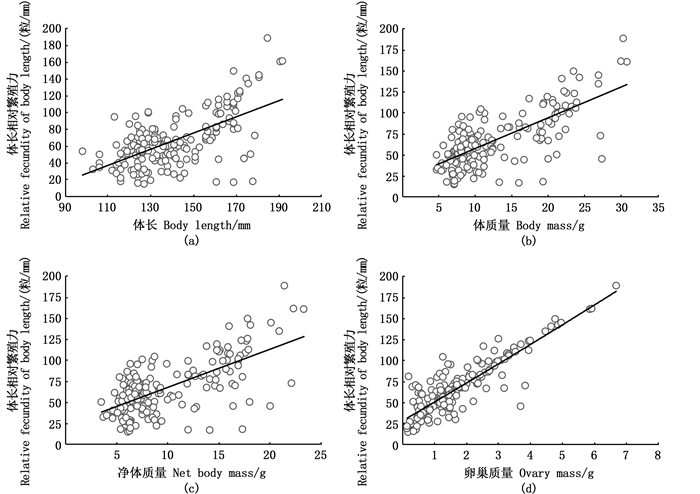
|
图 6 凤鲚体长相对繁殖力与各个生物学指标的关系 Fig. 6 Relationship between the body length relative fecundity and biological indices of C.mystus |
经逐步回归,凤鲚的个体绝对繁殖力、体长相对繁殖力、体质量相对繁殖力与6个生物学指标的最佳回归方程如表 3所示。绝对繁殖力和体长相对繁殖力的最佳拟合方程均仅采用了性腺质量这一参数,体质量相对繁殖力的最佳拟合方程采用了性腺质量和性腺指数2个参数。
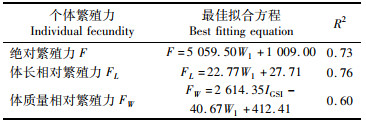
|
表 3 凤鲚个体繁殖力同各个生物学指标的最适拟合方程 Tab.3 Best fitting equation between fecundity of C. mystus and biological indicators |
对发育到V期的雌性凤鲚卵巢组织切片发现,凤鲚存在明显的核移位现象。2018年的产卵分数为0.26,2019年的产卵分数为0.24。其中,2018年5月、6月和7月凤鲚已产卵和待产卵的个体数量之比分别为7∶ 23、14∶ 37和3∶ 7,产卵分数分别为0.23、0.27和0.30。2019年5月和8月凤鲚已产卵和待产卵的个体数量之比分别为5∶ 17和7∶ 20,产卵分数分别为0.23和0.26。
3 讨论 3.1 肥满度和性腺指数肥满度能反映鱼类生长状况,其大小与温度、饵料、繁殖等密切相关[11]。根据现有研究,长江口凤鲚的肥满度为0.31~0.45 [9, 11-12]。本研究2018年凤鲚雌性个体的肥满度为0.32,2019年为0.33,长江口凤鲚的肥满度较前人的研究相比,总体处于较低水平,这可能是凤鲚的栖息环境发生了变化,导致生长繁殖策略相应的改变。2018与2019年长江口凤鲚的体长、体质量差异显著,但肥满度较为接近,这可能是由遗传基因特性决定的[9]。凤鲚的肥满度随着时间的变化呈下降趋势,可能是早期洄游的亲本发育更好。除此之外,雄性凤鲚的肥满度高于雌性个体,这意味着雌性相较于雄性,繁殖成本更高。
随着性腺发育,凤鲚的性腺指数自Ⅱ~Ⅴ期逐渐增大,随着卵细胞的排出,到Ⅵ期时凤鲚的性腺指数变小。研究发现,2018年凤鲚产卵群体的性腺指数为20.23%,与管卫兵等[11]、于晓[9]和毕雪娟[13]的结果相接近。2019年凤鲚产卵群体的性腺指数为14.09%,与2018年有较大差距,原因可能为温度会影响性腺的发育,随着水温上升凤鲚性腺逐渐发育[14],2019年为厄尔尼诺年,长江口水温偏低[15],性腺发育迟缓,因此性腺指数也较低。
3.2 个体繁殖力和卵径在有限的繁殖能量情况下,鱼类可以通过调节后代个体的大小和数量之间的能量分配,以最大化对种群资源量进行补充[16]。初生个体的大小一般与卵的大小有关,后代数量最直接的体现是绝对繁殖力,这种调节方式可以用来补偿过度开发导致的种群丰度下降[17]。
2018和2019年凤鲚的绝对繁殖力分别为11 621粒和6 131粒。根据调查,采集到的凤鲚样品2018年0龄个体占21.6%,2019年0龄个体占65.6%[18],1龄凤鲚的绝对繁殖力明显低于2龄和3龄,2018和2019年凤鲚繁殖力差异可能是产卵群体的年龄结构不同导致的。凤鲚的繁殖期为每年的5—9月,成鱼洄游至长江口南支上游的淡水区域进行产卵活动[19],2018年5月和6月的绝对繁殖力平均值明显高于7月,这可能是早期洄游的个体大多为发育良好的亲本,有更多的资源可以利用,为繁殖活动积累更多的能量,从而有更多的能量用于繁殖活动。
鱼类产卵类型可以分为一次产卵型和分批产卵型,可以通过其卵径的频率分布来判断鱼类的产卵类型[20],凤鲚卵径的分布频率只有一个波峰,因此长江口凤鲚为一次产卵型鱼类。卵径的大小能够影响仔鱼在捕获食物之前是否有足够的营养物质维持生命活动,从而会影响仔鱼的存活率[21-22]。2018和2019年长江口凤鲚的卵径分别为0.68和0.70 mm,结果显示,采集到的凤鲚卵径(0.70 mm)低于曾强等[12] (0.83 mm)、倪勇[23] (0.90~1.10 mm)和毕雪娟等[2] (0.75 mm)报道的结果,凤鲚卵径有变小的趋势。
3.3 个体繁殖力与生物学指标的关系鱼类的个体繁殖力不仅与环境因素、营养条件有关,还与其生物学指标密切相关[13]。不同鱼类的个体繁殖力与其生物学指标之间的关系不尽相同,绝对繁殖力同体长呈线性关系[如刀鲚(Coilia nasus)][24]、幂函数关系[如细纹狮子鱼(Liparis tanakae)][25]、抛物线关系[如纹缟虾虎鱼(Tridentiger trigonocephalus)][26]。大部分鱼类的绝对繁殖力与体质量呈线性关系,如刀鲚[24]、细纹狮子鱼[25]和黑鲷(Acanthopagrus schlegeli)[27]等。本文采用多个函数模型来拟合凤鲚个体繁殖力与个体生物学指标,结果显示:长江口凤鲚的绝对繁殖力和体长相对繁殖力与体长、体质量、净体质量、性腺质量均呈线性正相关。经逐步回归分析可以看出,凤鲚的繁殖力主要与性腺质量的关系最为密切,绝对繁殖力以及体长相对繁殖力与卵巢质量的关系呈线性相关。
3.4 产卵分数不同鱼种之间产卵分数差异显著,鲷科如金鲷(Chrysophrys auratus)和金赤鲷(Pagrus auratus)产卵分数在0.70以上,有着十分频繁的繁殖活动[28-29];而鲱科如拟沙丁鱼(Sardinops sagax)和大西洋沙丁鱼(Sardina pilchardus)的产卵分数为0.07~0.18 [30-32];鳀科如欧洲鳀(Engraulis encrasicolus)、秘鲁鳀(Engraulis ringens)、日本鳀(Engraulis japonicus)等产卵分数为0.13~0.37 [33-35]。受环境因素的影响,同种鱼类在不同海域其产卵分数的差别也很大,例如欧洲鳀在爱琴海附近产卵分数为0.13,而在比斯开湾附近为0.28[36]。凤鲚的产卵分数存在明显的季节差异,春季的产卵分数低于夏季,对日本鳀的研究也发现了类似现象[33]。温度会影响凤鲚性腺的发育,一般水温在18 ℃以上时,大多数凤鲚的性腺可以发育到Ⅴ期,因此温度可能是影响长江口凤鲚产卵分数的主要因素[14]。2018和2019年长江口凤鲚的产卵分数分别为0.26和0.24,2018年采样时间为5—7月,而2019年的采样时间为5月和8月,可能是采样时间不同导致了产卵分数的年间差异。本文首次进行长江口凤鲚产卵分数的研究,可为运用日产卵量方法来评估长江口凤鲚的繁殖力提供核心关键参数。
| [1] |
庄平, 张涛, 李圣法, 等. 长江口鱼类[M]. 2版. 北京: 中国农业出版社, 2018: 125-126. ZHUANG P, ZHANG T, LI S F, et al. Fishes of the Yangtze estuary[M]. 2nd ed. Beijing: China Agriculture Press, 2018: 125-126. |
| [2] |
毕雪娟, 张涛, 冯广朋, 等. 长江口凤鲚个体生殖力的研究[J]. 海洋渔业, 2015, 37(3): 223-232. BI X J, ZHANG T, FENG G P, et al. Individual fecundity of Coilia mystus in the Yangtze Estuary[J]. Marine Fisheries, 2015, 37(3): 223-232. DOI:10.3969/j.issn.1004-2490.2015.03.004 |
| [3] |
罗秉征. 河口及近海的生态特点与渔业资源[J]. 长江流域资源与环境, 1992, 1(1): 24-30. LUO B Z. Ecological characteristics and fishery resources of the Yangtze River Estuary and Adjacent Sea[J]. Resources and Environment in the Yangtze Basin, 1992, 1(1): 24-30. |
| [4] |
张国祥, 华家栋. 长江口凤鲚资源的变动及其最大持续产量的估算[J]. 水产科技情报, 1990, 17(5): 130-134. ZHANG G X, HUA J D. Resource change and estimation of maximum sustainable yield of Coilia mystus in Yangtze River[J]. Fisheries Science & Technology Information, 1990, 17(5): 130-134. |
| [5] |
王腾, 黄丹, 孙广文, 等. 鱼类分批繁殖力和繁殖频率的研究进展[J]. 动物学杂志, 2013, 48(1): 143-149. WANG T, HUANG D, SUN G W, et al. The research progress of fish batch fecundity and spawning frequency[J]. Chinese Journal of Zoology, 2013, 48(1): 143-149. |
| [6] |
洪波, 周轩, 王淼. 杭州湾北部海域凤鲚个体繁殖力初步研究[J]. 水产科技情报, 2021, 48(6): 335-341. HONG B, ZHOU X, WANG M. Preliminary study on individual fecundity of Coilia mystus in the North of Hangzhou Bay[J]. Fisheries Science & Technology Information, 2021, 48(6): 335-341. |
| [7] |
HE W P, LI Y X, LIU M, et al. Reproductive biology of Coilia mystus (linnaeus) from the Yangtze Estuary, China: responses to overexploitation[J]. Journal of Applied Ichthyology, 2011, 27(5): 1197-1202. DOI:10.1111/j.1439-0426.2011.01767.x |
| [8] |
刘凯, 张敏莹, 徐东坡, 等. 长江口凤鲚资源变动及最大持续产量研究[J]. 上海海洋大学学报, 2004, 13(4): 298-303. LIU K, ZHANG M Y, XU D P, et al. Studies on resource change and MSY of Coilia mystus in the Yangtze River Estuary[J]. Journal of Shanghai Fisheries University, 2004, 13(4): 298-303. |
| [9] |
于晓. 长江口凤鲚繁殖群体的生物学特性研究[D]. 上海: 上海海洋大学, 2014: 40-44. YU X. The research of biological characteristics of anadromous spawning Coilia mystus in Estuary of the Yangtze River[D]. Shanghai: Shanghai Ocean University, 2014: 40-44. |
| [10] |
殷名称. 鱼类生态学[M]. 北京: 中国农业出版社, 1995: 293. YIN M C. Fish ecology[M]. Beijing: China Agriculture Press, 1995: 293. |
| [11] |
管卫兵, 陈辉辉, 何文辉. 长江口凤鲚生殖群体的动态特征[J]. 渔业科学进展, 2011, 32(5): 1-9. GUAN W B, CHEN H H, HE W H. Reproductive characteristics and condition status of Coilia mystus (Linnaeus) in the Changjiang River Estuary[J]. Progress in Fishery Sciences, 2011, 32(5): 1-9. |
| [12] |
曾强, 董方勇. 凤鲚繁殖群体的生物学特性及因数关系的研究[J]. 湖泊科学, 1993, 5(2): 164-170. ZENG Q, DONG F Y. Study on the biological characteristics and factor correlation of Coilia mystus propagating population[J]. Journal of Lake Sciences, 1993, 5(2): 164-170. |
| [13] |
毕雪娟. 长江口凤鲚繁殖生物学及HSI评估[D]. 上海: 上海海洋大学, 2015: 12-18. BI X J. The reproductive biology and preliminary assessment of habitat suitability of Coilia mystus in the Yangtze Estuary[D]. Shanghai: Shanghai Ocean University, 2015: 12-18. |
| [14] |
赵峰, 杨琴, 宋超, 等. 长江口凤鲚生物学特征及其资源利用研究进展[J]. 海洋渔业, 2020, 42(1): 110-119. ZHAO F, YANG Q, SONG C, et al. Biological characteristics and resource utilization of Coilia mystus in the Yangtze Estuary[J]. Marine Fisheries, 2020, 42(1): 110-119. |
| [15] |
WANG J, WANG J, XU J F, et al. Seasonal and interannual variations of sea surface temperature and influencing factors in the Yangtze River Estuary[J]. Regional Studies in Marine Science, 2021, 45: 101827. |
| [16] |
SMITH C C, FRETWELL S D. The optimal balance between size and number of offspring[J]. The American Naturalist, 1974, 108(962): 499-506. |
| [17] |
DUNLOP E S, ENBERG K, JØRGENSEN C, et al. Toward darwinian fisheries management[J]. Evolutionary Applications, 2009, 2(3): 246-259. |
| [18] |
胡永斌. 长江口凤鲚和刀鲚年龄结构与生长特征的初步研究[D]. 上海: 上海海洋大学, 2020: 12-16. HU Y B. A preliminary study on the age structure and growth characteristics of Coilia mystus and Coilia nasus in the Yangtze River Estuary[D]. Shanghai: Shanghai Ocean University, 2020: 12-16. |
| [19] |
WANG D, WAN R, LI Z G, et al. The Non-stationary environmental effects on spawning habitat of fish in estuaries: a case study of Coilia mystus in the Yangtze Estuary[J]. Frontiers in Marine Science, 2021, 8: 766616. |
| [20] |
MURUA H, KRAUS G, SABORIDO-REY F, et al. Procedures to estimate fecundity of marine fish species in relation to their reproductive strategy[J]. Journal of Northwest Atlantic Fishery Science, 2003, 33: 33-54. |
| [21] |
BROSSET P, DONIOL-VALCROZE T, SWAIN D P, et al. Environmental variability controls recruitment but with different drivers among spawning components in Gulf of St. Lawrence herring stocks[J]. Fisheries Oceanography, 2019, 28(1): 1-17. |
| [22] |
BLAXTER J H S, HEMPEL G. The influence of egg size on herring larvae (Clupea harengus L.)[J]. ICES Journal of Marine Science, 1963, 28(2): 211-240. |
| [23] |
倪勇. 长江口区凤鲚的渔业及其资源保护[J]. 中国水产科学, 1999, 6(5): 75-77. NI Y. Fishery resources conservation for Coilia mystus in the Changjiang estuary[J]. Journal of Fishery Sciences of China, 1999, 6(5): 75-77. |
| [24] |
张健, 杨培民, 胡宗云, 等. 大洋河刀鲚繁殖生物学特性[J]. 淡水渔业, 2021, 51(6): 91-96. ZHANG J, YANG P M, HU Z Y, et al. Reproductive biology of Coilia nasus in Dayang River[J]. Freshwater Fisheries, 2021, 51(6): 91-96. |
| [25] |
单秀娟, 陈云龙, 周志鹏, 等. 黄海中南部细纹狮子鱼繁殖生物学特征的年际变化[J]. 渔业科学进展, 2014, 35(3): 1-8. SHAN X J, CHEN Y L, ZHOU Z P, et al. Inter-annual variations in propagational biological characteristics of Liparis tanakae in central and southern Yellow Sea[J]. Progress in Fishery Sciences, 2014, 35(3): 1-8. |
| [26] |
陈丽慧, 章龙珍, 冯广朋, 等. 长江口纹缟虾虎鱼个体生殖力的研究[J]. 大连海洋大学学报, 2008, 23(2): 81-86. CHEN L H, ZHANG L Z, FENG G P, et al. Individual fecundity of chameleon goby Tridentiger tigonocephalus in Yangtze estuary[J]. Journal of Dalian Fisheries University, 2008, 23(2): 81-86. |
| [27] |
陈得仿, 王腾, 刘永, 等. 大亚湾黑鲷繁殖特征的生物学研究[J]. 南方水产科学, 2019, 15(5): 41-47. CHEN D F, WANG T, LIU Y, et al. Biological study of reproductive characteristics of Acanthopagrus schlegeli in Daya Bay[J]. South China Fisheries Science, 2019, 15(5): 41-47. |
| [28] |
JACKSON G, CHENG Y W, WAKEFIELD C B. An evaluation of the daily egg production method to estimate spawning biomass of snapper (Pagrus auratus) in inner Shark Bay, Western Australia, following more than a decade of surveys 1997-2007[J]. Fisheries Research, 2012, 117-118: 22-34. |
| [29] |
MCGARVEY R, STEER M A, SMART J J, et al. Generalizing the Parker equation of DEPM: Incorporating the size dependence of population number and reproductive inputs to estimate spawning biomass and female population by size[J]. Fisheries Research, 2021, 242: 105992. |
| [30] |
CHARITONIDOU K, KJESBU O S, DOMINGUEZ-PETIT R, et al. Contrasting post-ovulatory follicle production in fishes with different spawning dynamics[J]. Fisheries Research, 2020, 231: 105710. |
| [31] |
WARD T M, BURCH P, MCLEAY L J, et al. Use of the daily egg production method for stock assessment of sardine, Sardinops sagax; lessons learned over a decade of application off southern Australia[J]. Reviews in Fisheries Science, 2011, 19(1): 1-20. |
| [32] |
WARD T M, GRAMMER G L, IVEY A R, et al. Increasing the precision of the daily egg production method; 2020's remix of a 1980's classic[J]. ICES Journal of Marine Science, 2021, 78(4): 1177-1195. |
| [33] |
KIM J, LO N C H. Temporal variation of seasonality of egg production and the spawning biomass of Pacific anchovy, Engraulis japonicus, in the southern waters of Korea in 1983-1994[J]. Fisheries Oceanography, 2001, 10(3): 297-310. |
| [34] |
CLARAMUNT G, CUBILLOS L, HERRERA G, et al. Spawning marker patterns of Engraulis ringens of northern Chile[J]. Fisheries Research, 2019, 219: 105306. |
| [35] |
PARKER K. A direct method for estimating northern anchovy, Engraulis mordax, spawning biomass[J]. Fisheries Bulletin, 1980, 78: 541-544. |
| [36] |
SOMARAKIS S, PALOMERA I, GARCIA A, et al. Daily egg production of anchovy in European waters[J]. ICES Journal of Marine Science, 2004, 61(6): 944-958. |
2. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
3. Key Laboratory of Marine Ecological Monitoring and Restoration Technologies, Shanghai 201306, China;
4. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


