2. 大洋渔业资源可持续开发教育部重点实验室, 上海 201306;
3. 中国水产科学研究院南海水产研究所, 广东 广州 510300;
4. 农业农村部大洋渔业开发重点实验室, 上海 201306;
5. 国家远洋渔业工程技术研究中心, 上海 201306
渔业捕捞是人类对海洋生态系统影响最大也是最广泛的一种干扰,且过度捕捞会导致渔业资源的减少甚至衰竭,严重影响海洋生态系统的稳定性,不利于实现可持续发展目标。近年来,渔业资源管理由单鱼种管理模式逐渐向基于生态系统的管理模式发展,人们越来越认识到在渔业管理中需要考虑生态系统因素[1]。将生态系统作为研究对象,需要满足两个条件:一是需要一定的数据支持建立描述生态系统的数学模型;二是需要有合适的生态系统指标来捕捉到整个生态系统发生的重要变化,生态系统指标可对生态系统进行量化显示,通过对不同指标的监测获得生态系统状况的相关信息[2]。
在传统的渔业管理中,鱼类资源通常是在单个种群的基础上进行管理的,所以大多数模型都是以单物种为对象,不考虑种群之间的相互作用,单物种模型适用于评估种群的当前状态并做出短期的预测,但对长期预测来说,种群死亡率、丰度和生物量等很容易受到种群之间相互作用的影响[3]。因此,国际上已经开发出多个多物种模型:统计模型,如随机多物种模型[4](Stochastic multi-species model, SMS),与年龄结构的单物种评估模型类似;生物量动态模型,如剩余产量模型[5],描述生物量的动态和捕食关系;生态模型,如生态通道模型[6](Ecopath with ecosim, EWE),用于生态系统的建模和渔业管理。
上述模型的发展大大促进了人们对海洋生态系统的研究。在R语言中通过数值模拟进行基于体长的多物种分析方法模型(A length-based multi-species analysis by numerical simulation in R, LeMaRns)可用来研究在外界压力下生态系统的变化。LeMaRns模型最初由HALL等[7]开发并用来描述乔治斯河岸鱼类群落,后由ROCHET等[8]和THORPE等[9]应用于北海鱼类群落,该模型已被用来评估混合渔业的影响[10-11],以及捕捞控制规则的效果[12]。LeMaRns模型可以结合其他模型一起工作[13], LeMaRns模型在有关假设前提下(如个体生长受食物的影响限制不强),可以实现将渔业技术和多物种相互作用结合起来研究生态系统问题。
印度洋的大洋性渔业起始于20世纪50年代,其中影响和规模较大的是金枪鱼渔业,但针对金枪鱼渔业管理的生态系统模型研究尚未开展。本文依据印度洋金枪鱼委员会(Indian Ocean Tuna Commission, IOTC)和Fishbase(https://www.fishbase.de/)等公开数据库和文献记载资料,构建基于印度洋金枪鱼渔业19个大洋性物种的LeMaRns生态系统模型,并模拟物种及生态系统结构在4种渔船作业方式、不同捕捞水平下的变化,研究结果可为印度洋的金枪鱼渔业管理提供参考,并为多鱼种渔业评估的进一步研究提供思路。
1 材料与方法 1.1 数据来源 1.1.1 渔业数据本文选取了印度洋海域的19个物种,其中16个是印度洋金枪鱼渔业主要捕捞及兼捕的物种,已被IOTC各个工作组调查评估过,可以满足LeMaRns模型的数据要求。这16个物种的生物量(B)、渔获量(C)、捕捞死亡率(F)和最大产卵种群生物量(Smax)数据来自IOTC的5个工作组,时间为2010—2019年,总共10年。这5个工作组分别是:旗鱼工作组(Working party on billfish, WPB)、生态系统和兼捕工作组(Working party on ecosystems and bycatch, WPEB)、近海金枪鱼工作组(Working party on neritic tunas, WPNT)、热带金枪鱼工作组(Working party on tropical tuna, WPTT)和温带金枪鱼工作组(Working party on temperate tunas,WPTmT)。
由于这16个物种主要处于食物网的中高营养级,为了使食物网更加丰富,本文又另外加入了1个与金枪鱼在摄食关系上比较密切的物种[帆蜥鱼(Alepisaurus ferox)]以及2个食物网底层物种[大头飞鱼(Exocoetus volitans)和日本鲭(Scomber japonicus)]。由于IOTC未对后面加入的3个物种进行评估,无法获取相关建模数据,因此根据与它们体长和营养位置相近的物种的数据进行估计。由于大头飞鱼与日本鲭的捕食者较多,位于食物链底层,所以生物量和Smax假设为与摄食关系矩阵中生物量最大的物种相等,由于帆蜥鱼不是经济鱼种且体长与平鳍旗鱼(Istiophorus platypterus)相近,同样处于较高营养级,所以生物量和Smax假设与平鳍旗鱼相等。为了降低这3个物种对构建印度洋LeMaRns生态系统模型的影响,本想将它们的渔获量和捕捞死亡率假设为0,由于模型拟合时数据不能为0,所以将这3个物种的渔获量和捕捞死亡率分别假设为1 t和0.01。
1.1.2 生物学参数LeMaRns模型需要19个物种的以下几个参数来运行(表 1):种群Von-Bertalanffy渐进长度L∞和生长参数k;体质量、体长关系参数WM和WL;50%个体成熟时的长度L50;Ricker亲体-补充量关系模型的生产力参数a、密度相关参数b。L∞、WM、WL和k的数值可以从Fishbase网站获取。根据THORSON等[14]的研究,L50可通过以下公式计算:
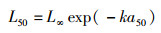 (1)
(1)

|
表 1 模型中19个物种的生活史参数 Tab.1 Life history parameters of 19 species in the model |
式中:L∞为物种的渐进长度;k为Von Bertalanffy生长参数;a50为初次成熟时的年龄,在Fishbase网站可查得。
根据HALL等[7]的研究,可以通过以下公式计算参数a和b:
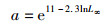 (2)
(2)
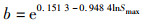 (3)
(3)
式中:L∞为物种的渐进长度;Smax为最大产卵种群生物量。
1.1.3 物种相互作用关系参数选取的19个物种包括16个印度洋金枪鱼渔业主要捕捞及兼捕物种,3个与金枪鱼密切相关并有摄食研究信息的物种,通过查阅文献[15-24]、查找相关网站(中文海洋鱼类资料库、Fishbase)等方法组成了相互作用关系矩阵(表 2)。
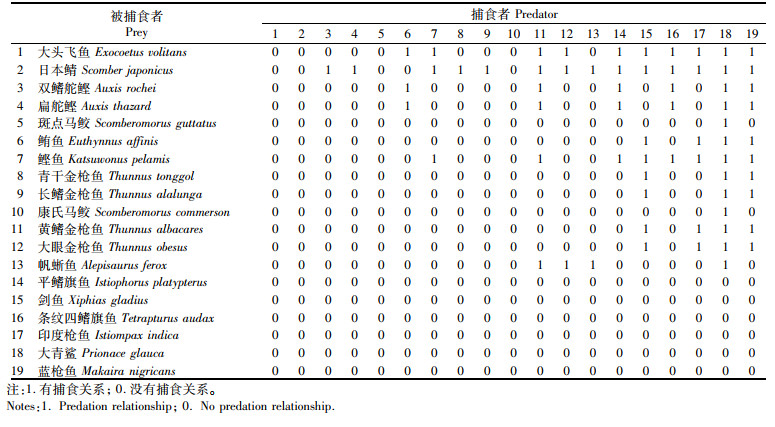
|
表 2 模型中19个物种的摄食关系矩阵 Tab.2 Feeding relationship matrix of 19 species in the model |
LeMaRns模型是基于体长结构的鱼类群落模型。鱼类群落结构可以简化为物种及其体长结构。一般来说,可以通过体质量或者体长来构建个体大小,例如Mizer模型[25]和FishSUMS模型[26]。LeMaRns模型的构建基于物种体长主要有两个方面的考虑,一是在渔业中,通常体长数据比体质量数据更容易获得[27];二是捕捞选择性通常与体长和渔具结构有关,因此也更容易进行模型特别是混合渔业情况下的模型参数化[3]。
LeMaRns模型根据鱼类的体长结构构建群落结构,把捕食行为简化为捕食者和被捕食者相对长度的函数,同时随着鱼类个体增长,摄食情况也跟着变化[28]。LeMaRns模型将包括捕捞死亡、自然死亡和捕食死亡在内的许多生活史过程表示为体长的函数,可以用相对较少的参数建立模型来再现群落的动态,使该模型适用于数据有限的渔业。
根据Von Bertalanffy生长方程,假设鱼类个体在其一生中持续生长:
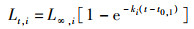 (4)
(4)
式中:L∞,i为物种i的渐进长度;ki为Von Bertalanffy生长参数;t0, i为物种i长度为0的理论年龄。由于LeMaRns模型是基于离散时间、离散长度,所以需要对增长函数进行离散化。通过以下方式可实现离散化,对于物种i在体长组j中所度过的时间t定义为
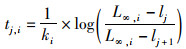 (5)
(5)
式中:lj为体长组j的下限长度;lj+1为体长组j的上限长度。
本研究设置为32个体长组,个体在达到模型定义的阈值时成熟,物种i在体长组j的成熟个体的比例定义为
 (6)
(6)
式中:L50为50%个体成熟时的长度,对于所有物种,ki默认等于10[9]。
繁殖是根据亲体-补充量关系模型来描述的。LeMaRns模型中有几种不同的补充量函数,本文根据HALL等[7]的研究,选择了Ricker补充量函数:
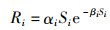 (7)
(7)
式中:Ri为补充量;Si为产卵种群生物量;αi为Ricker亲体-补充量关系模型中的生产力参数;βi为Ricker亲体-补充量关系模型中的密度相关参数。
LeMaRns模型包含3种不同类型的死亡率:自然死亡率(M1)、捕食死亡率(M2)和捕捞死亡率(F)。
自然死亡率(M1)是指由除了捕食和捕捞以外的原因造成的死亡,模型中共有3种自然死亡率函数可以选择。为了减小自然死亡率对模型稳定性的影响,本文采用了constant函数,对于所有体长组给出了0.2的恒定死亡率。
不同种群通过捕食死亡率(M2)联系在一起,而捕食死亡率随捕食者的数量、体型和物种偏好而变化。体型偏好通过基于对数正态分布的偏好函数来描述,物种偏好通过摄食关系矩阵指示特定捕食者是否捕食给定被捕食者。体长组j的物种i对体长组n的被捕食者m的捕食死亡率(M2)定义为
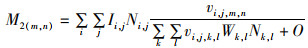 (8)
(8)
式中:W、N和I分别为被捕食者m在体长组n和捕食者i在体长组j的质量、丰度和食物量; k、l分别为物种和体长组;“o”在LeMaRns模型中代表鱼类摄食中的非模型猎物物种,模型动力学对其非常敏感,数值太小,一些被捕食物种将会灭绝,数值太大,会导致被捕食者的死亡率太低;vi, j, m, n为在体长组j的捕食者i对在体长组n的被捕食者m的相对偏好(适应性),通过以下公式定义:
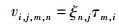 (9)
(9)
式中:ξn, j为体长组j的捕食者i对体长组n的被捕食者m的尺寸偏好;τm, i为捕食者i对被捕食者m的脆弱性,设置为0或者1,表示特定捕食者是否捕食给定的被捕食者。
捕捞死亡率在LeMaRns模型中取决于渔具的可捕性和捕捞努力量。在体长组j的物种i的瞬时捕捞死亡率为
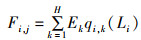 (10)
(10)
式中:Ek为第k个渔具的捕捞努力量,k=1…H;qi, k(Lj)为体长Lj的物种i通过渔具k的可捕性系数。
1.2.2 可捕性曲线在LeMaRns模型中有3种可捕性曲线,分别为logistic曲线、log_gaussian曲线和knife-edge曲线。本文选择了logistic曲线:
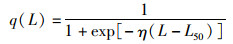 (11)
(11)
式中:η为logistic可捕性曲线斜率的陡度;L50为最大可捕性曲线的50% 处的长度。本文根据THORPE等[10]的研究,将η设置为0.25。
1.2.3 生态系统指标LeMaRns模型是一个基于长度的模型,它包含4个基于长度的生态系统指标,分别为大型鱼类指数(Large fish indicator, LFI)、平均最大长度(Mean maximum length, MML)、典型长度(Typical length, TyL)和长度分位数(Length quantiles, LQ)。由于都是长度为基础的指标,本文仅对LFI指标和MML指标进行研究。
LFI表示长度大于LLFI的鱼在时间t上的生物量占时间t上的总生物量的比例,通过以下公式表示:
 (12)
(12)
式中:Nj, i, t为体长组j的物种i在时间t上的个体数量;Wj, i为物种i在体长组j上的质量;I为一个指示函数,当Li≥LLFI时为1,当Li < LLFI时为0;Bi, t为物种i在时间t上的生物量。LLFI的大小设置需要进行采样调查[29],由于尚未在IOTC发现相关研究,本文采用的是MML平衡时的值,将LLFI设置为120 cm。
MML表示长度L∞的鱼在时间t上的生物量加权平均数,由以下公式表示:
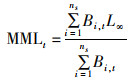 (13)
(13)
本文用捕捞努力量来表示捕捞水平,根据THORPE等[10]对可捕性的定义可知:
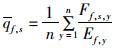 (14)
(14)
式中:qf, s为船队f对物种s的平均可捕性系数;Ff, s, y和Ef, y分别为船队f在y年的捕捞死亡率和捕捞努力量。假设可捕系数不变的情况下,捕捞努力量与捕捞死亡率有如下关系:
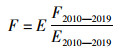 (15)
(15)
式中:E为假设的捕捞努力量;E2010—2019为2010—2019年平均的捕捞努力量;F2010—2019为2010—2019年船队的平均捕捞死亡率(表 3)。令努力量系数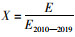
|
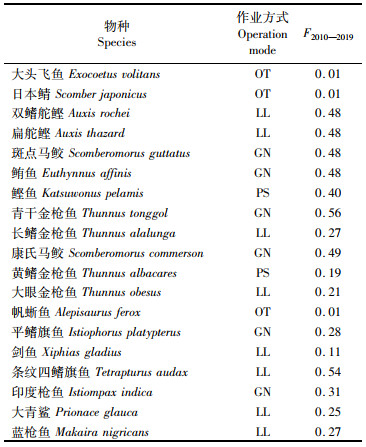
表 3 作业方式-物种组合和每个组合的F2010—2019 Tab.3 Operation mode-species combination and F2010-2019 of each combination |
本文假设印度洋金枪鱼渔业有4种不同的渔船作业方式,包括延绳钓(Long line, LL)、刺网(Gillnet, GN)、围网(Purse seine, PS)和其他(Other, OT),OT是针对大头飞鱼、日本鲭和帆蜥鱼的作业方式,实际的捕捞活动是复杂多变的,为了简化模型,使其便于研究,本文假设每一种物种都只能被一种作业方式捕捞,根据每个物种在2010—2019年每种作业方式的渔获量占该物种的总渔获量的比例,选择所占比例最大的作业方式假设为该物种唯一的作业方式(表 3)。
1.3 模型的拟合与验证 1.3.1 模型的拟合由公式(3)计算出的b值是一组初始值,为使模型达到平衡状态,需要对其进行拟合。此前,有不少研究[9, 30-31]已经在几种海洋生态系统模型中探讨了参数不确定性。本文采用SPENCE等[30]的方法,使用贝叶斯方法拟合LeMaRns模型的不确定参数b。即首先利用历史匹配法[32]确定一组参数值作为模型运行的初始值,然后使用马尔可夫链蒙特卡洛(Markov Chain Monte Carlo, MCMC)算法[33]和并行退火法[34]对后验分布进行抽样,从而拟合出比较合理的b值。
1.3.2 模型的验证为获得合理的结果,初始模型应符合以下两个标准[10]:(1)在未捕捞的情况下运行模型,所有物种都应该持续存在,并最终达到平衡状态;(2)以验证标准(1)的最终平衡状态为起点,在当前捕捞努力量(1×E2010—2019)情况下运行模型30 a,评估物种的预测生物量与2010—2019年平均生物量(B2010—2019)之比为0.5~2.0。
经验证在无捕捞的情况下运行模型50 a后,19个物种都持续存在,且最终各种群生物量都达到了平衡状态,生态系统的相关指标也在前期波动后达到了平衡状态,符合模型验证的第一条验证标准。以平衡时的最终状态为起点,在当前捕捞努力量(1×E2010—2019)的水平下模型预测30 a后,各种群生物量Bi与B2010—2019之比均为0.5~2.0(表 4),符合模型验证的第二条验证标准。综上所述,印度洋生态系统模型LeMaRns建立合理。
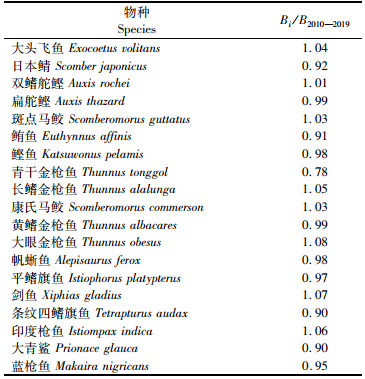
|
表 4 模型预测生物量Bi与IOTC单鱼种生物量估计值B2010—2019之比 Tab.4 Ratio of model-predicted biomass(Bi) to the IOTC single-species model derived biomass estimates(B2010-2019) |
在验证标准2的基础上,以其最终状态为起点,采用全因子实验设计,假设4种作业方式在10个捕捞努力量水平[(0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.7、2.0)× E2010—2019]上进行捕捞作业50 a,共产生10 000个捕捞情景。分析在该捕捞情景下,生态系统指标大型鱼类指数(LFI)、平均最大长度(MML)以及种群状态、生态系统结构的变化。
2 结果 2.1 种群生物量各物种种群生物量随着捕捞努力量增加的变化,清楚地显示出捕捞对种群生物量的负效应,即随着捕捞努力量的增加,种群生物量在下降。除此之外,还可以看到种群生物量对捕捞该种群的作业方式产生了最显著的变化,但平鳍旗鱼、剑鱼、印度枪鱼和大青鲨的种群生物量除了对捕捞这些种群的作业方式产生响应外,还对另外的作业方式产生了响应(图 1)。
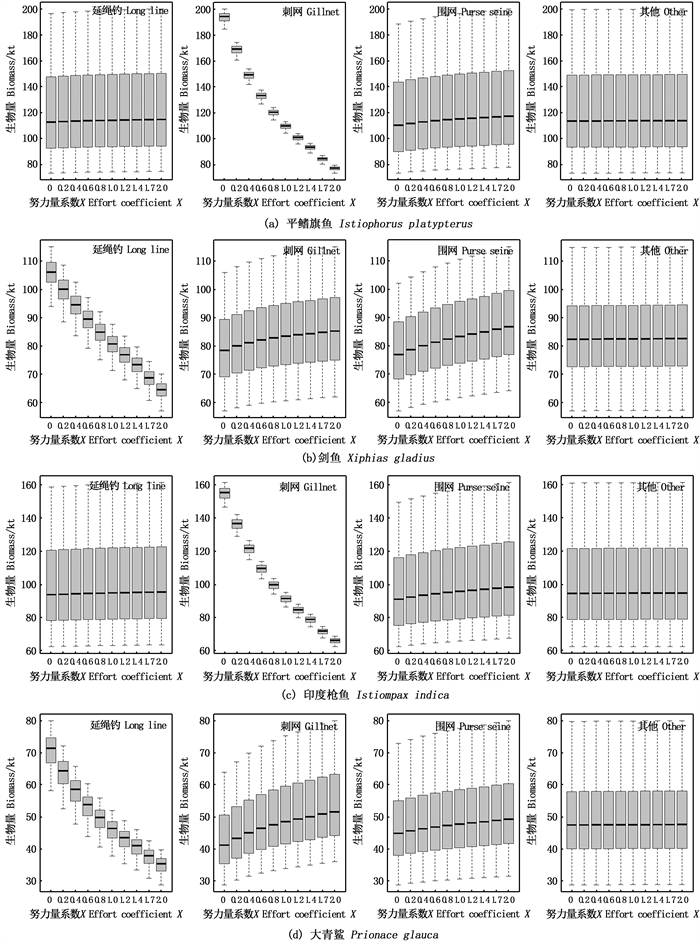
|
图 1 平鳍旗鱼、剑鱼、印度枪鱼和大青鲨在不同作业方式下的生物量变化 Fig. 1 Biomass changes of Istiophorus platypterus, Xiphias gladius, Istiompax indica and Prionace glauca in different operation modes |
从图 2可以看出,随着延绳钓捕捞努力量的增加,LFI指标从0.29~0.30减小到了0.24~0.25。LFI指标在刺网的捕捞努力量增加下先减小后增加,在围网的捕捞努力量增加下先增加后减小,在其他作业方式的捕捞努力量增加下略有增加,但LFI指标的变化基本在0.01内,说明这3种作业方式对LFI指标的影响较小,而延绳钓对LFI指标的影响最大。

|
图 2 不同作业方式的努力量系数变化对生态系统指标LFI的影响 Fig. 2 Effects of effort coefficient of different operation modes on ecosystem indicators LFI |
从图 3可以看出,对于MML指标,随着延绳钓捕捞努力量的增加,MML指标减小了7~8 cm;随着刺网捕捞努力量的增加,MML指标减小了约2 cm;随着围网捕捞努力量的增加,MML指标增大了约1 cm;随着其他作业方式捕捞努力量的增加,MML指标增大了约1 cm,所以延绳钓对MML指标的影响也最大。
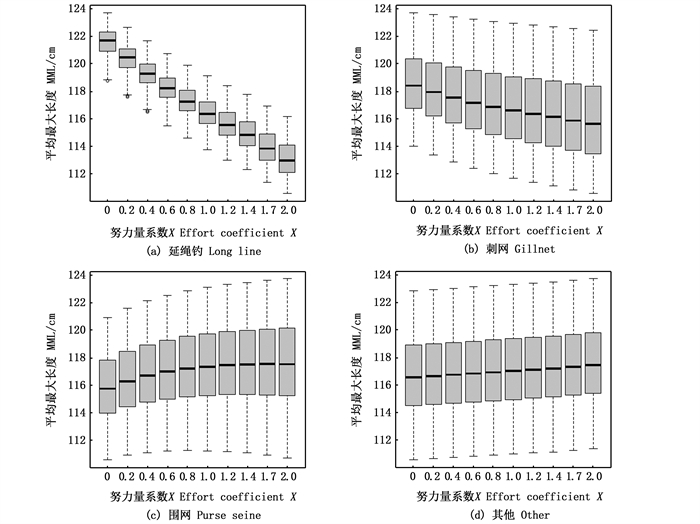
|
图 3 不同作业方式的努力量系数变化对生态系统指标MML的影响 Fig. 3 Effects of effort coefficient of different operation modes on ecosystem indicators MML |
相对种群生物量是当前种群生物量与原始种群生物量(未捕捞时)的比值,表示种群资源量变化的程度,若相对种群生物量低于10%,可认定该种群处于崩溃状态[10]。随着4种作业方式捕捞努力量的增加,处于风险状态的种群数量为0(图 4),说明在该捕捞情景下没有种群处于崩溃状态。
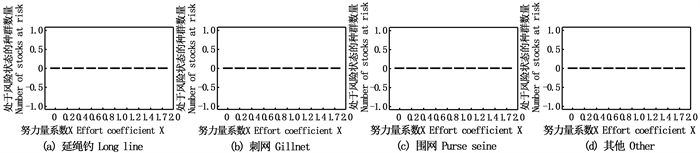
|
图 4 努力量系数增加时处于崩溃状态的种群数量 Fig. 4 Population number in collapse state with the increase of effort coefficient |
为了进一步观察鲣鱼、长鳍金枪鱼、黄鳍金枪鱼和大眼金枪鱼等4种重要经济物种在捕捞努力量增加或减小的情况下种群资源量的变化,将相对种群生物量修改为当前种群生物量与验证标准2的生物量(Bi)的比值。
鲣鱼、长鳍金枪鱼、黄鳍金枪鱼和大眼金枪鱼等4种重要经济物种的相对种群生物量随捕捞努力量变化如图 5所示。在当前捕捞努力量的两倍时(2×E2010—2019),鲣鱼、长鳍金枪鱼、黄鳍金枪鱼和大眼金枪鱼的相对种群生物量分别为0.6~0.7、0.6~0.7、0.7~0.8和0.6~0.7,表明4个物种在捕捞努力量增加1倍的情况下仍处于健康状态。相应的,当逐渐减小捕捞努力量时,各种群的相对种群生物量都会增大。在无捕捞的情况下,鲣鱼和长鳍金枪鱼的种群生物量增加了1倍,黄鳍金枪鱼和大眼金枪鱼的种群生物量分别是当前的1.4倍和1.5倍。
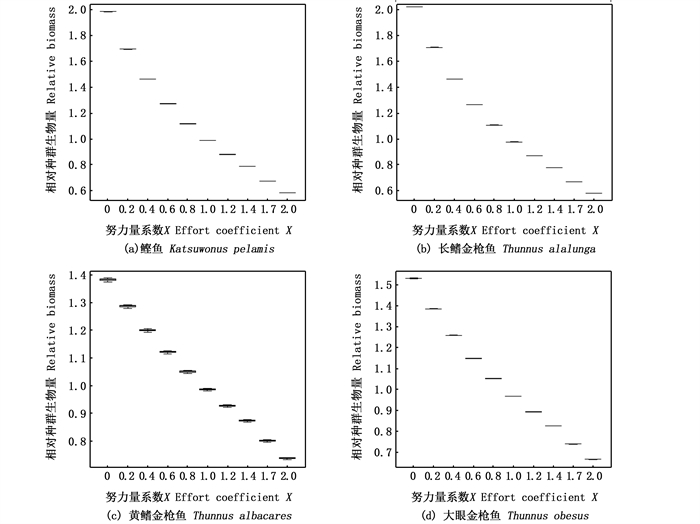
|
图 5 鲣鱼、长鳍金枪鱼、黄鳍金枪鱼和大眼金枪鱼的相对种群生物量随努力量系数的变化 Fig. 5 Variation of relative SSB of skipjack tuna, albacore, yellowfin tuna and bigeye tuna with effort coefficient |
随着商业性渔业的不断发展,人类对海洋生态系统的影响越来越大,过度捕捞已经成为比污染、水体富营养化、酸化等对生态系统影响更大的因素[35]。数学模型是分析和解决生态学问题的重要手段[36]。本文利用金枪鱼渔业中出现的16个已评估物种和3个未评估物种,构建LeMaRns生态系统模型研究不同作业类型对生态系统的影响。评价生态系统变化可用的指标很多,由于LeMaRns是基于体长结构的模型,本文仅考虑了LFI和MML两个与体长结构变化紧密相关的指标。在16个金枪鱼渔业涉及的主要鱼种之外还考虑3个未评估鱼种,主要是为使模型易于平衡,这是后续进行预测的基础。在研究过程中,本文也尝试了增加更多的鱼种,但物种越多,模型运行需要的时间越长。
3.1 捕捞对种群生物量的影响本次构建的生态系统模型符合THORPE等[10]的两个标准。还可以看出,当Bi与B2010—2019之比越接近1时,说明构建的生态系统越接近当前实际情况,结果的可信度就会越高。各物种的生物量随着捕捞努力量的变化,清楚地显示出捕捞对各种群生物量的负效应,即随着捕捞努力量的增加,各种群生物量在下降(图 1),这与其他关于捕捞对生态系统影响的研究结果一致[37-38]。
平鳍旗鱼、剑鱼、印度枪鱼和大青鲨等物种的生物量除了对捕捞它们的作业方式产生响应,还对另外的捕捞方式产生了响应(图 1),这是由于捕捞会导致物种之间的捕食关系发生变化,当1个物种的捕食者被捕捞时,该物种所受到的捕食压力就会下降,能更好地完成生长繁殖过程,所以该物种的生物量则会上升。以剑鱼和大青鲨为例,剑鱼和大青鲨的种群生物量除了受延绳钓的影响,还受到刺网和围网的影响。结合表 2可以看到,被刺网和围网捕捞并跟剑鱼有捕食关系的物种分别有2种(鲔鱼和青干金枪鱼)和2种(剑鱼和黄鳍金枪鱼),被刺网和围网捕捞并跟大青鲨有捕食关系的物种分别有4种(鲔鱼、青干金枪鱼、康氏马鲛和平鳍旗鱼)和2种(鲣鱼和黄鳍金枪鱼)。除延绳钓外,剑鱼受到围网的影响较大,大青鲨受到刺网的影响较大,这可能说明与该物种有捕食关系的物种被捕捞的越多,该物种的种群生物量变化就会越明显。
3.2 捕捞对生态系统指标的影响衡量指标性能的标准之一是敏感性,即区分指标对捕捞水平变化的反应能力;另一个标准是对捕捞反应的特异性,即与其他原因相比,该指标的变化在多大程度上是由捕捞驱动的[39]。LFI和MML两个指标在过往的研究中已经被证实了在研究海洋生态系统时的实用性[9]。
在金枪鱼渔业中,延绳钓渔业捕捞的个体一般较大,即主捕对象为中高体长组个体。作为两个以个体长度为基础的生态系统指标(图 2和图 3),LFI和MML都对延绳钓的响应较为敏感,这说明捕捞大型鱼类的作业方式会对生态系统结构造成更大的影响(表 3),因此在渔业管理中应更深入地了解延绳钓的作业方式,并与其他的作业方式进行谨慎地权衡,这是实现混合渔业管理目标的核心。LFI和MML两个指标的减小表明生态系统中大个体鱼类的比例下降,小个体鱼类的比例上升,这对生态系统的稳定性可能会产生负面的影响。当然,对小个体鱼类的捕捞量减少,也可能降低上述指数。
对于生态系统健康的监测,除了这两个指标外,还需要从生态系统的生产力、稳定性等指标进行综合衡量。也可以结合群落大小谱的斜率[40](The slope of the community size spectrum, SSS)等指标进行研究,已有研究证明[9],SSS是最能将捕捞引起的群落反应与捕捞水平联系起来的指标。
3.3 种群崩溃风险箱线图的宽度一定程度反映了数据的波动程度。箱线图越扁,则说明数据较为集中;箱线图越宽,则说明数据较为分散。根据图 4可以看出,在本文所设置的捕捞情景下未发现有种群处于崩溃状态,这与THORPE等[10]构建的北海生态系统有所不同。原因可能是生态系统本来就很稳定,在本文的捕捞情景下不会对生态系统造成破坏;也可能是数据的不精确或数据拟合过程中出现了问题,导致结果存在偏差。研究还发现,各种群的渔获量随着捕捞努力量的增加而增加,且未出现渔获量最高的转折点。由于19个物种的渔获量的图太多,且未出现渔获量最高点等值得分析的地方,本文没有对各种群渔获量进行展示。进一步的研究可以找到各种群的渔获量最高点,这样可以结合多种作业方式分析出每种作业方式的捕捞努力量为多少时,可以既不破坏生态系统的结构又获得较多的产量。
除此之外,鲣鱼、长鳍金枪鱼、黄鳍金枪鱼和大眼金枪鱼4种重要的经济物种的相对种群生物量在当前捕捞努力量(1×E2010—2019)下捕捞50 a后接近于1,说明捕捞前后种群的生物量变化不大(图 5),4个种群在捕捞前可能已经达到了平衡状态;在当前捕捞努力量的两倍(2×E2010—2019)下捕捞50 a后相对种群生物量仍处于较高的状态,说明在基于本文的相关假设下两倍的捕捞努力量水平下各种群的资源量仍处于健康状态,可以在当前基础上适当增加捕捞努力量。当我们减小捕捞努力量时,各种群生物量会逐渐上升,这对一些崩溃物种的恢复具有一定的指导意义。但是,上述结果是在基于生态系统模型的相关假设下得出的,一些鱼种的生物学过程(如亲体-补充量关系)和渔业过程(如单渔业捕捞)的建模也依赖于一定的假设。因此,在解读模型结果时需要注意。
4 结论对混合和多物种渔业管理建议的需求给生态系统的研究工作带来了许多挑战。目前,为了更好地为混合和多物种渔业的管理提出建议,通常将混合和多物种渔业问题分开解决。LeMaRns模型实现了将渔业技术和多物种相互作用包含在同一框架中,很好地解决了混合和多物种渔业问题,现在正在被用于评估北海种群替代长期管理计划的生物和经济影响[41]。
本文基于LeMaRns模型在北海的应用案例,首次尝试构建了基于印度洋金枪鱼渔业19个主要物种的体长结构多物种生态系统模型LeMaRns。通过模拟研究发现:(1)捕捞对各种群生物量产生负面效应,即随着捕捞努力量的增加,各种群生物量在下降,捕捞还会改变物种间的相互作用关系;(2)以个体长度为基础的LFI指标和MML指标都对延绳钓作业的响应较为敏感,说明延绳钓渔业对生态系统的影响最大,应注重延绳钓与其他的作业方式之间的捕捞努力量分配;(3)在本文所设置的捕捞情景下未发现有种群处于崩溃状态,且4种重要的经济物种的状态也比较健康。
除此之外,在研究过程中也发现了LeMaRns模型在应用于大洋生态系统时的一些问题。大洋性金枪鱼渔业是典型的混合渔业。分析混合渔业中的种群状况、捕捞影响及管理方案,应解决渔船之间的分配问题和物种之间的相互作用问题[42-43]。为模型简化,本文假定1个物种只能被1种渔船作业方式捕捞,构建的捕食关系也较为简单,仅聚焦于金枪鱼渔业涉及的鱼种,未包括所有物种。另外,由于模型被广泛应用于北海生态系统,而北海属于近海,相对于大洋生态系统而言,近海鱼类的洄游范围较小,影响较小,模型设计之初并未将鱼类的洄游纳入考虑,所以本文构建的是一个封闭的生态系统,没有考虑到物种的洄游、迁徙等问题,但洄游对大洋生态系统的影响较大,在今后的模型发展中应考虑这一点。建议后续研究主要从以下3个方面完善:(1)进一步研究如何模拟一个物种被多种作业方式同时捕捞以及物种的洄游问题,这可能需要对LeMaRns模型进行结构性改进;(2)开展食物网调查研究,在LeMaRns生态系统模型中,考虑囊括更多的鱼种,同时考虑模型运行时间的权衡;(3)考虑纳入环境因素的影响,比如大尺度环境变化可能影响被捕食者、捕食者生物量的区域分布,从而打破在整个区域随机捕食的假设。
| [1] |
FAO. What is the code of conduct for responsible fisheries[M]. Rome, ITA: Food and Agricultural Organization of the United Nations, 2001.
|
| [2] |
程家骅, 姜亚洲. 捕捞对海洋鱼类群落影响的研究进展[J]. 中国水产科学, 2008, 15(2): 359-366. CHENG J H, JIANG Y Z. Methods for evaluating fishing effects on fish community[J]. Journal of Fishery Sciences of China, 2008, 15(2): 359-366. DOI:10.3321/j.issn:1005-8737.2008.02.023 |
| [3] |
SPENCE M A, BANNISTER H J, BALL J E, et al. LeMaRns: A Length-based Multi-species analysis by numerical simulation in R[J]. PLoS One, 2020, 15(2): e0227767. DOI:10.1371/journal.pone.0227767 |
| [4] |
LEWY P, VINTHER M. A stochastic age-length-structured multispecies model applied to North Sea stocks[J]. ICES CM, 2004, 1-33. |
| [5] |
MUETER F J, MEGREY B A. Using multi-species surplus production models to estimate ecosystem-level maximum sustainable yields[J]. Fisheries Research, 2006, 81(2/3): 189-201. |
| [6] |
HEYMANS J J, COLL M, LINK J S, et al. Best practice in Ecopath with Ecosim food-web models for ecosystem-based management[J]. Ecological Modelling, 2016, 331: 173-184. DOI:10.1016/j.ecolmodel.2015.12.007 |
| [7] |
HALL S J, COLLIE J S, DUPLISEA D E, et al. A length-based multispecies model for evaluating community responses to fishing[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2006, 63(6): 1344-1359. DOI:10.1139/f06-039 |
| [8] |
ROCHET M J, COLLIE J S, JENNINGS S, et al. Does selective fishing conserve community biodiversity? Predictions from a length-based multispecies model[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2011, 68(3): 469-486. DOI:10.1139/F10-159 |
| [9] |
THORPE R B, LE QUESNE W J F, LUXFORD F, et al. Evaluation and management implications of uncertainty in a multispecies size-structured model of population and community responses to fishing[J]. Methods in Ecology and Evolution, 2015, 6(1): 49-58. DOI:10.1111/2041-210X.12292 |
| [10] |
THORPE R B, DOLDER P J, REEVES S, et al. Assessing fishery and ecological consequences of alternate management options for multispecies fisheries[J]. ICES Journal of Marine Science, 2016, 73(6): 1503-1512. DOI:10.1093/icesjms/fsw028 |
| [11] |
THORPE R B, JENNINGS S, DOLDER P J. Risks and benefits of catching pretty good yield in multispecies mixed fisheries[J]. ICES Journal of Marine Science, 2017, 74(8): 2097-2106. DOI:10.1093/icesjms/fsx062 |
| [12] |
THORPE R B, DE OLIVEIRA J A A. Comparing conceptual frameworks for a fish community MSY (FCMSY) using management strategy evaluation—an example from the North Sea[J]. ICES Journal of Marine Science, 2019, 76(4): 813-823. DOI:10.1093/icesjms/fsz015 |
| [13] |
SPENCE M A, BLANCHARD J L, ROSSBERG A G, et al. A general framework for combining ecosystem models[J]. Fish and Fisheries, 2018, 19(6): 1031-1042. DOI:10.1111/faf.12310 |
| [14] |
THORSON J T, MUNCH S B, COPE J M, et al. Predicting life history parameters for all fishes worldwide[J]. Ecological Applications, 2017, 27(8): 2262-2276. DOI:10.1002/eap.1606 |
| [15] |
林乾晗, 耿喆, 朱江峰, 等. 印度洋长鳍金枪鱼CPUE权重配置对资源状态指标的影响[J]. 上海海洋大学学报, 2022, 31(6): 1522-1532. LIN Q H, GENG Z, ZHU J F, et al. Impact of CPUE index weighting on stock status indicators of Indian Ocean albacore Thunnus alalunga[J]. Journal of Shanghai Ocean University, 2022, 31(6): 1522-1532. |
| [16] |
许柳雄, 朱国平, 宋利明. 印度洋中西部水域大眼金枪鱼的食性[J]. 水产学报, 2008, 32(3): 387-394. XU L X, ZHU G P, SONG L M. Feeding behavior of Thunnus obesus in the west-central Indian Ocean[J]. Journal of Fisheries of China, 2008, 32(3): 387-394. DOI:10.3321/j.issn:1000-0615.2008.03.009 |
| [17] |
朱国平, 许柳雄, 周应祺, 等. 印度洋中西部水域黄鳍金枪鱼的食性及其季节性变化[J]. 水产学报, 2008, 32(5): 725-732. ZHU G P, XU L X, ZHOU Y Q, et al. Feeding habits and its seasonal variations of Thunnus albacares in the west-central Indian Ocean[J]. Journal of Fisheries of China, 2008, 32(5): 725-732. DOI:10.3321/j.issn:1000-0615.2008.05.010 |
| [18] |
李攀, 陈锦淘, 朱国平, 等. 印度洋中南部大眼金枪鱼生物学特性研究[J]. 海洋渔业, 2010, 32(3): 283-289. LI P, CHEN J T, ZHU G P, et al. Biological characteristics of bigeye tuna (Thunnus obesus) in southern and central Indian Ocean[J]. Marine Fisheries, 2010, 32(3): 283-289. DOI:10.3969/j.issn.1004-2490.2010.03.008 |
| [19] |
李攀, 许柳雄, 朱国平, 等. 印度洋中南部长鳍金枪鱼生物学特性的研究[J]. 大连海洋大学学报, 2010, 25(3): 248-252. LI P, XU L X, ZHU G P, et al. Biological characteristics of albacore Thunnus alalunga in the southern and central Indian Ocean[J]. Journal of Dalian Ocean University, 2010, 25(3): 248-252. DOI:10.3969/j.issn.1000-9957.2010.03.012 |
| [20] |
耿喆, 朱江峰, 陈彦, 等. 中部大西洋大青鲨胃含物组成及其多样性研究[J]. 上海海洋大学学报, 2015, 24(1): 108-114. GENG Z, ZHU J F, CHEN Y, et al. Composition and diversity of stomach content of blue shark (Prinace glauca) in the central Atlantic Ocean[J]. Journal of Shanghai Ocean University, 2015, 24(1): 108-114. |
| [21] |
李欢欢. 印度洋西部黄鳍金枪鱼渔业生物学研究[D]. 上海: 上海海洋大学, 2015. LI H H. Study on fisheries biology for yellowfin tuna (Thunnus albacares) in the Western Indian Ocean[D]. Shanghai: Shanghai Ocean University, 2015. |
| [22] |
郑晓春, 戴小杰, 朱江峰, 等. 太平洋中东部海域大眼金枪鱼胃含物分析[J]. 南方水产科学, 2015, 11(1): 75-80. ZHENG X C, DAI X J, ZHU J F, et al. Analysis on stomach content of bigeye tuna (Thunnus obesus) in the eastern-central Pacific Ocean[J]. South China Fisheries Science, 2015, 11(1): 75-80. DOI:10.3969/j.issn.2095-0780.2015.01.011 |
| [23] |
耿喆, 朱江峰, 戴小杰. 东太平洋公海大青鲨的胃含物组成研究[J]. 南方水产科学, 2016, 12(6): 68-75. GENG Z, ZHU J F, DAI X J. Composition of stomach content of blue shark (Prionace glauca) in the tropical eastern Pacific Ocean[J]. South China Fisheries Science, 2016, 12(6): 68-75. DOI:10.3969/j.issn.2095-0780.2016.06.009 |
| [24] |
夏萌, 高春霞, 戴小杰, 等. 印度洋西南部海域大青鲨生物学特性初步研究[J]. 上海海洋大学学报, 2017, 26(2): 271-277. XIA M, GAO C X, DAI X J, et al. Preliminary analysis of biology for the blue shark, Prionace glauca, in the southwest Indian Ocean[J]. Journal of Shanghai Ocean University, 2017, 26(2): 271-277. |
| [25] |
SCOTT F, BLANCHARD J L, ANDERSEN K H. mizer: an R package for multispecies, trait-based and community size spectrum ecological modelling[J]. Methods in Ecology and Evolution, 2014, 5(10): 1121-1125. DOI:10.1111/2041-210X.12256 |
| [26] |
SPEIRS D C, GUIREY E J, GURNEY W S C, et al. A length-structured partial ecosystem model for cod in the North Sea[J]. Fisheries Research, 2010, 106(3): 474-494. DOI:10.1016/j.fishres.2010.09.023 |
| [27] |
CONNOR L, MATSON R, KELLY F L. Length-weight relationships for common freshwater fish species in Irish lakes and rivers[J]. Biology and Environment: Proceedings of the Royal Irish Academy, 2017, 117B(2): 65-75. DOI:10.3318/bioe.2017.07 |
| [28] |
JENNINGS S, PINNEGAR J K, POLUNIN N V C, et al. Weak cross-species relationships between body size and trophic level belie powerful size-based trophic structuring in fish communities[J]. Journal of Animal Ecology, 2001, 70(6): 934-944. DOI:10.1046/j.0021-8790.2001.00552.x |
| [29] |
GREENSTREET S P R, ROGERS S I, RICE J C, et al. Development of the EcoQO for the North Sea fish community[J]. ICES Journal of Marine Science, 2011, 68(1): 1-11. DOI:10.1093/icesjms/fsq156 |
| [30] |
SPENCE M A, BLACKWELL P G, BLANCHARD J L. Parameter uncertainty of a dynamic multispecies size spectrum model[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2016, 73(4): 589-597. DOI:10.1139/cjfas-2015-0022 |
| [31] |
MACKINSON S, PLATTS M, GARCIA C, et al. Evaluating the fishery and ecological consequences of the proposed north sea multi-annual plan[J]. PLoS One, 2018, 13(1): e0190015. DOI:10.1371/journal.pone.0190015 |
| [32] |
VERNON I, GOLDSTEIN M, BOWER R. Galaxy formation: Bayesian history matching for the observable universe[J]. Statistical Science, 2014, 29(1): 81-90. |
| [33] |
GELMAN A, CARLIN J B, STERN H S, et al. Bayesian data analysis[M]. 3rd ed. Oxford: Taylor and Francis, 2013: 1-675.
|
| [34] |
SWENDSEN R H, WANG J S. Replica monte Carlo simulation of spin-glasses[J]. Physical Review Letters, 1986, 57(21): 2607-2609. DOI:10.1103/PhysRevLett.57.2607 |
| [35] |
JACKSON J B C, KIRBY M X, BERGER W H, et al. Historical overfishing and the recent collapse of coastal ecosystems[J]. Science, 2001, 293(5530): 629-637. DOI:10.1126/science.1059199 |
| [36] |
李云凯, 刘恩生, 王辉, 等. 基于Ecopath模型的太湖生态系统结构与功能分析[J]. 应用生态学报, 2014, 25(7): 2033-2040. LI Y K, LIU E S, WANG H, et al. Analysis on the ecosystem structure and function of Lake Taihu based on Ecopath model[J]. Chinese Journal of Applied Ecology, 2014, 25(7): 2033-2040. |
| [37] |
陈作志, 邱永松, 贾晓平, 等. 捕捞对北部湾海洋生态系统的影响[J]. 应用生态学报, 2008, 19(7): 1604-1610. CHEN Z Z, QIU Y S, JIA X P, et al. Effects of fishing on the marine ecosystem of Beibu Gulf[J]. Chinese Journal of Applied Ecology, 2008, 19(7): 1604-1610. |
| [38] |
冯慧丽, 朱江峰, 陈彦. 基于Ecopath的热带东太平洋生态系统模型构建及其比较[J]. 上海海洋大学学报, 2019, 28(6): 921-932. FENG H L, ZHU J F, CHEN Y. Construction and historical comparison of ecosystem structure of the eastern tropical Pacific Ocean based on Ecopath model[J]. Journal of Shanghai Ocean University, 2019, 28(6): 921-932. |
| [39] |
HOULE J, FARNSWORTH K, ROSSBERG A, et al. Assessing the sensitivity and specificity of fish community indicators to management action[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2012, 69(6): 1065-1079. DOI:10.1139/f2012-044 |
| [40] |
SHIN Y J, ROCHET M J, JENNINGS S, et al. Using size-based indicators to evaluate the ecosystem effects of fishing[J]. ICES Journal of Marine Science, 2005, 62(3): 384-396. DOI:10.1016/j.icesjms.2005.01.004 |
| [41] |
STECF. Evaluation of the multi-annual plan for the North Sea demersal stocks[M]. STECF, ISPRA, 2015.
|
| [42] |
MURAWSKI S A. Can we manage our multispecies fisheries[J]. Fisheries, 1991, 16(5): 5-13. DOI:10.1577/1548-8446(1991)016<0005:CWMOMF>2.0.CO;2 |
| [43] |
VINTHER M, REEVES S A, PATTERSON K R. From single -species advice to mixed-species management: taking the next step[J]. ICES Journal of Marine Science, 2004, 61(8): 1398-1409. |
2. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
3. South China Sea Fisheries Research Institute, China Academy of Fisheries Science, Guangzhou 510300, Guangdong, China;
4. Key Laboratory of Oceanic Fisheries Exploitation, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
5. National Pelagic Fisherices Engineering Technology Research Center, Shanghai 201306, China
 2023,
Vol. 32
2023,
Vol. 32


