2. 中国水产科学研究院黄海水产研究所,山东 青岛 266071;
3. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室,山东 青岛 266071
在当前水产饲料产业中,高脂饲料正被广泛应用,以实现节约蛋白、降低成本等目的。但高脂饲料的使用容易造成脂肪过度沉积和脂肪代谢紊乱等问题,从而引起相关疾病,并造成经济损失。而且,在以腹部脂肪组织为主要脂肪沉积部位的鱼类中,脂肪的过度沉积还会影响体型美观,降低商品价值。为应对高脂饲料的负面影响,一系列营养学策略正被开发并应用于水产饲料中。相关研究[1-7]已经发现,氨基酸、维生素、磷脂、肉碱及胆汁酸等物质具有调节脂肪代谢作用,能在一定程度上缓解高脂饲料引起的脂肪过度累积,部分或者全面消除高脂饲料带来的负面影响。
以往研究[8]发现,一些氨基酸,尤其是含硫氨基酸蛋氨酸和牛磺酸在肉食性鱼类红鳍东方鲀(Takifugu rubripes)中具有显著的脂肪代谢调节作用,能够降低脂肪累积并对脂肪合成和氧化分解等过程产生调节作用。饲料中添加蛋氨酸可以调节红鳍东方鲀幼鱼肝脏和全鱼的脂肪积累,并提高鱼体生长速度。研究[9]还发现饲料中添加牛磺酸可刺激红鳍东方鲀胆汁酸和胆固醇的肝脏生物合成,并以多种方式调节脂质代谢。为进一步探究含硫氨基酸作为功能性物质在高脂饲料中添加对养殖鱼类脂肪累积和脂肪代谢的调节功效,本实验以我国北方支柱性海水养殖种类大菱鲆(Scophthalmus maximus)为研究对象,通过摄食生长实验来研究在高脂饲料中添加含硫氨基酸蛋氨酸、牛磺酸及半胱氨酸对鱼体脂肪累积和脂肪代谢的影响。大菱鲆和红鳍东方鲀具有相似的脂肪需求量,均为偏低脂需求类型(10%左右)。在以往研究中,关于蛋氨酸、牛磺酸等氨基酸的研究大多关注其需求量,而少有研究关注其作为功能性物质对特定代谢过程的影响[3-4, 8-16]。本实验结果有助于拓展在额外添加含硫氨基酸时作为功能性物质的代谢调节作用。
1 材料与方法 1.1 试验饲料试验饲料依据大菱鲆幼鱼基本营养需求设计。饲料蛋白源以鱼粉、豆粕、大豆浓缩蛋白等为主。脂肪源主要以鱼油和豆油为主。基础实验饲料粗蛋白含量约为44%,粗脂肪含量约为16%,脂肪含量高于普通商业饲料。通过在基础饲料中各自分别添加1.5%晶体蛋氨酸(Met)、晶体半胱氨酸(Cys)和晶体牛磺酸(Tau)来配制其他饲料处理组(表 1和2)。全部饲料原料粉碎后,过60目筛。按逐级放大法将氨基酸及其他微量组分和大宗原料进行混合。混合后加水混匀。使用实验室小型单螺杆挤压机制成直径3 mm的颗粒饲料,50 ℃烘箱内干燥12 h后放置于-20 ℃冷库中保存备用。

|
表 1 试验饲料组成及常规营养成分分析(%干物质基础) Tab.1 Formulation and proximate composition of the experimental diets (% dry matter basis) |

|
表 2 试验饲料脂肪酸成分分析(%总脂肪酸) Tab.2 Fatty acid profile of the experimental diets (% total fatty acids) |
试验所用大菱鲆苗种购自烟台市黄海水产有限公司。试验开始前将鱼苗放在2 000 L养殖缸中暂养14 d,暂养期间每天饱食投喂商品料2次(07:30和17:30)。选用规格均匀、体格健康、初始体质量为(7.98±0.02)g的大菱鲆幼鱼360尾为研究对象,随机分12个桶(220 L)中,每组试验饲料投喂3桶试验鱼,每桶饲养30尾鱼。养殖试验在室内流水海水系统进行。海水采用深井水。每日投喂2次(07:30和17:30),均为饱食投喂,进行56 d的摄食生长试验。养殖试验期间自然光照,水温为15.2~21.6 ℃,盐度为27~29,pH为7.5~8.0,水中溶解氧为6~8 mg/L。每天投喂后,及时清理粪便和残饵,并对实验用桶进行定期刷洗。
1.3 试验样品采集投喂养殖试验结束后,首先将试验大菱鲆饥饿24 h,然后对实验鱼进行称量(每桶称总质量),并统计每桶存活实验鱼尾数。分别从每个养殖缸中随机取3尾大菱鲆,每组9尾,用丁香酚(1∶ 10 000)将鱼麻醉,测个体体质量、体长、内脏团质量和肝脏质量以计算鱼的形体指标。再随机在每缸中取6尾鱼,用一次性注射器(1 mL)于尾静脉取血。取血后置入离心管(1.5 mL)中,首先在室温条件下自然凝结2 h,然后置于4 ℃条件下自然凝结6 h,再对其进行离心(836 g,4 ℃, 10 min),最后,取上清液即为所取血清。待取血完成后,将鱼置于冰上解剖,再收集肌肉、肝脏及鳍条附近皮下脂肪组织等样品。所有样品取样后立即于液氮中速冻,然后再转移到-76 ℃冰箱中储存、备用。取样结束后,随机挑选4条鱼放入-20 ℃冰箱备用。
1.4 样品分析样品中的水分采用在1个标准大气压、105 ℃下的烘干法(GB/T 6435—2014)测定;粗蛋白采用凯氏定氮法(GB/T 6433—2006)测定;灰分采用马弗炉灼烧法(GB/T 6438—2007)测定;用索氏抽提法(GB/T 6433—2006),以石油醚为抽提剂测定粗脂肪含量。
血清甘油三酯(TG)、总胆汁酸(TBA)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)及低密度脂蛋白胆固醇(LDL-C)含量均采用南京建成生物工程研究所试剂盒进行测定。
采用气相色谱法测定鱼体各组织及饲料脂肪酸组成。首先将样品用冻干机进行真空干燥,然后,于72 ℃水浴中进行样品的甲酯化处理(依次用KOH-甲醇和HCL-甲醇进行),加正己烷萃取,过夜后,取上清进行上机测定。所用气相色谱仪型号为日本岛津GC-2010 Pro,配有火焰电离检测器。柱温升温程序:以15 ℃/min从150 ℃升到200 ℃,然后以2 ℃/min升到250 ℃。进样口和检测器的温度均设置为250 ℃。
使用RNAiso Plus(TaKaRa)提取肌肉、肝脏、脂肪组织和肠道中的总RNA。用琼脂糖凝胶电泳(2%)检测所提RNA(1 μL)的完整性,依据OD260/OD280检测所提RNA的纯度和浓度。使用TaKaRa试剂盒(Prime Script RT reagent Kit with gDNA Eraser)进行cDNA的反转录。依据GenBank序列设计定量PCR的引物(表 3)。以β-actin和EF1α为双重看家基因。所有特异性引物扩增效率均为95%~105%。引物梯度稀释标准曲线R2值均大于0.99。荧光定量PCR仪采用Roche LightCycler 96;试剂盒采用TaKaRa定量试剂盒(SYBR® Premix Ex TaqTM)。反应体系的配制:cDNA模板,2 μL;2× SYBR® Premix Ex TaqTM, 10 μL;10 μmol/L上游引物,0.8 μL;10 μmol/L下游引物,0.8 μL;纯水,6.4 μL。荧光定量PCR程序:95 ℃解链5 min;40个循环:95 ℃解链, 5 s; 55 ℃退火, 20 s, 72 ℃延长, 10 s。最后,绘制熔解曲线(1.85 ℃/min,从58 ℃到95 ℃),以确定体系具有唯一的PCR特异性产物。每样品进行3次重复实验。mRNA的表达计算采用2-ΔΔCt法[17]。

|
表 3 试验所用引物序列 Tab.3 Primer sequences used in this experiment |
试验所用指标相关计算公式:
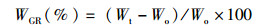 (1)
(1)
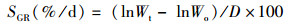 (2)
(2)
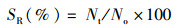 (3)
(3)
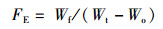 (4)
(4)
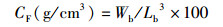 (5)
(5)
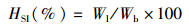 (6)
(6)
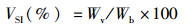 (7)
(7)
式中:WGR为增重率;Wt为终末体质量,g;Wo为初始体质量,g;SGR为特定生长率;D为实验天数,d;SR为存活率;Nt为终末尾数;No为初始尾数;Wf试验期间所用饲料总质量,g;CF为肥满度;Wb为鱼体质量,g;Lb为体长,cm;HSI为肝体比;Wl为肝脏质量,g;VSI为脏体比;Wv为内脏质量,g。
1.6 数据分析与统计所有数据表示为平均值±标准误(Mean ± SE)。数据统计采用单因素方差分析进行(SPSS 26.0),以Duncan’s多重比较法分析组间差异,当P<0.05时,认定为有显著性差异。
2 结果 2.1 添加蛋氨酸、半胱氨酸及牛磺酸对粗脂肪含量及其他机体常规成分的影响全鱼和肌肉粗脂肪在各处理组间没有显著性差异(P>0.05,表 4)。但是,肝脏粗脂肪含量在牛磺酸组最低,显著低于半胱氨酸组(P<0.05)。相应地,肝脏水分在牛磺酸组最高。

|
表 4 饲料中添加蛋氨酸、半胱氨酸及牛磺酸对大菱鲆常规体成分影响(%湿质量) Tab.4 Effects of dietary methionine, cysteine and taurine on proximate composition of turbot (%wet mass) |
全鱼水分在蛋氨酸组显著低于牛磺酸组(P<0.05),全鱼粗蛋白在蛋氨酸组显著高于对照组(P<0.05),全鱼粗灰分在半胱氨酸组显著高于对照组(P<0.05);肌肉粗蛋白在蛋氨酸组显著高于其他各组(P<0.05)。肌肉水分和肝脏水分在各组之间无显著差异(P>0.05)。
2.2 添加蛋氨酸、半胱氨酸及牛磺酸对脂代谢相关血清生化指标的影响牛磺酸组血清中甘油三酯含量显著高于其他组(P<0.05),且蛋氨酸组显著高于半胱氨酸组(P<0.05,表 5)。牛磺酸组血清中总胆固醇含量亦显著高于其他各组(P<0.05),而半胱氨酸组显著低于其他各组(P<0.05)。半胱氨酸组血清中高密度脂蛋白胆固醇显著低于蛋氨酸、牛磺酸组(P<0.05),而半胱氨酸组血清中低密度脂蛋白胆固醇含量显著高于其他各组(P<0.05)。血清总胆汁酸含量在各组间无显著性差异。

|
表 5 饲料中添加蛋氨酸、半胱氨酸及牛磺酸对大菱鲆脂代谢血清生化指标的影响 Tab.5 Effects of dietary methionine, cysteine and taurine on lipid-related parameters in serum of turbot |
与对照组相比,牛磺酸组肝脏中具有显著高的C16∶ 0含量,同时具有显著低的C20∶ 3n-3含量(P<0.05,表 6)。牛磺酸组和半胱氨酸组肝脏中C18∶ 3n-3含量显著高于对照组(P<0.05)。大菱鲆肝脏中其他各脂肪酸含量在各组之间均无显著差异(P>0.05)。

|
表 6 饲料中添加蛋氨酸、半胱氨酸和牛磺酸对大菱鲆肝脏脂肪酸影响(%总脂肪酸) Tab.6 Effects of dietary methionine, cysteine and taurine on liver fatty acid of turbot (% total fatty acid) |
大菱鲆裙边部位皮下脂肪组织中半胱氨酸组C18∶ 0含量显著低于对照组和牛磺酸组(P<0.05,表 7)。牛磺酸组具有最高的C18∶ 2n-6和C18∶ 3n-6,其中C18∶ 2n-6含量显著高于对照组,而C18∶ 3n-6含量显著高于其他各组(P<0.05)。与对照组相比,各氨基酸添加组的EPA含量均显著降低,其中,以牛磺酸组为最低。大菱鲆裙边部位皮下脂肪组织中其他脂肪酸的含量各组之间均无显著差异(P>0.05)。

|
表 7 饲料中添加蛋氨酸、半胱氨酸和牛磺酸对大菱鲆裙边部位皮下脂肪组织脂肪酸影响(%总脂肪酸) Tab.7 Effects of dietary methionine, cysteine and taurine on subcutaneous tissue around the fin acids of turbot (% total fatty acid) |
饲料中含硫氨基酸的添加仅影响了大菱鲆肌肉中n-3系列脂肪酸的含量(表 8)。半胱氨酸和牛磺酸组中C18∶ 3n-3含量显著高于对照组和蛋氨酸组(P<0.05)。半胱氨酸组中C20∶ 3n-3含量显著高于蛋氨酸组(P<0.05)。对照组C20∶ 5n-3含量显著高于其他各组(P<0.05)。大菱鲆肌肉中其他脂肪酸的含量在各组之间均无显著差异(P>0.05)。

|
表 8 饲料中添加蛋氨酸、半胱氨酸和牛磺酸对大菱鲆肌肉组织脂肪酸影响(%总脂肪酸) Tab.8 Effects of dietary methionine, cysteine and taurine on muscle fatty acids of turbot (% total fatty acid) |
对照组肝脏中ACACβ、ATGL、HSL及HNF4α的mRNA基因表达显著高于其他组(P<0.05,表 9)。蛋氨酸组FAS的mRNA基因表达显著高于其他组(P<0.05),其表达量是对照组的7倍多。半胱氨酸组DGAT1的mRNA基因表达量显著高于对照组(P<0.05)。蛋氨酸组SREBF1、PPARα1及PPARγ的mRNA基因表达含量显著高于牛磺酸组(P<0.05),对照组LXRα的mRNA基因表达含量显著高于牛磺酸组(P<0.05)。其他脂代谢基因在各组间无显著性差异。

|
表 9 饲料中添加蛋氨酸、半胱氨酸及牛磺酸对大菱鲆肝脏脂代谢基因表达的影响 Tab.9 Effects of dietary methionine, cysteine and taurine on expression of lipid metabolism genes in the liver of turbot |
牛磺酸组末均质量显著高于其他各组,增重率也在牛磺酸组最高(P<0.05,表 10)。半胱氨酸组饲料系数显著高于牛磺酸组。各组在成活率、增重率、特定生长率、肥满度、肝体比和脏体比方面均无显著差异(P>0.05)。

|
表 10 饲料中添加蛋氨酸、半胱氨酸和牛磺酸对大菱鲆生长性能和形体指标的影响 Tab.10 Effects of dietary methionine, cysteine and taurine on growth performance and somatic parameters of turbot |
基于之前在海水鱼中发现的含硫氨基酸对脂肪代谢的显著调节作用[8-9],本试验拟进一步验证在海水鱼饲料中添加含硫氨基酸对鱼体脂代谢的调节作用。前期试验在红鳍东方鲀中进行,因实验场地等原因,本试验在与红鳍东方鲀具有相近脂肪需求量的大菱鲆中进行。本研究结果进一步证实了含硫氨基酸对脂代谢的调节作用。其中,从肝脏脂肪含量来看,牛磺酸显示出较高的脂肪代谢调节潜力,牛磺酸具有潜在的降低脂肪肝的作用。肝脂沉积或肝脂过度沉积是高脂饲料投喂对养殖鱼类的一个重要的负面影响,常常导致脂肪肝,损坏肝脏功能和机体健康。牛磺酸调节鱼体脂肪沉积的作用目前在水产养殖鱼类中的相关报道并不多。仅有的一些报道显示相关结果在不同实验间并不统一,但总体上显示牛磺酸具有降脂的功能,正如在大西洋鲑(Sahno salar)[4]、军曹鱼(Rachycentron canadum)[18]和卵形鲳鲹(Trachinotus carolinus)[19]中发现的那样,但是,在另外一些实验中,如大西洋鲑和裸盖鱼(Anoplopoma fimbria)中,却并未发现牛磺酸的降脂作用,甚至发现了其升高脂肪含量的作用[20-21]。前期在红鳍东方鲀上的实验结果也表明牛磺酸具有升高肝脏甘油三酯的趋势[9],但该前期实验采用常规脂肪含量(10%左右)的饲料。值得一提的是,在YUN等[22]和QI等[23]以大菱鲆为研究对象的两项前期研究中均发现了饲料中添加牛磺酸的降脂作用。这些冲突或者不一致的结果表明,牛磺酸的脂肪调节作用可能跟鱼的种类、大小及实验条件等因素密切相关。
本试验中,不但表观肝脂含量结果表明了牛磺酸的降脂功能,肝脏中基因表达相关结果也表明了牛磺酸的降脂功能,饲料中牛磺酸的添加降低了脂肪合成相关一系列基因如ACACβ、FAS、SREBP1、PPARα1、PPARγ和LXRα的mRNA表达量。这进一步表明了牛磺酸的降肝脂潜力。相反地,蛋氨酸升高了脂肪酸从头合成相关基因FAS的表达,而半胱氨酸升高了甘油酯生成相关基因DGAT1的表达量,这显示出蛋氨酸和半胱氨酸可能具有升高脂肪含量的潜力。这种潜力在更长的养殖周期中可能会体现出来。本实验周期仅为8周,可能部分脂肪代谢调控潜力还没有充分体现出来。事实上,前期在红鳍东方鲀中的相关实验已经发现了蛋氨酸对脂肪含量的升高作用[8]。半胱氨酸的脂肪代谢调节功能研究得较少,但是蛋氨酸、半胱氨酸和牛磺酸在体内可以进行相关转化。蛋氨酸和半胱氨酸均可以最终生成牛磺酸。因此,半胱氨酸对脂肪代谢调节的直接或间接作用值得后续研究进一步揭示。
与肝脏脂肪含量及脂肪代谢基因表达结果相反,血清中甘油三酯(TG)和总胆固醇(TC)含量在牛磺酸组最高。一方面,这显示出牛磺酸较强的脂肪动员能力,而这种动员能力可能是牛磺酸脂肪代谢调节的另一种途径。另一方面,该结果显示了牛磺酸对胆固醇代谢的显著调节作用。牛磺酸对大菱鲆血清胆固醇的影响结果与在红鳍东方鲀中观察到的结果相一致。在红鳍东方鲀中,前期研究发现牛磺酸能够以相互独立的机制同时升高胆汁酸和胆固醇含量[9]。在对血清TG和TC的影响方面,半胱氨酸组则呈现出与牛磺酸相反的趋势,表明了其对脂肪代谢调节的作用同牛磺酸差异显著甚至具有相反的作用。高密度脂蛋白胆固醇(HDL-C)结果与TC类似,但低密度脂蛋白胆固醇(LDL-C)在各组间差异却不大,仅是在半胱氨酸组较高。胆固醇代谢在脂肪的转运中起到非常重要但同时也非常复杂的作用。目前基于现有的信息并不能很好地解释现有的高、低密度脂蛋白胆固醇结果。
脂肪酸结果方面,饲料中含硫氨基酸的添加主要影响了n-3系列脂肪酸及C18∶ 2n-6的含量。出乎意料的是,含硫氨基酸的添加降低了机体EPA的含量,基于目前的结果也很难对这一结果做出合理的解释,有待进一步实验去探索其机理机制。牛磺酸升高了鱼体C18∶ 2n-6和C18∶ 3n-3含量,尤其是升高了鳍条附近皮下脂肪组织中C18∶ 2n-6的含量。目前尚未有研究详细报道过含硫氨基酸对海水养殖鱼类脂肪酸组成的影响。牛磺酸对n-6系列脂肪酸的升高可能是因为该处理组优先利用其他脂肪酸后导致了n-6系列脂肪酸相对含量的上升。
在其他体成分方面,全鱼和肌肉粗蛋白含量都是在蛋氨酸组最高。这说明了蛋氨酸在保障蛋白供应和维持体蛋白合成方面的作用。蛋氨酸是最重要的限制性氨基酸之一, 其在饲料中的必需性已在红鳍东方鲀、大黄鱼和军曹鱼等一系列鱼种中得到了充分验证[11-13, 24]。本实验中,即使是过量状态下,蛋氨酸的添加也促进了鱼体蛋白合成,这更加证明了蛋氨酸对鱼体蛋白合成的重要性。蛋氨酸对鱼体蛋白的增加在异育银鲫(Carassius auratus gibelio)等种类中也有过报道[25]。
生长方面,如果与对照组相比,各组均未发现显著性差异。对生长无显著性影响的原因可能主要是本实验设计的目的侧重评估待试物的额外添加对脂肪沉积和代谢的影响,因此实验设计中使用的是氨基酸的额外过量添加(基础配方中鱼粉含量40%),这与研究氨基酸需求量的梯度实验不同。对生长无影响很可能是因为基础配方中的各含硫氨基酸含量已经满足了大菱鲆的需求。虽然大菱鲆对这几种含硫氨基酸的准确需求量数据目前并未有确切报道,但从红鳍东方鲀[11-12]、大黄鱼(Pseudosciaena crocea R)[13]、军曹鱼[14]、大口黑鲈(Micropterus salmoides)[15]和鲈鱼(Lateolabrax japonicus)[16]等种类上的研究结果来看,本实验配方中,在鱼粉添加量为40%的情况下,似已满足了大菱鲆对这几种含硫氨基酸的基本需求。相关试验氨基酸应已处于过量的状态,因此对生长无显著影响。但是,从各组终末体质量的结果来看,仍然能够发现牛磺酸组具有最高的终末体质量,饲料系数也最低,显示出其促进大菱鲆生长的潜力。牛磺酸在海洋动物中具有独特的高含量[26],在军曹鱼[19]、虹鳟(Oncorhynchus mykiss)[27]、真鲷(Pagrus major)[24]、斜带石斑鱼(Epinephelus coioides)[28]、罗非鱼(Oreochromis niloticus)[28]、草鱼(Ctenopharyngodon idella)[29]和牙鲆(Paralichthys olivaceus)[30]等种类中的相关研究已经表明了牛磺酸的促生长效应。本实验中,如果有一个较长的生长周期,或许能够观察到牛磺酸更明显的促生长效应。
本实验结果虽然部分验证了红鳍东方鲀中含硫氨基酸的脂代谢调节作用,但是在脂代谢基因表达、脂肪酸组成方面仍发现了两批次实验间的明显差异。造成这些差异的原因可能主要有:(1)种属差异。虽然红鳍东方鲀和大菱鲆同属于低脂肪需求的鱼类,但是其在脂肪存储方式和能量利用方面存在巨大的差异。河鲀无腹部脂肪组织,以肝脏为主要储脂部位[31],而大菱鲆虽然腹部脂肪组织也不发达,但是其以鳍条附近的皮下脂肪组织为主要储脂部位[32-33]。另一方面,河鲀为快速游泳型鱼类,而大菱鲆为底栖型鱼类,因此,在脂肪动员和能量利用特征方面两种鱼也存在巨大的差异。这些特征在两种鱼间的差异可能是导致含硫氨基酸生长和脂肪代谢调节作用在两种鱼间差异的原因之一。(2)饲料脂肪含量不同。本实验的初衷是探讨含硫氨基酸在高脂饲料中对脂肪沉积和代谢的调节作用。本实验中过高的脂肪含量可能导致生长的受阻(其他学者[34-35]的前期实验表明大菱鲆的适宜饲料脂肪含量是10%以内),导致实验鱼并非处于最佳生长状态,从而掩盖了相关含硫氨基酸的部分脂肪沉积和代谢调节作用。在高脂饲料的投喂状态下,可能需要一个更长的投喂养殖实验周期来使得试验氨基酸的脂肪沉积和代谢调节作用充分显现出来;或者是,一个中等程度的高脂可能更有利于实验处理的效果显现出来。综上所述,在本实验条件下,在大菱鲆高脂饲料(16%左右)中额外添加1.5%的蛋氨酸、半胱氨酸及牛磺酸对大菱鲆脂肪代谢具有重要的调节作用。这部分验证了前期在常规脂肪含量(10%左右)饲料实验中得出的“含硫氨基酸能够调节脂肪代谢”的实验假设。从肝脏脂肪含量和肝脏脂代谢基因表达情况来看,牛磺酸显示出具有降低肝脏脂肪累积的潜力,饲料牛磺酸的添加降低了肝脏脂肪含量及一系列脂合成相关基因的表达量,而蛋氨酸和半胱氨酸降低肝脏脂肪累积的效果不如牛磺酸显著。一个中等程度的饲料高脂(如14%左右)或者一个更长的投喂养殖周期可能更有利于含硫氨基酸脂代谢调节效果的显现。
| [1] |
陈昊杰. 胆汁酸对草鱼生长、脂质代谢及肠道微生物区系的影响[D]. 杨凌: 西北农林科技大学, 2016. CHEN H J. Influence of bile acids on the growth performance, lipid metabolism and the intestinal microbiota in Grass carp, Ctenopharyngodon idella[D]. Yangling: Northwest A & F University, 2016. |
| [2] |
KESHAVANATH P, RENUKA P. Effect of dietary L-carnitine supplements on growth and body composition of fingerling rohu, Labeo rohita (Hamilton)[J]. Aquaculture Nutrition, 1998, 4(2): 83-87. DOI:10.1046/j.1365-2095.1998.00052.x |
| [3] |
王学习. 牛磺酸对斜带石斑鱼脂肪代谢的影响及其机制研究[D]. 厦门: 集美大学, 2017. WANG X X. Effects of taurine on lipid metabolism and its mechanism in grouper (Epinephelus coioides)[D]. Xiamen: Jimei University, 2017. |
| [4] |
ESPE M, RUOHONEN K, EL-MOWAFI A. Effect of taurine supplementation on the metabolism and body lipid-to-protein ratio in juvenile Atlantic salmon (Salmo salar)[J]. Aquaculture Research, 2012, 43(3): 349-360. DOI:10.1111/j.1365-2109.2011.02837.x |
| [5] |
牛化欣, 雷霁霖, 常杰, 等. 维生素E对高脂饲料养殖大菱鲆生长、脂类代谢和抗氧化性能的影响[J]. 中国水产科学, 2014, 21(2): 291-299. NIU H X, LEI J L, CHANG J, et al. Effect of a vitamin E-supplemented high-fat diet on the growth, lipid metabolism and antioxidant function of turbot (Scophthalmus maximus L.)[J]. Journal of Fishery Sciences of China, 2014, 21(2): 291-299. |
| [6] |
麻艳群, 黄凯, 戴晓玲, 等. 饲料磷脂水平对巴丁鱼肝脏脂肪沉积及脂肪代谢酶活性的影响[J]. 饲料工业, 2015, 36(6): 31-35. MA Y Q, HUANG K, DAI X L, et al. Effect of dietary phospholipids level on lipid metabolism in liver of catfish (Pangasius sutchi)[J]. Feed Industry, 2015, 36(6): 31-35. |
| [7] |
毕清竹, 梁萌青, 廖章斌, 等. 饲料中胆汁酸对红鳍东方鲀脂肪酸组成及抗氧化能力的影响[J]. 上海海洋大学学报, 2020, 29(6): 829-839. BI Q Z, LIANG M Q, LIAO Z B, et al. Effect of dietary bile acid supplementation on fatty acid composition and anti-oxidative capacity of tiger puffer Takifugu rubripes[J]. Journal of Shanghai Ocean University, 2020, 29(6): 829-839. |
| [8] |
XU H G, ZHANG Q G, WEI Y L, et al. Dietary methionine increased the lipid accumulation in juvenile tiger puffer Takifugu rubripes[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2019, 230: 19-28. DOI:10.1016/j.cbpb.2019.01.005 |
| [9] |
XU H G, ZHANG Q G, KIM S K, et al. Dietary taurine stimulates the hepatic biosynthesis of both bile acids and cholesterol in the marine teleost, tiger puffer (Takifugu rubripes)[J]. The British Journal of Nutrition, 2020, 123(12): 1345-1356. DOI:10.1017/S0007114520000161 |
| [10] |
TAKEUCHI T, PARK G S, SEIKAI T, et al. Taurine content in Japanese flounder Paralichthys olivaceus T. & S. and red sea bream Pagrus major T. & S. during the period of seed production[J]. Aquaculture Research, 2001, 32(s1): 244-248. |
| [11] |
张庆功, 梁萌青, 徐后国, 等. 红鳍东方鲀幼鱼对饲料中蛋氨酸需求的研究[J]. 渔业科学进展, 2019, 40(4): 1-10. ZHANG Q G, LIANG M Q, XU H G, et al. Dietary methionine requirement of juvenile tiger puffer (Takifugu rubripes)[J]. Progress in Fishery Sciences, 2019, 40(4): 1-10. |
| [12] |
郭斌, 梁萌青, 徐后国, 等. 饲料中添加牛磺酸对红鳍东方鲀幼鱼生长性能、体组成和肝脏中牛磺酸合成关键酶活性的影响[J]. 动物营养学报, 2018, 30(11): 4580-4588. GUO B, LIANG M Q, XU H G, et al. Effects of dietary taurine on growth performance, body composition and activities of key taurine synthesis enzymes in liver of juvenile tiger puffer (Takifugu rubripes)[J]. Chinese Journal of Animal Nutrition, 2018, 30(11): 4580-4588. DOI:10.3969/j.issn.1006-267x.2018.11.034 |
| [13] |
MAI K S, WAN J L, AI Q H, et al. Dietary methionine requirement of large yellow croaker, Pseudosciaena crocea R[J]. Aquaculture, 2006, 253(1/4): 564-572. |
| [14] |
ZHOU Q C, WU Z H, TAN B P, et al. Optimal dietary methionine requirement for juvenile cobia (Rachycentron canadum)[J]. Aquaculture, 2006, 258(1/4): 551-557. |
| [15] |
陈乃松, 马建忠, 周恒永, 等. 大口黑鲈对饲料中蛋氨酸需求量的评定[J]. 水产学报, 2010, 34(8): 1244-1253. CHEN N S, MA J Z, ZHOU H Y, et al. Assessment of dietary methionine requirement in largemouth bass, Micropterus salmoides[J]. Journal of Fisheries of China, 2010, 34(8): 1244-1253. |
| [16] |
柳茜, 王成强, 梁萌青, 等. 牛磺酸及相关氨基酸对鲈鱼(Lateolabrax japonicus)幼鱼生长及组织氨基酸含量的影响[J]. 渔业科学进展, 2017, 38(4): 44-52. LIU X, WANG C Q, LIANG M Q, et al. Effects of dietary taurine and related amino acids on growth and amino acid composition of Japanese seabass (Lateolabrax japonicus)[J]. Progress in Fishery Sciences, 2017, 38(4): 44-52. |
| [17] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [18] |
LUNGER A N, MCLEAN E, GAYLORD T G, et al. Taurine supplementation to alternative dietary proteins used in fish meal replacement enhances growth of juvenile cobia (Rachycentron canadum)[J]. Aquaculture, 2007, 271(1/4): 401-410. |
| [19] |
SALZE G P, SPANGLER E, COBINE P A, et al. Investigation of biomarkers of early taurine deficiency in Florida pompano Trachinotus carolinus[J]. Aquaculture, 2016, 451: 254-265. DOI:10.1016/j.aquaculture.2015.09.019 |
| [20] |
ESPE M, RUOHONEN K, EL-MOWAFI A. Hydrolysed fish protein concentrate (FPC) reduces viscera mass in Atlantic salmon (Salmo salar) fed plant-protein-based diets[J]. Aquaculture Nutrition, 2012, 18(6): 599-609. DOI:10.1111/j.1365-2095.2012.00944.x |
| [21] |
JOHNSON R B, KIM S K, WATSON A M, et al. Effects of dietary taurine supplementation on growth, feed efficiency, and nutrient composition of juvenile sablefish (Anoplopoma fimbria) fed plant based feeds[J]. Aquaculture, 2015, 445: 79-85. DOI:10.1016/j.aquaculture.2015.03.030 |
| [22] |
YUN B, AI Q H, MAI K S, et al. Synergistic effects of dietary cholesterol and taurine on growth performance and cholesterol metabolism in juvenile turbot (Scophthalmus maximus L.) fed high plant protein diets[J]. Aquaculture, 2012, 324-325: 85-91. DOI:10.1016/j.aquaculture.2011.10.012 |
| [23] |
QI G S, AI Q H, MAI K, et al. Effects of dietary taurine supplementation to a casein-based diet on growth performance and taurine distribution in two sizes of juvenile turbot (Scophthalmus maximus L.)[J]. Aquaculture, 2012, 358-359: 122-128. DOI:10.1016/j.aquaculture.2012.06.018 |
| [24] |
TAKAGI S, MURATA H, GOTO T, et al. Necessity of dietary taurine supplementation for preventing green liver symptom and improving growth performance in yearling red sea bream Pagrus major fed nonfishmeal diets based on soy protein concentrate[J]. Fisheries Science, 2010, 76(1): 119-130. DOI:10.1007/s12562-009-0185-y |
| [25] |
贾鹏, 薛敏, 朱选, 等. 饲料蛋氨酸水平对异育银鲫幼鱼生长性能影响的研究[J]. 水生生物学报, 2013, 37(2): 217-226. JIA P, XUE M, ZHU X, et al. Effects of dietary methionine levels on the growth performance of juvenile gibel carp (Carassius auratus gibelio)[J]. Acta Hydrobiologica Sinica, 2013, 37(2): 217-226. |
| [26] |
符策峰, 李松林, 代敏, 等. 海洋性动物水解蛋白对珍珠龙胆石斑鱼生长、饲料利用及体组成的影响[J]. 上海海洋大学学报, 2021, 30(4): 624-633. FU C F, LI S L, DAI M, et al. Effects of marine animal protein hydrolysates on growth, feed utilization and body composition of hybrid grouper (Epinephelus fuscoguttatus ♀×Epinephelus lanceolatus ♂)[J]. Journal of Shanghai Ocean University, 2021, 30(4): 624-633. |
| [27] |
GAYLORD T G, TEAGUE A M, BARROWS F T. Taurine supplementation of all-plant protein diets for rainbow trout (Oncorhynchus mykiss)[J]. Journal of the World Aquaculture Society, 2006, 37(4): 509-517. DOI:10.1111/j.1749-7345.2006.00064.x |
| [28] |
王和伟. 饲料牛磺酸水平对吉富罗非鱼和斜带石斑鱼生长的影响[D]. 厦门: 集美大学, 2013. WANG H W. Effect of dietary taurine level on the growth performance of GIFT tilapia Oreochromis nilotictus and grouper Epinephelus coioides[D]. Xiamen: Jimei University, 2013. |
| [29] |
罗莉, 王琳, 龙勇, 等. 牛磺酸对草鱼生长效应研究[J]. 饲料工业, 2005, 26(12): 22-24. LUO L, WANG L, LONG Y, et al. Study on effects of taurine on growth performance of grass carp[J]. Feed Industry, 2005, 26(12): 22-24. |
| [30] |
KIM S K, TAKEUCHI T, AKIMOTO A, et al. Effect of taurine supplemented practical diet on growth performance and taurine contents in whole body and tissues of juvenile Japanese flounder Paralichthys olivaceus[J]. Fisheries Science, 2005, 71(3): 627-632. DOI:10.1111/j.1444-2906.2005.01008.x |
| [31] |
KANEKO G, YAMADA T, HAN Y N, et al. Differences in lipid distribution and expression of peroxisome proliferator-activated receptor gamma and lipoprotein lipase genes in torafugu and red seabream[J]. General and Comparative Endocrinology, 2013, 184: 51-60. DOI:10.1016/j.ygcen.2013.01.003 |
| [32] |
WU J L, ZHANG J L, DU X X, et al. Evaluation of the distribution of adipose tissues in fish using magnetic resonance imaging (MRI)[J]. Aquaculture, 2015, 448: 112-122. DOI:10.1016/j.aquaculture.2015.06.002 |
| [33] |
XU H G, BI Q Z, PRIBYTKOVA E, et al. Different lipid scenarios in three lean marine teleosts having different lipid storage patterns[J]. Aquaculture, 2021, 536: 736448. DOI:10.1016/j.aquaculture.2021.736448 |
| [34] |
LIU X W, MAI K S, LIUFU Z G, et al. Effects of dietary protein and lipid levels on growth, nutrient utilization, and the whole-body composition of turbot, Scophthalmus maximus, Linnaeus 1758, at different growth stages[J]. Journal of the World Aquaculture Society, 2014, 45(4): 355-366. DOI:10.1111/jwas.12135 |
| [35] |
SEVGILI H, KURTOǦLU A, OIKAWA M, et al. High dietary lipids elevate carbon loss without sparing protein in adequate protein-fed juvenile turbot (Psetta maxima Oreochromis nilotictus)[J]. Aquaculture International, 2014, 22(2): 797-810. DOI:10.1007/s10499-013-9708-8 |
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, Shandong, China;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, Shandong, China
 2022,
Vol. 31
2022,
Vol. 31


