2. 福州鑫恒智海鲜池设备有限公司, 福建 福州 350000;
3. 水域环境生态上海高校工程研究中心, 上海 201306
海产品作为海洋生物资源在解决人口增长、资源短缺等全球性问题方面扮演着越来越重要的角色,对人类生存与发展的重要作用已被广泛认同[1-3]。海产品暂养保活因密度高、代谢废物、排泄物积累导致暂养水中氮等营养盐含量严重超标,危及海产品存活率与品质,甚至造成食品安全等问题[4-6]。海产品属于冷血动物,生活环境温度降低可使其新陈代谢明显减弱,能够有效抑制机体与水中有害微生物的活力及各种酶的活性[7]。然而,目前海产品暂养中珊瑚砂粒子、过滤棉易被污染物覆盖,活性炭出现吸附饱和,清洗困难,水质浑浊,造成暂养对象因氨氮或亚硝酸盐过高及病菌感染而死亡。当含高盐、有机物、氨氮和磷的暂养水排放到河湖或海洋中,会影响水环境质量,对水生生物造成危害[8-9]。因此,迫切需要寻求一种不仅能去除暂养水体中氨氮、有机物等污染物,又能脱盐且经济环保高效的新方法。
微生物脱盐燃料电池(microbial desalination cell,MDC)作为一种集产电、脱盐、脱氮于一体的水处理技术[10-12]与藻类组成的生物电化学系统,能够结合藻类生长速度快、较好的水体净化能力以及生物催化性能,有效去除废水中有机物、氮和磷等营养盐,是很有开发前途的废水处理技术[13-15]。目前关于藻类MDC的研究,存在藻类MDC无法剧烈搅拌,导致大量微藻堆积,不利于微藻生长和系统稳定等问题,且温度是影响藻类MDC性能的重要参数,废水中有机污染物的去除率与阳极液温度有很大关系,在适宜温度下,有机污染物去除效率最高[16-18]。现有研究表明[19-20]不同温度对微生物燃料电池的性能具有很大影响,但温度对藻类MDC影响的研究鲜有报道[21-22],而且对大型海藻MDC的研究更是未见报道。因此,研究温度对藻类MDC性能影响,以及寻求一种可代替微藻微生物电化学系统的能源藻类,具有重大的理论和实践意义。
本研究以海产品暂养水为中间脱盐室进水,以大型海藻浒苔为阴极电子受体,同时运行6套间歇式海藻型MDC,比较6个不同温度(8、10、12、15、20和25 ℃)条件下,海藻型MDC处理海产品暂养水的产电、脱盐、COD降解和脱氮效果以及藻类生长的差异,为海产品低温暂养水的处理提供科技支撑。
1 材料与方法 1.1 样品来源实验接种微生物来自厌氧活性污泥,采自上海临港供排水发展有限公司污水处理厂二沉淀池,海藻浒苔(Ulva prolifera)采集于嵊泗列岛(30°39′37.674″N,122°23′16.6704″E),于灭菌海水中筛选鲜活藻体,软毛刷刷去表面附着物,然后采用高温高压灭菌的人工自配海水,反复清洗2~3次。在光照培养箱中保种:光照强度为50 μmol/(m2 ·s),光周期为12 h L∶ 12 h D,温度15 ℃,培养基采用f/2培养基[23]配制的灭菌人工海水,海水盐度调至35。
1.2 海藻型MDC的构建和启动实验采用有机玻璃制成的三室立方体生物阴极MDC反应器。阴、阳极室及脱盐室有效体积均为200 mL。阴、阳极室与脱盐室分别用阳离子交换膜和阴离子交换膜隔开,交换膜横截面积为12.56 cm2。阴阳极室均采用碳毡作电极,尺寸为4 cm×10 cm,通过钛丝导线将阴阳两极的电极和负载电阻连接形成电流回路。
参照上海世纪联华海产品暂养池中的水质指标(COD 38.47 mg/L,NH4+-N 14.62 mg/L,NO3--N 38.29 mg/L,pH 7.00~8.50,盐度30~35),以海水晶配制海产品暂养水,添加适量葡萄糖、KNO3、NH4Cl、KH2PO4和NaCl配制实验用水,COD为40 mg/L,NH4+-N浓度为15 mg/L,NO3--N浓度为40 mg/L,盐度为35,pH为7.00~8.50。阳极室加入160 mL海产品暂养水和20 mL生活污水以及20 mL厌氧污泥。脱盐室加入200 mL海产品暂养水。阴极室加入200 mL经121 ℃高压蒸汽灭菌20 min后的海产品暂养水,添加10 g浒苔和0.2 mL f/2培养基浓缩液,pH为7.00~8.50。整个反应器置于8、10、12、15、20和25 ℃下启动运行,光照强度为50 μmol/(m2 ·s),光周期为12 h L∶ 12 h D,外接电阻1 000 Ω。反应器采用间歇式运行,当周期内电压低于100 mV时更换阳极液和阴极液,当连续2个周期内输出电压相差不大且周期时间相近时,认为反应器启动成功。
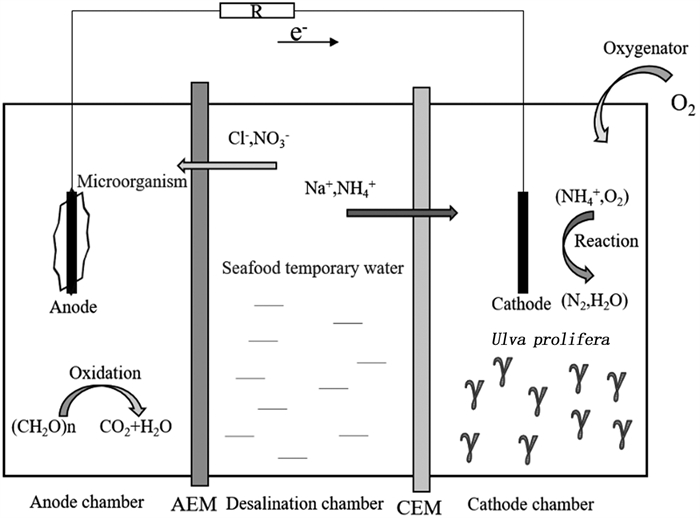
|
图 1 海藻型微生物脱盐电池运行原理示意图 Fig. 1 Schematic diagram of operation principle of seaweed microbial desalination battery |
采用八通道电压测量仪(PTKINS,湖北洛克泰克仪器股份有限公司)进行电压采集。培养后每天定时取水样,测定阳极室中COD浓度和脱盐室中N含量。COD采用高锰酸碱法进行测定,NH4+-N采用纳氏试法进行测定,NO3--N采用紫外分光光度法,TN采用过硫酸钾氧化法,DO、pH和盐度采用哈希水质分析仪测定,检测方法参照《水和废水监测分析方法》(第四版)中相关标准进行。
1.4 生长速率和叶绿素荧光参数的测定实验采用藻体鲜质量观测各温度下浒苔的生长速率。藻体鲜质量(g)=培养后藻体鲜质量-培养前藻体鲜质量。用长镊子取出培养的浒苔,吸水纸吸干藻体表面水分,置于干燥培养皿中采用电子天平称质量。相对生长速率[23] WR(%/d)=100×ln(Wn/Wn-1)/(tn-tn-1),Wn、Wn-1分别为tn、tn-1时藻体的鲜质量。使用双通道荧光仪(Dual-PAM-100)进行叶绿素荧光测定,待测样品在黑暗条件下处理15 min,在培养光强下测定叶绿素荧光诱导曲线,得到最大光化学效率(Fv/Fm)。
2 结果与讨论 2.1 不同温度下反应器的启动与运行温度是影响生物电化学系统性能的重要参数之一。可能影响MDC性能的参数,如内阻、溶液电导率、电极电位和微生物生长等都与温度有关[24]。本文研究了6种不同温度(8、10、12、15、20、25 ℃)对MDC性能的影响。在其它运行环境相同,反应器启动温度不同条件下,反应器输出电压变化情况如图 2所示。6种不同温度条件下,反应器初期电压均不稳定,在0~50 mV之间波动,启动时间较长,这主要是因为反应器启动初期,产电微生物对环境有一个适应过程,微生物生长缓慢,且接种的活性污泥经稀释后微生物菌群略少,导致阳极生物膜产电微生物的富集量较少[15]。随着反应器的不断运行,输出电压在一定时间内均能达到稳定,先缓慢上升达到峰值后趋于稳定,这是因为随着不断驯化,产电微生物适应新的环境,不断生长到对数生长期,使得输出电压逐渐提高到最大值,对底物的利用达到最大,输出电压稳定,而后由于阳极室内底物中营养物质不足,产电微生物处于衰亡期,进行内源呼吸,导致电压快速下降[25-27]。当电压低于100 mV时,更换底物,反应器电压均能缓慢上升并有一个短暂的稳定输出平台,两个相邻周期产电状况一致,电极对产电微生物的选择和富集完成,此时反应器阳极电极已具备了相当数量的生物膜,海藻型MDC启动完成,达到稳定运行状态。
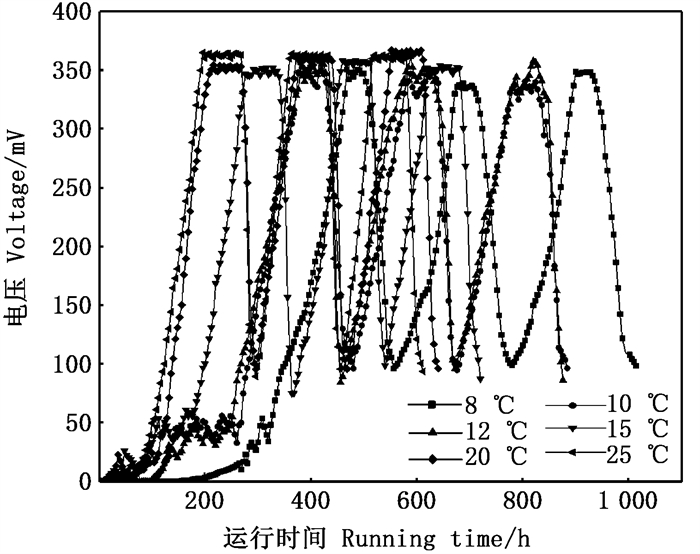
|
图 2 不同温度下启动阶段的电压输出 Fig. 2 Voltage output during startup at different temperature |
由图 2和表 1可知,系统在8、10、12、15、20、25 ℃温度下的最大输出电压无明显差异,电压峰值依次为350、360、361、358、366、364 mV。可见在处理海产品暂养水时,不同温度的输出电压接近,但与孙宇晴[28](500 mV)和徐成龙等[29](510 mV)的输出电压相比,本研究输出电压较低,可能是因为阳极底物浓度较低,阳极微生物降解阳极液有机物基质速率较低,影响底物转化率和产电性能,亦或是低温抑制了产电菌的代谢活性,从而降低了反应器的产电性能。反应器在8、10、12、15、20、25 ℃下达到稳定所需时间依次约为1 014、884、876、720、640、612 h,单个产电周期约为228、198、210、178、172、158 h,单个产电周期内输出电压稳定时间依次为36、44、60、72、80、84 h。低温下反应达到稳定所需时间和单个产电周期较长,且电压稳定时间较短,这主要是因为低温下阳极微生物需要更长的时间来适应环境,导致反应器达到稳定所需时间较长。但低温条件下,海藻型MDC仍能高效运行,且输出电压峰值与中低温无明显差异。

|
表 1 不同温度下MDC电压 Tab.1 MDC voltage at different temperature |
当系统稳定运行时,不同温度条件下单个产电周期内海藻型MDC阳极COD的变化如图 3所示。8、10、12、15、20、25 ℃下出水COD依次为14.50、13.35、9.51、6.63、5.67、5.86 mg/L,去除率依次为66.04 %、68.78%、77.73%、84.38%、85.99%、85.47%。8和10 ℃下COD的去除率约为65%,15 ℃以上去除率达到了85%。这表明随着反应器温度升高,出水COD逐渐降低,COD去除率逐渐升高。低温下COD的去除率低于中低温下的COD去除率,但低温下COD的去除率仍达到了65%以上,说明在低温环境下海藻型MDC仍能稳定运行且对COD有较好的降解效果。COD的去除主要是阳极生物膜上各种微生物自身新陈代谢的结果,海藻型MDC在中低温时有更好地去除效果,最大原因可能是因为阳极挂膜微生物在中低温中能够较好地生长,活性也较高,微生物的代谢速率增加,达到更好地底物降解速率[30],使得反应器有较高的COD去除率。徐成龙等[29]在运行温度25 ℃,阳极进水COD浓度为100 mg/L的1个周期内,COD的去除率约为80%。本研究在相同温度下COD去除率略高,主要是脱盐室内的硝酸盐透过阴离子交换膜进入阳极室内,在阳极室内发生了反硝化反应,消耗了部分COD[26]。

|
图 3 不同温度下COD浓度在1个周期内的降解效果 Fig. 3 Degradation effect of COD concentration in one cycle at different temperature |
不同温度下海藻型MDC脱盐室的盐度变化如图 4所示,进水盐度均为35,盐度下降到5以下时认为脱盐结束,脱盐率由中间脱盐室内的盐度变化来表征。由图 4可知,不同温度下海藻型MDC反应器的脱盐率分别为89.47 %、92.94%、89.38%、91.26%、93.14%、90.20%,脱盐率较高,均达到了90%左右。但不同温度下反应器所需的脱盐时间相差较大,8 ℃所需脱盐时间为184 h,10 ℃、12 ℃和15 ℃所需脱盐时间为168 h,20和25 ℃所需脱盐时间为132 h。要达到相同的脱盐率,低温所需时间是中高温的1.39倍,估计主要是在反应器运行过程中,在电场力驱动下中间盐室中的Na+和Cl-会向两侧阴阳极室移动[27],低温降低了微生物的代谢速率,减缓微生物产生电子;降低电流[31],减缓了Na+和Cl-向两侧阴阳极室的迁移速度,从而导致低温下达到相同脱盐率的脱盐周期较长。低温时反应器的脱盐周期虽较长,但低温下反应器的脱盐率仍能达到90%左右,表明低温条件下,延长反应器运行时间,可提高其脱盐效果。
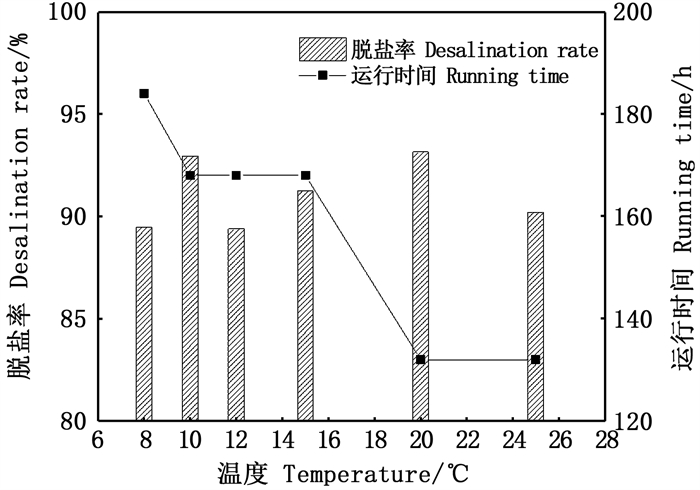
|
图 4 不同温度下脱盐室的脱盐效果 Fig. 4 Desalination effect of desalination chamber at different temperature |
不同温度下海藻型MDC中脱盐室内NH4+-N的变化如图 5所示。在电池运行过程中,中间脱盐室中的阴阳离子在电场力的作用下迁移至阴阳极室,水体中氨氮主要以NH4+离子状态存在,NH4+属阳离子,因此在电池运行过程中,NH4+可通过阳离子交换膜迁移至阴极室,从而使得中间脱盐室中的NH4+-N得以去除[26, 32]。
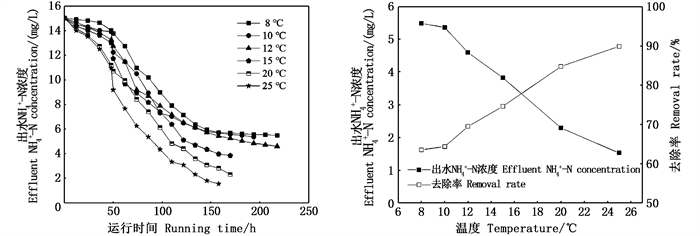
|
图 5 单个产电周期内不同温度下脱盐室NH4+-N的变化 Fig. 5 Variation of NH4+-N in desalination chamber at different temperature in a single power generation cycle |
由图 5可知,在海藻型MDC稳定运行中,单个产电周期内,不同温度条件下,反应器脱盐室中的NH4+-N浓度持续下降,且随着温度的降低,系统对NH4+-N的降解效率逐渐降低,表明低温对海藻型MDC降解NH4+-N有一定的影响。在单个产电周期前期,NH4+-N浓度缓慢持续下降,中期快速下降,后期再逐渐变得缓慢,这主要是与单个产电周期内电压的变化有关,电压缓慢升高,然后快速上升至峰值后稳定,继而再快速下降,电压的高低影响着NH4+的迁移速度,从而影响了NH4+-N浓度的变化。出水NH4+-N浓度依次为5.48、5.36、4.59、3.83、2.30、1.53 mg/L,NH4+-N去除率依次为63.60%、64.41%、69.49%、74.58%、84.75%和89.83%。低温下NH4+-N的降解效果较中低温差,这可能是因为海藻型MDC在脱氮过程中,NH4+在电场力的作用下通过阳离子交换膜转移到阴极室中[26, 31],低温影响了阳极产电微生物的富集,从而影响了反应器电场力对NH4+的驱动作用,导致低温下NH4+的迁移速度较慢。且藻类作为阴极电子受体的同时,还能够吸收系统中的氮源[33],部分NH4+也可通过阳离子交换膜的渗透作用迁移至阴极室内,迁移至阴极室内的NH4+被浒苔吸收,从而使得中间脱盐室中的NH4+-N得以去除,但藻类对营养盐的吸收易受温度的影响,低温降低了浒苔对NH4+的吸收速率[34],进而降低了低温下系统对NH4+-N的降解效率。总体来说,低温下海藻型MDC对NH4+-N仍有一定的去除效果。
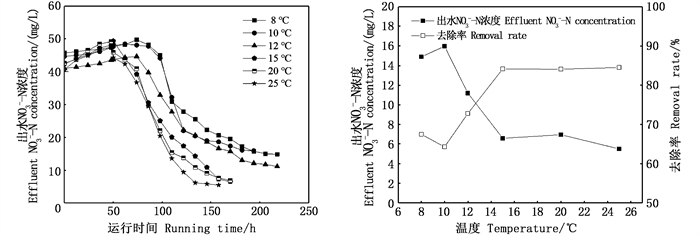
2.4.2 不同温度下NO3--N浓度的变化不同温度下脱盐室内的NO3--N变化如图 6所示。刘哲[26]等研究微生物脱盐燃料电池的脱氮过程中,NO3--N的去除有两种途径:一种途径是NO3-在电场力的作用下逐步迁移至阳极室,中间脱盐室中的NO3-得以去除,另一种途径是脱盐室内的NO3-积累到一定离子强度后,与阳极室之间存在较大浓度差,在渗透作用下,NO3-离子向阳极室迁移。
|
图 6 单个产电周期内不同温度下脱盐室NO3--N的变化 Fig. 6 Variation of NO3--N in desalination chamber at different temperature in a single power generation cycle |
NO3--N的去除和NH4+-N的去除完全不同,在单个产电周期运行期间内,不同温度条件下,脱盐室内的NO3--N浓度先升高后降低。这可能是脱盐室内部分NH4+-N发生硝化反应转化为NO3--N,以及NO3--N降解造成的。在最初的50和74 h内,NO3--N浓度缓慢增加,低温脱盐室中累积的NO3--N浓度明显低于中低温脱盐室中的NO3--N浓度,温度越低,NO3--N的累积越少,表明低温下脱盐室内发生的硝化反应不剧烈,由NH4+-N转化NO3--N的量较少。在50和74 h后,脱盐室的NO3--N浓度逐步缓慢降低,表明中间脱盐室中NO3--N的去除是一个生物电流依赖的过程,NO3-通过电场力作用,迁移至阳极室中,作为电子供体被还原。
单个产电周期运行后,不同温度下,NO3--N浓度分别降低至14.87、15.96、11.18、6.58、6.94、5.50 mg/L,去除率分别为67.46%、64.25%、72.76%、84.12%、84.05%和84.49%,NO3--N在低温下的去除率较低,约为65%,中低温下NO3--N的去除率达到了84%以上,表明低温对海藻型MDC去除NO3--N的效果有一定的抑制作用,但低温下NO3--N的去除率仍能达到60%以上。
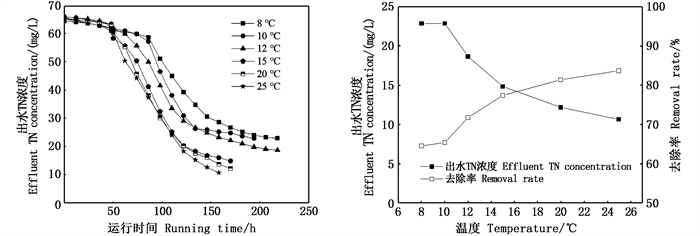
2.4.3 不同温度下TN浓度的变化不同温度下海藻型MDC中脱盐室内TN的变化如图 7所示。在海藻型MDC系统稳定运行后,单个产电周期内,不同温度条件下,脱盐室内的TN浓度呈现递减的态势。脱盐室进水TN浓度约为65 mg/L,初期TN浓度缓慢下降,系统运行至50~74 h,TN浓度快速降低,并于第122~146 h降至30 mg/L以下,去除率达到50%以上,后期随着产电的衰竭,TN浓度缓慢降低,表明海藻型MDC的TN去除效率与单个产电周期内系统产电性能和周期持续时间趋近,TN去除效率与海藻型MDC产电效率呈现相关性的特征。
|
图 7 单个产电周期内不同温度下脱盐室TN的变化 Fig. 7 Variation of TN in desalination chamber at different temperature in a single power generation cycle |
单个产电周期内,不同温度下,TN浓度分别为22.86、22.86、18.66、14.84、12.17、10.64 mg/L,去除率分别为64.55%、65.37%、71.73%、77.38%、81.35%和83.69%。低温下TN的去除率较中低温低,但低温下TN的去除率仍能达到65%左右,表明海藻型MDC在低温下仍有较好的去除效果。
2.5 温度对海藻型MDC中浒苔生长的影响 2.5.1 不同温度下浒苔鲜质量的变化不同温度下海藻型MDC阴极室内浒苔鲜质量变化如图 8所示。浒苔对温度变化表现出不同的适应性,浒苔的鲜质量、分枝及分枝长度等生长指标的变化可直观反映浒苔的生长状况。在海藻型MDC运行过程中,不同温度条件下,阴极室内浒苔鲜质量随温度升高呈现增加的趋势,增加量分别为3.45、4.46、5.56、7.04、9.18和10.41 g。在8~10 ℃的温度下,浒苔生长最慢,鲜质量仅增加了3.5~5.0 g,而20~25 ℃下生长最快,鲜质量增加了9.0~10.5 g,是8~10 ℃的2倍。这表明,温度对阴极室浒苔的生长有显著影响,20~25 ℃下浒苔有较好的生长性能,而低温抑制了浒苔的生长。刘琪琴等[34]研究了不同温度对浒苔生长的影响,发现浒苔在20和25 ℃时生长较快,在15 ℃生长受抑制,这与本研究结果一致。总体来说,浒苔在中低温下生长状况更好,而在低温条件下生长迟缓,说明低温对阴极室内浒苔的正常生长有一定的抑制作用。这主要是在适温范围内,一定程度的温度升高能够加快藻类的代谢,促进藻类的生长,一旦超过这个范围,藻体同化和异化作用减弱、营养吸收减慢、酶活性降低,藻类光合作用受到抑制,进而阻碍藻类的生长[35]。

|
图 8 不同温度下浒苔鲜质量的变化 Fig. 8 Changes of fresh weight of Ulra prolifera at different temperature |
藻类对营养盐的吸收与温度相关,温度是控制大型海藻氮吸收的重要因子,温度对呼吸作用及光合作用暗反应的酶活性有显著影响[34]。在一定的温度范围内,大型海藻对营养盐有较好的吸收效果,超过这个范围就不利于其对营养盐的吸收。高温可显著增加藻体的呼吸作用,减少用于生长的能量,降低藻体的生长,从而减少其对营养盐的吸收,而低温可降低藻体参与光合作用暗反应的酶活性,进而降低营养盐的吸收速率。在不同温度下,氮源对浒苔的生长有显著影响,同一氮源条件下,浒苔对NH4+-N的吸收速率随着温度的过高或过低而降低。在本研究中,低温条件下,海藻型MDC降解NH4+-N的效果较差,NH4+的迁移速度较慢,导致低温条件下海藻型MDC阴极室内浒苔的生长和NH4+-N的吸收速率受到了抑制,而海产品暂养水温度往往在10 ℃左右,表明海产品暂养水由于水温较低,可能会影响浒苔对水中NH4+-N的净化速率。
2.5.2 不同温度下浒苔相对生长率的变化大型海藻的生长是一个通过机体光合作用累积C和N代谢产物的复杂的生理过程,该过程受光照、温度和营养盐等众多生态因子的影响。温度是控制大型海藻氮吸收的重要因子,大型海藻对营养盐的吸收效果在一定的温度范围内,过高或过低均不利于营养盐的吸收。低温条件下,酶活性较低,导致大型海藻对营养盐的吸收速率降低,进而降低藻体的生长速率[34]。相关研究表明,浒苔在水温为5~30 ℃范围内均可正常生长,20~25 ℃为最适生长水温[36]。由图 9可见,本研究在8~25 ℃范围内,浒苔的相对生长速率随温度的降低而降低,可能超过了浒苔的最适生长水温。在相同氮源条件下,温度对浒苔的生长速率有极明显的影响。葛红星等[37]研究了不同温度条件下氮源对浒苔生长速率的影响发现,在22.5~31.5 ℃温度范围内,相同氮源情况下,浒苔的生长速率随温度的升高呈先升高后下降的趋势,可能超过浒苔最适生长范围,这与本研究结果相似。20和25 ℃下,阴极室内浒苔有相似的相对生长速率,与GAO等[38]的研究结果相似,呈现先升高后降低的趋势,这可能是因为藻体过大,藻体光合作用面积被遮盖,降低了藻体光合作用效率,进而降低藻体的相对生长速率。海藻型MDC阴极室内浒苔的相对生长速率可能还受脱盐室内NH4+-N降解速率的影响,海藻型MDC运行期间,脱盐室内NH4+-N不断被降解,在电场力的驱动下迁移至阴极室,从而被阴极室内浒苔吸收,浒苔得以快速生长。脱盐室NH4+-N的降解速率受温度的影响,温度降低,降低了NH4+-N的降解速率,导致迁移至阴极室的NH4+不断减少,降低了阴极室内浒苔对NH4+-N的吸收,进而降低了浒苔的相对生长速率。

|
图 9 不同温度下浒苔相对生长率变化 Fig. 9 Changes of relative growth rate of Ulra prolifera at different temperature |
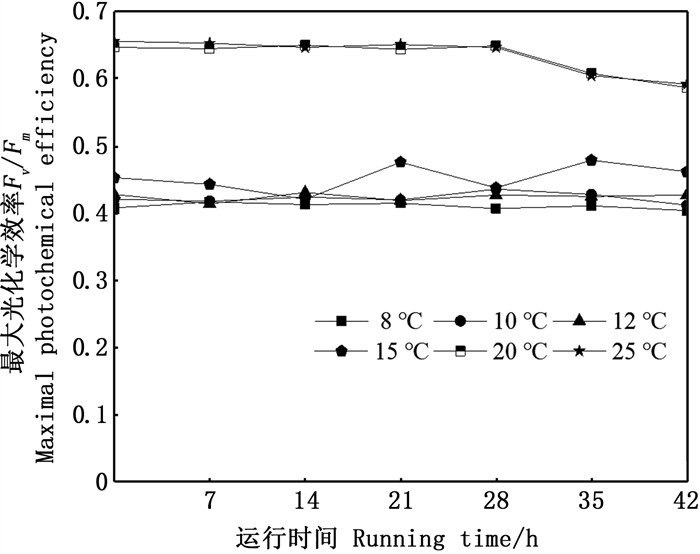
叶绿素荧光可以反映植物光合能力的变化,尤其是光系统Ⅱ(PS Ⅱ)的生理、生化变化。PS Ⅱ的最大量子产量(Fv/Fm)反映了植物潜在的最大光合能力。Fv/Fm能反映植物对光能的利用效率,是反映在各种胁迫下植物光合作用受抑制程度的理想指标[39]。浒苔的生长需要较强的光强和适宜的温度,Fv/Fm是一个较稳定的值,在非环境胁迫条件下极少变化,藻类在不适宜的环境条件下生长时,其自身的光系统会发生不同程度的损伤,最终造成光合作用的下降,因此,Fv/Fm可作为表征浒苔对外界环境因子适用性的一个指标,表征浒苔的生理状态[36]。由图 10可见,不同温度条件下,对海藻型MDC阴极室内浒苔叶绿素荧光参数测定结果表明,在8~25 ℃温度范围内,浒苔的Fv/Fm随温度的降低而逐渐降低,分析原因可能为低温降低了浒苔的呼吸作用和光合作用暗反应的酶活性[34],进而导致其光合作用利用率下降。张珺[36]等研究了不同温度对浒苔生理生态的影响,结果表明浒苔在25 ℃时Fv/Fm达到最大,当温度低于20 ℃时,浒苔对光能的利用能力随温度的降低而逐渐降低,在8、10、12和15 ℃,海藻型MDC持续运行下,浒苔Fv/Fm未发生明显变化,基本维持在0.4~0.5之间。在20、25 ℃下,浒苔Fv/Fm在海藻型MDC运行至28 d开始降低,这可能是由于阴极室内不充足的氮源,使得浒苔生长进入衰亡期,亦或是因为藻体过大,导致藻体接受光照的面积被其他藻体遮盖,从而降低了藻体光合作用效率[23, 40]。总体上,低温条件下,海藻型MDC仍可正常运行,达到处理海产品低温暂养水的目的,且阴极室内浒苔可生长。
|
图 10 不同温度下阴极室浒苔的最大光化学效率(Fv/Fm)的变化 Fig. 10 Changes of maximum photochemical efficiency (Fv/Fm) of Ulra prolifera in cathode chamber at different temperature |
海藻型MDC可直接氧化阳极室中的有机物产生电子,通过将这些电子从阳极转移到阴极来产生电能[41-42]。因此,它们可以用自己产生的能量运行。海藻型MDC主要由3部分组成:中间脱盐室,阳极室和阴极室[43-44]。在阳极室中,产电菌利用有机底物产生电子,电子通过外电路迁移至阴极。在阴极中,自由电子被转移到电子受体,通过还原反应来完成电化学反应,进而产生电流[45-46]。中间脱盐室中的离子,通过阴阳离子交换膜迁移至阳极室和阴极室,这是由于电池两侧之间的电位差产生的电场,以及电化学氧化还原电位导致阳极和阴极电解质中的电荷不平衡[47]。正离子移动到阴极,而负离子移动到阳极。通过将这些离子从盐水中分离出来,完成海水淡化过程[48-49]。同时,中间脱盐室海产品暂养水中的NO3--N和NH4+-N在电场作用下,也可通过阴阳离子交换膜进入阳极室和阴极室,进入阴极室内的NH4+-N被大型海藻浒苔吸收,达到脱氮的目的。
3 结论海藻型MDC在外电阻1 000 Ω的负载运行下,低温和中低温电压峰值和脱盐率无较大差异,而产电周期和脱盐周期差异显著,产电周期分别为228和158 h,脱盐周期分别为184和132 h,低温环境下海藻型MDC仍可产电脱盐。
海藻型MDC阳极COD去除率和脱盐室脱氮性能均存在差异。低温虽对其COD降解效果及脱氮性能有负面影响,但仍能稳定运行,且COD、NH4+-N、NO3--N和TN的去除率均能达到60%以上。
不同温度下,海藻型MDC阴极室浒苔生长存在差异。浒苔的相对生长率和Fv/Fm随温度的降低而降低,但鲜质量仍有增加,因此,低温下大型海藻型MDC阴极室浒苔虽生长缓慢,但仍可保持正常生长。
大型海藻型MDC在海产品低温暂养水处理和海水淡化方面都能稳定高效运行,这对于海产品暂养水处理的应用具有一定的潜力与价值。
| [1] |
FREITAS J, VAZ-PIRES P, CÂMARA J S. From aquaculture production to consumption: freshness, safety, traceability and authentication, the four pillars of quality[J]. Aquaculture, 2020, 518: 734857. DOI:10.1016/j.aquaculture.2019.734857 |
| [2] |
OTTINGER M, CLAUSS K, KUENZER C. Aquaculture: relevance, distribution, impacts and spatial assessments-A review[J]. Ocean & Coastal Management, 2016, 119: 244-266. |
| [3] |
卢家磊, 兰燕月, 张饮江, 等. 基于异构载体的海产品暂养水的协同处理[J]. 环境工程学报, 2020, 14(5): 1191-1200. LU J L, LAN Y Y, ZHANG Y J, et al. Cooperative treatment of temporary aquaculture water of seafood based on heterogeneous carriers[J]. Chinese Journal of Environmental Engineering, 2020, 14(5): 1191-1200. |
| [4] |
徐子涵, 茅林春. 虾保活运输的关键技术及装备研究进展[J]. 食品工业科技, 2018, 39(9): 306-310, 324. XU Z H, MAO L C. Research Progress on key technologies and equipment for live transportation of shrimp[J]. Science and Technology of Food Industry, 2018, 39(9): 306-310, 324. |
| [5] |
张饮江, 汪之和, 沈月新, 等. 日本鳗鲡离水保活技术的初步研究[J]. 水产科技情报, 2005, 32(6): 256-258, 261. ZHANG Y J, WANG Z H, SHEN Y X, et al. Preliminary study on the transportation technique for keeping freshwater Eel Anguilla alive after leaving water[J]. Fisheries Science & Technology Information, 2005, 32(6): 256-258, 261. |
| [6] |
何蓉, 谢晶. 水产品保活技术研究现状和进展[J]. 食品与机械, 2012, 28(5): 243-246. HE R, XIE J. Current status and advances in studies on technology of keeping alive of aquatic products[J]. Food & Machinery, 2012, 28(5): 243-246. |
| [7] |
贾敬敦, 朱蓓薇, 张辉. 现代海洋食品产业科技创新战略研究[M]. 北京: 科学出版社, 2020: 113. JIA J D, ZHU B W, ZHANG H. Research on science and technology innovation strategy of modern marine food industry[M]. Beijing: Science Press, 2020: 113. |
| [8] |
LANANAN F, HAMID S H A, DIN W N S, et al. Symbiotic bioremediation of aquaculture wastewater in reducing ammonia and phosphorus utilizing Effective Microorganism (EM-1) and microalgae (Chlorella sp.)[J]. International Biodeterioration & Biodegradation, 2014, 95: 127-134. |
| [9] |
JOHN E M, KRISHNAPRIYA K, SANKAR T V. Treatment of ammonia and nitrite in aquaculture wastewater by an assembled bacterial consortium[J]. Aquaculture, 2020, 526: 735390. DOI:10.1016/j.aquaculture.2020.735390 |
| [10] |
IMORO A Z, MENSAH M, BUAMAH R. Developments in the microbial desalination cell technology: a review[J]. Water-Energy Nexus, 2021, 4: 76-87. DOI:10.1016/j.wen.2021.04.002 |
| [11] |
陈文婷, 李轩, 付国楷. 不同阴极微生物脱盐电池处理榨菜废水性能及微生物群落分析[J]. 环境工程学报, 2020, 14(10): 2710-2718. CHEN W T, LI X, FU G K. Performance and microbial community analysis in microbial desalination cells with different cathodes for mustard tuber wasterwater treatmment[J]. Chinese Journal of Environmental Engineering, 2020, 14(10): 2710-2718. |
| [12] |
李晖. 堆叠型微生物燃料电池的放大试验研究[D]. 武汉: 武汉科技大学, 2015. LI H. Experimental study on scale-up stacked microbial fuel cells[D]. Wuhan: Wuhan University of Science and Technology, 2015. |
| [13] |
ARUN S, SINHAROY A, PAKSHIRAJAN K, et al. Algae based microbial fuel cells for wastewater treatment and recovery of value-added products[J]. Renewable and Sustainable Energy Reviews, 2020, 132: 110041. DOI:10.1016/j.rser.2020.110041 |
| [14] |
NHAT P V H, NGO H H, GUO W S, et al. Can algae-based technologies be an affordable green process for biofuel production and wastewater remediation?[J]. Bioresource Technology, 2018, 256: 491-501. DOI:10.1016/j.biortech.2018.02.031 |
| [15] |
李德溢. 微藻型微生物燃料电池处理养猪废水特性研究[D]. 西安: 长安大学, 2018. LI D Y. Characteristic study on swine wastewater treatment by microalgae microbial fuel cells[D]. Xi'an: Chang'an University, 2018. |
| [16] |
GOREN A Y, OKTEN H E. Simultaneous energy production, boron and COD removal using a novel microbial desalination cell[J]. Desalination, 2021, 518: 115267. DOI:10.1016/j.desal.2021.115267 |
| [17] |
MIRZAIENIA F, ASADIPOUR A, JAFARI A J, et al. Removal efficiency of nickel and lead from industrial wastewater using microbial desalination cell[J]. Applied Water Science, 2017, 7(7): 3617-3624. DOI:10.1007/s13201-016-0505-1 |
| [18] |
MALAKOOTIAN M, MAHDIZADEH H, NASIRI A, et al. Investigation of the efficiency of microbial desalination cell in removal of arsenic from aqueous solutions[J]. Desalination, 2018, 438: 19-23. DOI:10.1016/j.desal.2018.03.025 |
| [19] |
张筱, 程梦奇, 程梦雨, 等. 人工湿地中植物对低盐度养殖废水处理效果[J]. 上海海洋大学学报, 2021, 30(6): 1024-1033. ZHANG X, CHENG M Q, CHENG M Y, et al. Study on the treatment effect of plants in constructed wetland on low salinity culture wastewater[J]. Journal of Shanghai Ocean University, 2021, 30(6): 1024-1033. |
| [20] |
SONG Y, AN J, CHAE K J. Effect of temperature variation on the performance of microbial fuel cells[J]. Energy Technology, 2017, 5(12): 2163-2167. DOI:10.1002/ente.201700277 |
| [21] |
JADHAV G S, GHANGREKAR M M. Performance of microbial fuel cell subjected to variation in pH, temperature, external load and substrate concentration[J]. Bioresource Technology, 2009, 100(2): 717-723. DOI:10.1016/j.biortech.2008.07.041 |
| [22] |
RAGAB M, ELAWWAD A, ABDEL-HALIM H. Evaluating the performance of Microbial Desalination Cells subjected to different operating temperatures[J]. Desalination, 2019, 462: 56-66. DOI:10.1016/j.desal.2019.04.008 |
| [23] |
孟晓智, 苏贵森, 卓品利, 等. 温度和光照强度对浒苔生长和光合生理特性的影响[J]. 生物学杂志, 2018, 35(4): 49-52, 57. MENG X Z, SU G S, ZHUO P L, et al. Combined effects of temperature and light intensity on the growth and physiological performances of Ulva prolifera[J]. Journal of Biology, 2018, 35(4): 49-52, 57. |
| [24] |
TKACH O, SANGEETHA T, MARIA S, et al. Performance of low temperature Microbial Fuel Cells (MFCs) catalyzed by mixed bacterial consortia[J]. Journal of Environmental Sciences, 2017, 52: 284-292. DOI:10.1016/j.jes.2016.11.006 |
| [25] |
徐成龙. 微生物脱盐电池性能优化及处理盐碱地淋洗水的实验研究[D]. 上海: 上海海洋大学, 2020. XU C L. Performance optimization of microbial desalination cells and treatment of washing water in coastal saline-alkali soil[D]. Shanghai: Shanghai Ocean University, 2020. |
| [26] |
刘哲, 张智, 张林防, 等. 阳极COD对榨菜生产废水MDC产电、脱盐的影响及氨氮去除的微生物群落分析[J]. 环境工程学报, 2020, 14(4): 943-954. LIU Z, ZHANG Z, ZHANG L F, et al. Effect of anode COD on electricity generation and desalination of mustard production wastewater MDC and microbial community analysis under ammonia nitrogen removal[J]. Chinese Journal of Environmental Engineering, 2020, 14(4): 943-954. |
| [27] |
王永琪. 微生物脱盐燃料电池(MDC)用于脱除榨菜废水盐度的优化研究[D]. 重庆: 重庆大学, 2019. WANG Y Q. The optimization study of desalination in mustard tuber wastewater by microbial desalination fuel cell (MDC)[D]. Chongqing: Chongqing University, 2019. |
| [28] |
孙宇晴. 实现海水脱盐与重金属废水处理的MDC技术研究[D]. 哈尔滨: 哈尔滨工业大学, 2014. SUN Y Q. Research on MDC technologies of simultaneous seawater desalination and metallic wastewater treatment[D]. Harbin: Harbin Institute of Technology, 2014. |
| [29] |
徐成龙, 程梦奇, 张饮江, 等. 阳极进水COD浓度对三室空气阴极微生物脱盐燃料电池性能的影响[J]. 应用化工, 2019, 48(10): 2312-2315. XU C L, CHENG M Q, ZHANG Y J, et al. Influence of COD concentration on performance of a three-chambers microbial desalination cells[J]. Applied Chemical Industry, 2019, 48(10): 2312-2315. |
| [30] |
ZÁBRANSKÁ J, ŠTĚPOVÁ J, WACHTL R, et al. The activity of anaerobic biomass in thermophilic and mesophilic digesters at different loading rates[J]. Water Science & Technology, 2000, 42(9): 49-56. |
| [31] |
JACOBSON K S, DREW D M, HE Z. Efficient salt removal in a continuously operated upflow microbial desalination cell with an air cathode[J]. Bioresource Technology, 2011, 102(1): 376-380. |
| [32] |
朱峰. 下流式微生物燃料电池及微生物脱氮电池的研究[D]. 苏州: 苏州大学, 2011. ZHU F. Studies on the down-flow microbial fuel cell and the microbial denitrification cell[D]. Suzhou: Soochow University, 2011. |
| [33] |
刘文娣. 利用微藻处理畜禽废水及其燃料电池制备研究[D]. 北京: 北京化工大学, 2017. LIU W D. Study on treatment of livestock and poultry wastewater and preparation of fuel cells by microalgae[D]. Beijing: Beijing University of Chemical Technology, 2017. |
| [34] |
刘棋琴, 羊芃, 马明婕, 等. 温度对4种大型海藻氮磷吸收效率及光合生理特性的影响[J]. 水生生物学报, 2018, 42(5): 1050-1056. LIU Q Q, YANG P, MA M J, et al. The effects of temperature on the absorption efficiency of nitrogen and phosphorus and photosynthetic physiological charateristics in four macroalgae species[J]. Acta Hydrobiologica Sinica, 2018, 42(5): 1050-1056. |
| [35] |
刘静雯, 董双林. 光照和温度对细基江蓠繁枝变型的生长及生化组成影响[J]. 青岛海洋大学学报, 2001, 31(3): 332-338. LIU J W, DONG S L. Interactions between light and temperature on the growth and levels of chemical constituents of Gracilaria tenuistipitata var. Liui[J]. Journal of Ocean University of Qingdao, 2001, 31(3): 332-338. |
| [36] |
张珺, 周瑞佳, 赵升, 等. 不同盐度、温度及光照对漂浮浒苔生理生态的影响[J]. 海洋开发与管理, 2021, 38(3): 55-60. ZHANG J, ZHOU R J, ZHAO S, et al. Research on the effects of different salinity, temperature and illumination for Enteromorpha prolifera physiological ecology[J]. Ocean Development and Management, 2021, 38(3): 55-60. |
| [37] |
葛红星, 尼倩, 陈钊, 等. 温度对凡纳滨对虾工厂化养殖水体中浮游微藻优势种演替的影响[J]. 福建农林大学学报(自然科学版), 2019, 48(4): 466-473. GE H X, NI Q, CHEN Z, et al. Effects of water temperature on the succession of dominant species of planktonic microalgae in industrial farming ponds of Litopenaeus vannamei[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2019, 48(4): 466-473. |
| [38] |
GAO G, ZHONG Z H, ZHOU X H, et al. Changes in morphological plasticity of Ulva prolifera under different environmental conditions: a laboratory experiment[J]. Harmful Algae, 2016, 59: 51-58. |
| [39] |
王晨光, 郝兴宇, 李红英, 等. CO2浓度升高对大豆光合作用和叶绿素荧光的影响[J]. 核农学报, 2015, 29(8): 1583-1588. WANG C G, HAO X Y, LI H Y, et al. Effects of elevated atmospheric CO2 concentration on soybean photosynthesis and chlorophyll fluorescence parameters[J]. Journal of Nuclear Agricultural Sciences, 2015, 29(8): 1583-1588. |
| [40] |
汤文仲, 李信书, 黄海燕, 等. 不同光强和温度对长石莼(缘管浒苔)光合作用和叶绿素荧光参数的影响[J]. 水产学报, 2009, 33(5): 762-769. TANG W Z, LI X S, HUANG H Y, et al. Effects of different light intensity and temperature treatment on photosynthesis and chlorophyll fluorescence in Ulva linza[J]. Journal of Fisheries of China, 2009, 33(5): 762-769. |
| [41] |
KOKABIAN B, GHIMIRE U, GUDE V G. Water deionization with renewable energy production in microalgae-microbial desalination process[J]. Renewable Energy, 2018, 122: 354-361. |
| [42] |
SARATALE R G, SARATALE G D, PUGAZHENDHI A, et al. Microbiome involved in microbial electrochemical systems (MESs): a review[J]. Chemosphere, 2017, 177: 176-188. |
| [43] |
MA C Y, HOU C H. Enhancing the water desalination and electricity generation of a microbial desalination cell with a three-dimensional macroporous carbon nanotube-chitosan sponge anode[J]. Science of the Total Environment, 2019, 675: 41-50. |
| [44] |
YUAN H Y, ABU-REESH I M, HE Z. Enhancing desalination and wastewater treatment by coupling microbial desalination cells with forward osmosis[J]. Chemical Engineering Journal, 2015, 270: 437-443. |
| [45] |
ARANA T J, GUDE V G. A microbial desalination process with microalgae biocathode using sodium bicarbonate as an inorganic carbon source[J]. International Biodeterioration & Biodegradation, 2018, 130: 91-97. |
| [46] |
ZHANG J Y, YUAN H Y, DENG Y L, et al. Life cycle assessment of a microbial desalination cell for sustainable wastewater treatment and saline water desalination[J]. Journal of Cleaner Production, 2018, 200: 900-910. |
| [47] |
YUAN H Y, SUN S, ABU-REESH I M, et al. Unravelling and reconstructing the nexus of salinity, electricity, and microbial ecology for bioelectrochemical desalination[J]. Environmental Science & Technology, 2017, 51(21): 12672-12682. |
| [48] |
KOKABIAN B, GUDE V G. Sustainable photosynthetic biocathode in microbial desalination cells[J]. Chemical Engineering Journal, 2015, 262: 958-965. |
| [49] |
BARAHOEI M, HATAMIPOUR M S, KHOSRAVI M, et al. Salinity reduction of brackish water using a chemical photosynthesis desalination cell[J]. Science of the Total Environment, 2021, 779: 146473. |
2. Fuzhou Xinhengzhi Seafood Pool Equipment Co. Ltd., Fuzhou 350000, Fujian, China;
3. Engineering Research Center for Water Environment Ecology in Shanghai, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


