2. 上海海洋大学 食品学院, 上海 201306
糖尿病是一种代谢性疾病,表现为高血糖,主要是人体的胰岛素分泌缺陷,也可能是胰岛素生物功能受损,或两者兼有而引起的[1]。近年来糖尿病患者人数在不断上升,预计到2 045年全球糖尿病患者约6.93亿人[2],这主要是因为生活方式的改变使人类的“节约基因”发生改变,能量储存能力减退,其次是人们的自我保健意识增强,主动检查和预防而使数据更为准确。Ⅱ型糖尿病(type two diabetes mellitus, T2DM)为最常见的糖尿病类型,占糖尿病患者总数的90%以上[3]。此外,糖尿病还会引发多种并发症,包括肥胖、高血压、高胆固醇、心血管疾病和肾功能衰竭等[4],严重威胁机体健康,因此T2DM的治疗对于健康的恢复尤为重要。治疗T2DM目前是注射胰岛素或通过药制剂刺激胰岛素分泌来提高体内胰岛素的水平[5]。二肽基肽酶-Ⅳ(dipeptidyl peptidase-Ⅳ, DPP-Ⅳ)抑制剂可抑制体内DPP-Ⅳ对葡萄糖依赖性促胰岛素多肽(glucose-dependent insulinotropic polypeptide, GIP)和胰高血糖素样肽-1 (glucagon-like peptide-1, GLP-1)的降解,从而延长肠促胰岛素的半衰期,维持餐后胰岛素的稳态[6]。临床上已开发的DPP-Ⅳ抑制类药物,包括西他列汀(Sitagliptin)、维达列汀(Vildagliptin)、沙格列汀(Saxagliptin)、阿格列汀(Alogliptin)和利格列汀(Linagliptin)等,这些抑制剂对于糖尿病具有一定的治疗作用[7]。然而,列汀类药物会产生某些副作用,如引起严重的过敏反应以及出血性或坏死性急性胰腺炎等症状[8]。
生物活性肽是指蛋白质经过酶水解后释放出特定生理功能的特殊蛋白质片段[9],与传统合成药物相比,天然食物衍生的活性肽更安全、毒副作用更小,因此利用食物蛋白制备活性肽抑制DPP-Ⅳ活性更加符合人类的健康需求[10]。酶解法是制备生物活性肽的主要方法,具有来源广泛、安全性高、毒副作用小和可长期服用等优点[11]。当前,利用酶解法已从陆源生物蛋白中得到多种DPP-Ⅳ抑制肽,如从核桃蛋白[12]、小米蛋白[13]、乳清蛋白[14]、猪胶原蛋白[15]中均可获得DPP-Ⅳ抑制肽。与陆源生物相比,海洋生物为了适应海洋中的高盐、低温、高压和低氧等环境,使得海洋源蛋白的氨基酸组成和氨基酸序列不同于陆源蛋白[16],常见的鱼类、虾类、贝类、藻类、棘皮类生物都含有丰富的蛋白质,因此海洋生物蛋白有可能成为制备DPP-Ⅳ抑制肽的重要资源。本文综述海洋生物蛋白源DPP-Ⅳ抑制肽的酶法制备、分离纯化、结构鉴定及功能活性评价,旨在为海洋生物蛋白源DPP-Ⅳ抑制肽功能性食品的研发提供一定参考价值。
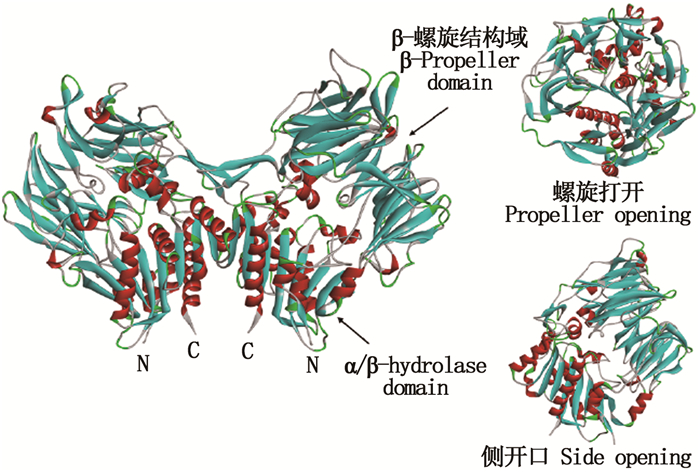
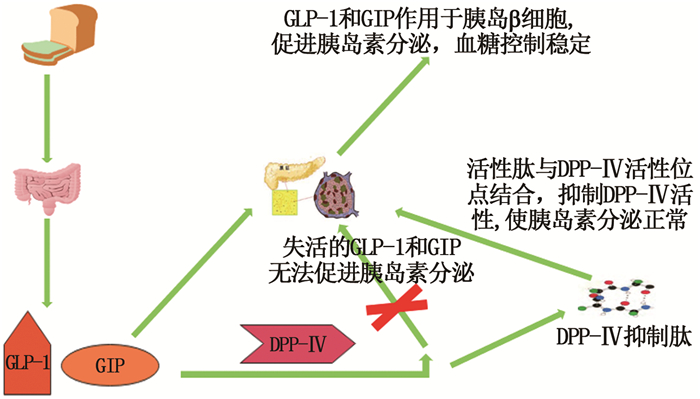
1 DPP-Ⅳ抑制肽的作用机理DPP-Ⅳ是一种丝氨酸蛋白酶,其三级结构如图 1所示,在人体大脑、胰腺和肾脏等组织中均有表达,其重要的作用底物为肠促胰岛素,包括GLP-1和GIP[17]。GLP-1和GIP可通过促进胰腺葡萄糖依赖性胰岛素分泌、抑制胰腺胰高血糖素释放、刺激细胞增殖和存活、延迟胃排空和调节食欲在葡萄糖稳态中发挥着关键作用[6]。由图 2可知,食物摄入体内后,会促进GLP-1和GIP分泌,GLP-1和GIP与特异性受体结合后可刺激并增加胰腺β细胞中葡萄糖依赖性胰岛素分泌,维持体内血糖正常水平[18]。然而,GLP-1和GIP作为DPP-Ⅳ的天然底物,极易在DPP-Ⅳ的作用下被切割并降解,从而丧失其生理功能[19]。因此,DPP-Ⅳ抑制肽可以保护肠促胰岛素免受DPP-Ⅳ酶破环,延长其半衰期,有效发挥其生理功能,防止血糖水平异常。
|
图 1 人DPP-Ⅳ的三级结构[23] Fig. 1 Structure of human DPP-Ⅳ |
|
图 2 DPP-Ⅳ抑制肽的作用机制[1] Fig. 2 Mechanism of action of DPP-Ⅳ inhibitory peptide |
DPP-Ⅳ抑制肽中某些氨基酸可与DPP-Ⅳ活性位点通过疏水作用、氢键和范德华力等作用力发生竞争性或非竞争性结合,从而抑制DPP-Ⅳ的活性。如:JIN等[20]研究发现,短肽LDKVFR对DPP-Ⅳ的作用为竞争性抑制,短肽VLATSGPG对DPP-Ⅳ的作用为非竞争性抑制;HONG等[21]研究发现,短肽WGDEHIPGSPYH对DPP-Ⅳ的作用为非竞争性抑制。尽管DPP-Ⅳ抑制肽降血糖作用的机制尚未完全明确,但大多研究认为疏水性氨基酸如Ala、Ile、Leu、Phe、Pro、Met、Trp和Val的存在有助于增强DPP-Ⅳ抑制肽的活性,提高DPP-Ⅳ抑制率[22]。
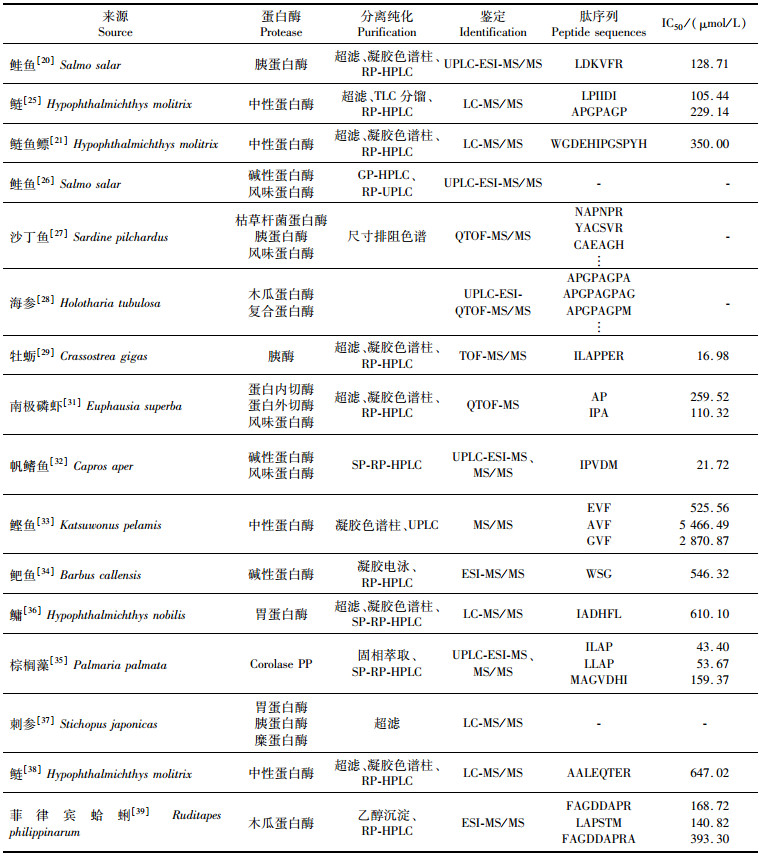
2 海洋蛋白源DPP-Ⅳ抑制肽的酶法制备酶具有专一性、高效性、温和性和多样性等特点,是当前从海洋天然产物制备功能活性物质的重要辅料。已发现多种蛋白酶可用于制备DPP-Ⅳ抑制肽,包括胃蛋白酶、胰蛋白酶、木瓜蛋白酶、碱性蛋白酶、中性蛋白酶、风味蛋白酶等,在实际工作中可选择单酶水解也可选择复合酶水解,而不同蛋白酶水解不同底物时可产生不一样的效果,因此对酶解工艺进行优化尤为重要[24]。在实际的工作中需要进行单因素实验或响应面试验优化酶解条件以获得最佳酶解工艺。表 1列出了利用酶解法从海洋生物中制备DPP-Ⅳ抑制肽的方法和结果。
|
表 1 海洋生物蛋白源DPP-Ⅳ抑制肽的制备、分离纯化及结构鉴定 Tab.1 Preparation, purification and identification of marine biological protein source DPP-Ⅳ inhibitory peptides |
ZHANG等[25]以鲢(Hypophthalmichthys molitrix)蛋白为原料,通过研究发现中性蛋白酶为最佳用酶,酶解后得到具有DPP-Ⅳ抑制作用的活性肽AGPPGPSG、APGPAGP、LPIIDI和ALAPSTM。HONG等[21]利用木瓜蛋白酶、菠萝蛋白酶、碱性蛋白酶、中性蛋白酶和风味蛋白酶酶解鲢鱼鳔制备DPP-Ⅳ抑制肽,也表明采用中性蛋白酶水解5 h获得的水解物有较高的DPP-Ⅳ抑制活性。HARNEDY等[26]研究用碱性蛋白酶和风味蛋白酶复合水解大西洋鲑鱼(Salmo salar)鱼皮明胶,水解度相对较高,且水解产物促胰岛素分泌和GLP-1分泌活性最高,在体外表现出显著的抗糖尿病活性。RIVERO-PINO等[27]发现先利用枯草杆菌蛋白酶水解沙丁鱼(Sardine pilchardus)蛋白质使水解度达到20%时,再加入胰蛋白酶和风味蛋白酶,可提高DPP-Ⅳ抑制肽NAPNPR、YACSVR和CAEAGH的获得率。刘志彤等[28]优化了海参(Holotharia tubulosa)DPP-Ⅳ抑制肽的制备条件,即木瓜蛋白酶与复合蛋白酶添加比例为1:1(质量比),加酶量为1%,酶解时间4 h,该条件下获得的酶解组分对DPP-Ⅳ的抑制率为66.97%。陈宏等[29]则研究建立了牡蛎(Crassostrea gigas)DPP-Ⅳ抑制肽最佳酶解条件:胰蛋白酶加酶量为0.8%、pH 8.0、温度37 ℃,酶解时间90 min。利用响应曲面设计方法也可获得最佳酶解条件,如吉薇等[30-31]利用动物蛋白水解酶对南极磷虾(Euphausia superba)蛋白进行酶解,最佳工艺:酶解时间3.85 h、温度45 ℃、pH 7.58、酶添加量237.55 U/g,水解产物对DPP-Ⅳ的抑制率为64.78%,获得两种活性较强的DPP-Ⅳ抑制肽AP和IPA。
除了上述海洋生物蛋白可用于制备DPP-Ⅳ抑制肽,其他海洋蛋白源也可应用于DPP-Ⅳ抑制肽的制备,如从帆鳍鱼(Capros aper)[32]、鲣鱼(Katsuwonus pelamis)[33]、鲃鱼(Barbus callensis)[34]、棕榈藻(Palmaria palmata)[35]中可制备得到的DPP-Ⅳ抑制肽也具有较高的活性。然而目前关于海洋虾类、贝类、藻类及其他生物中制备的DPP-Ⅳ抑制肽要比从海洋鱼类中制备的DPP-Ⅳ抑制肽少。因此,针对海洋虾、贝、藻类等生物DPP-Ⅳ抑制肽的研究仍具有很大的开发空间。
3 DPP-Ⅳ抑制肽的分离纯化食物蛋白质经过酶解后,酶解液中含有许多不同分子量、不同序列的肽及各种游离氨基酸,其中部分为无效成分,可能会对DPP-Ⅳ抑制肽的抑制活性产生不利影响,为了更高活性的DPP-Ⅳ抑制肽的富集和肽序列的鉴定,必须对酶解产物进行分离纯化处理。常用的分离纯化技术包括超滤(ultrafiltration)、离子交换色谱法(ion exchange chromatography, IEC)、凝胶色谱法(size exclusion chromatography, SEC)和反向高效液相色谱法(high performance liquid chromatography, RP-HPLC)等。
3.1 超滤超滤根据膜孔的大小而截留不同分子量的蛋白质及多肽,常应用于DPP-Ⅳ抑制肽的初级分离[40],见表 1。陈宏等[29]用3 ku超滤膜超滤牡蛎蛋白酶解液,<3 ku组分的IC50值为1.41 mg/mL,显著低于3 ku组分的IC50值,分子量越低则具有更高的DPP-Ⅳ抑制活性。吉薇等[31]将南极磷虾蛋白酶解物依次通过截留分子量为5 ku、3 ku、100 u的超滤膜,发现分子量为100~3 000 u活性肽具有最高的DPP-Ⅳ抑制活性,该组分的IC50值为0.833 mg/mL。此外,将蛋白水解物依次通过截留分子量为5 ku和3 ku的超滤膜,可实现大西洋鲑鱼皮和鳙(Hypophthalmichthys nobilis)蛋白DPP-Ⅳ抑制肽的初分离,其中从大西洋鲑鱼皮蛋白酶解物中<3 ku的组分DPP-Ⅳ抑制活性最高,IC50值为1.54 mg/mL,鳙鱼蛋白酶解物中对DPP-Ⅳ抑制率最高的组分其分子量<3 ku,该组分对DPP-Ⅳ抑制率约为85%[20, 36]。将鲢鱼鳔和鲢肌肉蛋白酶解物依次通过截留分子量为10 ku、5 ku和3 ku的超滤膜,发现两者DPP-Ⅳ抑制率最高的组分分子量均<3 ku,抑制率分别为84%和55.64%[21, 25]。GONG等[37]通过将刺参(Stichopus japonics)蛋白酶解物依次通过截留分子量为30 ku、10 ku和3 ku的超滤膜后,分子量<3 ku的组分对DPP-Ⅳ抑制活性最好,该组分可用于后续的纯化鉴定中。除了使超滤膜可实现DPP-Ⅳ抑制肽的初分离,利用乙醇沉淀方法也可实现目标产物的初分离,如利用60%乙醇溶液通过离心将菲律宾蛤蜊(Ruditapes philippinarum)水解产物分离成上清液和沉淀,达到菲律宾蛤蜊水解产物分离纯化目的[39]。
尽管超滤技术已广泛应用于DPP-Ⅳ抑制肽的分离纯化中,但超滤法只能实现DPP-Ⅳ抑制肽的初分离,分离后组分中DPP-Ⅳ抑制肽的纯度仍然较低,要想获得纯度和活性更高的肽段,需要运用更加精细的分离技术,如色谱分离技术。
3.2 色谱分离DPP-Ⅳ抑制肽的色谱分离法主要包括离子交换色谱法(IEC)、凝胶色谱法(SEC)和反向高效液相色谱法(RP-HPLC)等[41]。然而在实际的分离纯化中,单一的分离技术很难实现DPP-Ⅳ抑制肽的多级分离,因此一般采用两种方法结合共同实现活性肽的纯化,见表 1。如HARNEDY等[35]通过C18基质固相萃取(SPE)柱,然后再使用RP-HPLC从掌状红皮藻水解物中获得3种纯化DPP-Ⅳ抑制肽ILAP、LLAP和MAGVDHI。JIN等[20]使用了Sephadex G-25凝胶过滤和RP-HULC方法,从大西洋鲑鱼皮水解物中分离纯化出活性最高的DPP-Ⅳ抑制肽LDKVFR。通过Sephacryl-100凝胶过滤和RP-HPLC对超滤后的南极磷虾水解物、鲢鱼鳔蛋白水解物和牡蛎蛋白水解物中获得纯化的DPP-Ⅳ抑制肽[21, 29]。此外,在鲃鱼、鳙和鲢肌肉蛋白DPP-Ⅳ抑制肽的纯化中应用了SEC和RP-HPLC相结合的方法[34, 36, 38]。不同的色谱分离方法相互联用,集中了各种方法的优势,实现了DPP-Ⅳ抑制肽的再次分离,为后续多肽序列的鉴定提供了纯度更高的组分。
4 DPP-Ⅳ抑制肽体内外活性评价 4.1 体外活性评价大部分研究对于DPP-Ⅳ抑制肽活性的测定都涉及体外抑制活性的测定。DPP-Ⅳ抑制肽体外活性的测定方法为荧光底物法和发色底物法[42](表 1)。荧光底物法是指DPP-Ⅳ催化底物Gly-Pro-AMC生成Gly-Pro和带有荧光的AMC,在激发波长380 nm和发射波长460 nm处有特定吸收峰,通过测定AMC的荧光度值来反映酶活高低[43]。在评价鲑鱼皮[20]、鲑鱼明胶[26, 44]、牡蛎[29]、南极磷虾[31]、帆鳍鱼[32]、鲣鱼[33]、鲃鱼[34]、蓝鳕鱼(Micromesistius poutassou)[45]和钝顶螺旋藻(Spirulina platensis)[46]等水解产物的体外DPP-Ⅳ抑制活性时,均采用了荧光底物法。发色底物法是指DPP-Ⅳ催化底物Gly-Pro-pNA生成Gly-Pro和黄色的对硝基苯胺,后者在405 nm处有吸收峰,测定发色基团的吸光度值可判断酶活的高低。在研究鲢[25, 38]、鲢鱼鳔[21]、沙丁鱼[27]、鳙[36]、大比目鱼(Hippoglossus stenolepis)[47]、海参[28]、刺参[37]、菲律宾蛤蜊[39]、棕榈藻[35]和小球藻(Chlorella vulgaris)[48]等水解物的体外DPP-Ⅳ抑制活性时,采用了发色底物法。
上述2种方法均可测定DPP-Ⅳ抑制肽的活性,且操作简单,易于掌握。然而荧光底物法的成本、技术和仪器要求均比较高,不适宜普通实验室的大规模应用;而利用发色底物法测定可能会出现假阳性反应,进而影响判断结果。
4.2 细胞实验在糖尿病的控制中,可选择抑制DPP-Ⅳ的生物活性,提高体内GLP-1和GIP的含量,增加细胞对葡萄糖的摄取量,因此可通过细胞实验评估DPP-Ⅳ抑制肽是否具有上述功能,从而判定其降血糖功效,常用于评价DPP-Ⅳ抑制肽活性的细胞系有6种(表 2)。(1)BRIN-BD11细胞系:胰岛素分泌细胞对葡萄糖的反应,分析DPP-Ⅳ抑制肽对细胞胰岛素分泌的影响。HARNEDY等[26]利用BRIN-BD11细胞测定大西洋鲑鱼明胶水解物促胰岛素分泌的影响,发现该水解物能促进细胞素的分泌;相同地,从帆鳍鱼蛋白酶解物中分离的DPP-Ⅳ抑制肽IPVDM可有效促进BRIN-BD11细胞中胰岛素的分泌[32]。(2)GLUTag细胞系:利用ELISA技术测定细胞中GLP-1的分泌量。如蓝鳕鱼蛋白和大西洋鲑鱼明胶酶解物可促进GLUTag细胞中GLP-1的分泌,从而促进胰岛素的分泌,起到降低血糖水平的作用[26, 45]。(3)3T3-L1细胞系:通过荧光法测定脂肪细胞中葡萄糖的吸收量,如通过3T3-L1细胞实验发现蓝鳕鱼蛋白酶解物可增加摄取葡萄糖量,起到降糖作用[45],刺参蛋白水解物可改善3T3-L1细胞胰岛素抵抗及葡萄糖摄取量[37]。(4)Caco-2细胞系:可表达DPP-Ⅳ,用于测定DPP-Ⅳ抑制肽基于细胞原位DPP-Ⅳ的抑制活性,从鲢鱼鳔、鲣鱼和钝顶螺旋藻中获得的DPP-Ⅳ抑制肽均能有效抑制Caco-2细胞中DPP-Ⅳ活性[21, 33, 46]。(5)INS-1细胞系:大鼠胰岛细胞瘤细胞,可合成胰岛素原Ⅰ和Ⅱ。HONG等[21]发现活性肽WGDEHIPGSPYH和IPGSPY可增加INS-1细胞中胰岛素的分泌,这可能是活性肽充当了GLP-1模拟物或诱导细胞表达刺激葡萄糖依赖性胰岛素释放的受体,从而促进胰岛素分泌,发挥降血糖作用。(6)Hep G2细胞系:检验DPP-Ⅳ抑制肽能否改善Hep-G2肝细胞胰岛素抵抗情况。如刺参蛋白水解物可有效改善Hep-G2肝细胞胰岛素抵抗情况,增加细胞对葡萄糖的摄取量,降低血清葡萄糖水平[37]。不同细胞系已被应用于DPP-Ⅳ抑制肽的活性评价中,并显示出部分DPP-Ⅳ抑制肽具有一定的降血糖效果。

|
表 2 DPP-Ⅳ抑制肽的细胞及体内研究 Tab.2 Cellular and in vivo study of DPP-Ⅳ inhibitory peptide |
有些研究通过进一步模拟胃肠液消化来考察DPP-IV抑制肽抗消化的稳定性,如从牡蛎中获得的DPP-Ⅳ抑制肽EITALAPSTMK和ILAPPER。由于肽段EITALAPSTMK较长,通过BIOPEP在线预测模拟胃肠液消化后为肽段APSTM。合成肽APSTM和ILAPPER,测得IC50值分别为354.81 μmol/L和16.98 μmol/L,七肽ILAPPER的IC50值接近于阳性对照抑制肽Ile-Pro-Ile(Diprotin A)的IC50值12.45 μmol/L,表明肽段APSTM和ILAPPER具有良好的消化稳定性[29]。经胃肠模拟消化后,从牛、羊乳酪蛋白酶解产物获得的活性肽DPP-Ⅳ抑制活性基本维持稳定,其中所含有效序列MHQPPQPL、HPINHR和YPVEPF不存在消化酶酶切位点,表现出较稳定的抗消化道酶水解能力[49]。从鲑鱼副产物中获得的蛋白酶解产物在进行模拟胃肠液消化后仍保留其GLP-1分泌和DPP-Ⅳ抑制活性,并且提高了胰岛素分泌活性[26]。此外,从帆鳍鱼中获得的具有DPP-Ⅳ抑制活性的组分在经过体外模拟胃肠消化液后,其DPP-Ⅳ抑制活性及总体肽谱并未发生显著性差异,说明该组分能抵抗胃肠酶的消化降解[32]。尽管部分DPP-Ⅳ抑制肽在体外具有抵抗胃肠液消化能力,但对于DPP-Ⅳ抑制肽的应用方面来说,还需要更加深入的动物实验和人体实验。
4.3 动物实验生物活性肽在到达作用靶点前会在体内发生一系列的生理生化反应,导致其生物利用度和稳定性发生改变。因此,活性肽应用于人体前需要进行动物实验,评价其在人体内的活性效果及安全性,但目前有关DPP-Ⅳ抑制肽在人体中经过口服作用会产生怎样变化鲜有相关报道,有关DPP-Ⅳ抑制肽在小鼠体内的作用效果见表 2,通过构建糖尿病动物模型,对动物进行给药处理,根据给药前后动物的葡萄糖耐受量或测定动物血浆中的DPP-Ⅳ活性来判定活性肽的DPP-Ⅳ抑制活性。诱导糖尿病小鼠模型的方法主要有营养诱导糖尿病肥胖模型、化学诱导的糖尿病非肥胖模型和基因敲除模型。
WANG等[47]通过给雄性Sprague-Dawley鼠注射链脲佐菌素(streptozotocin, STZ)缓冲液一周,成功建立了糖尿病小鼠模型,证明了大比目鱼皮明胶酶解物能使血浆中DPP-Ⅳ活性降低,并提高GLP-1浓度和胰岛素水平,口服葡萄糖耐量实验(oral glucose tolerance test,OGTT)期间血糖降低。HSIEH等[50]利用STZ诱导的糖尿病鼠作为动物模型,证明了大西洋鲑鱼皮明胶水解物能促进小鼠血浆中GLP-1和胰岛素的分泌和OGTT期间血糖的降低。ZHU等[48]测定合成的小球藻蛋白DPP-Ⅳ抑制肽对小鼠血清中DPP-Ⅳ的IC50值发现:在小鼠血清中测定的合成肽的DPP-Ⅳ抑制活性的IC50值要低于体外实验测定结果,说明小球藻蛋白来源的DPP-Ⅳ抑制肽在体内能发挥着较好的抑制作用。由于大、小鼠的饲养方法简单,并且基因序列和人类的差不多,因此可应用于DPP-Ⅳ抑制肽活性评价的动物模型构建。
5 DPP-Ⅳ抑制肽的结构鉴定及构效关系DPP-Ⅳ抑制肽的活性主要与其分子量大小、氨基酸的种类和序列有关,鉴定肽的氨基酸序列对DPP-Ⅳ抑制肽构效关系的认识具有重要的意义。鉴定DPP-Ⅳ抑制肽一般使用分离技术和质谱联用方法,如HPLC-串联质谱(tanden mass spectrometry, MS/MS)、基质辅助激光解吸电离飞行时间(matrix-assisted laser desorption ionization time-of-flight, MALDI-TOF)-MS、UPLC(ultra-performance liquid chromatography)-带有电喷雾电离(electrospray ionization,ESI)-MS/MS和飞行时间(quadrupole time-of-flight,QTOF)-MS等[51],见表 1。利用TOF-MS/MS鉴定牡蛎DPP-Ⅳ抑制肽序列,其氨基酸序列为EITALAPSTMK和ILAPPER[29]。通过QTOF-MS可从南极磷虾酶解物中鉴定得到2种具有DPP-Ⅳ抑制活性的短肽,其氨基酸序列为AP和IPA[31]。此外,利用其他技术也可成功实现DPP-Ⅳ抑制肽的鉴定,如UPLC-ESI-QTOF-MS/MS可从海参酶解物中鉴定得到具有DPP-Ⅳ抑制作用的28种短肽,包括APGPAGPA、APGPAGPAG和APGPAGPM等[28];ESI-MS/MS从纯化的鲃蛋白水解组分SF4中鉴定出DPP-Ⅳ抑制活性较高的两种肽Trp-Ser-Gly和Phe-Ser-Asp[34];UPLC-ESI-MS/MS可用于帆鳍鱼DPP-Ⅳ抑制肽序列的鉴定,分析得到其氨基酸序列为IPVDM[32],并且利用该技术从大西洋鲑鱼皮蛋白酶解组分中成功鉴定得到一种新型的DPP-Ⅳ抑制肽LDKVFR[20, 35]。
海洋生物源DPP-Ⅳ抑制肽的抑制活性与其分子量、氨基酸的种类和排列顺序都有着密切的关系,对其构效关系进行研究,有利于在实际生产中应用。从表 1和表 2可看出,从海洋生物蛋白中制备获得DPP-Ⅳ抑制活性肽的分子量为2~16个氨基酸。除分子量外,DPP-Ⅳ抑制肽的活性与其氨基酸的组成具有一定相关性,这可能是由某些特殊氨基酸如疏水性氨基酸的结构特征而决定的(表 3)。据文献[52]报道,DPP-Ⅳ可优先从活性肽N末端切割X-Pro或X-Ala二肽,而当Pro位于多肽序列N末端1位、2位、3位或4位时,这一类活性肽可能具有更高的DPP-Ⅳ抑制活性[35]。IPI是迄今为止所有研究中抑制效果最强的DPP-Ⅳ抑制肽,具有上述结构,同时也说明了Pro及其在活性肽序列中的位置对DPP-Ⅳ抑制肽活性的发挥具有重要作用[53]。从南极磷虾和帆鳍鱼蛋白水解物中分别鉴定得到DPP-Ⅳ抑制活较强的短肽IPA和IPVDM,这2种肽段均含有IP-结构,与短肽IPI结构具有相似性[31-32]。大西洋鲑鱼鱼皮明胶中DPP-Ⅳ抑制活性很强的2种肽GPAE和GPGA[54],以及从鲢中获取的DPP-Ⅳ抑制肽LPIIDI和APGPAGP[25],这些活性肽的N末端第二个氨基酸均为Pro;大比目鱼皮DPP-Ⅳ抑制肽:SPGSSGPQGFTG、PPGPTGPRGQPGNIGF和GPVGPAGNPGANGLN,N端的第二个氨基酸均为Pro[47],并且Pro是序列中唯一的亚氨基酸,进一步说明了Pro在DPP-Ⅳ抑制肽中的重要性。除了Pro外,Ala位于活性肽的N末端特定位置上的DPP-Ⅳ抑制肽也具有较强的抑制作用,如从沙丁鱼蛋白酶解物中鉴定的短肽NAPNPR和YACSVR[27]、鳙鱼活性肽IADHFL[36]以及菲律宾蛤蜊活性肽FAGDDAPR、LAPSTM和FAGDDAPRA[39],这些短肽序列中Ala及其特殊位置均有利于增强DPP-Ⅳ抑制肽抑制作用。活性肽ILAPPER[29]、ILAP和LLAP[35]对DPP-Ⅳ具有较好的抑制活性,说明亮氨酸、异亮氨酸等其他疏水性氨基酸的存在可能有助于提高DPP-Ⅳ抑制肽的活性。

|
表 3 DPP-Ⅳ抑制肽的构效关系 Tab.3 Structure-activity relationship of DPP-Ⅳ inhibitory peptides |
总的来说,DPP-Ⅳ抑制肽的构效关系的揭示对其应用至关重要。尽管目前对于DPP-Ⅳ抑制肽氨基酸种类和氨基酸位置与DPP-Ⅳ之间的构效关系并未十分清楚,但随着研究的不断深入,两者之间相互作用关系将会越来越明确,更加利于DPP-Ⅳ抑制肽的生产利用。
6 总结与展望通过对国内外DPP-Ⅳ抑制肽的来源、分离纯化、结构鉴定、功能活性评价及构效关系的综述,揭示了食源性DPP-Ⅳ抑制肽有望发展为降血糖功能性食品。从已报道的文献来看,DPP-Ⅳ抑制肽大多为寡肽,分子量通常<3 ku,这可能是由于分子量小的活性肽更容易被吸收。此外,一些疏水氨基酸在降血糖作用中也发挥着重要的作用,如Ala、Gly、Ile、Leu、Phe、Pro、Met、Trp和Val等。然而,从应用的角度,还存在着一些问题有待解决:第一,对海洋生物来源的虾类、贝类和藻类的DPP-Ⅳ抑制肽的研究较少。第二,蛋白质水解产物含有多种肽段,但并不是所有的肽段都具有降血糖功能,分离纯化具有较高活性的目标肽过程复杂,并且获得的量较低。第三,关于DPP-Ⅳ抑制肽的研究大多停留在体外研究的水平,只有少数涉及到细胞及动物实验,相关的人体实验开展更加缺少,DPP-Ⅳ抑制肽在人体内的利用及安全性需要更加详细的评估。第四,当前对于DPP-Ⅳ抑制肽的研究缺少对其感官性质的评价,大多研究显示出疏水氨基酸对DPP-Ⅳ抑制活性具有一定的影响,但该类氨基酸会导致产生苦涩味道,因此开发口感更好DPP-Ⅳ抑制肽也成为了发展方向。随着国内对于DPP-Ⅳ抑制肽的不断深入研究,从海洋生物蛋白源中开发DPP-Ⅳ抑制肽并应用于糖尿病的治疗具有较好的发展前景。
| [1] |
董宇婷, 王荣春. 降糖肽的发展现状及研究进展[J]. 生物信息学, 2018, 16(2): 83-89. DONG Y T, WANG R C. The status quo and research progress of hypoglycemic peptide[J]. Chinese Journal of Bioinformatics, 2018, 16(2): 83-89. |
| [2] |
AZAR S T, ECHTAY A, AMM M, et al. Characteristics and treatment patterns of patients with type 2 diabetes in Lebanon: the DISCOVER study[J]. Eastern Mediterranean Health Journal, 2021, 27(5): 509-515. DOI:10.26719/2021.27.5.509 |
| [3] |
BI Y X, ZHANG L, LI X N, et al. Contributing factors of fatigue in patients with type 2 diabetes: a systematic review[J]. Psychoneuroendocrinology, 2021, 130: 105280. DOI:10.1016/j.psyneuen.2021.105280 |
| [4] |
POWER O, NONGONIERMA A B, JAKEMAN P, et al. Food protein hydrolysates as a source of dipeptidyl peptidase Ⅳ inhibitory peptides for the management of type 2 diabetes[J]. Proceedings of the Nutrition Society, 2014, 73(1): 34-46. DOI:10.1017/S0029665113003601 |
| [5] |
DEFRONZO R A, TRIPLITT C L, ABDUL-GHANI M, et al. Novel agents for the treatment of type 2 diabetes[J]. Diabetes Spectrum, 2014, 27(2): 100-112. DOI:10.2337/diaspect.27.2.100 |
| [6] |
LACROIX I M E, LI-CHAN E C Y. Isolation and characterization of peptides with dipeptidyl peptidase-Ⅳ inhibitory activity from pepsin-treated bovine whey proteins[J]. Peptides, 2014, 54: 39-48. DOI:10.1016/j.peptides.2014.01.002 |
| [7] |
DUEZ H, CARIOU B, STAELS B. DPP-4 inhibitors in the treatment of type 2 diabetes[J]. Biochemical Pharmacology, 2012, 83(7): 823-832. DOI:10.1016/j.bcp.2011.11.028 |
| [8] |
董杰, 刘鹭, 甲承立, 等. 乳酸菌代谢物中二肽基肽酶-4抑制剂的分离纯化及鉴定[J]. 食品科学, 2020, 41(8): 116-122. DONG J, LIU L, JIA C L, et al. Isolation, purification and identification of dipeptidyl peptidase-4 inhibitor from lactic acid bacterial metabolite[J]. Food Science, 2020, 41(8): 116-122. |
| [9] |
张风, 夏旭, 周爱梅, 等. 虾头虾壳蛋白质酶解制备抗氧化肽的研究[J]. 南方水产科学, 2015, 11(6): 79-87. ZHANG F, XIA X, ZHOU A M, et al. Research of antioxidant peptides produced from protein extracted from white shrimp head and shell[J]. South China Fisheries Science, 2015, 11(6): 79-87. DOI:10.3969/j.issn.2095-0780.2015.06.011 |
| [10] |
LACROIX I M E, LI-CHAN E C Y. Food-derived dipeptidyl-peptidase Ⅳ inhibitors as a potential approach for glycemic regulation-current knowledge and future research considerations[J]. Trends in Food Science & Technology, 2016, 54: 1-16. |
| [11] |
DALIRI E B M, OH D H, LEE B H. Bioactive peptides[J]. Foods, 2017, 6(5): 32. DOI:10.3390/foods6050032 |
| [12] |
KONG X Z, ZHANG L N, SONG W G, et al. Separation, identification and molecular binding mechanism of dipeptidyl peptidase Ⅳ inhibitory peptides derived from walnut (Juglans regia L.) protein[J]. Food Chemistry, 2021, 347: 129062. DOI:10.1016/j.foodchem.2021.129062 |
| [13] |
GU H F, GAO J, SHEN Q, et al. Dipeptidyl peptidase-Ⅳ inhibitory activity of millet protein peptides and the related mechanisms revealed by molecular docking[J]. LWT, 2021, 138: 110587. DOI:10.1016/j.lwt.2020.110587 |
| [14] |
NONGONIERMA A B, CADAMURO C, LE GOUIC A, et al. Dipeptidyl peptidase Ⅳ (DPP-Ⅳ) inhibitory properties of a camel whey protein enriched hydrolysate preparation[J]. Food Chemistry, 2019, 279: 70-79. DOI:10.1016/j.foodchem.2018.11.142 |
| [15] |
HUANG S L, HUNG C C, JAO C L, et al. Porcine skin gelatin hydrolysate as a dipeptidyl peptidase Ⅳ inhibitor improves glycemic control in streptozotocin-induced diabetic rats[J]. Journal of Functional Foods, 2014, 11: 235-242. DOI:10.1016/j.jff.2014.09.010 |
| [16] |
LARSEN R, EILERTSEN K E, ELVEVOLL E O. Health benefits of marine foods and ingredients[J]. Biotechnology Advances, 2011, 29(5): 508-518. DOI:10.1016/j.biotechadv.2011.05.017 |
| [17] |
LAN V T T, ITO K, OHNO M, et al. Analyzing a dipeptide library to identify human dipeptidyl peptidase Ⅳinhibitor[J]. Food Chemistry, 2015, 175: 66-73. DOI:10.1016/j.foodchem.2014.11.131 |
| [18] |
YABE D, SEINO Y. Two incretin hormones GLP-1 and GIP: comparison of their actions in insulin secretion and β cell preservation[J]. Progress in Biophysics and Molecular Biology, 2011, 107(2): 248-256. DOI:10.1016/j.pbiomolbio.2011.07.010 |
| [19] |
SEINO Y, YABE D. Glucose-dependent insulinotropic polypeptide and glucagon-like peptide-1:incretin actions beyond the pancreas[J]. Journal of Diabetes Investigation, 2013, 4(2): 108-130. DOI:10.1111/jdi.12065 |
| [20] |
JIN R T, TENG X Y, SHANG J Q, et al. Identification of novel DPP-Ⅳ inhibitory peptides from Atlantic salmon (Salmo salar) skin[J]. Food Research International, 2020, 133: 109161. DOI:10.1016/j.foodres.2020.109161 |
| [21] |
HONG H, ZHENG Y Y, SONG S J, et al. Identification and characterization of DPP-Ⅳ inhibitory peptides from silver carp swim bladder hydrolysates[J]. Food Bioscience, 2020, 38: 100748. DOI:10.1016/j.fbio.2020.100748 |
| [22] |
NONGONIERMA A B, FITZGERALD R J. Features of dipeptidyl peptidase Ⅳ (DPP-Ⅳ) inhibitory peptides from dietary proteins[J]. Journal of Food Biochemistry, 2019, 43(1): e12451. DOI:10.1111/jfbc.12451 |
| [23] |
陈宏. 牡蛎DPP-Ⅳ抑制肽的分离纯化及其作用机理研究[D]. 厦门: 集美大学, 2020. CHEN H. Purification and interaction mechanism of DPP-Ⅳ inhibitory peptides from Pacific oyster (Crassostrea gigas)[D]. Xiamen: Jimei University, 2020. |
| [24] |
王小慧, 戚勃, 杨贤庆, 等. 响应面法优化末水坛紫菜蛋白酶解工艺及其酶解液抗氧化活性研究[J]. 南方水产科学, 2019, 15(2): 93-101. WANG X H, QI B, YANG X Q, et al. Optimization of enzymatic hydrolysis of protein in abandoned Porphyra haitanensis by response surface methodology and study on antioxidant activity of its hydrolysate[J]. South China Fisheries Science, 2019, 15(2): 93-101. |
| [25] |
ZHANG Y, CHEN R, CHEN X L, et al. Dipeptidyl peptidase Ⅳ-inhibitory peptides derived from silver carp (Hypophthalmichthys molitrix Val.) proteins[J]. Journal of Agricultural and Food Chemistry, 2016, 64(4): 831-839. DOI:10.1021/acs.jafc.5b05429 |
| [26] |
HARNEDY P A, PARTHSARATHY V, MCLAUGHLIN C M, et al. Atlantic salmon (Salmo salar) co-product-derived protein hydrolysates: a source of antidiabetic peptides[J]. Food Research International, 2018, 106: 598-606. DOI:10.1016/j.foodres.2018.01.025 |
| [27] |
RIVERO-PINO F, ESPEJO-CARPIO F J, GUADIX E M. Production and identification of dipeptidyl peptidase Ⅳ (DPP-Ⅳ) inhibitory peptides from discarded Sardine pilchardus protein[J]. Food Chemistry, 2020, 328: 127096. DOI:10.1016/j.foodchem.2020.127096 |
| [28] |
刘志彤, 郑淋, 王晨阳, 等. 海参二肽基肽酶Ⅳ抑制肽的酶解制备及结构鉴定[J]. 现代食品科技, 2020, 36(8): 166-174. LIU Z T, ZHENG L, WANG C Y, et al. Preparation and structure identification of dipeptidyl-peptidase Ⅳ (DPP-Ⅳ) inhibitory peptides from Holotharia tubulosa by enzymatic hydrolysis[J]. Modern Food Science and Technology, 2020, 36(8): 166-174. |
| [29] |
陈宏, 章骞, 陈玉磊, 等. 利用牡蛎制备DPP-Ⅳ抑制肽及其活性分析[J]. 食品科学, 2021, 42(10): 120-126. CHEN H, ZHANG X, CHEN Y L, et al. Preparation and activity analysis of DPP-Ⅳ inhibitory peptides from Pacific oyster (Crassostrea gigas)[J]. Food Science, 2021, 42(10): 120-126. |
| [30] |
吉薇, 章超桦, 吉宏武. 响应面法优化南极磷虾酶法制备DPP-Ⅳ抑制肽工艺条件的研究[J]. 广东海洋大学学报, 2016, 36(6): 100-106. JI W, ZHANG C H, JI H W. Optimization of enzymatic preparation technology parameters of DPP-Ⅳ inhibitory peptides from Antarctic krill by response surface method[J]. Journal of Guangdong Ocean University, 2016, 36(6): 100-106. |
| [31] |
JI W, ZHANG C H, JI H W. Purification, identification and molecular mechanism of two dipeptidyl peptidase Ⅳ (DPP-Ⅳ) inhibitory peptides from Antarctic krill (Euphausia superba) protein hydrolysate[J]. Journal of Chromatography B, 2017, 1064: 56-61. |
| [32] |
HARNEDY-ROTHWELL P A, MCLAUGHLIN C M, O'KEEFFE M B, et al. Identification and characterisation of peptides from a boarfish (Capros aper) protein hydrolysate displaying in vitro dipeptidyl peptidase-Ⅳ (DPP-Ⅳ) inhibitory and insulinotropic activity[J]. Food Research International, 2020, 131: 108989. |
| [33] |
SEKI E, YAMAMOTO A, FUJIWARA Y, et al. Dipeptidyl peptidase-Ⅳ inhibitory activity of katsuobushi-derived peptides in caco-2 cell assay and oral glucose tolerance test in ICR mice[J]. Journal of Agricultural and Food Chemistry, 2020, 68(23): 6355-6367. |
| [34] |
SILA A, ALVAREZ O M, HADDAR A, et al. Purification, identification and structural modelling of DPP-Ⅳ inhibiting peptides from barbel protein hydrolysate[J]. Journal of Chromatography B, 2016, 1008: 260-269. |
| [35] |
HARNEDY P A, O'KEEFFE M B, FITZGERALD R J. Purification and identification of dipeptidyl peptidase (DPP) Ⅳ inhibitory peptides from the macroalga Palmaria palmata[J]. Food Chemistry, 2015, 172: 400-406. |
| [36] |
ZHANG C, ZHANG Y Q, WANG Z Y, et al. Production and identification of antioxidant and angiotensin-converting enzyme inhibition and dipeptidyl peptidase Ⅳ inhibitory peptides from bighead carp (Hypophthalmichthys nobilis) muscle hydrolysate[J]. Journal of Functional Foods, 2017, 35: 224-235. |
| [37] |
GONG P X, WANG B K, WU Y C, et al. Release of antidiabetic peptides from Stichopus japonicas by simulated gastrointestinal digestion[J]. Food Chemistry, 2020, 315: 126273. |
| [38] |
ZHANG Y Q, LIU H G, HONG H, et al. Purification and identification of dipeptidyl peptidase Ⅳ and angiotensin-converting enzyme inhibitory peptides from silver carp (Hypophthalmichthys molitrix) muscle hydrolysate[J]. European Food Research and Technology, 2018, 245(1): 243-255. |
| [39] |
LIU R, ZHOU L, ZHANG Y, et al. Rapid identification of dipeptidyl peptidase-Ⅳ (DPP-Ⅳ) inhibitory peptides from Ruditapes philippinarum hydrolysate[J]. Molecules, 2017, 22(10): 1714. |
| [40] |
OLAGUNJU A I, OMOBA O S, ENUJIUGHA V N, et al. Pigeon pea enzymatic protein hydrolysates and ultrafiltration peptide fractions as potential sources of antioxidant peptides: an in vitro study[J]. LWT, 2018, 97: 269-278. |
| [41] |
张艳华, 李影, 巨芳, 等. 高效液相色谱分离纯化多肽的研究进展[J]. 中国食物与营养, 2009(9): 34-36. ZHANG Y H, LI Y, JU F, et al. Research progress on separation and purification of peptides by high performance liquid chromatography[J]. Food and Nutrition in China, 2009(9): 34-36. |
| [42] |
苗雷, 许泓瑜, 雷楗勇, 等. 二肽基肽酶Ⅳ抑制剂体外筛选模型的建立及应用[J]. 中国药理学通报, 2009, 25(3): 411-414. MIAO L, XU H Y, LEI J Y, et al. Establishment and application of screening method for DPPⅣ inhibitors in vitro[J]. Chinese Pharmacological Bulletin, 2009, 25(3): 411-414. |
| [43] |
DIRIMANOV S, HÖGGER P. Fluorescence interference of polyphenols in assays screening for dipeptidyl peptidase Ⅳ inhibitory activity[J]. Food Frontiers, 2020, 1(4): 484-492. |
| [44] |
NEVES A C, HARNEDY P A, O'KEEFFE M B, et al. Peptide identification in a salmon gelatin hydrolysate with antihypertensive, dipeptidyl peptidase Ⅳ inhibitory and antioxidant activities[J]. Food Research International, 2017, 100: 112-120. |
| [45] |
HARNEDY P A, PARTHSARATHY V, MCLAUGHLIN C M, et al. Blue whiting (Micromesistius poutassou) muscle protein hydrolysate with in vitro and in vivo antidiabetic properties[J]. Journal of Functional Foods, 2018, 40: 137-145. |
| [46] |
LI Y C, AIELLO G, BOLLATI C, et al. Phycobiliproteins from Arthrospira platensis (Spirulina): a new source of peptides with dipeptidyl peptidase-Ⅳ inhibitory activity[J]. Nutrients, 2020, 12(3): 794. |
| [47] |
WANG T Y, HSIEH C H, HUNG C C, et al. Fish skin gelatin hydrolysates as dipeptidyl peptidase Ⅳ inhibitors and glucagon-like peptide-1 stimulators improve glycaemic control in diabetic rats: a comparison between warm- and cold-water fish[J]. Journal of Functional Foods, 2015, 19: 330-340. |
| [48] |
ZHU Q S, CHEN X J, WU J J, et al. Dipeptidyl peptidase Ⅳ inhibitory peptides from Chlorella vulgaris: in silico gastrointestinal hydrolysis and molecular mechanism[J]. European Food Research and Technology, 2017, 243(10): 1739-1748. |
| [49] |
张颖. 牛、羊乳酪蛋白源DPP-Ⅳ抑制肽的制备、鉴定及抑制机理研究[D]. 北京: 中国农业大学, 2016. ZHANG Y. Enzymatic preparation, identification and inhibition mechanism of DPP-Ⅳ inhibitory peptides derived from bovine and caprine milk casein[D]. Beijing: China Agricultural University, 2016. |
| [50] |
HSIEH C H, WANG T Y, HUNG C C, et al. Improvement of glycemic control in streptozotocin-induced diabetic rats by Atlantic salmon skin gelatin hydrolysate as the dipeptidyl-peptidase Ⅳ inhibitor[J]. Food & Function, 2015, 6(6): 1887-1892. |
| [51] |
赵蕊, 姚鑫淼, 周野, 等. 食源二肽基肽酶Ⅳ抑制剂的研究进展[J]. 食品科学, 2020, 41(7): 315-321. ZHAO R, YAO X M, ZHOU Y, et al. Recent advances and future prospects of food-derived dipeptidyl peptidase Ⅳ inhibitors[J]. Food Science, 2020, 41(7): 315-321. |
| [52] |
THOMA R, LÖFFLER B, STIHLE M, et al. Structural basis of proline-specific exopeptidase activity as observed in human dipeptidyl peptidase-Ⅳ[J]. Structure, 2003, 11(8): 947-959. |
| [53] |
GUAN C G, IWATANI S, XING X H, et al. Strategic preparations of DPP-Ⅳ inhibitory peptides from Val-Pro-Xaa and Ile-Pro-Xaa peptide mixtures[J]. International Journal of Peptide Research and Therapeutics, 2020, 27(1): 735-743. |
| [54] |
LI-CHAN E C Y, HUNAG S L, JAO C L, et al. Peptides derived from atlantic salmon skin gelatin as dipeptidyl-peptidase Ⅳ inhibitors[J]. Journal of Agricultural and Food Chemistry, 2012, 60(4): 973-978. |
2. College of Food Sciences and Technology, Shanghai Ocean University, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31

