2. 上海海洋大学 水域环境生态上海高校工程研究中心, 上海 201306
随着社会发展和人类活动加剧,水体富营养化成为了最亟待解决的水环境问题[1]。丝状藻的异常增殖是水体富营养化的一个重要体现,早期丝状藻体多为深绿色并附着于池底基质,生长期时连接成网状,上浮后渐渐变成黄绿色而悬浮于水面,衰亡期则颜色褪至灰白如旧棉絮浮于水面并伴有难闻刺鼻的腐烂气味[2]。丝状藻大量爆发后的主要危害包括:降低水体植物多样性[3],造成养殖水生动物的死亡[4],造成水质下降等[5]。刚毛藻(Cladophora sp.)是最常见的丝状藻之一[6],因此研究刚毛藻的防治技术具有十分重要的意义。目前常见的针对刚毛藻的防治以物理打捞和泼洒化学药剂为主[7-13]。物理打捞方式虽然直接、无污染,但费时费力;而化学药剂法虽然见效快,却存在二次污染等危险[14]。近年来,基于植物间化感作用的植物源抑藻剂因其兼具化学控藻与生物控藻的优点,获得了越来越多的关注[15]。RICE在《Allelopathy》将化感作用定义为:植物(或微生物)通过释放化学物质到环境中而产生对其他植物直接或间接的作用[16-17]。植物化感抑藻是目前的研究热点之一[18-22]。
现有研究表明:多种水生植物和陆生植物提取液均具有较强的化感抑藻作用[23-26]。ELADEL等[27]研究表明稻草的水提取液对鱼腥藻有良好的抑制效果,抑制率均达95 %以上。YUAN等[28]的研究表明,互花米草水提取液对铜绿微囊藻光合作用有抑制效果。LE ROUZIC等[29]研究得出柳叶提取物对绿藻和蓝藻均有良好的抑制效果。此外,部分学者对不同提取工艺剂不同部位的植物源抑藻效果进行了研究,结果表明不同提取剂及不同植物部位的抑藻效果均出现差异[30-33]。现有相关研究的受试藻类多为微藻,对于大型丝状藻类如刚毛藻的研究较少,且多数实验指标也集中于提取液对藻类细胞密度及叶绿素含量等表观指标的观察,较少涉及机理剖析[34]。
本实验基于叶绿素荧光测定技术,研究不同落叶配置的植物浸提液对刚毛藻生长及光合系统的抑制效果,并对提取方法及浓度的选择进行优化,通过对刚毛藻生物量及荧光参数的测定比较,优选出更为高效、目标精确的植物源抑藻剂,以期为以刚毛藻为代表的丝状藻的科学治理提供一定理论依据和参考。
1 材料与方法 1.1 实验材料实验材料银杏(Ginkgo biloba L.)和垂柳(Salix babylonica L.)落叶均采集于上海海洋大学临港校区,落叶采回后洗净,放入恒温干燥箱中烘干(80 ℃),粉碎后过100目筛储存备用。
实验用刚毛藻(Cladophora sp.)采自上海海洋大学校内河道,选取生长情况良好,颜色翠绿的刚毛藻作为实验对象,刚毛藻采回后使用过滤后湖水暂养于光照培养箱中,培养条件为:恒温光照培养[(25±1) ℃,45 μmol/(m2·s)],光暗比为12 h∶ 12 h。
实验所用乙醇、丙酮、氯仿等化学试剂均为市售分析纯试剂。
1.2 不同配置落叶浸提液的抑藻效果实验 1.2.1 植物落叶浸提液的制备单一植物浸提液的制备:分别称取3.00 g银杏叶/柳叶粉末于茶包袋中,包扎后将其浸泡于500 mL蒸馏水中24 h,制成质量浓度为6.00 g/L单一植物浸提液备用。
复方植物浸提液的制备:称取1.50 g银杏叶粉末和1.50 g柳叶粉末装于茶包袋中,包扎后将其浸泡于500 mL蒸馏水中24 h,制成质量浓度为6.00 g/L复方植物浸提液备用。
1.2.2 不同浸提液抑藻实验分组与设计本部分实验设置1个对照组和3个实验组(单一银杏叶组、单一柳叶组、银杏叶柳叶复方组),每组均设3个平行。采用1 L烧杯作为实验容器,对照组中加入500 mL蒸馏水,实验组中加入不同条件下制取的质量浓度均为6.00 g/L的500 mL浸提液,之后分别投入鲜质量为1.00 g的生长状态良好,颜色翠绿的刚毛藻,连续培养96 h。培养条件为:光照45 μmol/(m2·s),温度(25±1) ℃,光暗比为12 h∶ 12 h。分别于0和96 h测定刚毛藻生物量及光合荧光参数。
1.3 不同工艺银杏叶浸提液抑藻效果实验 1.3.1 银杏叶浸提液的制备采用乙醇、丙酮、氯仿和水4种提取剂对银杏叶粉末进行浸提,具体为取3.00 g银杏叶粉末装于茶包袋中,包扎后将其分别浸泡在50 mL 4种不同的提取剂中提取3次,每次30 min,合并浸提液,加热挥发提取剂后定容至500 mL,制得质量浓度为6.00 g/L的4种银杏叶浸提液备用。
1.3.2 不同提取剂对银杏叶浸提液抑藻效果的影响实验设计本部分实验设置1个对照组和4个实验组(乙醇组、丙酮组、氯仿组和水组),每组均设3个平行。采用1 L烧杯作为实验容器,对照组中加入500 mL蒸馏水,实验组中加入不同提取剂制取的质量浓度为6.00 g/L的500 mL银杏叶粉末浸提液,之后分别投入鲜质量为1.00 g的生长状态良好,颜色翠绿的刚毛藻,连续培养48 h。培养条件为光照45 μmol/(m2·s),温度(25±1) ℃,光暗比为12 h∶ 12 h。分别于0和48 h测定刚毛藻生物量及光合荧光参数。
1.4 不同质量浓度银杏叶浸提液抑藻效果实验 1.4.1 不同质量浓度浸提液的制备取3.00 g银杏叶粉末装于茶包袋中,包扎后将其浸泡在50 mL乙醇提取剂中提取3次,每次30 min,合并浸提液,加热挥发提取剂后定容至500 mL制成6.00 g/L母液备用。
1.4.2 不同质量浓度银杏叶粉末浸提液抑藻效果实验设计本部分实验设置1个对照组(0 g/L)和4个实验组(0.75 g/L、1.50 g/L、3.00 g/L、6.00 g/L),每组均设3个平行。采用1 L烧杯作为实验容器,对照组中加入500 mL蒸馏水,实验组中用蒸馏水将母液稀释成不同质量浓度的银杏叶浸提液,之后分别投入鲜质量为1.00 g的生长状态良好,颜色翠绿的刚毛藻,连续培养96 h,培养条件为光照45 μmol/(m2·s),温度(25±1) ℃,光暗比为12 h∶ 12 h。分别于0、24、48、72、96 h测量刚毛藻光合荧光参数。
1.5 刚毛藻生物量的测定植物浸提液对刚毛藻生长的影响以刚毛藻鲜质量为指标。测量时将刚毛藻从烧杯中取出,用纸巾将附着于藻体表面的水分吸收后测量鲜质量。
1.6 刚毛藻光合荧光参数的测定采用双通道调制叶绿素荧光仪(DUAL-PAM-100,德国)测定刚毛藻PSⅡ光化学活性变化情况,样品暗适应时间为20 min,读取荧光参数数值。测定的荧光参数包括最大光合效率Fv/Fm,实际光化学效率Yield,非光化学淬灭参数NPQ及快速光曲线初始斜率α值,最大电子传递效率等。
1.7 数据分析与处理生长抑制率计算公式为
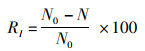 (1)
(1)
式中: RI为浸提液对刚毛藻生长抑制率,%;N0和N分别为对照组和实验组中刚毛藻鲜质量。
数据处理和图表绘制采用SPSS 24.0和Origin 2021软件。数据结果以平均值±标准差表示,利用SPSS 25.0软件,对符合正态分布和同质方差的数据,采用单因素方差分析(One-way ANOVA)和Tukey多重比较测试分析实验组与对照组间的差异显著性,P<0.05表示组间差异显著,P<0.01表示组间差异极显著。
2 结果与分析 2.1 不同配置落叶浸提液的抑藻效果 2.1.1 对刚毛藻生物量的影响不同种类植物浸提液对刚毛藻生物量的影响如图 1所示。结果表明,所有实验组对刚毛藻的生物量均有极显著影响(P<0.01)。与对照组相比,96 h时单一柳叶组和银杏叶柳叶复方组对刚毛藻生物量抑制率分别达62.89%和60.40%,而单一银杏叶组对刚毛藻的生物量抑制率高达66.65 %,不同植物配置的浸提液对刚毛藻生物量的抑制效果表现为单一银杏叶组>单一柳叶组>银杏叶柳叶复方组。
|
图 1 不同植物浸提液对刚毛藻生物量抑制效果 Fig. 1 Inhibitory effects of different plant extracts on biomass of Cladophora sp. |
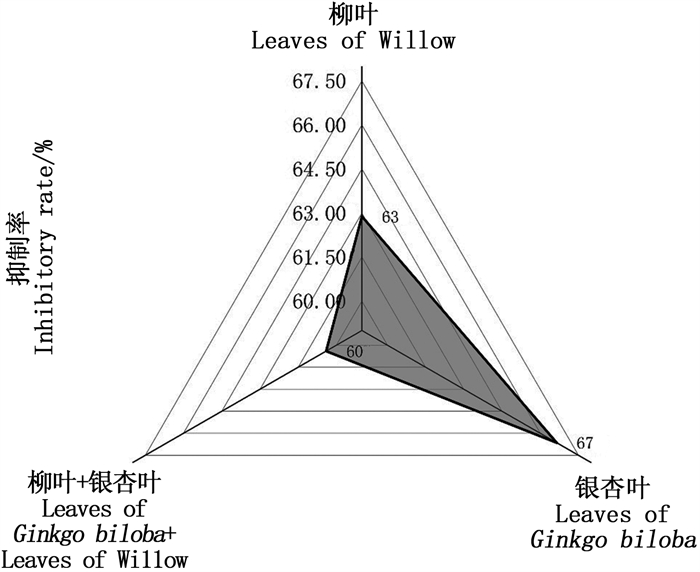
不同实验组对刚毛藻光合荧光参数的影响如图 2所示。结果表明,不同实验组对刚毛藻的Fv/Fm、Yield及NPQ均产生了极显著的抑制作用(P<0.01),其中单一银杏叶组对刚毛藻的光合作用胁迫效果最明显。由图 2a可以看出,96 h时,单一银杏叶组Fv/Fm由0 h时的0.695下降至0.023,抑制率达96.69%,优于单一柳叶组76.55%的抑制率和银杏叶柳叶组复方组93.09%的抑制率。由图 2b可以看出,单一银杏组中刚毛藻Yield由0 h的0.644下降至96 h的0.005,抑制率达99.22%,优于单一柳叶组89.13%的抑制率和银杏叶柳叶复方组94.88%的抑制率。NPQ反映植物耗散过剩光能为热量的能力,96 h时单一银杏叶组、单一柳叶组及银杏叶柳叶复方组NPQ值分别由0 h时的0.36下降至0.08、0.11和0.10。综合分析认为,各实验组对刚毛藻叶绿素荧光参数的抑制效果表现为单一银杏叶组>银杏叶柳叶复方组>单一柳叶组。
|
图中各处理组提取液质量浓度均为6.00 g/L;图中不同字母表示组间差异显著(P<0.05)。 The extract mass concentration is 6.00 g/L; Different letters in the figure indicate significant differences between groups. 图 2 不同植物浸提液对刚毛藻荧光参数的影响 Fig. 2 Effects of different plant extracts on the photosynthetic fluorescence parameter of Cladophora sp. |
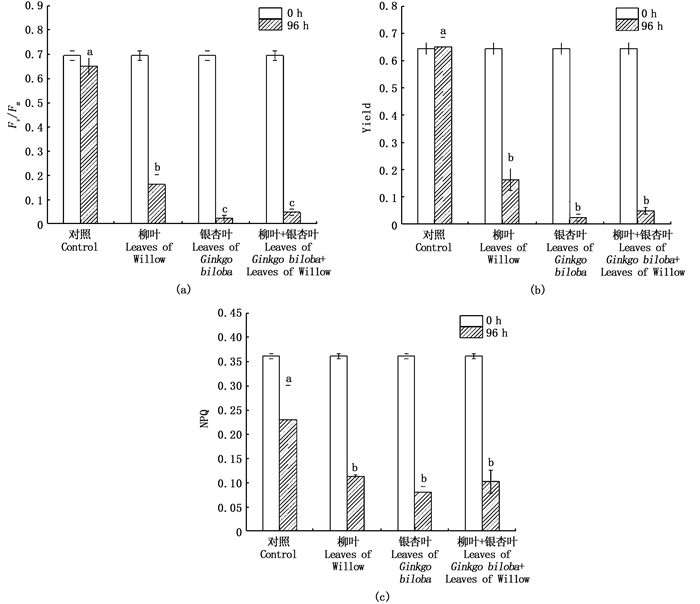
采用不同提取剂提取的银杏叶浸提液对刚毛藻生物量的影响如图 3所示。结果表明,相比对照组,4种提取剂制取的银杏叶浸提液对刚毛藻的抑制作用均存在极显著影响(P<0.01)。其中,银杏叶乙醇浸提液和丙酮浸提液对刚毛藻生物量抑制效果明显优于氯仿浸提液和水浸提液,前两组对刚毛藻生物量的抑制率分别达30.60%和32.44 %。各组对生物量的抑制效果表现为丙酮组、乙醇组>氯仿组、水组。
|
图 3 不同提取剂提取的银杏叶浸提液对刚毛藻生长的影响 Fig. 3 Effect of Ginkgo biloba extracts by different extractants on the growth of Cladophora sp. |
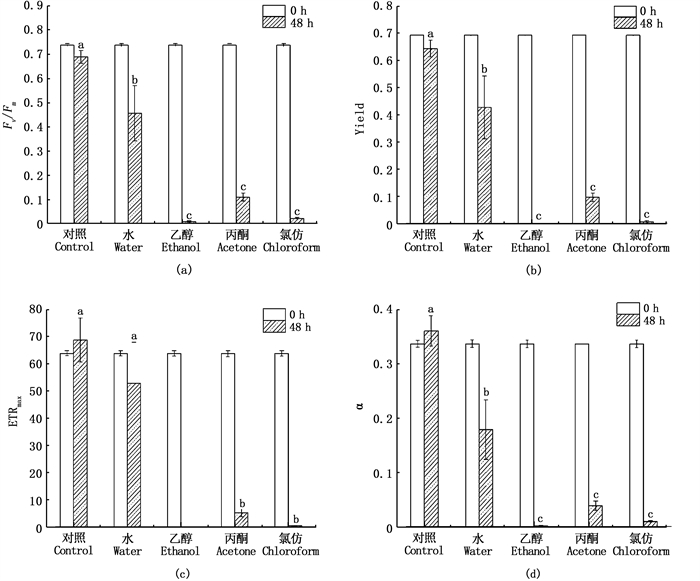
4种不同提取剂制得的银杏叶浸提液48 h对刚毛藻荧光参数影响如图 4所示。48 h时,乙醇、丙酮和氯仿提取剂对刚毛藻Fv/Fm抑制效果极显著(P<0.01),Fv/Fm值从0 h时的0.738分别下降至48 h时0.009、0.110、0.022,抑制率分别达98.78 %、85.09 %和97.02 %。乙醇、丙酮和氯仿提取剂对刚毛藻Yield抑制效果极显著(P<0.01),各组由本底值0.692下降至0.001、0.097、0.006,抑制率分别为99.86 %、85.98 %和99.13 %。乙醇、丙酮和氯仿对ETRmax抑制率分别达100%、91.97%和99.43%,对α值的抑制率分别达99.70 %、88.72 %和97.33 %。水组浸提液抑制效果较差,对刚毛藻Fv/Fm、Yield、ETRmax和α的抑制率仅为38.21%、38.29%、17.36%和46.88%。综合分析认为,各实验组对刚毛藻光合荧光参数的抑制效果表现为乙醇组>氯仿组>丙酮组>水组。
|
各处理组提取液质量浓度均为6.00 g/L;图中不同字母表示组间差异显著(P<0.05)。 The extract mass concentration is 6.00 g/L; Different letters in the figure indicate significant differences between groups. 图 4 不同浸提液对刚毛藻光合荧光参数影响 Fig. 4 Effects of different extracts on the photosynthetic fluorescence parameter of Cladophora sp. |
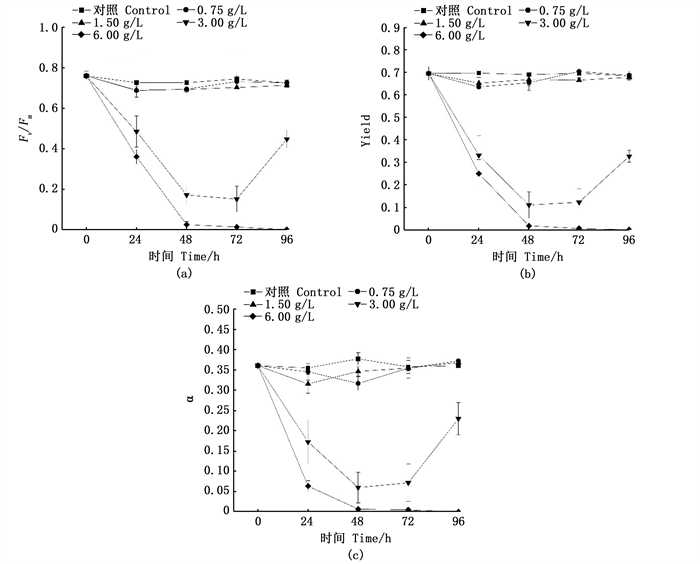
不同质量浓度银杏叶乙醇浸提液对刚毛藻叶绿素荧光参数的影响如图 5所示。结果表明,银杏叶乙醇浸提液对刚毛藻的抑制效果与质量浓度呈正相关。0.75 g/L和1.50 g/L质量浓度组银杏叶乙醇浸提液对刚毛藻荧光参数没有显著影响,3.00 g/L和6.00 g/L质量浓度组对刚毛藻的光合系统均有显著抑制效果(P<0.05)。在3.00 g/L银杏叶乙醇浸提液作用下,刚毛藻荧光参数Fv/Fm在48 h内呈直线下降趋势,并于72 h时达到最低值0.152;Yield和α值在48 h时数值下降至最低值,分别达0.11和0.06,72 h时Yield和α数值基本保持不变,但96 h时YⅡ和α数值出现回升现象,推测认为出现该现象的可能原因是72 h后浸提液中活性物质自然降解,导致抑藻效果降低。6.00 g/L实验组中刚毛藻荧光参数Fv/Fm、Yield及α值在96 h内均呈下降趋势,并于96 h时达到最低,所有测定的荧光参数抑制率均接近100%,推测认为6 g/L已达刚毛藻致死质量浓度。
|
图 5 不同质量浓度银杏叶浸提液对刚毛藻光合荧光参数影响 Fig. 5 Effects of different concentrations of Ginkgo biloba extract on the photosynthetic fluorescence parameter of Cladophora sp. |
已有研究报道了银杏叶及柳叶提取物对微型蓝藻的生长具有明显的抑制作用[29, 34],本实验研究结果进一步证实了银杏叶及柳叶提取物对刚毛藻同样具有抑制作用。单一植物浸提液及复方植物浸提液实验结果表明,银杏叶柳叶两种物质复配情况下对刚毛藻生物量的影响为拮抗作用,即复方对刚毛藻生物量的抑制率反而不如单一物质。而对于刚毛藻荧光参数的影响两种物质同样未呈现协同效应。推测认为银杏叶及柳叶浸提液中可能含有类似的抑藻活性物质,如黄酮类、有机酸类活性物质[35-39],导致复配条件下,抑藻效果不如单一植物浸提液。
采用不同提取剂浸提银杏叶活性成分的实验中,我们观察到采用丙酮与乙醇为提取剂制得的银杏叶浸提液对刚毛藻的生长抑制效果优于以氯仿和水为提取剂的实验组,推测可能原因包括:(1)银杏叶活性物质极性较强,根据相似相溶原理,极性更大的乙醇和丙酮能萃取出更多的对刚毛藻生长有抑制效果的活性物质;(2)银杏叶富含脂溶性活性物质,因此以乙醇、丙酮等有机溶剂作为提取剂时能浸提出更多的抑藻活性物质[40-42]。另一方面,该部分实验结果还表明以有机溶剂为提取剂的实验组(乙醇组、丙酮组、氯仿组)对刚毛藻光合荧光参数的抑制率明显强于以水为提取剂的实验组,推测其可能的原因是以有机溶剂为提取剂能够提取出对于刚毛藻光合系统有更好抑制效果的活性物质,这些活性物质的作用机理可能包括改变细胞膜通透性导致内含物泄露[43-46],破坏藻细胞的抗氧化酶体系,使得SOD等酶活性下降[33, 47]或者改变相关生长基因如细胞分裂基因、ATP转运和结合基因的表达[48]。
叶绿素荧光参数被视为植物光合作用与环境胁迫之间关系的内在探针,荧光参数的变化可以清晰表现出逆境对光合作用的各种影响[49]。Fv/Fm反映了PSⅡ反应中心利用捕获能量的情况,其变化规律与Yield,ETRmax及α的变化趋势相似,添加植物源抑制剂后,各参数均出现不同程度下降。在本实验中,Fv/Fm等参数的降低说明刚毛藻形成光合产物少,表明活性物质作用于刚毛藻时对光合系统造成损害。NPQ是植物的一种保护机制,表明吸收的光能中不能用于光合电子传递而以热的形式耗散掉的部分[50],在正常范围内,植物能够通过正常增加耗散过剩光能为热能来维持植物的正常生长[51],反映为逆境条件下NPQ值升高。但本实验验证不同植物抑藻效果中,NPQ和Fv/Fm及Yield表现出相同下降趋势,表明在高胁迫状态下,刚毛藻的光合机构已经被破坏,植物体没有能力正常调节耗散过量光能,无法维持刚毛藻的正常生长。本实验不同质量浓度抑藻效果中,低质量浓度(1.50 g/L及以下)对刚毛藻的光合系统没有产生明显的破坏,检测数据均趋于正常。在3.00 g/L质量浓度组作用下,Fv/Fm等值呈先下降后上升的趋势,说明该质量浓度组作用下,光合系统发生可逆损伤,而在6.00 g/L质量浓度组作用下,Fv/Fm等值呈下降趋势且不再上升,说明该质量浓度组作用下光合系统活性受到抑制,电子传递活性降低,最大光能转换效率减弱[52],且刚毛藻无法通过自身调节恢复该损伤。
4 结论(1) 单一银杏叶浸提液对刚毛藻生长及光合荧光参数的抑制效果优于单一柳叶浸提液及银杏叶柳叶复方浸提液。
(2) 综合分析认为,以乙醇为提取剂制得的银杏叶浸提液对刚毛藻生长及光合系统的抑制效果优于丙酮、氯仿及水。
(3) 银杏叶乙醇浸提液的抑制作用随着质量浓度的增加而增大,6.00 g/L质量浓度条件下,刚毛藻光合系统受到不可逆损伤。
| [1] |
马婕, 申利亚, 何培民, 等. 苏州城区河道浮游植物功能群演替特征及其对环境因子的响应[J]. 上海海洋大学学报, 2021, 30(1): 103-112. MA J, SHEN L Y, HE P M, et al. Succession characteristics and responses to environmental factors of phytoplankton functional groups in river courses in the urban area of Suzhou City[J]. Journal of Shanghai Ocean University, 2021, 30(1): 103-112. |
| [2] |
GOLDSBOROUGH L G, ROBINSON G G C. Pattern in wetlands[M]//JAN STEVENSON R, BOTHWELL M L, LOWE R L. Algal Ecology. San Diego: Elsevier, 1996: 77-117.
|
| [3] |
BONNET M P, POULIN M. Numerical modelling of the planktonic succession in a nutrient-rich reservoir: environmental and physiological factors leading to Microcystis aeruginosa dominance[J]. Ecological Modelling, 2002, 156(2/3): 93-112. |
| [4] |
姚雁鸿, 何文辉, 余来宁. 池塘蓝藻水华的产生及对养殖的危害[J]. 江西农业学报, 2007, 19(4): 98-100. YAO Y H, HE W H, YU L N. Mechanism of forming of Cyanobacteria bloom and its effects on aquaculture[J]. Acta Agriculturae Jiangxi, 2007, 19(4): 98-100. DOI:10.3969/j.issn.1001-8581.2007.04.035 |
| [5] |
李敦海, 史龙新, 李根保, 等. 丝状绿藻腐烂过程对水质和沉水植物黑藻生长的影响实验研究[J]. 环境科学与管理, 2006, 31(6): 27-30. LI D H, SHI L X, LI G B, et al. Effect of Decomposed Filamentous green algae on water quality and the growth of submerged macrophyte Hydrilla verticillata[J]. Environmental Science and Management, 2006, 31(6): 27-30. DOI:10.3969/j.issn.1673-1212.2006.06.008 |
| [6] |
刘霞, 陈宇炜. 刚毛藻(Cladophora)生态学研究进展[J]. 湖泊科学, 2018, 30(4): 881-896. LIU X, CHEN Y W. A review on the ecology of Cladophora[J]. Journal of Lake Sciences, 2018, 30(4): 881-896. |
| [7] |
陈贺林, 李芸, 储昭升, 等. 超声波控藻技术现状及研究进展[J]. 环境工程技术学报, 2020, 10(1): 72-78. CHEN H L, LI Y, CHU Z S, et al. Present situation and research progress of ultrasonic algae control technology[J]. Journal of Environmental Engineering Technology, 2020, 10(1): 72-78. |
| [8] |
KONG Y, PENG Y Z, ZHANG Z, et al. Removal of Microcystis aeruginosa by ultrasound: Inactivation mechanism and release of algal organic matter[J]. Ultrasonics Sonochemistry, 2019, 56: 447-457. DOI:10.1016/j.ultsonch.2019.04.017 |
| [9] |
王寿兵, 徐紫然, 张洁. 大型湖库富营养化蓝藻水华防控技术发展述评[J]. 水资源保护, 2016, 32(4): 88-99. WANG S B, XU Z R, ZHANG J. A review of technologies for prevention and control of cyanobacteria blooms in large-scale eutrophicated lakes and reservoirs[J]. Water Resources Protection, 2016, 32(4): 88-99. |
| [10] |
JANČULA D, MARŠÁLEK B. Critical review of actually available chemical compounds for prevention and management of cyanobacterial blooms[J]. Chemosphere, 2011, 85(9): 1415-1422. DOI:10.1016/j.chemosphere.2011.08.036 |
| [11] |
TSAI K P, UZUN H, CHEN H, et al. Control wildfire-induced Microcystis aeruginosa blooms by copper sulfate: Trade-offs between reducing algal organic matter and promoting disinfection byproduct formation[J]. Water Research, 2019, 158: 227-236. DOI:10.1016/j.watres.2019.04.013 |
| [12] |
WU L, QIU Z H, ZHOU Y, et al. Physiological effects of the herbicide glyphosate on the cyanobacterium Microcystis aeruginosa[J]. Aquatic Toxicology, 2016, 178: 72-79. DOI:10.1016/j.aquatox.2016.07.010 |
| [13] |
MARTÍNEZ-RUIZ E B, MARTíNEZ-JERóNIMO F. Exposure to the herbicide 2, 4-D produces different toxic effects in two different phytoplankters: A green microalga (Ankistrodesmus falcatus) and a toxigenic cyanobacterium (Microcystis aeruginosa)[J]. Science of the Total Environment, 2018, 619-620: 1566-1578. DOI:10.1016/j.scitotenv.2017.10.145 |
| [14] |
黄维, 裴毅, 陈飞勇. 水体蓝藻清除的研究及其新型机械除藻初探[J]. 企业技术开发, 2008, 27(4): 29-31. HUANG W, PEI Y, CHEN F Y. Present situation of clearing blue-algae and preliminary study on new type mechanical removal algae[J]. Technological Development of Enterprise, 2008, 27(4): 29-31. DOI:10.14165/j.cnki.hunansci.2008.04.002 |
| [15] |
朱小琴, 刀国华, 陶益, 等. 典型植物化感物质对铜绿微囊藻生长的抑制效果评价[J]. 中国环境科学, 2020, 40(5): 2230-2237. ZHU X Q, DAO G H, TAO Y, et al. Evaluation of growth inhibition of typical plant-derived allelochemicals on Microcystis aeruginosa[J]. China Environmental Science, 2020, 40(5): 2230-2237. DOI:10.3969/j.issn.1000-6923.2020.05.045 |
| [16] |
RICE E L. Allelopathy[M]. 2nd ed. London: Academic Press, 1984.
|
| [17] |
胡利静, 肖艳翼, 刘腾飞, 等. 植物化感抑藻作用及机制的研究[J]. 水产养殖, 2016, 37(10): 41-47. HU L J, XIAO Y Y, LIU T F, et al. The study on mechanism of the allelopathy in algals inhibition[J]. Journal of Aquaculture, 2016, 37(10): 41-47. DOI:10.3969/j.issn.1004-2091.2016.10.008 |
| [18] |
PARK M H, HAN M S, AHN C Y, et al. Growth inhibition of Bloom-forming cyanobacterium Microcystis aeruginosa by rice straw extract[J]. Letters in Applied Microbiology, 2006, 43(3): 307-312. DOI:10.1111/j.1472-765X.2006.01951.x |
| [19] |
QIAN Y P, XU N, LIU J, et al. Inhibitory effects of Pontederia cordata on the growth of Microcystis aeruginosa[J]. Water Science & Technology, 2018, 2017(1): 99-107. |
| [20] |
HONG Y, HU H Y, SAKODA A, et al. Isolation and characterization of antialgal allelochemicals from Arundo donax L.[J]. Allelopathy Journal, 2010, 25(2): 357-368. |
| [21] |
张饮江, 宋盈颖, 赵圆, 等. 针对浮萍暴发式生长的植物源除草剂的筛选[J]. 上海海洋大学学报, 2016, 25(4): 575-581. ZHANG Y J, SONG Y Y, ZHAO Y, et al. The influence of Chinese herb extracts addition on the growth of duckweed (Soirodela polyrhiza) under laboratory conditions[J]. Journal of Shanghai Ocean University, 2016, 25(4): 575-581. |
| [22] |
WARIDEL P, WOLFENDER J L, LACHAVANNE J B, et al. ent-Labdane diterpenes from the aquatic plant Potamogeton pectinatus[J]. Phytochemistry, 2003, 64(7): 1309-1317. DOI:10.1016/j.phytochem.2003.08.014 |
| [23] |
鲁志营, 高云霓, 刘碧云, 等. 水生植物化感抑藻作用机制研究进展[J]. 环境科学与技术, 2013, 36(7): 64-69, 75. LU Z Y, GAO Y N, LIU B Y, et al. Advances in research on mechanism of inhibitory effects on phytoplankton mediated by aquatic plant allelochemicals[J]. Environmental Science & Technology, 2013, 36(7): 64-69, 75. DOI:10.3969/j.issn.1003-6504.2013.07.013 |
| [24] |
边归国. 陆生植物化感作用抑制藻类生长的研究进展[J]. 环境科学与技术, 2012, 35(2): 90-95. BIAN G G. Review on inhibition of terrestrial plant allelopathy of algae growth[J]. Environmental Science & Technology, 2012, 35(2): 90-95. DOI:10.3969/j.issn.1003-6504.2012.02.019 |
| [25] |
张建恒, 霍元子, 王阳阳, 等. 浒苔与球等鞭金藻相互抑制的实验验证[J]. 上海海洋大学学报, 2011, 20(2): 211-216. ZHANG J H, HUO Y Z, WANG Y Y, et al. Experimental validation on inhibitory effects between Ulva prolifera and Isochrysis galbana under controlled laboratory conditions[J]. Journal of Shanghai Ocean University, 2011, 20(2): 211-216. |
| [26] |
贾惠雁, 陈永华, 陈明利, 等. 5种水生植物对铜绿微囊藻的抑制与生理影响研究[J]. 农业现代化研究, 2019, 40(6): 1056-1064. JIA H Y, CHEN Y H, CHEN M L, et al. Allelopathic effect of five aquatic plants on Microcystis aeruginosa[J]. Research of Agricultural Modernization, 2019, 40(6): 1056-1064. |
| [27] |
ELADEL H, BATTAH M, DAWA A, et al. Effect of rice straw extracts on growth of two phytoplankton isolated from a fish pond[J]. Journal of Applied Phycology, 2019, 31(6): 3557-3563. DOI:10.1007/s10811-019-01766-0 |
| [28] |
YUAN R Y, LI Y, LI J H, et al. The allelopathic effects of aqueous extracts from Spartina alterniflora on controlling the Microcystis aeruginosa blooms[J]. Science of the Total Environment, 2020, 712: 136332. DOI:10.1016/j.scitotenv.2019.136332 |
| [29] |
LE ROUZIC B, THIéBAUT G, BRIENT L. Selective growth inhibition of cyanobacteria species (Planktothrix agardhii) by a riparian tree leaf extract[J]. Ecological Engineering, 2016, 97: 74-78. |
| [30] |
PATIL V, ABATE R, YANG Y F, et al. Allelopathic effect of Pyropia haitanensis (Rhodophyta) on the bloom-forming Skeletonema costatum (Bacillariophyta)[J]. Journal of Applied Phycology, 2020, 32(2): 1275-1286. |
| [31] |
张庭廷, 陈传平, 何梅, 等. 几种高等水生植物的克藻效应研究[J]. 生物学杂志, 2007, 24(4): 32-36. ZHANG T T, CHEN C P, HE M, et al. Allelopathic effects of several higher aquatic plants on algae[J]. Journal of Biology, 2007, 24(4): 32-36. |
| [32] |
ZHAO W, ZHENG Z, ZHANG J L, et al. Allelopathically inhibitory effects of eucalyptus extracts on the growth of Microcystis aeruginosa[J]. Chemosphere, 2019, 225: 424-433. |
| [33] |
向丽, 邹华, 黄亚元, 等. 稻秆对铜绿微囊藻抑制作用的研究[J]. 环境工程学报, 2011, 5(2): 279-283. XIANG L, ZOU H, HUANG Y Y, et al. Study on inhibitory effects of rice straw on Microcystis aeruginosa growth[J]. Chinese Journal of Environmental Engineering, 2011, 5(2): 279-283. |
| [34] |
石雨鑫, 汤春宇, 谭梦, 等. 常见入侵植物水提液对水华藻生长及光合荧光特性的影响[J]. 上海农业学报, 2020, 36(2): 101-107. SHI Y X, TANG C Y, TAN M, et al. Effects of water extracts of common invasive plants on growth and photosynthetic fluorescence characteristics of water bloom algae[J]. Acta Agriculturae Shanghai, 2020, 36(2): 101-107. |
| [35] |
NI L X, HAO X Y, LI S Y, et al. Inhibitory effects of the extracts with different solvents from three compositae plants on cyanobacterium Microcystis aeruginosas[J]. Science China Chemistry, 2011, 54(7): 1123-1129. |
| [36] |
张之浩. 富营养化水体原位生态修复中沉水植物的功能研究[D]. 长沙: 中南林业科技大学, 2018. ZHANG Z H. Study on the functions of submerged macrophytes in in-situ ecological restoration of eutrophic waters[D]. Changsha: Central South University of Forestry and Technology, 2018. |
| [37] |
李江. 挺水植物对城市景观水体铜绿微囊藻化感抑制作用与机理研究[D]. 长沙: 湖南大学, 2017. LI J. The allelopathic effect and underlying mechanism of emergent plants on the growth of Microcystis aeruginosa in landscape water[D]. Changsha: Hunan University, 2017. |
| [38] |
MECINA G F, DOKKEDAL A L, SALDANHA L L, et al. Response of Microcystis aeruginosa BCCUSP 232 to barley (Hordeum vulgare L.) straw degradation extract and fractions[J]. Science of the Total Environment, 2017, 599-600: 1837-1847. |
| [39] |
HUANG H M, XIAO X, GHADOUANI A, et al. Effects of natural flavonoids on photosynthetic activity and cell integrity in Microcystis aeruginosa[J]. Toxins, 2015, 7(1): 66-80. |
| [40] |
鲍宇茹, 张慧茹, 刘来亭. 银杏叶黄酮提取工艺及其抗氧化活性研究[J]. 河南工业大学学报(自然科学版), 2016, 37(5): 96-99. BAO Y R, ZHANG H R, LIU L T. Optimization of extraction process of flavonoids from Ginkgo biloba leaves and antioxidant activity[J]. Journal of Henan University of Technology (Natural Science Edition), 2016, 37(5): 96-99. |
| [41] |
魏雨, 张景迅, 张玉忠, 等. 银杏黄酮提取工艺及纯化研究[J]. 化学世界, 2018, 59(12): 795-800. WEI Y, ZHANG J X, ZHANG Y Z, et al. Study on the extraction and purification of flavonoids from Ginkgo biloba leaves[J]. Chemical World, 2018, 59(12): 795-800. |
| [42] |
李志平, 李护护. 银杏叶中黄酮类化合物的提取和分离[J]. 中国油脂, 2021, 46(2): 131-134. LI Z P, LI H H. Extraction and separation of flavonoids from Ginkgo biloba leaves[J]. China Oils and Fats, 2021, 46(2): 131-134. |
| [43] |
张振业, 吴晓霞, 张俊松, 等. 植物化感抑藻作用的研究进展[J]. 广东农业科学, 2012, 39(19): 146-150. ZHANG Z Y, WU X X, ZHANG J S, et al. Research progress of plant allelopathic effects on inhibitory of aglae growth[J]. Guangdong Agricultural Sciences, 2012, 39(19): 146-150. |
| [44] |
林必桂, 杨柳燕, 肖琳, 等. 赖氨酸对铜绿微囊藻细胞的抑制机理[J]. 生态与农村环境学报, 2008, 24(4): 68-72. LIN B G, YANG L Y, XIAO L, et al. Mechanism of Lysine inhibiting Microcystis aeruginosa cells[J]. Journal of Ecology and Rural Environment, 2008, 24(4): 68-72. |
| [45] |
HUA Q, LIU Y G, YAN Z L, et al. Allelopathic effect of the rice straw aqueous extract on the growth of Microcystis aeruginosa[J]. Ecotoxicology and Environmental Safety, 2018, 148: 953-959. |
| [46] |
李锋民, 胡洪营, 种云霄, 等. 2-甲基乙酰乙酸乙酯对藻细胞膜和亚显微结构的影响[J]. 环境科学, 2007, 28(7): 1534-1538. LI F M, HU H Y, CHONG Y X, et al. Effects of allelochemical EMA isolated from Phragmites communis on algal cell membrane lipid and ultrastructure[J]. Environmental Science, 2007, 28(7): 1534-1538. |
| [47] |
WANG H P, LIU F, LUO P, et al. Allelopathic effects of Myriophyllum aquaticum on two cyanobacteria of Anabaena flos-aquae and Microcystis aeruginosa[J]. Bulletin of Environmental Contamination and Toxicology, 2017, 98(4): 556-561. |
| [48] |
WANG J, DAI C, ZHANG X Q, et al. Elucidating the molecular mechanism of the inhibitory effect of epigallocatechin-3-gallate on Microcystis aeruginosa[J]. Journal of Applied Phycology, 2018, 30(3): 1747-1758. |
| [49] |
黄建, 冯耀祖, 刘易, 等. NaCl胁迫对蓖麻功能叶光系统Ⅱ荧光特性的影响[J]. 干旱区资源与环境, 2015, 29(7): 145-149. HUANG J, FENG Y Z, LIU Y, et al. Effects of NaCl stress on photosystem Ⅱ chlorophyll fluorescence characteristics of functional leaves in Castor[J]. Journal of Arid Land Resources and Environment, 2015, 29(7): 145-149. |
| [50] |
钱永强, 周晓星, 韩蕾, 等. Cd2+胁迫对银芽柳PSⅡ叶绿素荧光光响应曲线的影响[J]. 生态学报, 2011, 31(20): 6134-6142. QIAN Y Q, ZHOU X X, HAN L, et al. Rapid light-response curves of PSⅡ chlorophyll fluorescence parameters in leaves of Salix leucopithecia subjected to cadmium-ion stress[J]. Acta Ecologica Sinica, 2011, 31(20): 6134-6142. |
| [51] |
GONZÁLEZ-GRANDE P, SUÁREZ N, MARÍN O. Effect of salinity and seed salt priming on the physiology of adult plants of Solanum lycopersicum cv. 'Río Grande'[J]. Brazilian Journal of Botany, 2020, 43(4): 775-787. |
| [52] |
赵跃锋, 任晓雪, 陈昆. 盐胁迫对茄子种子萌发、光合指标及叶绿素荧光参数的影响[J]. 天津农业科学, 2018, 24(8): 4-6, 10. ZHAO Y F, REN X X, CHEN K. Effects of salt stress on seed germination, photosynthetic index and chlorophyll fluorescence parameters of Eggplant[J]. Tianjin Agricultural Sciences, 2018, 24(8): 4-6, 10. |
2. Engineering Research Center of Water Environment Ecology, Shanghai Ocean University, Shanghai 201306, China
 2023,
Vol. 32
2023,
Vol. 32


